化学式及化学方程式的书写
初中阶段常见物质的化学式及其书写方法

初中阶段常见物质的化学式及其书写方法正确的书写化学式是学好初中化学的基础,只有正确的书写化学式才能正确表示对应物质的元素组成及之间的质量比,只有正确的书写化学式才能将对应物质的相对分子质量计算正确,只有正确的书写化学式才能将对应化学反应的化学方程式书写正确,进而才能理解化学反应中微观粒子的个数关系和化学反应中所涉及到的物质质量的关系等等。
总而言之,只有正确的书写化学式才能学好初中化学。
现将初中阶段常见物质的化学式及其书写方法总结如下:一、常见单质化学式的书写:(1)由原子直接构成的单质:(直接用元素符号表示其化学式)①金属:Na、Mg、Al、K、Ca、Fe、Cu、Zn、Ba、Ag等;②稀有气体:He、Ne、Ar等;③常见的固体非金属单质:C、Si、P、S等。
(2)由分子构成的单质:(用“Xn”表示其化学式)如:H2、O2、N2、O3、Cl2、C60等。
二、常见化合物化学式的书写方法:化合物中的元素化合时大部分遵循化合价原则:在化合物里,正、负化合价的代数和为零。
现将常见元素化合价与常见原子团化合价总结如下:①常见元素的化合价:一价钾钠氯氢银,二价氧钙钡镁锌;三铝、四硅、五氮磷,二三铁、二四碳;二、四、六硫价齐全,铜汞二价最常见;氢正一、氧负二,正负化合价和为零。
②常见原子团化合价:氢氧根离子:OH﹣、硝酸根离子:NO3﹣,硫酸根离子:SO42﹣、碳酸根离子:CO32﹣,磷酸根离子:PO43﹣、铵根离子:NH4+。
负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根。
③根据化合价书写化学式的方法:三、初中阶段常见化合物的化学式:(1)常见氧化物化学式的书写:(用“Xn Om”表示其化学式)如:水:H2O、过氧化氢:H2O2、一氧化碳:CO、二氧化碳:CO2、二氧化硫:SO2、三氧化硫:SO3、五氧化二磷:P2O5、氧化铁:Fe2O3、四氧化三铁:Fe3O4、氧化镁:MgO、氧化铜:CuO、氧化钙:CaO、氧化铝:Al2O3、二氧化氮:NO2、一氧化氮:NO。
(word完整版)书写化学方程式的步骤之一

书写化学方程式的步骤之一①写出反应物和生成物的化学式.反应物写在左边,生成物写在右边,中间用短线相隔,反应物或生成物不止一种时,用加号“+”把它们连接起来。
②配平。
化学方程式要符合质量守恒定律,配平的含义是要使反应物和生成物的元素种类和每种元素的原子个数相等。
配平后,把短线改成等号。
③注明反应条件。
如果反应需要在加热、点燃或有催化剂等条件下进行,那么要将这些条件写在等号上方或下方。
如果有两种以上的条件,一般把加热(用符号“△"表示)写在等号的下方。
④注明生成物的状态。
如果反应在溶液中进行,生成物中有沉淀,一般用符号“↓"标在沉淀生成物化学式的右边表示出来;如果反应物不是气体,而生成物中有气体那么在气体生成物化学式的右边用符号“↑”表示出来。
书写化学方程式的步骤之二1.写出反应物和生成物的化学式根据事实确定反应物和生成物并写出它们的化学式,反应物的化学式写在左边,生成物的化学式写在右边。
如果反应物或生成物不止一种,则用加号把它们连接起来,并在式子左、右两边之间划一线。
例如:P+O2──P2O52.配平化学方程式在反应物和生成物的化学式前面配上适当的系数,使式子左、右两边每一种元素的原子总数相等,这个过程叫做化学方程式的配平。
配平化学方程式的方法有很多种,最常用的是求最小公倍数法。
在上面的式子里,左边的氧原子数是2,右边的氧原子数是5,两数的最小公倍数是l0。
因此,在O2的前面配上系数5,在P2O5前面配上系数2,即P+5O2──2P2O5这样,式子两边氧原子的总数相等了,但磷原子的总数不等,必须在P的前面配上系数4,即4P+5O2──2P2O5式子两边各元素的原子数配平后,把线改为等号,即4P+5O22P2O53.标明反应条件和生成物的状态在特定条件下进行的化学反应,必须把外界条件,如点燃、加热(用“△”号表示)、催化剂等,写在等号的上方(如果有两种以上的条件,一般把加热符号写在下方)。
【高中化学】化学方程式的书写方法和注意点

【高中化学】化学方程式的书写方法和注意点书写化学方程式要遵守两个原则:一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
1.化学方程式的编写步骤以编写碳与氧化铁在高温下反应的化学方程式为例,概括步骤如下:①根据反应的事实(该反应生成铁和二氧化碳气体),在式子的左边写出反应物的化学式,在式子的右边写出生成物的化学式。
反应物或生成物不止一种,就分别用加号把它们连接起来(反应物之间的“+”号表示“……跟……反应”,生成物之间的“+”号表示“……跟……”),并在式子左、右之间划一条短线段。
在这一步里,一定要注意把各种物质的化学式写正确,否则,写出的式子无意义!c+fe2o3──fe+co2② 根据质量守恒定律,采用匹配系数法使同一元素左右两侧的原子数相等(即平衡),然后将短线段改为等号(等号表示“生成…”)。
需要注意的是,匹配级别只能选择合适的系数,化学式不能更改。
3c+2fe2o3=4fe+3co2③在等号或箭号上、下方注明反应条件,如点燃、通电、高温、加热(用“△”号表示)、催化剂等,同时,标明生成物中的气体或沉淀产物的状态。
生成物是气体的在其化学式的右边加上“↑”号(反应物中如有气体,则气态生成物不再标“↑”符号);产物是沉淀的加“↓”号。
3c+2fe2o34fe+3co2↑概而言之,在书写化学方程式时,必须要符合化学反应的客观规律,不能凭空臆造。
书写程序一般是:写好化学式―系数要配平―中间联等号―条件要注清―生成气体或沉淀,要用箭号来标明。
要写好化学方程式,还要熟练掌握和运用酸、碱、盐的溶解性表,金属活动性顺序和常见元素、原子团的化合价,以及书写物质化学式的技能。
写作方法及注意事项写出符号表达式例:h20=电解=h2+o2(水通电生成氢气和氧气)2.配平例:2h2o=电解=2h2+o23.注明反应条件和物态等例:2h2o=电解=2h2↑+o2↑反应条件1.热化学方程式不写反应条件。
初三化学如何正确书写化学方程式

如何正确书写化学方程式一、化学方程式1、定义: 用化学式来表示化学反应的式子2、书写原则:①以客观事实为依据②遵循质量守恒定律,等号两边各原子的种类和数目相等二、化学方程式的写法:①写:左边写出反应物的化学式,右边写出生成物的化学式。
如果反应物或者生成物不止一种,就用“+”连接,读作:“和”;反应物和生成物之间用短线连接,读作:“生成”2O P +— 52O P②配平:在化学式前面配上适当的化学计量数,使得反应前后每一种元素的原子总数相等 252O P + — 252O P③注明反应发生的条件,如:点燃、Δ、催化剂等;标出生成物的状态,如:↓,↑把短线改成等号252O P + 点燃 252O P知识点一:化学方程式书写原则 例1. 在炼铁工业中,常用石灰石将铁矿石中的杂质二氧化硅转化为炉渣除去,发生反应的化学方程式为:CaCO 3+SiO 2X+CO 2↑,其中X 的化学式是( ) A . CaSiO 4 B . Ca 2SiO 3 C . CaSi 2O 3 D . CaSiO 3例2.在一密闭容器中加入甲、乙、丙、丁四种物质,在运动条件下发生化学反应,测得反应前及t 1、t 2时各物质质量如图所示,下列说法中不正确的是( )A.该反应为化合反应B.丙可能为该反应的催化剂C.该反应中,乙、丁的质量变化之比为7:5D.该反应中,甲、乙的质量变化之比为1:4例3. 甲烷和水反应可以制备水煤气(混和气体),其反应的微观示意图如图所示:根据以上微观示意图得出的结论中,正确的是()A.水煤气的成分是一氧化碳和氧气B.反应中含氢元素的化合物有三种C.反应前后碳元素的化合价没有发生变化D.反应中甲和丙的质量之比为4:7例4.下列化学方程式书写正确的是()例5. (2015•益阳•11)下列化学方程式与对应反应类型均正确的是()化学方程式反应类型A H2O H2+O2↑分解反应B CaO+H2O═Ca(OH)2化合反应C 2Fe+6HCl═2FeCl3+3H2↑置换反应D SO3+2NaOH═Na2SO4+H2O 复分解反应例6. “题16图”为某化学反应的微观示意图。
化学方程式的书写

水垢的主要成份是CaCO3和Mg(OH)2,某 化学研究小组的同学通过实验测定水 垢中CaCO3的含量:取200g水垢,加入 过量的稀盐酸,同时测量5分钟内生成 的CO2的质量,结果如下表,试回答下 列问题:(1)4分钟后,水垢中CaCO3 是否反应完全?(2)该水垢中CaCO3 的质量分数是多少?
4P + 5 O 2P O
在化学方程式中:
“+”表示“和”、“跟”、“与”
“=”表示反应物质量与生成物质 量相等、同时也表示生成号。
“↑”表示有气体产生 “↓”表示沉淀(不溶于水的物质)生成
化学方程式的读法:
CO2 + H2O === H2CO3 C + O2 CO2
说明:
1、将“—”变成“=”,“=”表示遵 循质量守恒定律。 2、标“↑、 ↓”。 “↑”只标在生成的气体后面,若反 应物中有气体,则不标。 “↓”只标在难溶于水的物质后面, 若反应体系中无水,则不标。
根据化学方程式计算步骤:
①设(求什么,设什么,不带 单位。设:××质量为x) ②写(正确书写方程式)
算出已知量与未知量的质量比
③列 ④求
标出已知量与未知量 列关系式
⑤答
[例1]电解18g水可得氢气多少克?
[例2]要使12g碳完全燃烧至少需 要多少升的氧气?[氧气的密度为 32/22.4(g/L)] 至少需要多少升空气?
(5)、实验室制备二氧化碳
(6)、将二氧化碳通入澄清石灰水 (7)、按要求写化学方程式 有水生成的分解反应 有二氧化碳生成的分解反应
配平下列化学方程式:
目的:遵循质量守恒定律 原则:最小公倍数。 方法:先配原子个数较多的 最后配单质前面的系数 在配平过程中可配上分数,最 后必须化为整数。
常见物质化学式及化学方程式归纳

物质化学式的书写和读法依据组成纯净物的元素种类是否单一将纯净物分为单质和化合物。
纯净物具有固定的组成和性质,可以用化学式表示,各种物质的化学式都是通过实验方法测定出来的,一种纯净物只能由一个化学式来表示,不能主观臆造。
一.单质化学式的书写和读法(由同种元素组成的纯净物)1.稀有气体单质、固态非金属单质、金属单质(由原子直接构成)等物质的化学式直接用元素符号表示。
(1)氦气---He (2)氖气---Ne (3)氩气---Ar (4)碳---C (5)磷---P (6)硫---S (7)硅---Si (8)钠--- Na (9)镁---Mg (10)铝--- Al (11)钙---Ca (12)钾---K (13)铜---Cu(14)铁--- Fe (15)锌---Zn (16)汞---Hg (17)银---Ag (18)钡---Ba★【读法】直接读出元素的名称。
2.双原子(或多原子)构成分子的单质化学式的书写,在元素符号右下角标注每个分子中原子的个数。
(1)氧气--- O2(2)氢气--- H2 (3)氮气---N2(4)氯气--- Cl2(5)臭氧---O3(6)碳60---C60(7)溴---Br2(8)碘---I2★【读法】元素名称后加“气或直接读出元素名称”。
二.化合物化学式的书写和读法(由不同种元素组成的纯净物)(一)由两种元素组成的化合物的化学式的书写和读法1.氧化物化学式的书写和读法(由两种元素组成,其中一种元素是氧元素的化合物)(1)氧化镁---MgO (2)氧化铜CuO (3)氧化钙---CaO (4)氧化钠---Na2O(5)氧化锌---ZnO (6)氧化汞---HgO (7)氧化铁---Fe2O3(8)氧化铝---Al2O3(9)二氧化锰---MnO2(10)四氧化三铁---Fe3O4(11)二氧化碳---CO2(12)二氧化硫---SO2(13)二氧化氮---NO2 (14)三氧化硫---SO3 (15)五氧化二磷---P2O5(16)一氧化碳---CO (17)一氧化氮---NO ▼(18)水--- H2O ▼(19)过氧化氢--- H2O2★【书写规则和读法】氧化物的化学式中,氧元素符号写在右边,另一种元素的符号写在左边,即“先读的后写,后读的先写”一般称为“氧化某”,例如“氧化铜”,后读“铜”,则先写铜的元素符号“Cu”,先读“氧”,则后写氧元素的符号“O”,故氧化铜的化学式为“CuO”。
化学方程式的写法和平衡法则

化学方程式的写法和平衡法则化学方程式是表示化学反应的数学表达式,它由反应物、生成物和反应条件组成。
化学方程式的写法遵循一定的规则,即平衡法则。
平衡法则要求化学方程式中的反应物和生成物的原子数目必须相等,以保持反应前后的原子守恒。
一、化学方程式的写法:1.反应物:反应物位于化学方程式的左侧,用“+”号分隔。
2.生成物:生成物位于化学方程式的右侧,用“+”号分隔。
3.反应条件:反应条件位于化学方程式的上方或下方,如温度、压力、催化剂等。
4.化学式:化学式表示化合物中元素的种类和数目,元素符号表示元素,下标表示原子数目。
5.状态符号:状态符号表示物质的状态,如(s)表示固体,(l)表示液体,(g)表示气体,(aq)表示溶液。
二、平衡法则:1.原子守恒:化学方程式中反应物和生成物的原子数目必须相等,以保持反应前后的原子守恒。
2.电荷守恒:化学方程式中反应物和生成物的总电荷数目必须相等,以保持反应前后的电荷守恒。
3.质量守恒:化学方程式中反应物和生成物的总质量数目必须相等,以保持反应前后的质量守恒。
三、化学方程式的平衡:1.平衡状态:当化学方程式中反应物和生成物的原子数目相等时,方程式达到平衡状态。
2.平衡常数:平衡常数(K)表示在平衡状态下反应物和生成物的浓度比值。
3.平衡移动:当平衡状态下反应物浓度增加或生成物浓度减少时,平衡会向生成物方向移动,反之亦然。
四、化学方程式的书写步骤:1.确定反应物和生成物:根据反应物和生成物的化学式。
2.写出未平衡的化学方程式:将反应物和生成物按照反应顺序写出来。
3.平衡原子数目:调整反应物和生成物的前缀,使得原子数目相等。
4.检查电荷守恒:确保反应物和生成物的总电荷数目相等。
5.确定平衡状态:当反应物和生成物的原子数目相等时,方程式达到平衡状态。
6.写出平衡常数:根据平衡状态下反应物和生成物的浓度比值,写出平衡常数(K)。
五、化学方程式的应用:1.预测反应产物:通过化学方程式可以预测反应生成的产物。
化学方程式的书写

【化学方程式的书写原则】1)必须以客观事实为依据,不能凭空臆造事实上不存在的物质和化学反应.2)遵守质量守恒定律,使等号两边原子的种类和数目必须相等.2.化学方程式的书写步骤:书写化学方程式要按一定步骤进行,避免出现一些不必要的错误,如漏掉反应条件和“↑”“↓”等.书写化学方程式的一般步骤可概括为:“一写,二配,三注”(以高锰酸钾受热分解为例)【化学方程式的书写步骤】1)写:根据事实写出反应物和生成物的化学式(左反、右生),并在反应物和生成物之间画一条短线.2)配:配平化学方程式的目的是使等号两边的原子种类与数目相等,遵守质量守恒定律,配平后要加以检查.3)注:注明化学反应发生的条件(点燃、加热等),标出生成物状态(气体,沉淀等),把短线改成等号.【书写化学方程式的注意事项】1)化学反应的常见条件有“点燃”、“加热”(常用“△”表示)“高温”,“催化剂”等,写在等号上方;2)如果反应物没有气体而生成物中有气体,在气体物质的化学式右边要注“↑”;3)溶液中的反应如果生成物是固体,在固体物质化学式右边注“↓”.【书写化学方程式的口诀】左写反应物,右写生成物;写准化学式,系数(化学计量数)要配平;中间连等号,条件要注明;生成气体和沉淀,要用“↑”“↓”来标明.【化学方程式的配平】配平化学方程式就是在化学式前面配上适当的化学计量数使式子左、右两边的每一种元素的原子数目相等.常用的配平方法有最小公倍数法、观察法、奇数配偶法、归一法及得失电子守恒法.1)最小公倍数法:这种方法适合于常见的难度不大的化学方程式.例如在KClO3→KCl+O2↑这个反应式中右边氧原子个数为2,左边是3,则最小公倍数为6,因此KClO3前系数应配 2,O2前配 3,式子变为:2KClO3→2KCl+3O2↑,由于左边钾原子和氯原子数变为2个,则KCl 前应配系数2,短线改为等号,标明条件即可:2KClO32KCl+3O2↑(反应条件为二氧化锰催化和加热.“MnO2”写在等号上方;“△”写在等号下方)2)奇偶配平法:这种方法适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶,例如:C2H2+O2→CO2+H2O,此方程式配平先从出现次数最多的氧原子配起.O2内有2个氧原子,无论化学式前系数为几,氧原子总数应为偶数.故右边H₂O的系数应配2(若推出其它的分子系数出现分数则可配4),由此推知C2H2前2,式子变为:2C2H2+O2→CO2+2H2O,由此可知CO2前系数应为4,最后配单质O2为5,把短线改为等号,写明条件即可:2C2H2+5O2=4CO2+2H2O3)3)观察法:有时方程式中会出现一种化学式比较复杂的物质,我们可通过这个复杂的分子去推其他化学式的系数,例如:Fe+H2O──Fe3O4+H2,Fe3O4化学式较复杂,显然,Fe3O4中Fe来源于单质Fe,O来自于H2O,则Fe前配3,H2O前配4,则式子为:3Fe+4H2O=Fe3O4+H2由此推出H2系数为4,写明条件,短线改为等号即可:3Fe+4H2O(g)Fe3O4+4H2↑4)归一法(或待定系数法):找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.5)得失电子守恒法:电子得失法的原理是:氧化还原反应中,还原剂失去电子的总数必须等于氧化剂获得电子的总数.根据这一规则,可以配平氧化还原反应方程式.下面是配平的具体方法:1°从反应式里找出氧化剂和还原剂,并标明被氧化元素或还原元素的原子在反应前后化合价发生变化的情况,以便确定它们的电子得失数.2°使得失电子数相等,由此确定氧化剂和还原剂等有关物质化学式的系数.3°由已得的系数,判定其它物质的系数,由此得配平的反应式.。
初中常见化学式及化学方程式

初中常见化学式及化学方程式初中常见化学式及化学方程式大全在日常生活或是工作,学习中,大家一定都或多或少地接触过一些化学知识,下面是店铺为大家收集的有关初中常见化学式及化学方程式相关内容,仅供参考,希望能够帮助到大家。
一、化合反应1、镁在空气中燃烧:2Mg+ O2 2MgO2、铁在氧气中燃烧:3Fe +2O2 Fe3O43、铝在空气中燃烧:4Al+ 3O2 2Al2O34、氢气在空气中燃烧:2H2 +O2 2H2O5、红磷在空气中燃烧:4P +5O2 2P2O56、硫粉在空气中燃烧: S+ O2 SO27、碳在氧气中充分燃烧:C +O2 28、碳在氧气中不充分燃烧:2C +O2CO9、二氧化碳通过灼热碳层: C +CO2 2CO10、一氧化碳在氧气中燃烧:2CO +O2 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl22NaCl二、分解反应1、实验室用双氧水制氧气:2H2O22H2O +O2↑2、加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 +O2↑3、水在直流电的作用下分解:2H2O 2H2↑+O2 ↑4、碳酸化学物理学报不稳定而分解:H2CO3 === H2O+CO2↑5、高温煅烧石灰石(二氧化碳工业制法):CaCO3 CaO+ CO2↑三、置换反应1、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu2、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑3、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑4、氢气还原氧化铜:H2 +CuO Cu +H2O5、木炭还原氧化铜:C+ 2CuO 2↑6、甲烷在空气中燃烧:CH4 +2O2 CO2+2H2O7、水蒸气通过灼热碳层:H2O +C 2 +CO8、焦炭还原氧化铁:3C +2Fe2O3 3CO2↑其他1、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 ==Cu(OH)2 + Na2SO42、甲烷在空气中燃烧:CH4 +2O2 2 +2H2O3、酒精在空气中燃烧:C2H5OH+ 3O2 2CO2 +3H2O4、一氧化碳还原氧化铜:25、一氧化碳还原氧化铁:3CO+ Fe2O3 26、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2 ==== CaCO3 + H2O7、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2==== Na2CO3 +H2O8、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑9、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl === 2NaCl +H2O +CO2↑。
初中化学《化学式、化学方程式和反应现象归纳大全》
一、化学式书写二、化学方程式、反应现象、应用1.2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2.2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验3.4Al+3O2点燃或Δ2Al2O3银白金属变为白色固体4.3Fe+2O2点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放出大量热5.C+O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊6.S+O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰7.2H2+O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料8.4P+5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量9.CH4+2O2点燃2H2O+CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧10.2KClO3 MnO2Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气11.2KMnO4Δ K2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气12.2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验13.2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水14.C u2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热15.N H4HCO3ΔNH3↑+ H2O +CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失16.Z n+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气17.F e+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解18.M g+H2SO4 =MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解19.2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解20.F e2O3+3H2Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性21.2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、22.H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸23.C uSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验24.2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因25.2CO+O2点燃2CO2蓝色火焰煤气燃烧26.C + CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属27.2Fe2O3+3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4+2C高温3Fe + 2CO2↑冶炼金属28.C + CO2高温2CO29.C O2 + H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性30.H2CO3ΔCO2↑+ H2O 石蕊红色褪去31.C a(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁32.C aCO3+H2O+CO2 = Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化33.C a(HCO3)2Δ CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成34.2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头35.C aCO3高温 CaO+ CO2↑工业制备二氧化碳和生石灰36.C aCO3+2HCl=CaCl2+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢37.N a2CO3+H2SO4=Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理第 3 页共12 页2009年11月10日38.N a2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理39.C uO +CO Δ Cu + CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属40.F e2O3+3CO高温 2Fe+3CO2冶炼金属原理41.C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧42.F e+CuSO4=Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜43.M g+FeSO4= Fe+ MgSO4溶液由浅绿色变为无色44.C u+2AgNO3=2Ag+ Cu(NO3)2红色金属表面覆盖一层银白色物质镀银45.Z n+CuSO4= Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜46.F e2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈47.A l2O3+6HCl=2AlCl3+3H2O 白色固体溶解48.C uO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色49.M gO+2HCl=MgCl2+ H2O 白色固体溶解 CaO+2HCl=CaCl2+ H2O 白色固体溶解50.N aOH+HCl=NaCl+ H2O 白色固体溶解51.C u(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解52.M g(OH)2+2HCl=MgCl2+2H2O 白色固体溶解53.A l(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多54.F e(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色55.C a(OH)2+2HCl=CaCl2+2H2O56.H Cl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理57.F e2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈58.A l2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解59.C uO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色60.2NaOH+H2SO4=Na2SO4+2H2O61.C u(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解62.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解63.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色64.B a(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理65.B aCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理66.B a(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理67.C uO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色68.N aOH+HNO3=NaNO3+ H2O69.C u(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解70.F e(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色71.2NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、72.2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)73.F eCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成74.A lCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成75.M gCl2+2NaOH = Mg(OH)2↓+2NaCl76.C uCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成77.C aO+ H2O = Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆78.C a(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱79.B a(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成80.C a(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成81.C uSO4+5H2O= CuSO4·H2O 白色粉末变为蓝色检验物质中是否含有水82.C uSO4·H2OΔ CuSO4+5H2O 蓝色晶体变为白色粉末83.A gNO3+NaCl = AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子84.B aCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子85.C aCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成86.M gCl2+Ba(OH)2=BaCl2+Mg(OH)2↓有白色沉淀生成87.C aCO3+2HCl=CaCl2+H2O+CO2↑88.M gCO3+2HCl= MgCl2+H2O+ CO2↑89.N H4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子90.NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体化学方程式汇总一.物质与氧气的反应:第 5 页共12 页2009年11月10日(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 二.几个分解反应:13.水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14.加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 === H2O + CO2↑18.高温煅烧石灰石:CaCO3 高温 CaO + CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20.木炭还原氧化铜:C+ 2CuO高温 2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224.一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2 四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 +酸 -------- 盐+氢气(置换反应)26.锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27.铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28.镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29.铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30.锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31.铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32.镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33.铝和稀盐酸2Al + 6HCl== 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg (3)碱性氧化物 +酸 -------- 盐 +水37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O第7 页共12 页2009年11月10日39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 +另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl 五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O 77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2四、熟记一些物质的学名、俗名及对应的化学式第9 页共12 页2009年11月10日Hg汞(水银)CO2二氧化碳(干冰)CO一氧化碳(煤气)CH4甲烷(沼气天然气)CaO氧化钙(生石灰)Ca(OH)2氢氧化钙(熟石灰、消石灰)CaCO3碳酸钙(石灰石、大理石)NaCl氯化钠(食盐)KMn O4高锰酸钾(灰锰氧)C2H5OH乙醇(酒精)CH3COOH乙酸(醋酸)NaOH氢氧化钠(烧碱、苛性钠)Na2CO3碳酸钠(纯碱、苏打)NaH CO3碳酸氢钠(小苏打)HCl氢氯酸(盐酸)CuSO4·5H2O五水硫酸铜(胆矾、蓝矾)(NH4)2SO4硫酸铵(硫铵)NH4HCO3碳酸氢铵(碳铵)Cu2(OH)2CO3碱式碳酸铜(铜绿)NH4NO3硝酸铵(硝铵)K2CO3碳酸钾(草木灰主要成分)五、化学反应类型1、化合反应:A+B→C2、分解反应:C→A+B3、置换反应:A+BC→B+AC4、复分解反应:A B+CD→AD+CB三、常见物质的颜色、气味等:红色:红P、Cu、Fe2O3红褐色:Fe(OH)3浅绿色:Fe2+盐的溶液黄色:S、Fe3+盐的溶液绿色:Cu2(OH)2CO3紫黑色:KMnO4晶体蓝色:Cu(OH)2、CuCO3、CuSO4·5H2O、Cu2+盐的溶液紫红色:KMnO4溶液黑色:C、Fe粉、CuO、MnO2、Fe3O4化学式、化学方程式反应现象应用归纳白色:BaSO4、AgCl、MgO、P2O5、CaO、NaOH、Ca(OH)2、CaC O3、KClO3、KCl、NaCl、BaCO3、CuSO4、Na2CO3等无色气体:空气、O2、H2、CO2、CO、CH4、N2、SO2常见的有色气体:NO2 红棕色气体F2(淡黄绿色)Cl2(黄绿色)Br2(g)(红棕色)I2(g)(紫红色)NO2(红棕色)O3(淡蓝色)刺激性气味气体:SO2、HCl、HNO3等无色透明:金刚石、干冰以及大部分酸、碱、盐的溶液和酒精、乙酸的溶液第11 页共12 页2009年11月10日阴离子。
常见化学式、化学方程式

常见化学式1、单质:①非金属单质:氢气H2碳C 氮气N2氧气O2磷P 硫S 氯气Cl2②金属单质:钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn2、常见氧化物:书写规则:其它元素在前,氧元素在后;金属元素在前,非金属元素在后读法:氧化某或几氧化几某水H2O 一氧化碳CO 二氧化碳CO2五氧化二磷P2O5氧化钠Na2O 二氧化氮NO2一氧化氮NO 二氧化硅SiO2 二氧化硫SO2三氧化硫SO3氧化镁MgO 氧化铜CuO三氧化二铁(铁红)Fe2O3四氧化三铁Fe3O4二氧化锰MnO2三氧化二铝(氧化铝)Al2O3双氧水(过氧化氢溶液)H2O23、氯化物/盐酸盐:氯化钾KCl 氯化钠(食盐) NaCl 氯化镁MgCl2氯化钙CaCl2氯化铜CuCl2氯化锌ZnCl2氯化钡BaCl2氯化铝AlCl3氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl4、常见的酸:硫酸H2SO4盐酸HCl 硝酸HNO3 磷酸H3PO4碳酸H2CO3 5、常见的盐:硫酸铜CuSO4硫酸钡BaSO4硫酸钙CaSO4硫酸钾K2SO4硫酸镁MgSO4硫酸亚铁FeSO4硫酸铁Fe2(SO4)3硫酸铝Al2(SO4)3硝酸钠NaNO3硝酸钾KNO3硝酸银AgNO3亚硝酸钠NaNO2碳酸钠Na2CO3碳酸钙CaCO3碳酸镁MgCO3碳酸钾K2CO3高锰酸钾KMnO4锰酸钾K2MnO46、常见的碱:氢氧化钠NaOH 氢氧化钙Ca(OH)2氢氧化钡Ba(OH)2氢氧化镁Mg(OH)2氢氧化铜Cu(OH)2 氢氧化钾KOH 氢氧化铝Al(OH)3氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)27、常见有机物:甲烷CH4乙炔C2H2甲醇CH3OH 乙醇C2H5OH 乙酸CH3COOH 8、常见结晶水合物:碱式碳酸铜Cu2(OH)2CO3明矾KAl(SO4)2•12H2O 绿矾FeSO4•7H2O 蓝矾CuSO4•5H2O 碳酸钠晶体Na2CO3•10H2O9、常见化肥:尿素CO(NH2)2硝酸铵NH4NO3硫酸铵(NH4)2SO4碳酸氢铵NH4HCO3 10、常见原子团:碳酸根(CO3)硫酸根(SO4)硝酸根(NO3)氢氧根(OH)铵根(NH4)化学反应方程式化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铝在空气中燃烧:4Al + 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 + O2点燃2H2O5、红磷在空气中燃烧:4P + 5O2点燃2P2O56、硫粉在空气中燃烧:S + O2点燃SO27、碳在氧气中充分燃烧:C + O2点燃CO28、碳在氧气中不充分燃烧:2C + O2点燃2CO9、二氧化碳通过灼热碳层:C + CO2高温2CO10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰与水反应:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ====== CuSO4·5H2O 14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑17、加热氯酸钾和二氧化锰的混合物:2KClO3MnO2△2KCl + 3O2↑18、水在直流电的作用下分解:2H2O通电2H2↑+ O2↑19、碳酸不稳定而分解:H2CO3=== H2O + CO2↑20、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO + CO2↑置换反应21、锌和稀硫酸:Zn + H2SO4=== ZnSO4 + H2↑22、铁和稀硫酸:Fe + H2SO4=== FeSO4 + H2↑23、镁和稀硫酸:Mg + H2SO4=== MgSO4 + H2↑24、铝和稀硫酸:2Al +3H2SO4=== Al2(SO4)3 +3H2↑25、锌和稀盐酸:Zn + 2HCl === ZnCl2 + H2↑26、铁和稀盐酸:Fe + 2HCl === FeCl2 + H2↑27、镁和稀盐酸:Mg +2HCl === MgCl2 + H2↑MnO228、铝和稀盐酸:2Al + 6HCl === 2AlCl3 + 3H2↑29、铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4 + Cu30、锌和硫酸铜溶液反应:Zn + CuSO4=== ZnSO4 + Cu31、铜和硝酸汞溶液反应:Cu + Hg(NO3)2=== Cu(NO3)2 + Hg 32、氢气还原氧化铜:H2 + CuO △Cu + H2O33、木炭还原氧化铜:C +2CuO 高温2Cu + CO2↑34、水蒸气通过灼热碳层:H2O + C 高温H2 + CO35、焦炭还原氧化铁:3C +2Fe2O3高温4Fe + 3CO2↑复分解反应(1)酸+ 碱-------- 盐+ 水36、盐酸和烧碱起反应:HCl + NaOH === NaCl +H2O37、盐酸和氢氧化钾反应:HCl + KOH === KCl +H2O38、盐酸和氢氧化铜反应:2HCl + Cu(OH)2=== CuCl2 + 2H2O 39、盐酸和氢氧化钙反应:2HCl + Ca(OH)2=== CaCl2 + 2H2O 40、盐酸和氢氧化铁反应:3HCl + Fe(OH)3=== FeCl3 + 3H2O 41、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3=== AlCl3 + 3H2O 42、硫酸和烧碱反应:H2SO4 + 2NaOH === Na2SO4 + 2H2O 43、硫酸和氢氧化钾反应:H2SO4 + 2KOH === K2SO4 + 2H2O 44、硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2=== CuSO4 + 2H2O 45、硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3=== Fe2(SO4)3 + 6H2O 46、硝酸和烧碱反应:HNO3+NaOH === NaNO3 +H2O(2)酸+ 盐-----另一种酸+ 另一种盐47、大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑48、碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑49、碳酸镁与稀盐酸反应:MgCO3 + 2HCl === MgCl2 + H2O + CO2↑50、盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓+ HNO351、硫酸和碳酸钠反应:Na2CO3 + H2SO4=== Na2SO4 + H2O + CO2↑52、硫酸和氯化钡溶液反应:H2SO4 + BaCl2=== BaSO4↓+ 2HCl (3)碱+ 盐-----另一种碱+ 另一种盐53、氢氧化钠与硫酸铜:2NaOH + CuSO4=== Cu(OH)2↓+ Na2SO4 54、氢氧化钠与氯化铁:3NaOH + FeCl3=== Fe(OH)3↓+ 3NaCl 55、氢氧化钠与氯化镁:2NaOH + MgCl2=== Mg(OH)2↓+ 2NaCl 56、氢氧化钠与氯化铜:2NaOH + CuCl2=== Cu(OH)2↓+ 2NaCl 57、氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3=== CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐58、氯化钠溶液和硝酸银溶液:NaCl + AgNO3=== AgCl↓+ NaNO3 59、硫酸钠和氯化钡:Na2SO4 + BaCl2=== BaSO4↓+ 2NaCl (5)酸+ 碱性氧化物-----盐+ 水60、盐酸和氧化钙反应:2HCl + CaO === CaCl2 + H2O61、硫酸和氧化镁反应:H2SO4 + MgO=== MgSO4 + H2O其他反应62、苛性钠暴露在空气中变质:2NaOH + CO2=== Na2CO3 + H2O63、苛性钠吸收二氧化硫气体:2NaOH + SO2=== Na2SO3 + H2O 64、苛性钠吸收三氧化硫气体:2NaOH + SO3=== Na2SO4 + H2O 65、消石灰放在空气中变质:Ca(OH)2 + CO2=== CaCO3↓+ H2O 66、消石灰吸收二氧化硫:Ca(OH)2 + SO2=== CaSO3↓+ H2O 67、一氧化碳还原氧化铜:CO +CuO △Cu + CO268、一氧化碳还原氧化铁:3CO +Fe2O3高温2Fe + 3CO269、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O70、酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O71、甲醇在空气中燃烧:2CH3OH + 3O2点燃2CO2 + 4H2O 初中化学基础知识总结一、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般为无色。
化学式与化学方程式的写法

一、化学式的含义及书写方法1.概念:用元素符号来表示物质组成的式子叫做化学式。
纯净物都有一定的组成,都可用一个相应的化学式来表示其组成。
有些化学式还能表示这种物质的分子构成,这种化学式也叫做分子式。
【要点诠释】化学式的意义描述分子构成,具体到某种物质的分子,就要说:每个某分子是由几个某原子构成的。
强调每个分子!2.化学式中元素符号周围的数字的意义每一个化学式中的数字都有其特定的意义,特别要注意化学式前面的数字与化学式中元素符号右下角的数字具有不同的意义。
例如:3.化学式的写法和读法化学式的写法:(1)单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式,如:铁(Fe)、汞(Hg)、氦气(He)、碳(C)、硫(S)、磷(P)等;常见非金属气体的分子由两个原子构成,其化学式分别表示为:氧气(O2)、氢气(H2)、氮气(N2)、氯气(Cl2)等。
(2)化合物(目前只研究两种元素组成的化合物):氧化物的化学式书写,总是氧在后,其他元素在前,如Al2O3、SO2等;金属与非金属形成的化合物,其化学式总是金属在前,非金属在后,如NaCl、MgCl2等。
化学式中原子个数为1时,“1”不标出。
化学式的读法:由两种元素组成的化合物,其读法顺序一般与化学式的书写顺序相反,从右到左读作“某化某”,例如:KCl读作氯化钾。
有时还要读出化学式中各种元素的原子个数,例如:Fe3O4读作四氧化三铁,P2O5读作五氧化二磷。
二、化合价1、化合价的含义元素化合价是元素的原子之间形成化合物时表现出来的一种性质,用来表示原子之间化合的数目。
1.化合价的表示方法:通常在元素符号或原子团(作为整体参加反应的原子集团)的正上方用+n或—n表示。
【要点诠释】化合价与离子符号的书写有一定区别与联系,如下表所示。
化合价与最外层电子数的关系:元素的最高正价数值与该元素的最外层电子数相等;元素的负价数值=8﹣该元素原子最外层电子数。
化学教案:化学式与化学方程式的书写

化学教案:化学式与化学方程式的书写一、化学式的书写化学式是化学元素和化合物的符号表示。
它用来描述化学物质的组成部分和结构,是化学领域中最基本的表示方法之一。
化学式由元素的符号和下标组成,下标表示该元素原子的个数。
在书写化学式时,需要遵循一定的规则和规范。
1.1 元素符号的书写元素符号是用来表示元素的缩写,由一个或多个字母组成。
通常情况下,元素符号使用拉丁字母的第一个大写字母作为代表。
如果元素符号是由两个字母组成,则第一个字母为大写,第二个字母为小写。
例如,氧元素的符号为O,碳元素的符号为C,氮元素的符号为N。
1.2 原子的个数表示在化学式中,原子的个数通过下标表示。
下标数字写在元素符号的右下方。
如果一个原子的个数为1,则通常情况下省略下标1。
例如,H2O表示由2个氢原子和1个氧原子组成的水分子,C6H12O6表示由6个碳原子、12个氢原子和6个氧原子组成的葡萄糖分子。
1.3 离子式和分子式化合物可以分为离子化合物和分子化合物。
在表示离子化合物时,需要标明离子的电荷。
正离子在化学式的右上方标明,负离子在化学式的右下方标明。
离子之间的个数以最简整数比例表示。
例如,氯化钠的离子式为Na+Cl-,其中Na+表示正离子钠离子,Cl-表示负离子氯离子。
分子化合物由非金属元素组成,它们以共用电子对形式结合。
在表示分子化合物时,不需要标明电荷。
例如,二氧化碳的分子式为CO2,其中C表示碳原子,O表示氧原子。
二、化学方程式的书写化学方程式是描述化学反应的符号表示。
它由反应物和生成物的化学式组成,中间通过反应箭头连接。
化学方程式反映了反应物的摩尔比例和产物的摩尔比例。
2.1 反应物和生成物的书写在化学方程式中,反应物写在反应箭头的左边,生成物写在反应箭头的右边。
通常情况下,写在同一水平线上的物质属于同一状态,写在不同水平线上的物质属于不同状态。
例如,H2(g) + O2(g) -> H2O(l)表示氢气和氧气反应生成液态的水。
化合价及化学式

一、分解反应
AB
H2O H2O2
通电
A+B H2 + O2 H2O+O2
MnO2
二、化合反应
A+B Na+Cl2 H2+Cl2 NaCl
HCl
AB
三、置换反应
A+BC
Mg+HCl
B+AC
MgCl2+H2
为什么Mg能将HCl中的H给置换出来 生成H2????????
三、置换反应
A+BC
B+AC
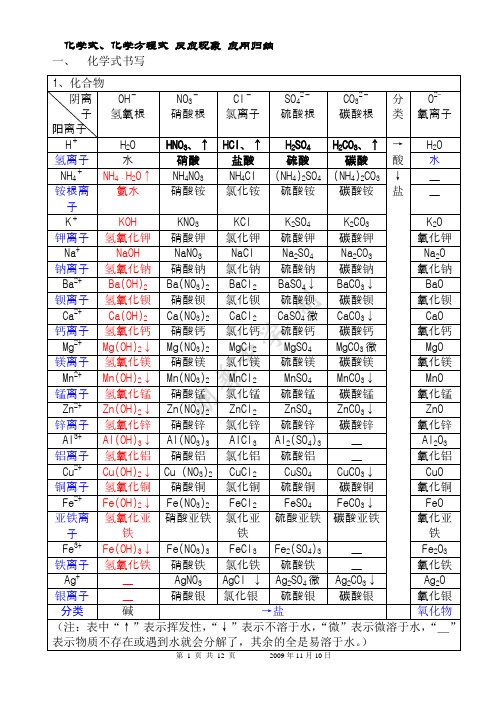
化学式及化学方程式书写
1、元素化合价口诀
一价K、Na、H、Cl、Ag 二价O、Ca、Ba、Mg、Zn 三Al四Si五价P谈变价也不难 二三Fe、二四C、二四六S都齐全 Cu、Hg二价最常见
2、化学式书写原则(一)
1)先读的后写后读的先写
2)金属在前,非金属在后 3)正价在前、负价在后 例如: 氯化钠 例如: 氧化钙 氯化钾 氟化钠
氧化亚铜
6、化学式读法(一)
由两种元素组成的化合物,其化学式名称一般读作“某化 某”,如:“ NaCl”读作“氯化钠”。这恰好与书写顺 序相反。 练习
Na2S 硫化钠 HCl 氯化氢
MgCl2 氯化镁 MgO 氧化镁 BaCl2 氯化钡 HBr 溴化氢
6、化学式读法(二)
在读化合物的化学式时,有时要读出各元素的原子个 数,但“1”一般不读出。如“CuO ”读作“氧化 铜”。若该元素是变价元素,在这些物质的化学式中, 该元素的原子个数不同,此时这个“1”字就要读出。 如“ ”读作“二氧化碳”,“CO”读作“一氧化碳”。 CO2 SO3 NO2
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au 金属活动顺序表
化学式和化学方程式的书写步骤

书写化学式具体步骤:(读写顺序相反。
写:金H非O)
(1)书写步骤:①写出组成化合物的元素符号
金属元素在前,非金属元素在后;正价元素在前,负价元素在后
②标出元素的化合价
③十字交叉(绝对值)
④取最小公约数,省略数字1
⑤检查化学式化合物中元素化合价代数和为零。
P154这些常见的离子要去记住
例:氧化铝:
①Al O ② Al (+3) O (-2) 数字应写在元素符号上边③十字交叉就是Al的化合价是O的原子个数,O的化合价是Al的原子个数,Al2O3 ④检查化学式化合物中元素化合价代数和为零。
书写化学方程式具体步骤(韵语)
左边反应物,右边生成物
写好化学式,方程要配平
短线改等号,条件要注明
生成气体或沉淀,上下箭头来分清。
化合反应;A+B=c(视情况在等号上方加反应条件,下同)
分解反应;A=B+C
置换反应A+BC=AC+B
复分解反应AB+BD=AD+BC
中和反应是属于复分解反应的
友情提示:本资料代表个人观点,如有帮助请下载,谢谢您的浏览!。
化学式及化学方程式的表示与应用

化学式及化学方程式的表示与应用化学式及化学方程式是化学领域中最基本的表达工具,它们用于表示物质的组成和化学反应过程。
本文将介绍化学式和化学方程式的表示方法,并探讨它们在实际应用中的重要性。
一、化学式的表示化学式用于表示物质的组成和结构。
根据需要表达的物质类型和特定的化学规则,化学式可以分为分子式、离子式和结构式等不同形式。
1. 分子式分子式用于表示分子物质的组成,以元素符号和下标的方式表示元素的种类和相对原子个数。
例如,水的分子式为H2O,其中H表示氢元素,O表示氧元素,下标2表示氢原子的个数。
2. 离子式离子式用于表示离子化合物的组成,包括阳离子和阴离子。
它使用方括号和电荷符号表示离子,电荷符号位于右上角。
例如,氯化钠的离子式为Na+[Cl-],其中Na+表示钠离子,Cl-表示氯离子。
3. 结构式结构式用于表示化合物的分子结构,它通过化学键和原子之间的连接方式展示分子的空间结构。
结构式可以是平面式、简化式或立体式,根据需要选择合适的方式来表示。
例如,乙醇的结构式可以表示为CH3-CH2-OH,其中CH3表示甲基基团,CH2表示亚甲基基团,OH 表示羟基。
二、化学方程式的表示化学方程式用于描述化学反应过程,包括反应物、生成物以及反应条件等信息。
通常,化学方程式可以分为简化方程式和离子方程式两种形式。
1. 简化方程式简化方程式用化学式表示反应物和生成物,并使用箭头表示反应过程。
例如,氢气与氧气反应生成水的简化方程式可以表示为2H2 + O2 → 2H2O。
2. 离子方程式离子方程式用离子式表示反应物和生成物,并使用箭头表示反应过程。
在溶液中进行的离子反应通常使用离子方程式表示。
例如,氯化钠与银硝酸发生反应生成氯化银和硝酸钠的离子方程式可以表示为NaCl + AgNO3 → AgCl↓ + NaNO3。
三、化学式和化学方程式的应用化学式和化学方程式在化学领域中具有广泛的应用,对研究和理解物质的性质和反应过程起着关键作用。
九年级上册化学文字表达式

九年级上册化学文字表达式
九年级上册化学教材中的一些常用文字表达式包括:
1. 化学反应方程式的表示:反应物+ 反应物→生成物+ 生成物
例如:2H₂ + O₂ →2H₂O
2. 元素符号的表示:元素符号通常使用拉丁字母的缩写形式,如氢(H)、氧(O)、碳(C)等。
3. 化学离子式的表示:离子式使用元素符号和带电荷的标记表示,正离子在负离子之前。
例如:氯化钠(NaCl)中,Na⁺是正离子,Cl⁻是负离子。
4. 化学平衡方程式的表示:反应物和生成物之间通过“+”连接,反应物和生成物的系数表示反应物和生成物的摩尔比例关系。
例如:2H₂ + O₂ →2H₂O 表示了氢气和氧气反应生成水的平衡方程式。
5. 化学式的表示:化合物的化学式由元素符号和下标表示,下标表示元素在化合物中的原子个数。
例如:二氧化碳(CO₂)中,C表示碳元素,O表示氧元素,数字2表示氧元素的个数。
这些表达式是九年级上册化学学习中常用的文字表达方式,通过它们可以更准确地描述化学反应、离子式和化合物的结构。
九年级化学上册化学式、化学方程式详解

化学式的书写(详解版)元素符号:1氢2氦3锂4铍5硼6碳7氮8氧9氟10氖H He Li Be B C N O F Ne○侵○害○你○皮○膨○碳○蛋○养○福○奶11钠12镁13铝14硅15磷16硫17氯18氩19钾20钙Na Mg Al Si P S Cl Ar K Ca○那○美○女○桂○林○留○绿○牙○加○钙铁Fe 铜Cu锌Zn 银Ag 钡Ba 锰Mn 汞Hg根的符号:名称:氢氧根(-1价)硝酸根(-1价)硫酸根(-2价)碳酸根(-2价)铵根(+1价)符号:OH- NO3 - SO4 2 - CO3 2 - NH4+记化合价:1、标化合价:(1)符号+、- 在前,数字在后;写在元素或根的正上方;(数字1不能省)HCl NaCl Na OH Na OH(2)金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价;NaCl Ca O(3)在化合物里,正、负化合价的代数和为0;P2O5:(+5)×2+(-2)×5=0√NaOH:(+1)+(-1)=0√或NaOH:(+1)+(-2)+(+1)=0√(4)一些元素在不同的物质中可显不同的化合价,这时元素的化合价就要通过计算得出。
如:KClO3中Cl的化合价计算方法:(+1)+X+(-2)×3=0 解得:X=+5 得出:KClO3 Fe2O3中Fe的化合价计算方法:2X+(-2)×3=0 解得:X=+3 得出:Fe2O32、记化合价:(一般只记只有一个化合价元素的化合价,或元素常见的化合价)(1)元素化合价的记忆(氯为-1价,氧和硫为-2价,其余都为正价)一价氢氯钠钾银,二价氧钙钡镁锌;HCl HCl NaCl KCl AgNO3CaO CaO BaSO4MgO ZnSO4三铝四硅五氮磷,二三铁、二四碳;Al2O3 SiO2HNO3P2O5FeO(氧化亚铁) Fe2O3(氧化铁) CO CO2二四六硫都齐全,铜汞二价最常见;H2S SO2H2SO4CuO(氧化铜) HgO Cu2O(氧化亚铜) Hg2O氢一氧二为标准,单质零价记心间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学式及化学方程式的书写(一)书写化学式的要领
一是要熟练记忆元素符号,
二是书写化合物的化学式时,要熟练记忆常见元素和原子团的化合价,
三是书写化合物的化学式要符合各元素正
负化合价的代数和为零的原则。
化学式的一般写法是:
(1)单质的化学式
除H2、O2、N2为双原子分子外,其余单质(稀有气体He、Ne、Ar、金属单质Fe、Cu、Ag和固态非金属单质CSP等)都是以元素符号表示其化学式。
(2)化合物的化学式
书写规律:先读后写,后读先写;排好顺序,写好角号。
一般将显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。
书写步骤:定位、标价、交叉约简和检验四步。
例如:写出氧化铝、硫酸、氢氧化铜和硫酸铁的化学式。
①定位:确定元素或原子团的顺序。
AlO、HSO4、CuOH、FeSO4
②标价:正确地在各元素或原子团的上方标出化合价。
+3-2 +1--2 +2--1 +3--2
AlO、HSO4、CuOH、FeSO4
③交叉约简:将化合价的绝对值交叉写在对方元素或原子团的右下方,能约简的要约为最简约数。
原子或原子团的个数为1时,通常1省去不写。
原子团在2个或2个以上时,应加上括号。
Al2O3、H2SO4、Cu(OH)2、Fe2(SO4)3
④检验:当正价总数与负价总数之和为零时,化学式正确。
(二)书写化学方程式的技巧
1.书写化学方程式的步骤
写好化学式—系数要配平—中间联等号—
条件要注清—生成气体或沉淀,要用箭号来标明。
2.化学方程式的配平
①最小公倍数法
这种方法适合常见的难度不大的化学方程式。
例如,KClO₃→KCl+O₂↑
2KClO₃→2KCl+3O₂↑
2KClO₃====2KCl+3O₂↑
练习Al+Fe3O4──Fe+Al2O3
②归一法
找到关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数。
若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数。
例:
1NH3+O2——NO+H2O
1NH3+O2——1NO+3/2H2O
1NH3+5/4O2——1NO+3/2H2O
4NH3+5O2===4NO+6H2O
练习:NH4NO3——N2+O2+H2O
FeS2 + O2——SO2 + Fe2O3
C2H6 +O2——CO2 +H2O
③观察法:
从化学式较复杂的一种生成物推求有关反应物化学式的化学计量数和这一生成物的化学计量数;根据求得的化学式的化学计量数,再找出其它化学式的倾泄计量数,这样即可配平。
Fe2O3+CO——Fe+CO2
Fe2O3 + 3CO——Fe + 3CO2
Fe2O3 + 3CO——2Fe + 3CO2
Fe2O3 + 3CO == 2Fe + 3CO2(反应条件高温)
练习:配平H2O + Fe →Fe2O3 + H2
④待定系数法
待定系数法的第一步是用英文字母表示各分子式前的系数。
举例:请用待定系数法配平下列反应式:Cu+HNO3(浓)——Cu(NO3)2+NO2↑+H2O根据题意的要求用英文字母表示各分子前的系数,于是得到如下反应方程式:
A·Cu+B·HNO3——C·Cu(NO3)2+D·NO2↑+ E·H2O…①
该法的第二步是根据质量守恒定律和电荷守恒定律列多元一次方程组 A = C B=2E B = 2C + D3B = 6C + 2D + E 该法的第三步是令方程组中某个未知数为“1”,然后解方程组。
根据题意的要求,我们令B = 1,代入方程组得下列方程组:A = C 1 = 2E 1 = 2C + D 3 = 6C + 2D + E解之得:A=1/4,C=1/4,D=1/2,E=1/2将A、B、C、D、E的数值代入反应方程式①得:1/4Cu+HNO3(浓)——1/4Cu(NO3)2+1/2NO2↑+1/2H2O……②
该法的第四步是若有的系数是分数,则要在化学反应方程式两边同乘以各分母的最小公倍数。
使分数变为整数。
根据题意的要求将方程②两边同乘以4得:Cu+4HNO3(浓)=== Cu(NO3)2+2NO2↑+2H2O。
