1.4 胶回收PCR产物(纯化)
胶回收、DNA产品纯化

*
2012-核酸纯化-01
罗金辉: 多交流,共同进步!
康为世纪产品培训之 DNA产物纯化、凝胶回收产品
主要内容
*
DNA产物纯化产品
凝胶回收产品
哪些客户,哪些实验会用?
*
PCR
DNA产物纯化/胶回收
酶切
50次
--
198
升级产品
200次
--
598
升级产品
CW0520
微量DNA产物纯化试剂盒
50次
198
258
CW0517
大量DNA产物纯化试剂盒
50次
258
298
CW0522B
寡核苷酸纯化试剂盒
20次
188
198
DNA产物纯化产品卖点:
DNA产物纯化产品
*
回收量大: 可获得多至20 ug的DNA
回收效率高:升级后的吸附柱回收DNA 效率更高。
100次
198
--
取消
200次
328
--
取消
CW2302
快速琼脂糖凝胶 DNA回收试剂盒
50次
--
198
升级产品
200次
--
598
升级产品
CW0524
微量琼脂糖凝胶 DNA回收试剂盒
50次
198
258
CW0518
大量琼脂糖凝胶 DNA回收试剂盒
50次
258
298
胶回收产品卖点:
胶回收产品
*
01
回收片段范围宽:50 bp-50 kb
02
胶回收方法全攻略

胶回收方法全攻略说到电泳凝胶的片断回收,想来在实验室久已的“老手”们都会不屑一顾。
确实,一般在各个和分子生物学沾到一点边儿的实验室里,从琼脂糖凝胶中回收DNA,仅仅是一种简单不过的常规实验操作。
虽说早期的凝胶电泳片断回收没有1—2个小时是搞不定的,每个实验室也有自己的独门秘诀,可后来各大品牌纷纷推出了了多种不同用途,不同价钱的快速凝胶回收试剂盒,一下子将胶回收的时间缩短到10多分钟,操作也大大简化,胶回收就变成“小菜一碟”了。
然而,从bbs逛上一圈下来,发现实际上还是有不少人为胶回收这种看似简单的操作而烦恼。
到底是什么导致了实验新手,甚至是老手在这个已经发展近40年的常规性实验中卡壳?由于胶回收的质量和数量直接影响后继的一系列实验——比如酶切连接、转化筛选、测序或者PCR 扩增、标记乃至显微注射等等,为大家搜罗各种产品和方法的优缺点,注意事项,做一个胶回收全攻略篇。
一、胶回收的关键参数胶回收的质量直接影响后继实验的成功与否。
要想做好胶回收,无论是自己亲力亲为还是借助目前五花八门的胶回收试剂,最基本的评定标准无外乎这么几个:质量( 回收产物的纯度和浓度),回收效率,操作方便(速度),柱子的载量等等。
回收产物质量:回收产物的质量主要指纯度。
常规电泳过程中,普通级别的琼脂糖自带的一些性状不明的多糖,会连同DNA一起从凝胶中抽提出来,会强烈抑制后继的连接、酶切、或者标记、扩增等实验。
从凝胶中回收DNA片断,产物的纯度自然是我们考虑的第一要务。
对于大片断DNA回收,质量还包括了产物的完整与否,如果机械剪切力使得回收产物大小不一致,后果决不是你希望碰见的。
而对于较小片断回收,质量其实还包括了回收产物的浓度。
因为产物浓度太小,对后继实验同样也有影响,比如连接、标记实验等等就很不爽,往往不得不再浓缩一次,增加了操作的复杂性。
此外,极微量的纯化介质或者是某些试剂混入回收产物中也会对结果产生致命的影响。
回收率:回收得率,是我们考虑的另一个重要参数。
DNA产物纯化

DNA产物回收及纯化(此步骤仅供参考)(此步骤仅供参考,具体操作根据试剂盒说明书操作)一、DNA回收1、实验准备:1)、仪器:核酸电泳仪、凝胶成像系统、天平、台式微量高速离心机、水浴锅2)、试剂:质粒、PCR产物、SanPrep柱式DNA胶回收试剂盒(上海生工)3)、器材:1.5ml 离心管、1000ul、200ul枪及枪头、刀、滤纸、保鲜膜2、实验流程:1、DNA样品制备2、胶回收电泳(100~120v(常取140V恒压),500mA(电流调至最大),30min(样品过胶盒1/3但不超过2/3))3、取1.5ml离心管称量,记录,铺放保鲜膜于桌面,准备滤纸、1000ul、200ul枪及枪头,刀,50℃水浴标号 1 2 3EP管EP管+胶重胶重Buffer B2(每100mg胶加300ul Buffer B2)加入1/3Buffer B2体积的异丙醇。
(选做)对于< 500bp 的片段4、从琼脂糖凝胶中割下含目标片段的胶块,称重,记录。
5、加入胶块重量倍的Buffer B2,50℃水浴5-10分钟溶胶。
6、(选做)对于< 500 bp 的片段,加入1/3Buffer B2体积的异丙醇。
7、将溶胶液移入吸附柱中,8,000 ×g离心30秒。
倒掉收集管中液体。
8、加入500 μl Wash Solution,9,000 ×g离心30秒,倒掉收集管中液体。
9、重复步骤8一次。
10、空吸附柱于9,000 ×g(1200rpm)离心1分钟。
11、空吸附柱开盖于超净台下吹风5min,使残留乙醇挥发12、将吸附柱放入一个干净的1.5 ml离心管中,在吸附膜中央加入30-40 μl Elution Buffer,室温静置1分钟后,离心1分钟。
-20℃保存管中DNA溶液。
13、取5ul质粒进行琼脂糖凝胶电泳,2ul于nanordrop 测量质粒的浓度及纯度,余于-200C保存备用.14 、计算回收率:纯化前DNA浓度*体积/纯化后DNA浓度及体积二、DNA产物纯化1、实验准备:1)、仪器:台式微量高速离心机,水浴锅2)、试剂:PCR产物、SanPrep柱式PCR产物纯化试剂盒(上海生工)3)、器材:1.5ml 离心管、1000ul、200ul枪及枪头2、实验流程:1、PCR样品制备2、在PCR反应液中加入5倍体积的Buffer B3,充分混匀。
PCR产物的克隆(DNA的胶回收和连接)技术方案及实验原理

PCR产物的克隆(DNA的胶回收和连接)技术方案及实验原理【实验原理】1.DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中,通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA 片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
2.利用Taq酶能够在PCR产物的3’末端加上一个非模板依赖的A,而T载体是一种带有3’T突出端的载体,在连接酶作用下,可以把PCR产物插入到质粒载体的多克隆位点,可用于PCR产物的克隆和测序。
商品化的T载体有很多。
本实验采用TaKaRa公司的pMDTM18-T Simple Vector。
这个载体以pUC19载体为基础,消除了pUC18载体上的多克隆酶切位点,经EcoRⅤ酶切后在两侧的3'端添上“T”制备而成(见附录1)。
由于本载体上消除了多克隆酶切位点,克隆后的PCR产物将无法使用载体上的限制酶切下,需要在PCR扩增引物上导入合适的酶切位点。
【试剂与器材】(一)试剂1.pMDTM18-T Simple Vector Kit(Takara公司)。
2.TAE电泳缓冲液3.琼脂糖(Agarose)4.6×电泳加样缓冲液:0.25%溴粉蓝,40%(w/v) 蔗糖水溶液,贮存于4℃。
2 / 95.溴化乙锭(EB)溶液母液:配制成10mg/mL,用铝箔或黑纸包裹容器,储于室温即可。
6.70%乙醇7.胶回收试剂盒(Omega公司)(二)器材水平式电泳装置,电泳仪,台式高速离心机, 恒温水浴锅, 微量移液枪, 微波炉或电炉,紫外透射仪, 凝胶成像系统或其它照相设备。
【操作方法】(一)胶回收试剂盒回收PCR产物(以Omega公司Gel Extraction Kit为例)1.当目的片段DNA完全分离时,转移凝胶至紫外灯上尽可能快地切下目的片段。
2.凝胶块转移至1.5ml离心管(离心管已经称重了)中,称重得出凝胶块的重量。
PCR产物的TA克隆(DNA的胶回收和连接) PCR实验技术

PCR产物的TA克隆(DNA的胶回收和连接)
【实验原理】
1.DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中,通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
2.利用Taq酶能够在PCR产物的3’末端加上一个非模板依赖的A,而T载体是一种带有3’T突出端的载体,在连接酶作用下,可以把PCR产物插入到质粒载体的多克隆位点,可用于PCR产物的克隆和测序。
商品化的T载体有很多。
本实验采用TaKaRa公司的pMDTM18-T Simple Vector。
这个载体以pUC19载体为基础,消除了pUC18载体上的多克隆酶切位点,经EcoRⅤ酶切后在两侧的3'端添上“T”制备而成(见附录1)。
由于本载体上消除了多克隆酶切位点,克隆后的PCR产物将无法使用载体上的限制酶切下,需要在PCR扩增引物上导入合适的酶切位点。
【试剂与器材】
(一)试剂
1.pMDTM18-T Simple Vector Kit(Takara公司)。
2.TAE电泳缓冲液
3.琼脂糖(Agarose)
4.6×电泳加样缓冲液:0.25%溴粉蓝,40%(w/v) 蔗糖水溶液,贮存于4℃。
1 / 9。
PCR产物胶回收实验
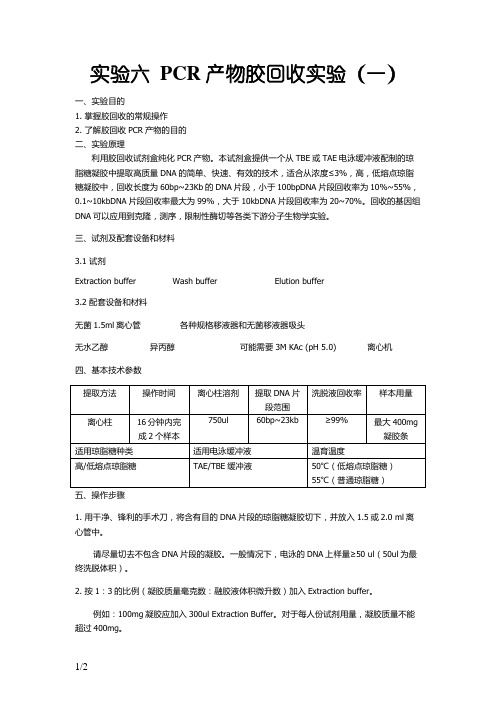
实验六 PCR产物胶回收实验(一)一、实验目的1. 掌握胶回收的常规操作2. 了解胶回收PCR产物的目的二、实验原理利用胶回收试剂盒纯化PCR产物。
本试剂盒提供一个从TBE或TAE电泳缓冲液配制的琼脂糖凝胶中提取高质量DNA的简单、快速、有效的技术,适合从浓度≤3%,高,低熔点琼脂糖凝胶中,回收长度为60bp~23Kb的DNA片段,小于100bpDNA片段回收率为10%~55%,0.1~10kbDNA片段回收率最大为99%,大于10kbDNA片段回收率为20~70%。
回收的基因组DNA可以应用到克隆,测序,限制性酶切等各类下游分子生物学实验。
三、试剂及配套设备和材料3.1 试剂Extraction buffer Wash buffer Elution buffer3.2 配套设备和材料无菌1.5ml离心管各种规格移液器和无菌移液器吸头无水乙醇异丙醇可能需要3M KAc (pH 5.0) 离心机四、基本技术参数1. 用干净、锋利的手术刀,将含有目的DNA片段的琼脂糖凝胶切下,并放入1.5或2.0 ml离心管中。
请尽量切去不包含DNA片段的凝胶。
一般情况下,电泳的DNA上样量≥50 ul(50ul为最终洗脱体积)。
2. 按1:3的比例(凝胶质量毫克数:融胶液体积微升数)加入Extraction buffer。
例如:100mg凝胶应加入300ul Extraction Buffer。
对于每人份试剂用量,凝胶质量不能超过400mg。
3. 于恒温水浴或金属浴中50℃温育,直到凝胶融化。
一般温育时间为10分钟,温育过程中没隔23分钟混匀一次。
如果温育后,混合液体颜色变紫,请加入10 ul 3M KAc (pH 5.0),使混合液颜色变回黄色。
4. 可选:按1:1的比例(凝胶质量毫克数:异丙醇体积微升数)加入异丙醇,并混合均匀。
如DNA片段大于500bp/小于4kb,不需要加异丙醇。
5. 将混合液全部转移到Spin column内,于6,000g离心1分钟,并弃去接液管内液体。
PCR产物胶回收实验

PCR产物胶回收实验引言:PCR(聚合酶链式反应)是一种用于扩增DNA片段的常用技术。
在PCR实验中,扩增产物通常需要从琼脂糖凝胶上回收和纯化,以便进一步的分析和应用。
本文将介绍一种PCR产物胶回收的实验方法。
实验材料:1. 扩增产物:经过PCR扩增得到的DNA片段。
2. 琼脂糖凝胶:用于扩增产物分离和纯化。
3. 胶回收缓冲液:用于胶回收的缓冲液。
4. 真空浓缩仪:用于回收DNA片段。
5. 无菌纯水:用于制备实验溶液。
6. DNA电泳仪:用于检测和分析PCR产物。
实验步骤:1. 准备琼脂糖凝胶:a. 根据实验需要,制备适合的琼脂糖凝胶。
b. 加入适量的琼脂糖凝胶染料(如安全染料)。
2. 进行PCR扩增:a. 根据所需扩增片段的序列,设计引物,并合成引物。
b. 准备PCR反应体系,包括DNA模板、引物、Taq DNA聚合酶等。
c. 进行PCR扩增反应。
3. 分析PCR产物:a. 用电泳法将PCR产物与DNA标准品一同进行电泳。
b. 根据需要,记录PCR产物的迁移距离和片段大小。
4. 准备胶回收缓冲液:a. 根据实验所需,制备合适的胶回收缓冲液。
5. 胶回收:a. 使用刮胶刀将PCR产物切下,放入离心管中。
b. 添加足够的胶回收缓冲液,使产物完全浸没其中。
c. 低温热激活离心管以使产物与缓冲液充分混合。
d. 放入离心机中离心,以使产物完全沉积到离心管底部。
6. 剔除上清:a. 使用吸走器小心地吸取上清,避免吸取产物。
b. 检查离心管底部是否完全干燥,如有残余液体则继续吸取。
7. 回收DNA片段:a. 加入适量的无菌纯水,以溶解和洗涤DNA片段。
b. 用手轻轻摇晃离心管,使DNA片段溶于水中。
c. 使用真空浓缩仪,将溶解的DNA片段浓缩至所需浓度。
8. 分析纯化后的PCR产物:a. 用电泳法将纯化后的PCR产物与DNA标准品一同进行电泳。
b. 检查PCR产物的迁移距离并与之前的分析结果进行比较。
结论:通过PCR产物胶回收实验,我们成功地从琼脂糖凝胶中回收和纯化了PCR扩增的DNA片段。
PCR产物回收说明书
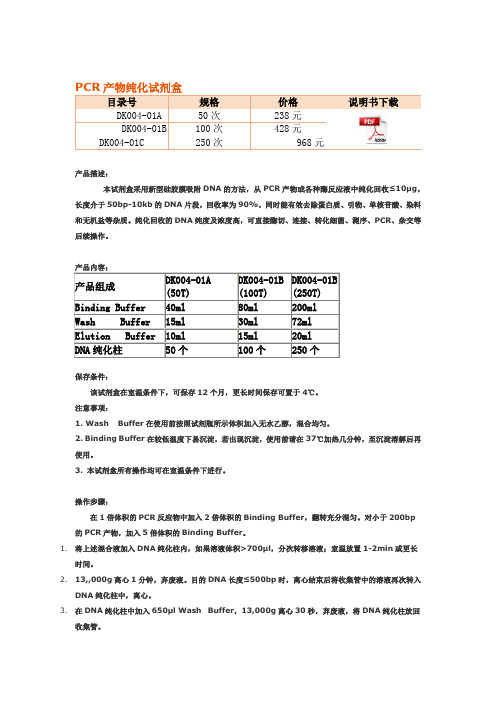
在1倍体积翻转充分混匀。对小于200bp的PCR产物,加入5倍体积的Binding Buffer。
1.将上述混合液加入DNA纯化柱内,如果溶液体积>700μl,分次转移溶液;室温放置1-2min或更长时间。
2.13,,000g离心1分钟,弃废液。目的DNA长度≤500bp时,离心结束后将收集管中的溶液再次转入DNA纯化柱中,离心。
PCR产物纯化试剂盒
目录号
规格
价格
说明书下载
DK004-01A
50次
238元
DK004-01B
100次
428元
DK004-01C
250次
968元
产品描述:
本试剂盒采用新型硅胶膜吸附DNA的方法,从PCR产物或各种酶反应液中纯化回收≤10μg,长度介于50bp-10kb的DNA片段,回收率为90%,同时能有效去除蛋白质、引物、单核苷酸、染料和无机盐等杂质。纯化回收的DNA纯度及浓度高,可直接酶切、连接、转化细菌、测序、PCR、杂交等后续操作。
建议:加入Elution Buffer后将柱子整个温育5min后再离心洗脱可以增加DNA回收效率。
对大于8Kb的片段,加溶液Elution Buffer后将柱子整个温育15-30min可以提高回收效率。
1.13,000g离心1 min,所得液体即为高纯度DNA。
产品内容:
产品组成
DK004-01A
(50T)
DK004-01B
(100T)
DK004-01B
(250T)
Binding Buffer
40ml
80ml
200ml
Wash Buffer
15ml
30ml
72ml
pcr产物纯化回收跑胶试验结果分析

pcr产物纯化回收跑胶试验结果分析PCR产物的回收(玻璃奶吸附法)SYBR会使DNA部分显出绿色荧光,在紫外灯下辨认绿色荧光,可将胶切下。
实验结果及分析本次试验中,在最后一步检测中看到了荧光,说明了DNA的存在,证明回收到了PCR的产物PCR产物的直接纯化:一、原理PCR产物一般都含有过量的引物、Taq DNA酶及dNTP,这些成分的存在将直接影响到后续的酶切、双脱氧PCR测序反应等过程,因此有必要除去。
目前核酸纯化的方法有很多,商用化试剂盒的出现使得DNA的纯化过程变得更加简便快捷。
本实验中, Buffer PCR-A促使大于100bp 的DNA片段选择性地吸附到 silica膜上。
经 Buffer W. BufferW2洗涤去除残留在sica膜上的小于50-mer的引物、酶蛋白、单核苷酸、荧光染料或放射性同位素标记的单核苷酸后,吸附到sica膜上的DNA片段经微量水或 Eluent洗脱下来,即可用于各种分子生物学的操作。
二、材料与方法1、材料PCR产物2、仪器、用具恒温孵育器(65C)、离心机、移液器、1.5ml离心管3、试剂Buffer_PCR -A Buffer w1;已加无水乙醇的 Buffer V2 Eluent或去离子水4、方法(1)在PCR反应液中加入3倍体积的Buffer PCR-A若需加入的BufferPCR-A不足100ul,则加入100ul。
(2)将DNA --prep Tube置于2 -ml Microfuge Tube中,将步骤(1)中的混合液移入DNA -prep Tube I中,5500rpm离心1min。
(3)弃滤液,将DNA -prep Tube置回到原2 -ml Microfuge Tube 中,加入500 ul Bufer W1,5500rpm离心1min。
(4)弃滤液,将DNA -prep Tube置回到原2 -ml Microfuge Tube 中,加入700山已加无水乙醇的 Buffer V2,5500rpm离心1min,以同样的方法再用700山己加无水乙醇的 Buffer\2洗涤一次。
pcr产物回收原理

pcr产物回收原理PCR产物回收原理。
PCR(聚合酶链式反应)是一种用于扩增DNA片段的技术,它是分子生物学领域中非常重要的工具。
在PCR过程中,产生了大量的PCR产物,而回收这些产物对于后续的实验和分析非常重要。
本文将介绍PCR产物回收的原理及方法。
PCR产物回收的原理主要包括DNA片段的寡聚物纯化和DNA片段的凝胶回收两个方面。
首先,DNA片段的寡聚物纯化是指通过将PCR产物与寡聚物结合,然后利用寡聚物的亲和性将DNA片段纯化出来。
这种方法可以有效地去除PCR反应体系中的盐离子、引物和聚合酶等杂质,从而得到纯净的DNA片段。
其次,DNA片段的凝胶回收是指将PCR产物通过琼脂糖凝胶电泳分离出来,然后通过切割凝胶并使用凝胶回收试剂盒将DNA片段从凝胶中提取出来。
这种方法可以根据DNA片段的大小选择性地回收目标片段,从而得到所需的DNA片段。
在实际操作中,可以根据实验需求选择合适的回收方法。
下面将介绍两种常用的PCR产物回收方法。
首先是寡聚物纯化法。
这种方法通常使用商业化的DNA寡聚物纯化试剂盒,通过将PCR产物与寡聚物结合,然后通过洗涤步骤将DNA片段从其他杂质中分离出来。
这种方法操作简单,纯化效果好,适用于小规模的PCR产物回收。
其次是凝胶回收法。
这种方法通常需要进行琼脂糖凝胶电泳,将PCR产物按照大小分离出来,然后通过切割凝胶并使用凝胶回收试剂盒将DNA片段从凝胶中提取出来。
这种方法适用于需要回收多个目标片段或者需要大量PCR产物的情况。
总的来说,PCR产物回收是PCR技术中非常重要的一步,它直接影响到后续实验的结果和分析。
选择合适的回收方法并严格按照操作步骤进行操作,可以有效地得到纯净的DNA片段,为后续的实验和分析奠定基础。
在实际操作中,需要注意操作规范,避免污染和损失,保证回收的PCR产物质量和数量。
同时,根据实验需求选择合适的回收方法,并结合实际情况进行操作,可以提高PCR产物回收的效率和质量。
pcr产物回收原理

pcr产物回收原理PCR产物回收原理。
PCR(聚合酶链式反应)是一种常用的分子生物学技术,它可以在体外扩增DNA片段,为分子生物学研究和临床诊断提供了重要的工具。
在PCR反应中,产物回收是一个关键步骤,它可以影响到PCR产物的纯度和浓度。
本文将介绍PCR产物回收的原理及相关技术。
一、PCR产物回收原理。
在PCR反应中,经过多轮循环扩增后,会得到目标DNA片段的大量产物。
但是,这些产物通常还伴随着引物、酶、盐类等多种杂质。
为了进一步的应用,需要对PCR产物进行回收和纯化。
PCR产物回收的原理主要包括DNA与固相载体的结合、杂质的去除和洗脱等步骤。
首先,PCR产物与固相载体发生特异性结合。
固相载体通常是硅胶膜、硅胶柱或磁珠等材料,它们能够与DNA发生亲和结合,而杂质则被去除。
其次,通过洗脱步骤,可以将目标DNA从固相载体上解离出来,从而得到纯净的PCR产物。
最后,经过洗脱和浓缩处理,可以得到高浓度、高纯度的PCR产物,为后续实验提供良好的基础。
二、PCR产物回收的常用技术。
1. 硅胶膜法。
硅胶膜法是PCR产物回收的常用技术之一。
在该方法中,PCR产物首先与硅胶膜发生结合,然后通过洗脱步骤将目标DNA洗脱下来。
硅胶膜法具有操作简单、成本低廉的优点,适用于小规模PCR产物的回收。
2. 硅胶柱法。
硅胶柱法是一种高通量PCR产物回收技术,通过硅胶柱的柱塞作用,可以快速、高效地将PCR产物纯化。
硅胶柱法适用于大规模PCR产物的回收,可以同时处理多个样品,提高实验效率。
3. 磁珠法。
磁珠法是一种新兴的PCR产物回收技术,通过在磁场作用下,使带有亲和基团的磁珠与PCR产物结合,然后利用磁力分离的原理实现PCR产物的回收和纯化。
磁珠法具有操作简便、高效快速的特点,适用于高通量PCR产物的回收。
三、PCR产物回收的应用。
PCR产物回收技术在分子生物学研究和临床诊断中有着广泛的应用。
例如,在基因克隆、测序分析、基因表达定量等实验中,都需要对PCR产物进行回收和纯化。
第二部分dna产物纯化和凝胶回收

第二部分 DNA产物纯化和凝胶回收分子生物学实验中经常用到基因克隆及载体构建,而PCR和酶切是基因克隆最常用到的技术,在PCR反应中有模板、引物、酶及其他盐类等物质参与,酶切实验中也往往涉及内切酶、其他蛋白及盐类等,这些杂质对后续的实验一般具有较大的影响,因此,必须对目的DNA产物进行纯化。
纯化的方式有直接纯化与切胶纯化,具体运用哪种纯化方法要视具体情况而定。
DNA产物纯化试剂盒:适用于酶切或PCR产物中只有一条DNA片段或所有的片段都需要回收,这种试剂盒属于直接纯化,不需要凝胶电泳,直接对反应产物进行纯化回收。
琼脂糖凝胶回收试剂盒:最常用、适用于绝大多数的DNA纯化实验,可从多条DNA 片段中纯化其中一条或几条。
这种试剂盒属于切胶纯化,需要凝胶电泳,如测序或构建载体,就要对目的条带采取该方法处理。
通用型DNA纯化回收试剂盒:既可以对凝胶溶解纯化,又可以直接对溶液纯化。
本公司生产的DNA纯化回收试剂盒采用可与核酸特异吸附的硅胶膜,通过在低pH和高盐缓冲液中结合DNA,在高pH值和低盐缓冲液或水中洗脱DNA的原理,达到纯化DNA 产物的目的,同时去除各种蛋白质、无机盐和有机物杂质等。
DNA片段回收与纯化技术简介质粒、噬菌体等经酶切、电泳,PCR产物或PCR产物经电泳后,常常需要对其中一些DNA片段进行回收和纯化,以用于克隆、测序或探针标记等实验。
经典DNA回收和纯化常用方法有压碎法、低融点琼脂糖法、冻融法等,由于这些方法操作复杂,回收率偏低等缺点,很少有人再用。
凝胶溶解系统的改进,硅胶吸附膜的利用,使DNA片段回收纯化变得更为容易,目前市场上销售的纯化回收试剂盒大都采用离心柱与硅胶膜结合的模式,以这种方法纯化回收,操作简便,用时短,回收效率高。
DNA片段纯化与回收试剂盒的工作原理在获得DNA片段后,采用吸附材料与之结合,通过漂洗液的清洗去除杂质,用水或洗脱液回收。
目前大多数生物公司都采用硅胶膜作为吸附介质,可以特异地吸附DNA片段,有效去除体系中的蛋白、盐类和有机物质。
PCR产物纯化

PCR产物纯化和切胶回收一、pcr产物纯化PCR扩增完成后需要进行琼脂糖凝胶电泳检测,在条带单一无其他杂带的情况下,可以直接对产物进行纯化,常见的纯化方法有:1、硅胶层析柱法原理:大多数离心柱中吸附DNA的是一层硅胶膜,实际上就是一层玻璃纤维,其表面有大量修饰的硅羟基(Si-OH),硅羟基在溶液中解离后带负电,然后与带正电盐离子、带负电DNA形成电桥,从而吸附住DNA,使得DNA双链变单链,不会被生物大分子溶剂洗脱,但能经水溶性缓冲液水化后,被定量回收,从而实现纯化分离。
2、磁珠法(abs60151)原理:磁珠是有磁性的能吸附DNA的物质,其内部核心是铁离子,在磁场作用下可以吸附在磁体上。
在核心外,经过羧化,带有羧基基团,在特定的离子条件下,可以与DNA结合。
结合后,在外磁场的作用下,磁珠与DNA结合体移动到磁体周围,可以很方便去除其他多余的液体,这时,不能与磁珠结合的所有杂质都随水溶液一并去除。
然后,在洗脱条件下,DNA与磁珠分离,溶解在水中,将溶解有DNA的溶液转移,就得到了纯化后的DNA样本。
3、其他纯化方法①渗透液结合醇沉纯化原理:利用分子大小不同,小分子的物质能够通过渗透膜溶解到大量的溶液中去,而大分子的物质不能通过渗透膜,所以继续留存在透析袋中,通过乙醇沉淀最后达到去除小分子物质,得到纯化的有机大分子的效果。
②直接沉淀纯化原理:DNA分子在高盐离子醇溶液中会被沉淀出来,而其他物质继续溶液在溶液中,沉淀出来的DNA分子经过离心与溶液成分分开,达到纯化的目的。
二、凝胶回收纯化如电泳检测结果存在非特异性条带,则需要将目的条带切出来,再用胶回收试剂盒(abs60098)对凝胶进行回收纯化,相较于直接纯化,只是多了一步溶胶的过程,相应的产物纯度提高,回收率则下降。
附:在PCR扩增完成后,反应体系中除了DNA片段,还存在离子、dNTP、引物及聚合酶等物质,这些物质会影响后续克隆测序等实验,因此对其产物进行纯化是必不可缺的步骤,不同的纯化手段各有自己的优缺点。
PCR产物纯化回收试剂盒操作方法及步骤说明书
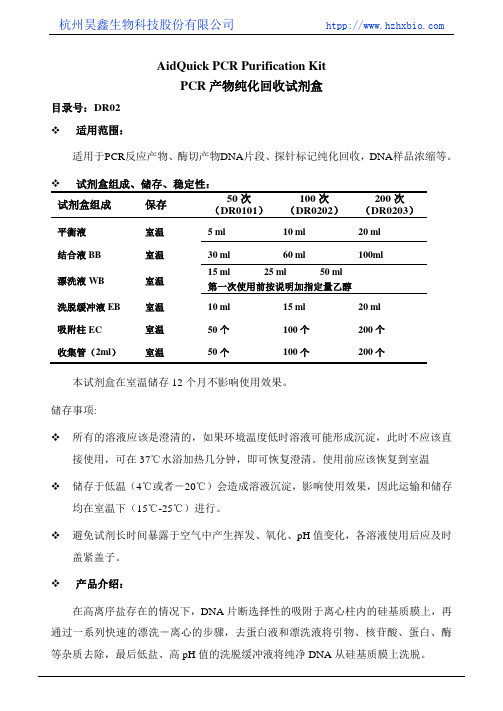
杭州昊鑫生物科技股份有限公司 htpp://AidQuick PCR Purification KitPCR产物纯化回收试剂盒目录号:DR02适用范围:适用于PCR反应产物、酶切产物DNA片段、探针标记纯化回收,DNA样品浓缩等。
试剂盒组成、储存、稳定性:试剂盒组成保存50次(DR0101)100次(DR0202)200次(DR0203)平衡液室温 5 ml 10 ml 20 ml 结合液BB 室温30 ml 60 ml 100ml漂洗液WB 室温15 ml 25 ml 50 ml 第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温10 ml 15 ml 20 ml吸附柱EC 室温50个100个200个收集管(2ml)室温50个100个200个本试剂盒在室温储存12个月不影响使用效果。
储存事项:所有的溶液应该是澄清的,如果环境温度低时溶液可能形成沉淀,此时不应该直接使用,可在37℃水浴加热几分钟,即可恢复澄清。
使用前应该恢复到室温储存于低温(4℃或者-20℃)会造成溶液沉淀,影响使用效果,因此运输和储存均在室温下(15℃-25℃)进行。
避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
产品介绍:在高离序盐存在的情况下,DNA片断选择性的吸附于离心柱内的硅基质膜上,再通过一系列快速的漂洗-离心的步骤,去蛋白液和漂洗液将引物、核苷酸、蛋白、酶等杂质去除,最后低盐、高pH值的洗脱缓冲液将纯净DNA从硅基质膜上洗脱。
产品特点:1. 离心吸附柱内硅基质膜全部采用进口世界著名公司特制吸附膜,柱与柱之间吸附量差异极小,可重复性好。
克服了国产试剂盒膜质量不稳定的弊端。
2. 使用了优质结合液,不含传统结合液的碘化钠和高氯酸盐,不抑制回收后酶切、连接克隆等下游反应。
3. 结合液加酚红调制成为了黄颜色,便于监测pH值变化从而达到最佳结合效果,大大提高回收效率。
4. 快速、方便,不需要使用有毒的苯酚、氯仿等试剂,也不需要乙醇沉淀。
关于胶回收

胶回收一. 提高胶回收量的办法:1)增加电泳时的上样量。
2)电泳缓冲液用新鲜配制的。
3)切胶时尽量只切有条带的胶,减小切胶体积:含目的片断很少的胶就不要要了,不然影响回收率。
4)把切的两块或多块胶融化后,无论多大的体积都用一个管子,转移到同一个柱子上。
5)溶胶时所加的溶液可多一点,这样更有利于DNA与膜的结合,不过一般不要多余750ul。
6)胶回收的关键是通过柱子的溶液的盐浓度、酸碱性(电荷)和疏水性使DNA与柱子结合,因此,若电泳缓冲液的PH偏高,可在溶胶液中加入10ul (PH 5.0,3mol/L的 NaAC);为了使DNA分子更好的拦截在膜上,可以添加30%异丙醇在加热溶解胶后的液体里。
7)加洗脱液之前,将柱子在室温放置几分钟(大约需10分钟),以使乙醇充分挥发。
8)最后少加些洗脱液,尽量减少回收体积,一般用30-50μl洗脱液洗脱(不能太少,否则无法浸湿膜反而不利于洗脱);洗脱液滴在膜中央,以充分洗脱结合在膜上的DNA。
9)可以在加入洗脱液之后,可以在55度水浴5分钟或放在50度水浴10分钟以上再洗脱,或用封口膜密封4度过夜,第二天再离心回收,效果不错。
10)将离心后的洗脱液加回吸附柱,再次离心。
DNA胶回收实验技术总结胶回收一. 提高胶回收量的办法:1)增加电泳时的上样量。
2)电泳缓冲液用新鲜配制的。
3)切胶时尽量只切有条带的胶,减小切胶体积:含目的片断很少的胶就不要要了,不然影响回收率。
4)把切的两块或多块胶融化后,无论多大的体积都用一个管子,转移到同一个柱子上。
5)溶胶时所加的溶液可多一点,这样更有利于DNA与膜的结合,不过一般不要多余750ul。
6)胶回收的关键是通过柱子的溶液的盐浓度、酸碱性(电荷)和疏水性使DNA与柱子结合,因此,若电泳缓冲液的PH偏高,可在溶胶液中加入10ul(PH 5.0,3mol/L的 NaAC);为了使DNA分子更好的拦截在膜上,可以添加30%异丙醇在加热溶解胶后的液体里。
PCR产物纯化

1.PCR产物纯化方法酒精/NaAc法1 每管加入1/10体积的3 M NaAc,到管底2 每管加入2.5倍体积的100% 酒精,混匀;3 2000-3000 xg离心30 min,倒置96孔板离心至185 xg停止离心,去除酒精;4 每管加入100 µL 70% 酒精,1650 xg 4°C离心15 min,倒置96孔板离心至185 xg停止离心,去除酒精;5 重复70% 酒精洗涤1次;6 让残余的酒精挥发干,加入原体积一半的去离子水溶解DNA。
该方法是最经典经济的PCR产物纯化再测序方法,使用该方法纯化后可以直接交给公司做测序反应,而且效果不比割胶纯化差!!!附试剂配置:3M NaAc注意:不同测序MIX采用不同PH值,如MIX1.0、2.0和3.0: pH4.6; 1.1 和3.1: pH5.2(MIX为ABI公司,当前国内测序仪一般为ABI公司生产),102.06 g NaAc•3H2O溶于200mLdH2O中,冰醋酸调至pH5.2,定容至250 mL,分装,高压消毒。
125 mMEDTA按照《分子克隆》配制。
2.具我的经验pcr产物纯化并不一定要用试剂盒,我用自己的方法纯化的效果反而更好,而且节约!!步骤如下:1.紫外灯下切胶,(目的片段)2.TE 溶.3.取溶液,用氯仿, Tris- 饱和酚抽提数次,3-44,无水酒精沉淀,5.70%酒精洗2次6.-20 保存即可3.P CR产物不一定用试剂盒纯化,我一般用低熔点琼脂糖纯化,效果很好:1。
PCR产物低熔点琼脂糖凝胶电泳,80V,30min。
2。
紫外灯下尽可能的把多余的胶切掉。
将胶放入1.5ml的EP管里。
3。
70度加热10分钟,让胶充分熔化,加入两倍体积的TE。
混匀4。
加入等体积的苯酚、氯仿抽提,4000RPM离心10分钟,吸取上清于另一离心管内,注意不要把白色物质(低熔点琼脂糖)吸上来。
5。
1/10醋酸钠、2倍体积的无水乙醇沉淀DNA,-20度1-2小时6。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、目的基因的扩增
(四)、PCR产物的提纯
实验目的:
回收得到纯的目的DNA,去除影响DNA连接酶活性的物质及其它DNA片段。
纯化产物用于酶切和连接反应。
主要实验仪器:
冰箱,为试剂、样品或菌种提供冷冻、冷藏的保存环境制冰机,用于制备碎冰块
微量移液器,用于吸取微量试剂及样品
超净工作台,提供无菌工作台面
常温离心机,用于样品的常温离心分离
核酸电泳仪,用于核酸的电泳分离分析
主要实验室剂:
酚/氯仿/异戊醇、无水乙醇、70%乙醇、TE。
实验步骤:
将PCR反应液转入1.5ml离心管中,加入50ulTE和100ul 酚/氯仿/异戊醇,盖好离心管盖子,上下颠倒混匀。
将管置于离心机中,12000rpm离心5min。
取上清,加入1/10体积3mol醋酸钠和2.5倍体积预冷的无水乙醇,上下颠倒混匀,室温放置20min沉淀DNA。
将管置于离心机中,12000rpm离心10min。
离心后现象:(图片)。
弃上清,加入1ml70%乙醇,12000rpm离心5min。
离心后现象:(图片)。
弃上清。
将管口打开,倒置于纸巾上数秒,使液体尽可能流尽,再平放于纸巾上室温干燥10min。
加30ulTE溶解沉淀,取5ul样品跑电泳。
电泳图谱为:(图片)。
确认回收到PCR产物后,剩余样品置于-20℃冰箱中备用,用于酶切。
END。
