GSK_generateGMPCPDF_GSK天津被收回EUGMP证书
药企GMP证书被收回说明了什么

药企GMP证书被收回说明了什么回头看看2014年,不断地有GMP证被收回,被收回的GMP 证书集中在中药饮片、中药注射剂领域。
从数量上看,广东省、安徽省等中药材前处理、炮制的大省份相对多一些。
在新版GMP推行之后,回访式飞检悄然多了起来,药监部门正在慢慢增加着“主动型”飞检。
取得GMP证仅仅是一个开始,是进入这个行业的基本门槛,并不代表着“最高任务”。
但很长时间以来,很多制药企业都把取得GMP证、通过各种认证检查当做“首要任务”,似乎只要把各种核查应付过去之后,就可以松口气,瞬间就松散了,整个质量管理处在“管一管,好一好”的波动式状态。
主动式飞检的增加,从一定程度上对企业起到了警示的作用,而且现在的飞检不仅仅是形式上的,查到问题也不仅仅“责令整改”,确实有了“真刀真枪”的惩戒措施。
一直以来,公众潜意识地认为,严重的惩罚似乎只会出现在“小企业”,毕竟小企业本身的实力较为薄弱,也容易查出问题;而“大企业”相对来说实力强,投入大,操作规范。
而且知名药企都是当地的税收大户,所以公众想当然以为地方药监部门难免会有一些“顾虑”。
然而近年的事实证明,监管部门认定的是客观事实,和其他因素无关。
只要不符合相关标准,就得不到认可。
从保障患者和整个行业健康发展的角度出发,只有符不符合标准之分,而没有企业大小之分。
不符合认证条件的,只有暂时退出,什么时候符合标准了,什么时候再进入。
在这样一个攸关社会基本健康权益的行业里,本来就不应该有什么“面子”、“特权”可言。
行业在进步之中,不可避免地需要舍弃一些东西,就好像一棵植物要长得好,有时就得去掉“残枝枯叶”,甚至一刀剪掉“顶端优势”,因为那是不得不做的事情。
这种“去掉”依托两种途径:市场的自然淘汰,以及监管部门的执法监督。
市场经济会用自己的方式逐步淘汰一些在质量、价格、核心竞争力上都不占优势的企业,而监管部门的督查手段则行之有效地直接将不合规企业拦在了门外。
这是不同的角色行使不同的职权,起到了互相推进的作用。
药企哪些行为会导致GMP证书被收回呢?

药企哪些行为会导致GMP 证书被收回呢?
,药企对药材商审计不全也是重大失误。
另外,去年广东食药监局收回一家药企GMP 证书时,其原因是该药企委托另外一家药企生产,但是,被委托公司存在中西药生产交替共线进行,清场不彻底等问题,这影响该药企产品质量,由此带来的后果两家药企的GMP 证书均被撤销。
二、中药饮片企业的不可触碰的雷区。
今年,中药饮片是国家局飞检的重点,国家局披露的飞检的目标主要是饮片企业,那么,饮片企业的雷区在哪里呢?
1,生产记录造假,多家饮片企业被查的原因都包括生产记录作假。
而且从药监局的披露来讲,这些作假的技术含量极低,例如,有饮片企业车间切药岗位仅有1 名操作人员,但相关生产记录显示,多个批次产品同一时间段内由同一个人进行切制。
如此脱离实际,实在是作假水平太低了。
当然也有需要专业知识鉴定的造假,例如,有药企就被发现热风循环烘箱、高效液相色谱仪,与目前所生产的中药饮片品种、数量不相匹配,由此被发现造假。
2,检验记录造假。
中药饮片没有按照《中国药典》等法定质量标准全检,对产品未做含量测定、重金属及有害元素检验。
3,超范围生产中药饮片,其中需要特别注意的是毒性饮片的销售问题,有几家饮片企业就是因为炮制范围不包括毒性饮片备查,因此,度过炮制的饮片是有毒的,切记申请审批。
4,生产管理混乱。
包括车间清洁不彻底,生产设备无清洁状态标识;饮片无货位卡标示,饮片不集中存放;不设立原药材阴凉库,不按规定阴凉。
EU GMP欧盟GMP中文版

欧盟药品管理规则第 4 卷药品生产质量管理规范1998 版欧洲共同体前言欧洲共同体制药工业在药品的开发,生产和控制过程中保持高标准的质量保证。
上市许可系统保证由有能力的权威机构对药品的安全,质量和有效性是否达到相应的规定进行评估。
生产许可系统保证在欧洲市场上获准销售的药品是由授权的生产商生产,其日常活动由权威机构定期检查。
无论是在欧共体之内销售,还是在欧共体之外销售,所有欧共体的药品生产企业都必须通过生产许可。
有两个药品生产和质量管理指导原则,药品生产和质量管理规范(GMP)和指南来源于两个指导原则, 一个是人用药物指导原则(指导原则91/356/EEC)一个是兽用药物指导原则(指导原则91/412/EEC),这两个指导原则1991年被欧共体采纳。
根据这些原则,制定了详细的药品生产和质量管理规范,用于对申请生产许可的企业进行评估和对药品生产企业进行检查的基础。
GMP的原则和详细的指南适用于需要按照第16条75/319/ EEC和修改的第24条81/851/EEC要求认证的所有的操作。
也与所有其它大规模药品生产过程,诸如医院负责的临床试验用药的制备有关。
所有的成员国和工业企业本身都同意GMP适用于人用药物的生产,也适用于兽用药物的生产。
在两个附录中对兽用药品和兽用免疫药品的GMP指南做了详细的调整。
指南用章来表述,每章用标题来概括章节的原则内容。
第一章质量管理列出了药品生产的质量保证的基本概念。
后续各章的原则列出了质量保证的目标和提供了足够的让生产商在执行这一原则时所必须考虑的基本要素。
这一指南除了在9个章节中表述了GMP的基本要素外, 还包括一系列附录提供了与之有关的活动的特定范围的细节。
有时几个附录同时使用,如关于无菌制剂,辐射性药物,生化药物的附录。
在附录后还列出了这一指南所使用的术语表.指南的第一版在1989 年出版, 包括一个无菌药品生产的附录。
第二版在1992 年1月出版; 欧共体指到原则包括给人用药品和兽用药品的GMP提供原则和指南的欧共体于1991 年6月13 日颁布的91/356指导原则和1991 年7月23 日颁布的91/412指导原则。
全国收回药品GMP证书舆情分析报告

全国收回药品GMP证书舆情分析报告一、舆情概述随着国内医药产业的发展,制药行业在实施药品GMP的历程中,也逐步迈向规范化保证、体系化管理、精细化要求和科学化生产的阶段,经历了近二十年三版药品GMP的修订和实施,在保障人民用药安全、规范企业生产、促进产业发展的各个方面,药品GMP基本出色的完成了其“历史使命”,但应该深刻的认识到,药品GMP认证不是一劳永逸的,通过了药品GMP认证,不等于企业就拥有一个药品GMP车间,更不等于生产出来的产品符合药品GMP的要求,也不能就此判定为是质量可控,符合注册用途的产品。
正如很多通过了药品GMP认证的企业,仍然可能出现产品质量问题,甚至是违法违规的问题。
这就是近两年药品飞行检查被提上监管新常态的原因,鉴于飞行检查的突出特点,即突然性、独立性和高效性,使其在查清问题、管控风险和震慑业内方面起到重要作用。
2014年“飞检”成为业内热点名词,食药总局曾于2014年5月、11月二度公开《药品飞行检查办法(征求意见稿)》征集意见,最终《药品医疗器械飞行检查办法》于2015年5月18日经国家食药总局局务会审议通过,于9月1日起正式实施。
一边是新的监管思路的探索、一边是飞检工作如火如荼的进行,2014-2015年飞检曝光、收回药品GMP证书和立案查处等事件频发,净化行业的“大洗牌”似乎已经到来。
为了准确反映药品飞行检查的时效性、体现风险管理和风险研判的成果,省审核查验中心对2015年全国收证相关舆情进行监测,并建立舆情监测数据库,本次舆情监测信息来源为汇总2015年国家总局网站“飞检专栏”和各省局曝光平台的飞检、收证以及各类专项检查等信息,通过数理统计和汇总分析,力图客观反映当前行业存在的系统性、区域性风险和趋势,为省内的药品GMP认证检查、飞行检查、药品GMP跟踪检查和各类专项检查,以及日常监管工作中,如何针对问题,发现问题,以问题为导向,形成监管政策提供思路和数据支持。
二、数据量化对比分析(一)2015年收证整体情况2015年,国家总局网站-专题专栏-飞检专栏合计发布飞检信息34条,涉及药品生产企业32家,中药材专业市场5家。
两家药品生产企业因违规而被收回《药品GMP证书》

两家药品生产企业因违规而被收回《药品GMP证书》
佚名
【期刊名称】《中国药事》
【年(卷),期】2006(20)8
【摘要】在全国整顿和规范药品市场秩序专项行动中,食品药品监督管理部门派
出检查组,分别对侯马霸王药业有限公司、北海集琦方舟基因药业有限公司进行了现场检查。
经查,以上两家企业药品生产不符合《药品生产质量管理规范》的要求。
【总页数】1页(P477-477)
【关键词】药品生产企业;GMP证书;《药品生产质量管理规范》;违规;药品市场秩序;药品监督管理;现场检查;公司;药业
【正文语种】中文
【中图分类】R95;R951
【相关文献】
1.北京市食品药品监督管理局关于收回北京顺鑫祥云药业有限责任公司药品GMP
证书的公告 [J], ;
2.北京市食品药品监督管理局关于收回北京赛而生物药业有限公司药品GMP证书的公告 [J], ;
3.北京市食品药品监督管理局关于收回北京御生堂制药有限公司药品GMP证书的公告 [J], ;
4.对于多家药品生产企业GMP证书被收回的思考 [J], 张华康;谢新年
5.北京市食品药品监督管理局关于收回北京御生堂制药有限公司药品GMP证书的公告 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
被国家收回药品GMP证书的检查问题的汇总
6.香砂平胃丸、肝复康丸、金鸡虎补丸等原始记录中未发现加入辅料的记录,但在库房羧甲基纤维素钠及淀粉的“物料库卡”上显示丸剂车间有领这两种辅料记录。生产技术部部长承认水丸、水密丸中确实加入了上述两种辅料。(6801-4)
被国家收回药品GMP证书药品生产企业的检查问题汇总
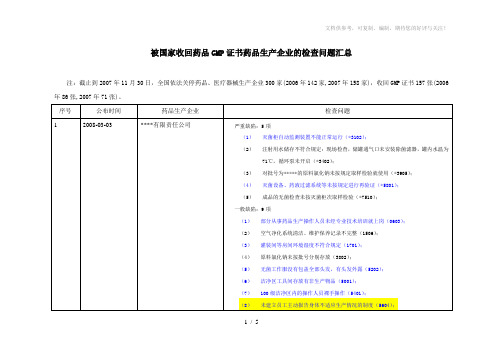
注:截止到2007年11月30日,全国依法关停药品、医疗器械生产企业300家(2006年142家,2007年158家),收回GMP证书157张(2006年86张,2007年71张)。
序号
公布时间
药品生产企业
检查问题
1
2008-03-03
****有限责任公司
2007年7月16日,国家局公布广东佰易药业有限公司已经被依法吊销《药品生产许可证》,根据《药品注册管理办法》的有关规定,该公司所持有的药品批准文号自行废止。现将该公司人狂犬病免疫球蛋白等7个品种22个药品批准文号予以注销。
4
2007-01-16
海口康力元制药有限公司
海口康力元这次被查出主要是因为管理问题,而不是质量问题。康力元新厂用的是临时仓库,根据有关规定药品不应该放在临时仓库,因此这个错误导致了证书被收回。公司的问题出在仓储环节。根据《药品生产质量管理规范》相关规定:生产区和储存区应有与生产规模相适应的面积和空间用以安置设备、物料。
一般缺陷:
1.车间布置调整混乱。如称量间作为器具暂存间;称量、制丸、抛光在一间房内完成。(0902)
2.车间内无物料中间站,物料桶放在走廊上,物流通道的气闸室存放淀粉和糊精。(1201)
3.无原药材加工炮制记录;提取原始记录简单,投料量无法核实。(6801-1)
2015年全国收回药品GMP证书情况统计

2015年全国收回药品GMP证书情况统计第一篇:2015年全国收回药品GMP证书情况统计《2015年全国收回药品GMP证书情况统计》。
2015年,全国共有140家药企144张GMP证书被收回,有些药企还被收回了不止一张,悲催!在收回GMP的“成绩单”上,各省的表现不尽相同。
据统计,广东和吉林,连续2年获得冠亚军。
附:2015年全国各省收回药品GMP证书情况(数据来源:CFDA)在同行们付出了144张的GMP证书代价背后,给我们又有哪些启示呢?小编连夜对所有省份数据进行了分析,并和14年数据进行了对比。
特征如下: 1收证剂型分布情况中药饮片仍是重灾区!中药饮片方面,2015年,全年收回82张,点总收回数的56.9%;2014年收回20张,占当年收回数的40%;可以看到,中药饮片都是近二年的“收证大户”、“重灾区”。
80%都是中药企业同样值得关注的是,在50张非无菌制剂企业中,有33家所于中成药生产企业,加上82家被收证的中药饮片企业,属于中药企业被收证总数为115家,占收证总数79.9%。
2收证省份分布情况第一梯队:广东、吉林2省,连续2年获得冠亚军;第二梯队:安徽、山东、广西、甘肃、陕西5省,居二梯队;也称发狠队,去年收1-3张,今年突然发力收回9-14张;第三梯队:辽宁、四川、湖南、黑龙江、江西、海南、福建、重庆8省市,今年年收证数量在2-5张,居三梯队;第四梯队:浙江、青海、宁夏、内蒙、河南、河北、贵州7省,今年各收1张,居第四梯队;第五梯队:云南、新疆、西藏、天津、深圳、上海、山西、江苏、北京9省市,2015年未收证,居第五梯队,也称0蛋队。
其中连续2年都未收证的省份有云南、新疆、西藏、天津、上海、山西、江苏7省市。
3返还GMP证书情况分析收回GMP证书,不同于注销GMP证书;收回GMP证书,允许企业改正的机会,药企在此期间暂停生产,按要求整改,经药监部门再次核查,确认符合要求后,可以发回GMP证书(套用光头强那句经典用语:我还会回来的!)。
005-GMP文件的撤消及收回管理制度

编号:SQ-06-MS-005-1
部门:质量部
页码:共2页,ห้องสมุดไป่ตู้2页
一、目的:加强对GMP文件的撤消及收回的管理,确保GMP文件撤消及收回的工作达到GMP的要求。
二、范围:适用于公司GMP文件的撤消及收回管理。
三、责任人:GMP文件撤消及收回人、QA负责人。
四、内容:
1.GMP文件的撤消,因不能符合现行管理的要求、工艺改变、设备更换、环境及生产条件变改等,需要对GMP文件进行撤消的,按下列条件进行管理。
贵州圣泉药业有限公司
类别:文件编号:SQ-06-MS-005-1
部门:质量部页码:共2页,第1页
GMP文件的撤消及收回
管理制度
起草:年月日
Q A审阅:年月日
批准:年月日
生效日期:年月日
授权:下列部门拥有并执行本标准(√)
质量部()生产部()物资储运部()
工程部()销售部()行政部()
类别:文件
GMP文件的撤消及收回
1.1.GMP文件的撤消由撤消部门提出书面意见交QA审核,由分管副总批准进行撤消。
1.2.经批准撤消的文件,应由QA书面通知相关部门。
1.3.被撤消文件除QA留一份存档外,原文件不得在现场出现。
2.GMP文件的收回。
2.1.经修正之后的文件的原文件,应被撤消并进行收回。
2.2.经修正后的文件,由QA将复印件发至有关部门后,应同时收回原文件,并进行销毁。
2.3.经批准撤消的文件,应由QA书面通知相关部门,收回被撤消文件。
2.4.经QA收回的文件,原文件不得在现场出现。
GSK中美史克 计算机化系统验证 GMP实施分享 新

计算机化系统验证享-GMP实施分享管鑫质量部,验证经理中美天津史克制药有限公司2015.05前言计算机技术逐渐应用于工业领域计算机主要用于控制设备,自身也是设备的一种计算机领域有着自专属的业领域业计算机领域有着自己专属的工业领域,IT工业计算机是种控制机器的机器计算机是一种控制机器的机器内容提要•什么是计算机化系统?•如何进行系统验证?如何进行系统验证验证实例备料自动打签系统•-什么是计算机化系统什是计算机化系《药品生产质量管理规范》2010 版十四章附则:用于报告或自动控制的集成系统包括数据输入电子处理和信息输出统,包括数据输入、电子处理和信息输出。
附录2《计算机化系统》第一条:本附录适用于在药品生产质量管理过程中应用的计算机化系统它由系列硬件和软件组成以满足特定的功能算机化系统,它由一系列硬件和软件组成,以满足特定的功能。
1.系统软件(System software)1(System software)操作操作系统和通用功能的一套程序。
在硬件及应用软件之间起接口的作用,且管理计算机的使用厂家提供诊断之间起接口的作用,且管理计算机的使用。
厂家提供诊断性测试,即确认该软件。
2.应用软件(Application software)2(A li ti ft)针对用户的特殊需求而开发、购买或修订的程序(主程序或子程序),它可执行数据的收集、处理、报告、存档及它可执行数据的收集处理报告存档及过程控制。
3.可配置软件(Configurable software)由供应商开发的程序(主程序或子程序),该软件可提供通用功能,使用户可按某种途径为自己设计程序。
功能使户按某种途径为自设程序4. 计算机系统(Computer system)4(Computer system)由硬件、系统软件、应用软件以及相关外围设备组成的,可执行某一功能或一组功能的系统。
可执行某一功能或一组功能的系统5. 计算机化系统(Computerized system)指受控系统、计算机控制系统以及人机接口的组合体系。
对取消gmp认证流程的好处

对取消gmp认证流程的好处英文回答:Benefits of Eliminating GMP Certification:1. Reduced Compliance Burden:GMP certification requires manufacturers to adhere to a stringent set of regulations. Eliminating certification would reduce this regulatory burden, freeing up resources for innovation and operational efficiency.2. Enhanced Flexibility and Innovation:Without the constraints of GMP certification, manufacturers would have more flexibility to explore new technologies and processes. This could lead to faster development cycles, improved product quality, and reduced costs.3. Increased Competition and Market Access:Eliminating certification barriers could increase competition and allow smaller businesses to enter the market. This would drive down prices, improve quality, and increase consumer choice.4. Reduced Government Oversight:GMP certification involves government inspections and oversight. Removing certification would reduce government involvement in the manufacturing process, allowing businesses to operate with greater autonomy.5. Streamlined Global Trade:GMP certification requirements vary across countries, creating barriers to international trade. Eliminating certification would facilitate smoother flow of goods across borders, boosting global economic growth.中文回答:取消GMP认证的益处:1. 减轻合规负担:GMP认证要求制造商遵守严格的法规。
GMP认证确定取消,将实施两证合一

GMP认证确定取消,将实施两证合一导语上海市食品药品监督管理局关于印发《关于深化“放管服”改革优化行政审批的实施意见》的通知,意见对“简政放权,减少审批事项”作出如下部署:合并审批根据国家统一部署,将药品GMP认证、药品GSP认证分别与药品生产许可和药品经营许可合并。
取消审批依法取消化妆品生产企业卫生条件审核、中药保护品种的申请(初审)、药品广告异地备案、医疗器械广告审查、医疗机构放射性药品使用许可(一、二类)等5项。
同时,将麻醉药品、第一类精神药品和第二类精神药品原料药生产计划和麻醉药品、第一类精神药品需用计划由审批事项改为服务事项。
下放审批将国产非特殊用途化妆品备案下放至区市场监管局,与区市场监管局的初审职责合并。
关于实施节点,该文附表提到药品GMP认证、药品GSP认证分别与药品生产许可和药品经营许可合并的时间节点为《药品管理法》修订实施后,即新修订的《药品管理法》中关于取消GMP/GSP认证相关的措施已得到国家批准,将于近期发布。
由此,GMP认证取消,已经确定!时间事项名称具体改革举措节点食品生产许可证核发(特殊食品)1.许可延续实施当场办结。
2.减少审查环节。
将处室审查由三级审查改为两级审查,即由现在的办事人员、分管副处长、处长三级审查改为办事人员、处长两级审查。
3.提供提前咨询和指导的服务,加强提前服务的制度化、规范化建设。
4.加强食品生产许可审查员管理。
将审查员管理纳入信息化系统,实现全市审查员统一信息化管理。
2018年第三季度国产保健食品备案细化准入标准,完善办事指南。
已完成医疗机构制剂临床审批1.提供提前咨询和指导的服务,加强提前服务的制度化、规范化建设。
2.细化准入标准,完善办事指南,加强信息公开。
3.加强技术审评环节和行政审查环节的衔接和信息互通。
2018年第四季度医疗机构制剂注册1.根据《中医药法》,对应用传统工艺配制的中药制剂实施备案管理。
2.提供提前咨询和指导的服务,加强提前服务的制度化、规范化建设。
北京天津重庆上海2017年被药监部门收回GMP证书企业

备注
重庆 省(区、市)2017年收回药品GMP证书统计表
省份 序号 企业名称 省局外网发布信息链接 证书编号 收回日期 发还日期 认证范围 备注
重庆 重庆 重庆 重庆
重庆
重庆市开县 /CL0
医用氧
1 制氧厂
035/34324.html
CQ20160008 2017/3/18 尚未发还 (气态,
原料药 (普瑞巴
5 重庆赛维药 /CL0
林) 2017/8/10 2017/12/12 原料药
业有限公司
035/35830.html
CQ20150033
(格列美
脲、普瑞
巴林)
CQ20160016
片剂
上海 省(区、市)2017年收回药品GMP证书统计表
省份 序号 企业名称 省局外网发布信息链接 证书编号 收回日期 发还日期 认证范围 备注
天津 省(区、市)2017年收回药品GMP证书统计表
省份 序号 企业名称 省局外网发布信息链接 证书编号 收回日期 发还日期 认证范围 备注
天津
1
天津儿童药 业有限公
/xwzx/gs/ypGMPrz/11935.
TJ20160099
2017.2.24
尚未发还 颗粒剂
空分)
原料药
2
重庆江峡生 /CL0
化制药有限
035/34565.html
CQ20160012
公司
2017/4/8
(胃蛋白 2017/12/19 酶、胰酶
、胆红素
、胃膜
3
重庆汉华制 /CL0
药有限公司
035/34875.html
上海 上海
中药饮片
(含直接
天津市食品药品监督管理局药品GMP认证公告(2013年第1号)

天津市食品药品监督管理局药品GMP认证公告(2013年
第1号)
文章属性
•【制定机关】天津市食品药品监督管理局
•【公布日期】2013.01.22
•【字号】2013年第1号
•【施行日期】2013.01.22
•【效力等级】地方规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
天津市食品药品监督管理局药品GMP认证公告
(2013年第1号)
按照国家食品药品监督管理局《药品生产质量管理规范认证管理办法》的规定,经现场检查和审核批准,中国大冢制药有限公司符合《药品生产质量管理规范(2010年修订)》要求,发给《药品GMP证书》。
特此公告。
天津市食品药品监督
管理局
二〇一三年一月二十二日附表:天津市药品GMP认证目录(略)。
GMP药品召回的名词解释

GMP药品召回的名词解释在药品生产和销售的过程中,GMP(Good Manufacturing Practice)是一项重要的质量管理体系。
维持符合GMP标准的药品生产,确保药品的安全、有效和质量,是保障公众健康的关键环节。
然而,尽管GMP准则的严格执行,仍然不能完全消除药品中可能存在的风险。
当出现药品质量问题或安全隐患时,药品制造商可能需要采取召回措施,以确保消费者不再使用有问题的药品。
本文将对GMP药品召回进行深入解释,并探讨其对药品行业、制造商和消费者的影响。
GMP药品召回是指制造商或监管机构发现药品存在重大缺陷或安全隐患时,采取主动或被动的行动,要求回收药品。
这些缺陷和隐患可能由生产工艺、原材料、产品设计、标签说明、包装或封装等环节引起。
药品召回的形式多样,可能包括扩展期或类似行为,如召回、冻结库存或销毁等。
召回的药品可能已处于各个环节,如生产、分销商、医疗机构或患者手中。
药品召回通常是制造商、监管机构和相关方合作的结果。
制造商通常需要承担召回药品的成本,并在一定的时限内完成召回过程。
GMP药品召回对各方面都会产生一定的影响。
首先,药品制造商可能因为药品召回而面临严重的财务和声誉损失。
在召回过程中,制造商需要支付召回成本,并承担可能的赔偿责任。
此外,召回行为可能对消费者对于制造商产品的信任产生负面影响,进而影响市场份额和销售量。
因此,制造商应当加强质量管理,以避免召回事件的发生。
其次,药品召回对监管机构也提出了重要的挑战。
监管机构必须及时发现和评估药品质量问题,并通过召回措施确保公众健康和安全。
然而,监管机构在资源和能力方面可能面临一定的限制,导致无法全面监管每一批药品的生产和销售。
因此,建立更加有效的监管体系和监测机制,对于减少潜在的药品质量问题和召回事件意义重大。
对于消费者来说,药品召回意味着他们可能已经使用或正在使用潜在的有问题的药品。
受影响的消费者可能面临健康风险,并需要采取相应的行动。
药品GMP认证审查公告(第63号)

药品GMP认证审查公告(第63号)药品GMP认证审查公告(第63号)企业名称认证范围发证机关现场检查时间检查员名单葛兰素史克(天津)有限公司小容量注射剂进口分包装天津市食品药品监督管理局2005年03月16日-2005年03月16日孙玉龙詹丽梅李静天津市津康制药有限公司片剂(头孢菌素类)、颗粒剂(头孢菌素类)、原料药(头孢地尼、核黄素磷酸钠、格列本脲)天津市食品药品监督管理局2005年03月22日-2005年03月23日刘树春李静李明义修正药业集团股片剂(含抗肿瘤吉林省食品药2005年03月19丁利剑石宝份有限公司药)、胶囊剂(含头孢菌素类)、颗粒剂、喷雾剂、橡胶膏剂品监督管理局日-2005年03月21日瑛武永峰吉林省红石制药厂糖浆剂、合剂(含口服液)吉林省食品药品监督管理局2005年03月25日-2005年03月26日丁利剑石宝瑛武永峰吉林省华侨药业有限公司片剂、胶囊剂、丸剂(蜜丸、水蜜丸、水丸、浓缩丸)、煎膏剂、酒剂吉林省食品药品监督管理局2005年03月27日-2005年03月29日丁利剑石宝瑛武永峰哈药集团生物工原料药(胸腺五黑龙江省食品2005年03月01闻平张利平程有限公司肽)药品监督管理局日-2005年03月02日李忠义哈药集团三精黑河药业有限公司丸剂(水丸、蜜丸)黑龙江省食品药品监督管理局2005年03月03日-2005年03月04日闻平张利平李忠义哈药集团黑龙江同泰药业有限公司片剂(含头孢菌素类)、胶囊剂黑龙江省食品药品监督管理局2005年03月16日-2005年03月17日张景春冯维荣胡丽君上海青平药业有限公司原料药(地巴唑、氢氧化铝、盐酸多塞平、鱼腥草素钠、三硅酸镁)上海市食品药品监督管理局2005年03月22日-2005年03月24日柳涛王乐菲申健民上海同济堂药业中药饮片(净制、上海市食品药2005年02月01刘伟强黄群有限公司切制、蒸制、炒制、炙制、煅制)品监督管理局日-2005年02月02日祥陆逸雁常州四药制药有限公司软膏剂(含激素类)、乳膏剂(含激素类)江苏省食品药品监督管理局2005年03月08日-2005年03月09日任依群邱黎永胡勇常州方圆制药有限公司原料药(更昔洛韦)江苏省食品药品监督管理局2005年03月10日-2005年03月11日任依群邱黎永胡勇常州兰陵制药有限公司原料药(盐酸昂丹司琼)江苏省食品药品监督管理局2005年03月06日-2005年03月07日钱树德邱黎永胡勇江苏圣宝罗药业有限公司溶液剂(外用)、软膏剂、凝胶剂江苏省食品药品监督管理局2005年03月06日-2005年03月任依群蒋成龚声瑾07日南京亿华药业有限公司片剂(含头孢菌素类)、颗粒剂、干混悬剂(头孢菌素类)江苏省食品药品监督管理局2005年03月05日-2005年03月06日段新民李嘉凯朱建中山东胜利药业有限公司片剂、颗粒剂、口服液、合剂山东省食品药品监督管理局2005年03月09日-2005年03月11日翟向鸾邢波刘元红山东天达生物制药股份有限公司无菌原料药(阿洛西林钠)山东省食品药品监督管理局2005年03月05日-2005年03月06日翟向鸾邢波刘元红山东汉方制药有限公司洗剂山东省食品药品监督管理局2005年03月05日-2005年03月曹云波吴向红潘炳文06日山东仙河药业有限公司原料药(蒙脱石)山东省食品药品监督管理局2005年03月07日-2005年03月09日翟向鸾邢波刘元红青岛泰东制药有限公司原料药(芦丁)山东省食品药品监督管理局2004年11月17日-2004年11月18日曹云波吴向红孙成考安徽龙源药业有限公司颗粒剂安徽省食品药品监督管理局2005年03月25日-2005年03月26日颜沪军涂旭光王智俊桂林南药股份有限公司原料药(盐酸阿莫地喹)广西壮族自治区食品药品监督管理局2005年03月22日-2005年03月23日曾华林覃忠于王小娜福建省福清药业有限公司片剂、胶囊剂、颗粒剂、散剂、茶剂、口服溶液剂、糖浆剂、混悬剂、滴眼剂、滴耳剂、滴鼻剂、酊剂(外用)、溶液剂(外用)、栓剂福建省食品药品监督管理局2005年02月25日-2005年02月25日林徽黄荔红张靖湖北百科药业股份有限公司原料药(巴柳氮钠、加替沙星、托拉塞米)湖北省食品药品监督管理局2005年03月21日-2005年03月22日李亚武刘忠明涂林湖北福星医药有气雾剂湖北省食品药2005年03月17李亚武刘忠限公司品监督管理局日-2005年03月18日明涂林湖北天义药业有限公司原料药(更昔洛韦)湖北省食品药品监督管理局2005年03月19日-2005年03月20日李亚武刘忠明涂林河南羚锐生物药业有限公司软膏剂河南省食品药品监督管理局2005年03月19日-2005年03月20日关蕾刘天玉陶建伟天津药业焦作有限公司原料药(辅酶A)河南省食品药品监督管理局2005年03月19日-2005年03月20日李平李学鑫丰世勤成都亚中生物制药有限责任公司中药提取物(醋酸妊娠双烯醇四川省食品药品监督管理局2005年01月23日-2005年01月张良君全维民许敏酮)(仅供出口用)24日济宁市安康制药有限责任公司片剂、原料药(谷维素、糠甾醇)山东省食品药品监督管理局2005年01月21日-2005年01月23日华丽萍高东风王玉强临沂山松药业有限公司片剂、硬胶囊剂山东省食品药品监督管理局2005年01月24日-2005年01月25日华丽萍高东风王玉强山东润华药业有限公司片剂、合剂、口服液山东省食品药品监督管理局2005年01月27日-2005年01月29日王玉珍潘光亮张旗中国海洋大学兰太药业有限责任原料药(甘草锌、甘草酸单铵盐山东省食品药品监督管理局2005年01月26日-2005年01月李玉生朱秀娟杨瑞恩公司A、甘草次酸)28日山东鲁银颐和药业有限公司片剂、颗粒剂、口服液、酊剂、糖浆剂山东省食品药品监督管理局2005年01月26日-2005年01月28日华丽萍高东风王玉强淄博华龙制药有限公司原料药(维生素C)山东省食品药品监督管理局2005年01月26日-2005年01月28日李玉生朱秀娟杨瑞恩寿光富康制药有限公司原料药(磺胺甲噁唑)山东省食品药品监督管理局2005年01月24日-2005年01月25日李玉生朱秀娟杨瑞恩青岛康原药业有限公司原料药(绒促性素、尿促性素)山东省食品药品监督管理局2005年01月29日-2005年01月30日杜建国张学森刘学起武汉生物制品研究所A群链球菌制剂国家食品药品监督管理局2004年12月22日-2004年12月23日白坚石赵运江王岩山东齐都药业有限公司大容量注射剂(含抗肿瘤药,玻璃输液瓶),大容量注射剂(多层共挤输液袋)国家食品药品监督管理局2005年01月16日-2005年01月18日屈浩鹏郭长才岳勇深圳市赛百诺基因技术有限公司重组人p53腺病毒注射液(小容量注射剂)国家食品药品监督管理局2005年01月27日-2005年01月28日饶春明万宗举孔燕马东光黑龙江省医用氧气总公司医用氧国家食品药品监督管理局2005年01月13日-2005年01月何永惠姜国明肖旭15日中国医学科学院医学生物学研究所小容量注射剂、体外诊断试剂国家食品药品监督管理局2005年01月25日-2005年01月26日江风田万红袁利勇上海世康特制药有限公司片剂、胶囊剂、颗粒剂、散剂、原料药(聚磺苯乙烯钠)国家食品药品监督管理局2004年12月27日-2004年12月29日颛孙燕季建敏潘祥福浙江浙北药业有限公司粉针剂,冻干粉针剂、大容量注射剂国家食品药品监督管理局2005年01月16日-2005年01月19日刘燕鲁欧阳晓枚陈慧平。
国家药品监督管理局公告2020年第19号——国家药监局关于注销医疗器械注册证书的公告

国家药品监督管理局公告2020年第19号——国家药监局关于注销医疗器械注册证书的公告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2020.02.26
•【文号】国家药品监督管理局公告2020年第19号
•【施行日期】2020.02.26
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局公告
2020年第19号
国家药监局关于注销医疗器械注册证书的公告按照《体外诊断试剂注册管理办法》《医疗器械注册管理办法》的规定,根据企业申请,现注销北京鑫诺美迪基因检测技术有限公司的注册证号为国械注准20143402134的肠道病毒(EV)通用型核酸检测试剂盒(PCR-荧光探针法)、注册证号为国械注准20173400405的乙型肝炎病毒核酸检测试剂盒(PCR-荧光探针法)、注册证号为国械注准20143402152的柯萨奇病毒A16型(CA16)核酸检测试剂盒(PCR-荧光探针法)、注册证号为国械注准20143402147的肠道病毒71型(EV71)核酸检测试剂盒(PCR-荧光探针法);微创(北京)生命医学科技有限公司的注册证号为国械注准20143142163的胰岛素泵共5个产品的医疗器械注册证书。
特此公告。
国家药监局2020年2月26日。
