全国高中学生化学竞赛决赛(冬令营)理论试题及答案
全国高中化学竞赛决赛(冬令营)理论试题及解答

2000年全国高中学生化学竞赛(决赛)理论试题2000.1.11.杭州● 竞赛时间4小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定地方(方框内),不得用铅笔填写,写在其他地方的应答一律无效。
使用指定的草稿纸。
不得持有任何其他纸张。
● 把营号写在所有试卷(包括草稿纸)右上角处,不写姓名和所属学校,否则按废卷论。
● 允许使用非编程计算器、直尺、橡皮等文具,但不得带文具盒进入考场。
1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLi Be B C N O FNa Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co NiCu Zn G a G e As Se BrRb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn Ïà ¶Ô Ô- ×Ó ÖÊ Á¿第1题A 的单质和B 的单质在常温下激烈反应,得到化合物X 。
高中化学 竞赛决赛(冬令营)理论试题

促敦市安顿阳光实验学校高中学生化学竞赛决赛(冬令营)理论试题H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95压力pφ=1bar(巴)=100000Pa(帕斯卡) R=8.314 J·K-1·mol-1第1题(8分)1990年代初发现了碳纳米管,它们是管径仅几纳米的微管,其结构相当于石墨结构层卷曲连接而成。
近年,人们合成了化合物E的纳米管,其结构与碳纳米管十分相似。
气体A与气体B相遇立即生成一种白色的晶体C。
已知在同温同压下,气体A的密度约为气体B的密度的4倍;气体B易溶于水,向其浓水溶液通入CO2可生成白色晶体D;晶体D的热稳性不高,在室温下缓慢分解,放出CO2、水蒸气和B;晶体C在高温下分解生成具有润滑性的白色晶体E1;E1在高温高压下可转变为一种硬度很高的晶体E2。
E1和E2是化合物E的两种不同结晶形态,分别与碳的两种常见同素异形体的晶体结构相似,都是型固体材料;E可与单质氟反,主要产物之一是A。
(1)写出A、B、C、D、E的化学式。
(2)写出A与B反的化学反方程式,按酸碱理论的观点,这是一种什么类型的反?A、B、C各属于哪一类物质?(3)分别说明E1和E2的晶体结构特征、化学键特征和它们的可能用途。
(4)化合物A与C6H5NH2在苯中回流,可生成它们的1︰1加合物;将这种加合物加热到280℃,生成一种环状化合物(其中每摩尔加合物失去2摩尔HF);这种环状化合物是一种非极性物质。
写出它的分子式和结构式。
第2题(8分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)之间的能量差ΔE(=E c-E v)称为带隙,图中的e-为电子、h+为空穴。
第20届全国高中化学竞赛决赛(冬令营)理论试题与答案

中国化学会第 20 届全国高中学生化学竞赛(决赛)理论试题参考答案及评分细则第 1 题(14 分)1-1 当g G m< 0时,反应可正向进行,由此解得T1>1186K, T2>1500 K,T3>1761K,故只有反应①在 1500K 以下可自动正向进行。
(计算2分,结果1分,共3分)Ti O2+ 2Cl2= Ti Cl4+2CO(1 分)1-2(方程式未配平不得分 )1-3 VOCl 3与 TiCl 4沸点相近(1分)Cu+ VOCl 3= VOCl 2+CuCl(1 分)1-4 TiCl 4 +2Mg=Ti+2MgCl 2(1分)1-5(1)Mg C O=Mg O + C O(1分)32Mg O + Cl+ C=Mg Cl+ C O(1分)22(2)阴极反应:Mg 2+-= Mg( 0.5 分)+2e阳极反应:--( 0.5 分)2Cl = Cl 2+2e电解反应: MgCl 2= Mg +Cl 2(1 分)1( 0.5分)(3)r H m = ∑v B f H m = 596.32 kJ molr S m =∑v B S m = 77.30+268.20-231.02=114.48(J·K-1·mol-1)( 0.5分)r G m = r H m —T r S m =596.32—1023×114.48×10-3=479.21(kJ·mol-1)(1 分)E = –r G m/ZF=–479210/(2×96500)= -2.48(V)E理 =2.48V(1分)第2 题2-12-2 ( 1) ZnS + 2H 2SO4=ZnSO 4+SO2+S+2H 2OCuS + 2H 2 SO4=CuSO4+SO2+S+2H 2O 加水的目的是浸取反应生成的可溶性硫酸盐。
(2) As2S3 +3Na 2S=2Na3AsS3SnS2 +Na 2S=NaSnS3加入氢氧化钠的目的是防止硫化钠水解2-3(1)S2O42-+Fe2O3+2H+=2SO32-+2Fe2++H2O (2) Na4[FeA 2]第 3 题(10 分)3-1[(3++ H O[(] )2++F e H) ]2= F e O H H O 2O6 2O5+ H 33-2(3 分)(1 分)(1 分)(0.5 分)(1 分)(1 分)(2 分)(1 分)H4 + O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)。
第20届全国高中化学竞赛决赛(冬令营)理论试题及答案.pdf

变色为终点,消耗 HCI 标准溶液 22.78mL。
步骤二:称取纯的有机弱酸(H2B)样品 0.1963g。将样品定量溶解在 50.00mL 纯水中,选择
甲基橙为指示剂进行滴定。当加入新标定的 0.0950mol/L 氢氧化钠标准溶液 9.21mL 时,发
现该法不当,遂停止滴定,用酸度计测定了停止滴定时溶液的 pH=2.87。已知 H2B 的 pKal=2.86,
构式。
(3 分)
第 3 题(10 分)
无机高分子絮凝刑具有效能高、价格低廉的优点,广泛用于给水排水、工业废水及城市污水
处理。
3-1 大多数金属离子都能生成多核水解产物。铁盐溶于水后生成水合铁(Ⅲ)离子,当溶液 pH
升高时发生水解,首先生成黄色的水解产物[FeOH(H2O5)]2+,写出水解反应方程式。 (1 分)
(2 分)
1-4 精制后的 TiCl4 用金属镁还原可得海绵钛,写出化学反应方程式。
(1 分)
1-5 菱镁矿(主要成分为 MgCO3)煅烧分解后与焦炭混合在氯化器中加热到 1373 K,通入氯
气生成 MgCl2。在 1023 K 电解熔融 MgCl2 得到金属镁。
(1)写出用菱镁矿煅烧及氯化制取 MgCl2 的化学反应方程式。
(2) 写出 B 中氨基酸的结构式式并命名。
(3) 写出 C 中糖分子的费歇尔投影式,并给出该糖的名称。
O OO
HO
HO
OH
C
OH
(2 分) (2 分) (2 分)
第 8 题(15 分) 8-1 化合物 A(C10H12O3)具有旋光性,能溶于 NaHCO3 水溶液,并可起碘仿反应。将 A 加热
的化合物 B,B 无旋光性,也能溶于 NaHCO3 水溶液。B 经臭氧化,并在 Zn 粉和醋酸存在下 分解得化合物 C 和 D,C 可进行碘仿反应。D 加强热放出 CO2,并得化合物 E(C7H6O),E 可进行银镜反应,试写出 A、B、C、D、E 的结构式。(10 分)
全国高中学生化学竞赛决赛(冬令营)理论试题与实验试题及参考答案

竞赛:碘酸钙的制备及含量测定注意事项:●实验时间为 5.0 小时,请仔细阅读试题内容,合理安排时间,完成全部内容。
每超过5 分钟要扣 1 分,最长不超过 20分钟。
●若制备失败可向监考教师索取原料重做,但要扣 5 分;若产品不够纯度测定所需量,可向监考教师索取分析样品,但要扣16.5 分。
●需监考教师签字的,考生务必主动配合,未当场签字者无效。
伪造数据者,以零分计。
●完成全部实验内容后,将产品、实验报告(包括试题)交给监考教师,并清洗所用仪器和整理桌面,经监考教师签字后方可离开考场。
●废弃物应放入指定容器内。
●实验过程请注意安全。
一、实验内容1.产品的合成:碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO 3·HIO 3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应生成碘酸钙。
2.产品的分析:用间接碘量法测定。
3.完成实验报告。
二、主要仪器、试剂及材料1.主要仪器圆底烧瓶 100mL 1 只球形冷凝管(带磨口塞) 1 支磁力搅拌器 1 台电接点温度计(导电表) 1 支电子继电器 1 台电加热器( 300W ) 1 只结晶皿(水浴缸) 1 只温度计 (100℃ ) 1 支漏斗、吸滤瓶、表面皿各 1 只布氏漏斗和抽滤瓶(带橡皮塞) 1 只滴定管夹 1 只烧杯600ml 、 500ml 1 只量筒100ml 1 只150ml 2 只10ml 2 只100ml 1 只玻管(直管、弯管)各 1 支碘量瓶250ml 3 只移液管(胖肚)50ml 1 支橡皮管25ml 1 支碱式滴定管50ml 1 支塑料洗瓶、木夹各 1 只容量瓶250ml 2 只滴管 2 支洗耳球、角匙、镊子各 1 只玻棒 2 支铁架台、铁圈、铁夹 3 付●公用仪器电子天平(最大称量100 克,± 0.0001 克)电炉( 800W )电子天平(最大称量100 克,± 0.01 克)循环水式真空泵2.试剂及材料1 mol · L -1碘化学纯( CP)氯化钙溶液氯酸钾化学纯( CP)1∶ 1高氯酸溶液碘化钾分析纯( AR )碘酸钾标准溶液30%氢氧化钾溶液0.1 mol · L -1硫代硫酸钠标准溶液0.5mol · L -1氢氧化钠溶液0.5%淀粉溶液6 mol· L -1盐酸无水乙醇化学纯( CP)1 mol· L -1硫酸pH 试纸( 1-14)滤纸、称量纸、碎冰3.主要原料和产品的某些性质3. 1几种盐的溶解度(克/100 克水)温度 /℃010********KIO 3 4.60 6.278.0812.618.324.8KCl28.131.234.240.145.851.3KClO 40.76 1.06 1.68 3.737.3013.4Ca(IO 3) 20.119( 5℃)0.195( 15℃) 0.307(25℃ )0.5200.6210.6693. 2 碘酸钙在不同温度下的存在形态碘酸钙存在形态无水盐一水合物六水合物稳定的温度区域>57.5℃32-57.5 ℃<32℃3. 3 摩尔质量 /g mol·-1碘酸钙无水盐 389.88一水合物 407.90六水合物 497.90硫代硫酸钠 158.10碘酸钾 170.80碘 253.80氯酸钾 122.55三、操作步骤1.制备碘酸钙在 100mL 圆底烧瓶中依次加入 2.20 克碘、 2.00 克氯酸钾(均由教师定量供给)和 45mL 水,放入搅拌磁子,然后把烧瓶置入水浴缸内,用铁夹固定,开动搅拌器,使氯酸钾溶解,滴加 6mol·L -1盐酸 8 滴( pH ~ 1),装上冷凝管,通冷却水,冷凝管顶部塞上带玻璃管塞子,用橡皮管把反应产生的气体导向盛有约100mL 氢氧化钠溶液的大烧杯内吸收。
2004年全国高中学生化学竞赛决赛(冬令营)理论试题及答案

2004年全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/F⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
⒊溴在自然界中主要存在于海水中,每吨海水约含0.14 kg溴。
Br2的沸点为58.78℃;溴在水中的溶解度3.58 g/100 g H20(20℃)。
利用本题的信息说明如何从海水中提取Br2,写出相应的化学方程式,并用方框图表达流程。
第三题(6分)过氧乙酸是一种广谱消毒剂,可用过氧化氢与乙酸反应制取,调节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸。
过氧乙酸含量的分析方法如下:准确称取0.5027 g过氧乙酸试样,置于预先盛有40 mLH20、5 mol 3 mol/LH2SO4溶液和2~3滴1 mol/L MnSO4溶液并已冷却至5℃的碘量瓶中,摇匀,用0.02366 mol/L KMnO4标准溶液滴定至溶液呈浅粉色(30 s不退色),消耗了12.49 mL;随即加人10 mL 20%KI溶液和2~3滴(NH4)2 MoO4溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置5 min ~10 min,用0.1018mol/LNa2S2O3标准溶液滴定,接近终点时加人3 mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持30s不重新显色,为终点,消耗了Na2S2O3 23.61 mL。
2004年全国高中学生化学竞赛决赛(冬令营)理论试题及答案

2004年全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
表1 字母所代表的物质A B C D E F G HNO2+ NO N2O3N2H4NH3 N2O4H2N2O2NH2OH①()不是平面分子,其衍生物用作高能燃料。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/FA X- X2HXO HXO2 XO3- XO4-F -3.06 0 / / / /Cl -1.36 0 1.61 4.91 7.32 9.79 Br -1.06 0 1.60 / 7.60 11.12I -0.54 0 1.45 / 5.97 9.27B X-X2XO- XO2- XO3-XO4-F -3.06 0 / / / /Cl -1.36 0 0.40 1.72 2.38 3.18 Br -1.06 0 0.45 / 2.61 4.47I -0.54 0 0.45 / 1.01 2.41⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
2022年全国高中化学竞赛决赛冬令营理论试题及答案

中国化学会第20届全国高中学生化学竞赛(决赛)理论试题1月17日● 本竞赛试题共8题,总分120分,竞赛时间4小时。
迟到超过30分钟者不得进入考场,考试开始后1小时内不得离开考场。
解答完毕,将试卷和答卷及草稿纸折好,背面朝上放于桌面,撤离考场。
● 试卷和答卷已分别装订成册,不得拆散,所有解答必须写在答卷旳指定位置,写于其她位置无效.● 选手营号写在答卷每页左边指定位置,不得写所属地区,学校名称和姓名,否则按废卷论。
● 使用黑色墨水钢笔或圆珠笔答题,不得使用铅笔(涉及作图)。
使用提供旳草稿纸.不得携带任何其她纸张进入考场。
● 容许使用非编程计算器及直尺,橡皮、涂改液等文具,不得将文具盒以及手机、小灵通、BP机等通讯工具带入考场,一经发现将严肃解决。
原予量:H 1.008 B 10.81 C 2.01 N 14.01 O 16.00第1题(14分)钛及其合金具有密度小、强度高、耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。
国内四川省有大型钒钛磁铁矿。
从由钒钛磁铁矿经“选矿”得到旳钛铁矿提取金属钛(海绵钛)旳重要工艺过程如下:钛铁生铁海面钛l-1 钛铁矿旳重要成分为FeTiO3。
控制电炉熔炼温度(<1500K),用碳还原出铁,而钛则进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。
已知:FeTiO 3C TiO 2TiC Fe CO FeTiO 3FeTiO 3+=++++++C C 43==Fe CO 3Ti ++Fe 3CO①②③G m r J .mol-1===G m r J .mol-1G mr J .mol -1190900-161T 750000--500T913800519T通过计算判断在电炉熔炼中重要发生以上哪个反映? (3分) 1-2 写出在1073—1273K 下氯化反映旳化学方程式。
(1分) 1-3 氯化得到旳TiCl 4中具有旳VOCl 3必须用高效精馏旳措施除去,为什么? 实际生产中常在409 K 下用Cu 还原VOCl 3,反映物旳摩尔比为1:l ,生成氯化亚铜和难溶于TiCl 4旳还原物,写出还原反映方程式。
2000年全国高中学生化学竞赛决赛(冬令营)理论试题与实验试题及参考答案

2000.1.11 杭州碘酸钙的制备及含量测定注意事项:●实验时间为5.0小时,请仔细阅读试题内容,合理安排时间,完成全部内容。
每超过5分钟要扣1分,最长不超过20分钟。
●若制备失败可向监考教师索取原料重做,但要扣5分;若产品不够纯度测定所需量,可向监考教师索取分析样品,但要扣16.5分。
●需监考教师签字的,考生务必主动配合,未当场签字者无效。
伪造数据者,以零分计。
●完成全部实验内容后,将产品、实验报告(包括试题)交给监考教师,并清洗所用仪器和整理桌面,经监考教师签字后方可离开考场。
●废弃物应放入指定容器内。
●实验过程请注意安全。
一、实验内容1.产品的合成:碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应生成碘酸钙。
2.产品的分析:用间接碘量法测定。
3.完成实验报告。
二、主要仪器、试剂及材料1.主要仪器圆底烧瓶100mL 1只球形冷凝管(带磨口塞)1支磁力搅拌器1台电接点温度计(导电表)1支电子继电器1台电加热器(300W)1只结晶皿(水浴缸)1只温度计(100℃) 1支漏斗、吸滤瓶、表面皿各1只布氏漏斗和抽滤瓶(带橡皮塞)1只滴定管夹1只烧杯600ml、500ml 1只量筒100ml 1只150ml 2只10ml 2只100ml 1只玻管(直管、弯管)各1支碘量瓶250ml 3只移液管(胖肚)50ml 1支橡皮管25ml 1支碱式滴定管50ml 1支塑料洗瓶、木夹各1只容量瓶250ml 2只滴管2支洗耳球、角匙、镊子各1只玻棒2支铁架台、铁圈、铁夹3付●公用仪器电子天平(最大称量100克,±0.0001克)电炉(800W)电子天平(最大称量100克,±0.01克)循环水式真空泵2.试剂及材料碘化学纯(CP) 1 mol·L-1 氯化钙溶液氯酸钾化学纯(CP)1∶1 高氯酸溶液碘化钾分析纯(AR)碘酸钾标准溶液30%氢氧化钾溶液0.1 mol·L-1硫代硫酸钠标准溶液0.5mol·L-1 氢氧化钠溶液0.5% 淀粉溶液6 mol·L-1盐酸无水乙醇化学纯(CP)1 mol·L-1硫酸pH试纸(1-14)滤纸、称量纸、碎冰3.主要原料和产品的某些性质3.1几种盐的溶解度(克/100克水)碘酸钙无水盐389.88 一水合物407.90 六水合物497.90硫代硫酸钠158.10 碘酸钾170.80 碘253.80 氯酸钾122.55三、操作步骤1.制备碘酸钙在100mL圆底烧瓶中依次加入2.20克碘、2.00克氯酸钾(均由教师定量供给)和45mL 水,放入搅拌磁子,然后把烧瓶置入水浴缸内,用铁夹固定,开动搅拌器,使氯酸钾溶解,滴加6mol·L-1盐酸8滴(pH~1),装上冷凝管,通冷却水,冷凝管顶部塞上带玻璃管塞子,用橡皮管把反应产生的气体导向盛有约100mL氢氧化钠溶液的大烧杯内吸收。
2004年全国高中学生化学竞赛决赛(冬令营)理论试题及答案
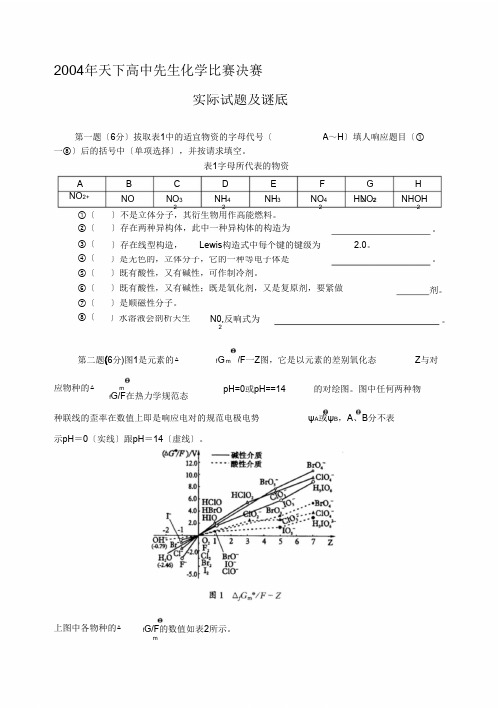
2004年天下高中先生化学比赛决赛实际试题及谜底第一题〔6分〕拔取表1中的适宜物资的字母代号〔一⑧〕后的括号中〔单项选择〕,并按请求填空。
表1字母所代表的物资A~H〕填人响应题目〔①A B C D E F G HNO2+ NO NO32 NH42NH3 NO42HNO2 NHOH22 2①〔②〔③〔④〔⑤〔⑥〔⑦〔⑧〔〕不是立体分子,其衍生物用作高能燃料。
〕存在两种异构体,此中一种异构体的构造为。
〕存在线型构造,Lewis构造式中每个键的键级为 2.0。
〕是无色的,立体分子,它的一种等电子体是〕既有酸性,又有碱性,可作制冷剂。
〕既有酸性,又有碱性;既是氧化剂,又是复原剂,要紧做〕是顺磁性分子。
剂。
〕水溶液会剖析天生N0,反响式为2。
第二题(6分)图1是元素的△ f G m/F一Z图,它是以元素的差别氧化态Z与对应物种的△mf G/F在热力学规范态pH=0或pH==14 的对绘图。
图中任何两种物种联线的歪率在数值上即是响应电对的规范电极电势ψA或ψB,A、B分不表示pH=0〔实线〕跟pH=14〔虚线〕。
上图中各物种的△f G/F的数值如表2所示。
m表2各物资的△G/FfmA F X - X 2 0 HXO / HXO 2XO 3-/ XO 4-/ -3.06 -1.36 -1.06 -0.54 / Cl Br I0 1.61 1.60 1.45 4.91 7.32 7.60 5.979.79 11.12 9.270 / /0 ---B F X - X 2 XO - / XO / 2XO / 3XO / 4-3.06 -1.36 -1.06 -0.540 Cl Br I0 0 00.40 0.45 0.451.722.38 2.61 1.013.184.47 2.41/ /ψA (IO/I -)- (IO/I -) - -A4(ClO/HClO 2)⒈用上表供给的数据盘算:3ψ B3ψ ⒉由上述信息答复:对统一氧化态的卤素,其含氧酸的氧化才干是年夜于、即是 依然小于其含氧酸盐的氧化性。
全国高中学生化学竞赛决赛(冬令营)理论试题及答案

2004年全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号( A 〜H )填人相应标题(① 一⑧)后的括号中(单选),并按要求填空。
表1字母所代表的物质AB C D E F G H +NO 2NON 2O 3N 2H 4 NH 3N 2O 4 H 2N 2O 2 NH 2OH◎()不是平面分子,其衍生物用作高能燃料。
笑()存在两种异构体,其中一种异构体的结构为。
3()具有线型结构,Lewis 结构式中每个键的键级为2.0。
)是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
@()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
炉()是顺磁性分子。
)水溶液会分解生成N 2O ,反应式为。
第二题(6分)图1是元素的厶f G m /F 一 Z 图,它是以元素的不同氧化态Z 与对应物BrO/ CIO/已0图 I ijG.nVF-Z上图中各物种的厶 f G m"'/F 的数值如表 2所示。
表2各物质的厶f G m /F种的△ f G m"/F 在热力学标准态pH =0 或 pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势 2 A 或2 B , A 、 B 分别表示 pH=0 (实线)和pH = 14 (虚线)。
OHr : (-Q.79)HQZr •54HC1OHBrO Hl5 61ZQ 吗.0氐0 r 轴 2.0 k tier—種性介减 --- 醯性介M1 e A " 3 e B " 3e A "422•由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于 还是小于其含氧酸盐的氧化性。
3•溴在自然界中主要存在于海水中,每吨海水约含0.14 kg 溴。
B 「2的沸点为58.78 C;溴在水中的溶解度 3.58 g/100 g H 20 ( 20 C )。
2004年全国高中学生化学竞赛决赛(冬令营)理论试题及答案.pdf

2004年全国高中学生化学竞赛决赛理论试题及答案 第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
表1 字母所代表的物质 ABCDEFGHNO2+NON2O3N2H4NH3N2O4H2N2O2NH2OH ①( )不是平面分子,其衍生物用作高能燃料。
②( )存在两种异构体,其中一种异构体的结构为 。
③( )具有线型结构,Lewis结构式中每个键的键级为2.0。
④( )是无色的,平面分子,它的一种等电子体是 。
⑤( )既有酸性,又有碱性,可作制冷剂。
⑥( )既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做 剂。
⑦( )是顺磁性分子。
⑧( )水溶液会分解生成N20,反应式为 。
第二题(6分)图1是元素的△fGm/F一Z图,它是以元素的不同氧化态Z与对应物种的△fGm/F在热力学标准态pH=0或pH==14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、 B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△fGm/F的数值如表2所示。
表2 各物质的△fGm/F AX-X2HXOHXO2XO3-XO4-F-3.060////Cl-1.3601.614.917.329.79Br-1.0601.60/7.6011.12I-0.5401.45/5.979.27BX-X2XO-XO2-XO3-XO4-F-3.060////Cl-1.3600.401.722.383.18Br-1.0600.45/2.614.47I-0.5400.45/1.012.41⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2) ⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
⒊溴在自然界中主要存在于海水中,每吨海水约含0.14 kg溴。
高中化学 第20届全国学竞赛决赛(冬令营)理论试题

中国化学会第20届全国高中学生化学竞赛(决赛)理论试题2007年1月17日● 本竞赛试题共8题,总分120分,竞赛时间4小时。
迟到超过30分钟者不得进入考场,考试开始后1小时内不得离开考场。
解答完毕,将试卷和答卷及草稿纸折好,背面朝上放于桌面,撤离考场。
● 试卷和答卷已分别装订成册,不得拆散,所有解答必须写在答卷的指定位置,写于其他 位置无效.● 选手营号写在答卷每页左边指定位置,不得写所属地区,学校名称和姓名,否则按废卷 论。
● 使用黑色墨水钢笔或圆珠笔答题,不得使用铅笔(包括作图)。
使用提供的草稿纸.不得携带任何其他纸张进入考场。
● 允许使用非编程计算器及直尺,橡皮、涂改液等文具,不得将文具盒以及手机、小灵通、BP 机等通讯工具带入考场,一经发现将严肃处理。
原予量: H 1.008 B 10.81 C 2.01 N 14.01 O 16.00第1题 (14分)钛及其合金具有密度小、强度高、耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。
我国四川省有大型钒钛磁铁矿。
从由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:钛铁铁海面钛l-1 钛铁矿的主要成分为FeTiO 3。
控制电炉熔炼温度(<1500K),用碳还原出铁,而钛则进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。
已知:FeTiO 3C TiO 2TiC Fe CO FeTiO 3FeTiO3+=++++++C C 43==Fe CO 3Ti ++Fe 3CO①②③G m r J .mol-1===G m r J .mol-1G mr J .mol-1190900-161T 750000--500T 913800519T通过计算判断在电炉熔炼中主要发生以上哪个反应? (3分)1-2 写出在1073—1273K 下氯化反应的化学方程式。
(1分)1-3 氯化得到的TiCl 4中含有的VOCl 3必须用高效精馏的方法除去,为什么? 实际生产中常在409 K 下用Cu 还原VOCl 3,反应物的摩尔比为1:l ,生成氯化亚铜和难溶于TiCl 4的还原物,写出还原反应方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2004 年全国高中学生化学竞赛决赛理论试题及答案第一题 ( 6分)选取表 1 中的合适物质的字母代号( A ~ H )填人相应标题(① 一⑧)后的括号中(单选),并按要求填空。
表 1字母所代表的物质AB C D EF G H +NO +NO N 2O 3 N 2H 4 NH 3 N 2O 4 H 2N 2O 2 NH 2OH① ( )不是平面分子,其衍生物用作高能燃料。
② ( )存在两种异构体,其中一种异构体的结构为。
③ ( )具有线型结构, Lewis 结构式中每个键的键级为 2.0 。
④ ( )是无色的,平面分子,它的一种等电子体是。
⑤ ( )既有酸性,又有碱性,可作制冷剂。
⑥ ( )既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦ ( )是顺磁性分子。
⑧ ( )水溶液会分解生成 N 20, 反应式为。
第二题 (6分)图 1是元素的△ f G m /F 一 Z 图,它是以元素的不同氧化态 Z 与对应物图中各物种的△ f G m /F 的数值如表 2 所示。
f m A X - X 2HXO HXO 2 XO 3-XO 4-F -3.06 0 / / //种的△ f G m /F 在热力学标准态 pH =0 或 pH == 14 的对画图。
图中任何两种物种联 线的斜率在数值上等于相应电对的标准电极电势 ψA 或 ψB ,A 、 B 分别表示 pH = 0 (实线)和 pH= 14(虚线)。
⒈用上表提供的数据计算: ψA (IO 3/I ) ψB (IO 3/I ) ψA (ClO 4/HClO 2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于 还是小于其含氧酸盐的氧化性。
⒊溴在自然界中主要存在于海水中,每吨海水约含 0.14 kg 溴。
Br 2 的沸点为 58.78 ℃;溴在水中的溶解度 3.58 g/100 g H 20( 20 ℃)。
利用本题的信息说明如何 从海水中提取 Br 2,写出相应的化学方程式,并用方框图表达流程。
第三题 (6 分)过氧乙酸是一种广谱消毒剂,可用过氧化氢与乙酸反应制取,调 节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸。
过氧乙酸含量的分析方法如下:准确称取 0.5027 g 过氧乙酸试样,置于预先盛有H 2SO 4溶液和 2~3 滴 1 mol/L MnSO 4溶液并已冷却至0.02366 mol/L KMnO 4 标准溶液滴定至溶液呈浅粉色(mol/LNa 2S 2O 3标准溶液滴定, 接近终点时加人 3 mL 0.5 %淀粉指示剂, 继续滴定至 蓝色消失,并保持 30s 不重新显色,为终点,消耗了 Na 2S 2O 3 23.61 mL 。
⒈写出与测定有关的化学方程式。
⒉计算过氧乙酸的质量分数 (要求 3 位有效数字; 过氧乙酸的摩尔质量为 76 .05g/mol )。
⒊本法的 KMnO 4 滴定不同于常规方法,为什么? ⒋简述为什么此法实验结果只能达到 3 位有效数字。
⒌过氧乙酸不稳定,易受热分解。
写出热分解反应方程式。
第四题 ( 8分)日本的白川英树等于 1977 年首先合成出带有金属光泽的聚乙炔薄 膜,发现它具有导电性。
这是世界上第一个导电高分子聚合物。
研究者为此获得了 2000 年诺贝尔化学奖。
⒈写出聚乙炔分子的顺式和反式两种构型。
⒉ . 若把聚乙炔分子看成一维晶体,指出该晶体的结构基元。
⒊假设有一种聚40 mLH 20、 5 mol 3 mol/L5℃的碘量瓶中,摇匀,用 30 s 不退色),消耗了12.49 mL; 随即加人 10 mL 20 % KI 溶液和 2~ 3 滴( NH 4) 2 MoO 4 溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置 5 min ~ 10 min ,用 0.1018乙炔由 9 个乙炔分子聚合而成,聚乙炔分子中碳一碳平均键长为 140 pm 。
若将上述线型聚乙炔分子头尾连接起来,形成一个大环轮烯分子,请画出该分子的结构。
π 电子在环上运动的能量可由公式给出,式中 h 为普朗克常数 (6.626 × 10-34J·s),m e是电子质量( 9.109 × 10 -31 kg ), l是大环周边的长度,量子数 n=0 ,士 1,士 2,⋯计算电子从基态跃迁到第一激发态需要吸收的光的波长。
第五题 ( 6 分)氢是重要而洁净的能源。
要利用氢气作能源,必须解决好安全有效地储存氢气问题。
化学家研究出利用合金储存氢气, LaNi 5 是一种储氢材料。
LaNi 5 的晶体结构已经测定,属六方晶系,晶胞参数 a=511 pm,c =397 pm, 晶体结构如图 2 所示。
⒈从 LaNi 5晶体结构图中勾画出一个LaNi 5 晶胞。
⒉每个晶胞中含有多少个 La 原子和 Ni 原子?⒊LaNi 5晶胞中含有 3 个八面体空隙和 6个四面体空隙,若每个空隙填人 1个 H 原子,计算该储氢材料吸氢后氢的密度,该密度是标准状态下氢气密度(8.987×-5 -3 8 -110-5 g·m-3 )的多少倍? (氢的相对原子质量为 1.008 ;光速 c 为 2.998 × 10 8 m·s-1;忽略吸氢前后晶胞的体积变化)。
第六题 ( 7 分)地球表面约70%以上是海洋,全球约 95 %的生物物种在海洋中,由此可见海洋拥有极其丰富的天然资源,是有待开发的天然宝库。
从某种海洋微生物中分离得到具有生理活性的有机化合物 A ,用质谱法和元素分析法测得 A 的化学式为 C15H28O4。
在苯溶液中, A 可与等物质的量的 Pb(OAc) 4反应,生成物经酸水解得乙醛酸和另一化合物B。
B遇热失去一分子水得化合物C。
将 C与 KMnO 4溶液共热得草酸和十一酸。
⒈请写出化合物 A、B 和 C 的结构式。
⒉ A 可能存在多少种光学异构体?⒊已测得化合物 B 为 S 一构型,请写出化合物 A 最稳定的构象式。
⒋写出 A 的 3-羟基与 D- 甘露糖形成的α -单糖苷的构象式。
D- 甘露糖的结构式如下:提示:药物合成中常见如下反应:⒉写出下列反应式中 E ~ I 的结构式:第八题 ( 12 分)车载甲醇质子交换膜燃料电池 (PEMFC ) 将甲醇蒸气转化为氢 气的工艺有两种:( 1)水蒸气变换(重整)法;( 2) 空气氧化法。
两种工艺都得到 副产品 CO 。
⒈分别写出这两种工艺的化学方程式,通过计算,说明这两种工艺的优缺点。
有关资料( 298 .15K )列于表 3。
表 3物质的热力学数据物质-1Δf H m /kJ · mol-1S m /J ·K -1· mol -1CH 3OH(g)-200.66 239.81 CO 2(g)-393.51 213.64第七题 (9 分)⒈写出下列反应式中A ~ D 的结构⒉上述两种工艺产生的少量 CO 会吸附在燃料电池的 Pt 或其他贵金属催化剂表面,阻碍 H2 的吸附和电氧化,引起燃料电池放电性能急剧下降,为此,开发了除去 CO 的方法。
现有一组实验结果( 500K )如表 4。
表中 P CO、P O2 分别为 CO 和 O2的分压; r co 为以每秒每个催化剂 Ru 活性位上所消耗的 CO 分子数表示的 CO 的氧化速率。
⑴求催化剂 Ru 上 CO 氧化反应分别对 CO 和 O2 的反应级数(取整数),写出速率方程。
⑵固体 Ru 表面具有吸附气体分子的能力,但是气体分子只有碰到空活性位才可能发生吸附作用。
当已吸附分子的热运动的动能足以克服固体引力场的势垒时,才能脱附,重新回到气相。
假设 CO 和 O2 的吸附与脱附互不影响,并且表面是均匀的,以θ 表示气体分子覆盖活性位的百分数(覆盖度),则气体的吸附速率与气体的压力成正比,也与固体表面的空活性位数成正比。
研究提出 CO 在 Ru 上的氧化反应的一种机理如下:其中 kco,ads 、 kco,des 分别为 CO 在 Ru 的活性位上的吸附速率常数和脱附速率常数, ko 2,ads 为 O2 在 Ru 的活性位上的吸附速率常数。
M 表示 Ru 催化剂表面上的活性位。
CO 在 Ru 表面活性位上的吸附比O2 的吸附强得多。
试根据上述反应机理推导 CO 在催化剂 Ru 表面上氧化反应的速率方程(不考虑 O2 的脱附;也不考虑产物CO 2的吸附),并与实验结果比较。
⒊有关物质的热力学函数( 298 . 15 K )如表 5。
在 373.15K ,100kPa 下,水的蒸发焓Δvap H m =40.64kJ ·mol -1,在298.15 ~-1 -1373.15K 间水的等压热容为 75.6 J ·K-1·mol -1。
⑴将上述工艺得到的富氢气体作为质子交换膜燃料电池的燃料。
燃料电池的理论效率是指电池所能做的最大电功相对于燃料反应焓变的效率。
在298.15K ,100kPa 下,当 1 molH 2燃烧分别生成 H 2O(l)和 H 2 O(g)时,计算燃料电池工作的理论效率,并分析两者存在差别的原因。
⑵若燃料电池在 473.15 K 、 100 kPa 下工作,其理论效率又为多少(可忽略焓变和嫡变随温度的变化)?⑶说明⑴和⑵中的同一反应有不同理论效率的原因。
答案及评分标准第一题( 6 分)每空 0.5 分第二题( 6 分)⒉大于(0.5 分)⒊化学方程式:⑴将氯气通人浓缩的酸性的海水中,Cl 2 +2Br -=2Cl -+Br 2(1 分)⑵压缩空气将溴吹出,碱性溶液吸收:2- - - - - -3Br2+3CO32-=BrO 3-+5Br -+3CO 2或 3Br 2+6OH -= BrO 3-+5Br -+3H2O (1 分)⑶浓缩⑷酸化BrO 3-+5Br -+6H +=3Br 2↑ ++3H 2O (1 分)⑸冷凝: Br 2(g ) → Br 2(l ) 流程框图:(1 分 )2KMnO 4+3H 2SO 4+5H 2O 2=2MnSO 4+K 2SO 4+5O 2+8H 2O2KI+2H 2SO 4+CH 3COOOH=2KHSO 4+ CH 3COOH+H 2O+I 2 I 2+2Na 2S 2O 3=2NaI+Na 2S 4O 6 (各 0.5 分 )⒉计算过程:4.可推测:过氧乙酸在水溶液中会分解,因而该测定方法本身不可能达到 数字的准确度。
(1 分) ⒌ CH 3COOOHCH 3COOH+ 21 O 2↑第四题( 8 分)第三题( 6 分)⒈化学方程过氧乙酸的质量分数= 0.182 ⒊为避免过氧乙酸与高锰酸钾反应。
