乙型肝炎病毒基因分型检测标准操作规程(PCR-反向斑点杂交法)
PCR反向斑点杂交技术在乙型肝炎病毒基因分型检测中的应用

本文研究结果 可 以看 出, 尿 液 显 微 镜 计 数 法 虽 然 准 确 性
高, 但 是 从 尿 液显 微 镜 计 数 法 的 操 作 方 法 看 出 , 工 作 人 员 的 工 作量确实很大 ; 而尿液分析 仪检测法 虽然方 便 、 快捷、 经济 , 但
是 准 确 率 略 低 于 显 微 镜 计 数 法 。从 这 个 方 面 看 尿 液 检 测 仪 适
用 于 初 诊 患 者 或 者 适 用 于 各 单 位 及 机 关 的正 常 体 检 , 体 现 尿 液 检 测 仪 的优 越 性 , 但是 , 若患者 要复诊 , 和确 诊的情 况下 , 建 议 使用两种方法联合起来 , 通 过 两 种 办 法 的联 合 检 验 才 能 有 效 的 确 保 检 查 中不 会 出 现 漏 检 的 状 况 , 这 是对 前来 诊治 患者 的 负 责, 也 是 对 医 疗 工 作 者 自身 的 负 责 , 若 出 现 两 种 检 验 方 法 不 能
[ 8 ] 翁玉玲 , 李哲 . 尿 液潜 血 试 验 与 镜 检 红 细 胞 结 果 的对 比观 察 E J 3 .
中 国 医 药 指南 , 2 0 1 2 , 1 0 ( 2 9 ) : 5 2 5 3 .
红 细 胞 计 数 法 为 标 准 的情 况 下 , 尿 液 分 析 仪 的 检 测 结 果 出 现 了 1 0 . 0 的假阳性率 , 1 3 . 3 的假 阴性 率 。 同时 通 过 表 1 结 果 观 察 显 微 镜 红 细 胞 计 数 的 阳性 率 要 低 于 尿 液 分 析 仪 , 通 过 表 2发 现 尿 液 分 析 仪 的假 阳性 率 较 高 , 这种结果的出现通过分析是 由 以下 原 因导 致 的 : ( 1 ) 尿 液 分 析 仪 的 原 理 是 通 过 血 红 蛋 白 中 亚 铁 血 红 素 中 的过 氧 化 物 发 生 反 应 从 而 判 断 的 阳性 , 而 患 者 尿 液
PCR-反向点杂交法与DNA直接测序法检测HBV耐药变异与基因型的比较研究的开题报告

PCR-反向点杂交法与DNA直接测序法检测HBV耐药变异与基因型的比较研究的开题报告
一、选题背景
乙型肝炎病毒(HBV)感染对人类健康造成极大的危害。
由于该病
毒的高度变异性,对病毒耐药性的检测和流行病学调查变得至关重要。
PCR-反向点杂交法和DNA直接测序法是目前常用的检测方法之一。
本研究旨在比较这两种方法在检测HBV耐药变异和基因型上的优劣势。
二、研究目的
1.比较PCR-反向点杂交法和DNA直接测序法在检测HBV耐药变异
上的有效性和准确性;
2.分析PCR-反向点杂交法和DNA直接测序法在检测HBV基因型上
的应用优势和局限性;
3.探索在临床实践中应用PCR-反向点杂交法和DNA直接测序法检测HBV耐药变异和基因型的价值。
三、研究内容及方法
本研究计划从2019年1月至2021年12月,选取100名HBV患者,采用PCR-反向点杂交法和DNA直接测序法分别检测其耐药变异和基因型,并对比这两种检测方法的结果。
数据统计分析采用SPSS19.0软件,对检测结果进行描述性分析、比较性分析及相关性分析。
四、预期成果
通过PCR-反向点杂交法和DNA直接测序法的比较,研究可以明确
两种方法在HBV耐药变异和基因型检测上的优势和劣势,为临床实践提
供有效的检测手段和科学依据。
研究结果有望在该领域产生重要的理论
与实践意义。
五、研究意义
该研究可以为HBV感染的临床治疗提供有效的检测手段和临床依据,有助于提高HBV感染治疗的准确性和个性化治疗水平,为HBV感染的流行病学调查提供科学依据,为研究HBV变异机制和病原学提供可靠的数
据支持。
SRY基因检测试剂盒PCR-反向斑点杂交法
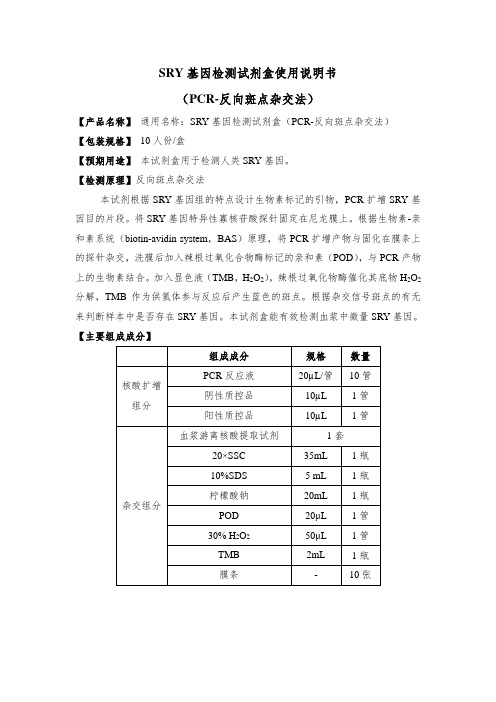
SRY基因检测试剂盒使用说明书(PCR-反向斑点杂交法)【产品名称】通用名称:SRY基因检测试剂盒(PCR-反向斑点杂交法)【包装规格】10人份/盒【预期用途】本试剂盒用于检测人类SRY基因。
【检测原理】反向斑点杂交法本试剂根据SRY基因组的特点设计生物素标记的引物,PCR扩增SRY基因目的片段。
将SRY基因特异性寡核苷酸探针固定在尼龙膜上。
根据生物素-亲和素系统(biotin-avidin system,BAS)原理,将PCR扩增产物与固化在膜条上的探针杂交,洗膜后加入辣根过氧化合物酶标记的亲和素(POD),与PCR产物上的生物素结合。
加入显色液(TMB,H2O2),辣根过氧化物酶催化其底物H2O2分解,TMB作为供氢体参与反应后产生蓝色的斑点。
根据杂交信号斑点的有无来判断样本中是否存在SRY基因。
本试剂盒能有效检测血浆中微量SRY基因。
【主要组成成分】【自配试剂】使用前配制下列试剂:1、A液(2×洗膜缓冲液):25mL 20×SSC和2.5mL 10%SDS用双蒸水定容到250mL。
2、B液(0.5×洗膜缓冲液):5mL 20×SSC,2mL 10%SDS用双蒸水定容到200mL。
3、C液:15mL 1M柠檬酸钠加双蒸水定容至150mL。
【储存条件及有效期】核酸扩增组分于-20℃以下冷冻保存;POD、30% H2O2和膜条于2~8℃冷藏保存。
TMB应2~8℃避光保存。
20×SSC、10%SDS和柠檬酸钠室温保存。
微量游离DNA提取试剂盒(自动磁珠法)(Cat#Yu-CF02-2-1)保存见说明书。
试剂有效期12个月。
【适用仪器】核酸扩增仪:ABI-Veriti,USA;Ependorf Gradient,German;MJPTC-100,USA;AB9700,USA等。
分子杂交仪:亚能YN-H16,China;FYY-3,China等。
【检测步骤】样本检测包括三个步骤:血浆(血清)游离DNA提取;PCR扩增;杂交检测。
PCR-反向斑点杂交法检测HBV YMDD模序混合感染

PCR-反向斑点杂交法检测HBV YMDD模序混合感染袁耀钦;潘小划;何东华;欧志英【期刊名称】《热带医学杂志》【年(卷),期】2007(7)11【摘要】目的为HBV感染临床个体化治疗、指导临床用药寻找一种能更好地检测HBV YMDD模序混合感染的方法。
方法28份已知乙肝病人血清,其中10份为HBV YMDD模序感染,5份为HBV YIDD模序感染,5份为HBV YVDD模序感染,2份为HBV YMDD和YIDD模序混合感染,2份为HBV YMDD和YVDD模序混合感染,2份为HBV YIDD和YVDD模序混合感染,2份为HBV YMDD、YIDD和YVDD模序混合感染,都用PCR产物直接测序和PCR-流过式反向斑点杂交(Flowthrough-RDB)方法检测。
结果HBV YMDD模序单一感染标本用两种方法检测准确性都达到100%,对混合感染标本PCR-流过式反向斑点杂交方法检测准确性也可达100%,然而用PCR产物直接测序方法只能检测其中一种或两种型别。
结论PCR-流过式反向斑点杂交方法是一种敏感、特异和快速的检测HBV YMDD野生型及其突变型模序单一感染和混合感染的有效方法,比PCR产物直接测序更优越,更有利于实现临床个体化治疗和指导临床用药。
【总页数】4页(P1064-1067)【关键词】HBV;拉米夫定;PCR-流过式反向斑点杂交;测序【作者】袁耀钦;潘小划;何东华;欧志英【作者单位】广东省东莞市茶山医院;中山大学达安基因诊断中心;广州市儿童医院【正文语种】中文【中图分类】R512.62【相关文献】1.应用PCR-反向斑点杂交法快速检测和鉴定常见医学真菌 [J], 郭梅;牟兆钦;谢湘峰;陈建魁;尹秀云2.PCR-反向点杂交法检测 HBV 耐药变异与基因型的探讨 [J], 张达衡;陈红玲;谭满胜;陈瑞林;杨春媚3.应用PCR-反向斑点杂交法快速检测和鉴定医学重要真菌 [J], 郭梅;牟兆钦;谢湘峰;陈建魁;尹秀云4.反向斑点杂交技术检测HBV YMDD基序变异的应用和评价 [J], 张太松;董瑞华;李建芳;林炳生;雍万军;胡守旺;李明;周新宇5.PCR荧光法和 PCR-反向斑点杂交法检测人乳头瘤病毒比较研究 [J], 王海宁;剌梅;李欣;杨小青;杨小艺因版权原因,仅展示原文概要,查看原文内容请购买。
乙肝病毒核酸检测实验操作流程

原理图
每产生一条DNA链,就切断一条探针 每切断一条探针,就产生一个荧光信号 信号强度与结合探针的DNA分子数成正比
操作流程
一、标本采集
一次性无菌注射器抽取 受检者静脉血2毫升,注 入无菌的干燥玻璃管 用一次性无菌注射器抽取 受检者静脉血2毫升,注 入含EDTA或枸橼酸钠抗凝 剂的试管
血 清 的 采 集
93℃ 30秒→55℃ 45秒→30个循环
结果分析
1.
2.结果读取
3.结果报告
结果的报告必须简单清楚 定量测定则必须报告量的多少 1、结果高于测定方法线性范围上限,可报告>多少; 也可对样本稀释后再测,结果乘以稀释倍数 2、结果低于方法的测定范围下限,则报告多少即可, 不能报告“0”或阴性
乙肝病毒核酸检测 实验操作流程
广西临床检验中心 唐 娟
主要内容
HBV-DNA的检测原理
标本采集
HBV-DNA操作流程
DNA 提取 PCR 扩增
HBV-DNA检测结果分析
临床意义
检测原理
HBV : 用一对乙型肝炎病毒特性引物(Primer)和一
条乙型肝炎病毒特异性荧光探针,配以PCR反
应液、耐热DNA聚合酶(Taq酶)、四种脱氧 核苷酸单体(dNTPs)等成分,用PCR体外扩 增法定量检测乙型肝炎病毒DNA
室温(22~25ºC)放置 30~60 分钟血标本使用 水平离心机,4000转/分 离心5分钟
血 浆 的 采 集
立即轻轻颠倒玻璃管混合 5~10次,使抗凝剂与静 脉血充分混匀
吸取上层血清,转移至 1.5ml灭菌离心管
5~10分钟后即可分离出 血浆,转移至1.5ml灭菌 离心管
乙型肝炎病毒核酸定量检测标准作业指导书

乙型肝炎病毒核酸定量检测标准作业指导书-模板1.目的采用PCR技术、实时荧光探针技术,用于临床血清或血浆标本中的乙型肝炎病毒核酸的定量检测,或用于乙型肝炎的辅助诊断和抗病毒药物治疗中的疗效观察。
2.范围适用于乙型肝炎病毒核酸(HBV DNA)定量检测(PCR-荧光探针法)。
3. 职责3.1 操作人员:负责标本制备检测、仪器操作、报告发送。
3.2 专业组组长:负责本组耗材的请购,监督本组标本检测、仪器操作、报告发送、质控管理等各方面工作。
3.3 实验室主任:负责监督和指导实验室各方面工作。
4. 原理采用荧光PCR技术,以HBV基因组中相对保守区为靶区域,设计特异性引物及荧光探针,在样品核酸纯化之后,通过荧光定量PCR对HBV DNA进行扩增,并检测荧光信号,仪器软件系统自动绘制出实时扩增曲线,根据阈循环值(CT)实现对未知样品的检测。
另外,本试剂盒带有内标物质,用于对核酸提取的整个过程进行监控,减少假阴性结果的出现。
5. 样品要求5.1 适用样品类型:血清或血浆。
5.2 样品采集:5.2.1 血清用一次性无菌注射器抽取受检者静脉血2ml,注入无菌的真空采血管中(未加抗凝剂),室温(22-25℃)放置30-60min血标本可自发完全凝集析出血清,或直接使用水平离心机,1500rpm离心5min,吸取上层血清,转移至1.5ml灭菌离心管。
5.2.2血浆用一次性无菌注射器抽取受检者静脉血2ml,注入含EDTA(乙二胺四乙酸二钠)抗凝剂的真空采血管,立即轻轻颠倒混匀5-10次,使抗凝剂与静脉血充分混匀,5-10min后分离血浆于无菌的1.5ml灭菌离心管。
5.3 样品保存和运送使用专用样品0℃冰壶送检,温度约维持在4℃左右。
分离后的血清或血浆可立即用于测试,也可以保存于-20℃待测,保存期为6个月。
5.4 拒收样品:拒绝重度溶血样品、肝素抗凝的血浆。
6. 仪器和试剂6.1 仪器AB7500核酸扩增仪、恒温金属浴、生物安全柜、低温离心机等。
乙型肝炎病毒实验室检测技术规范

乙型肝炎病毒实验室检测技术规范简介本文档旨在制定乙型肝炎病毒实验室检测技术规范,以确保实验室操作的准确性、有效性和安全性。
本规范适用于乙型肝炎病毒的检测工作,包括样本采集、处理、实验操作和数据分析等环节。
实验室设备和材料要求- 实验室应配备符合乙型肝炎病毒检测要求的设备,包括PCR 仪、离心机、显微镜等。
- 实验室应储备足够的试剂和耗材,确保进行实验所需材料的充足性和质量。
- 实验室应建立样本采集、储存和处理的标准操作流程,确保样本的完整性和稳定性。
实验操作规范- 实验操作前,操作人员应接受相关的乙型肝炎病毒检测方法培训,熟悉操作流程和安全注意事项。
- 实验操作中应严格遵守无菌技术操作要求,避免交叉污染和误差的发生。
- 样本采集时应采用合适的器械和方法,并确保采集的样本足够,并满足乙型肝炎病毒检测的要求。
- 样本处理过程中应遵循实验室内的安全操作规定,包括穿戴个人防护装备、定期消毒等。
- 实验操作中应遵循乙型肝炎病毒检测方法的标准程序,确保操作的准确性和可靠性。
数据分析和结果报告要求- 实验数据应进行准确的记录和整理,确保数据的可追溯性和准确性。
- 数据分析应遵循乙型肝炎病毒检测方法的要求,运用适当的统计方法和质控措施进行数据分析。
- 检测结果应及时报告,包括样本编号、检测方法、检测结果等内容,并存档备查。
质量控制要求- 实验室应建立质量控制体系,包括质量控制样品的使用和监测,以确保实验结果的准确性和可靠性。
- 定期进行设备的校准和维护,确保设备运行的准确性和稳定性。
- 实验操作过程中应进行内部质量控制的监测,包括设立质控样品和进行校准实验等。
安全要求- 实验室应遵守乙型肝炎病毒实验室安全管理规范,包括建立安全操作标准、储存和处置感染性废弃物等。
- 操作人员应接受相关的安全培训,熟悉应急处理措施和事故报告要求。
- 实验室应建立和维护安全管理档案,包括安全设施和装备的维护记录、事故处理记录等。
总结本文档为乙型肝炎病毒实验室检测技术规范,提供了实验室设备和材料要求、实验操作规范、数据分析和结果报告要求、质量控制要求以及安全要求等方面的内容。
最新《乙型肝炎病毒、丙型肝炎病毒...

最新《乙型肝炎病毒、丙型肝炎病毒...乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒(1+2型)核酸检测试剂盒(PCR-荧光法)操作规程1.目的规范核酸检测试验操作,确保检测结果的准确性。
2.原理2.1 汇集:吸取8份(或以下)样品到指定的汇集管。
2.2提取:病毒核酸提取的方法为磁珠法。
试剂盒提供之内对照(IC)为不具感染性的假病毒,在进行样品核酸提取前加入样品中,监控提取、扩增和分析的全过程。
标本经裂解液处理后会将病毒外鞘膜破坏,蛋白质变形,使病毒裂解释放出病毒基因组核酸。
加入表面包被有二氧化硅的磁珠颗粒,在高盐环境下带负电荷的核酸吸附到带正电荷的的磁珠颗粒表面。
洗液可以洗去未结合的物质,如变性的蛋白、细胞碎片、PCR抑制物等并降低盐浓度。
纯化的病毒在特定的环境下从磁珠颗粒表面洗脱下来成为扩增的模板。
2.3扩增:采用PCR扩增TaqMan荧光探针标定技术同时对HBV (DNA)、HCV(RNA)、HIV(RNA)进行检测。
在反转录酶的作用下HCVRNA、HIVRNA反转录成cDNA,再与HBVDNA一同通过TaqDNA聚合酶的作用扩增病毒核酸的保守区域,TaqDNA聚合酶5`—3`外切酶活性切割反应系统中带荧光标记的TaqMan探针,随着PCR的进行,荧光信号不断积累。
通过PCR 仪的检测血液标本达到和超过荧光阈值的信号给出样品的阴阳性结果。
选择性PCR扩增:采用UNG-dUTP抗污染系统。
在PCR扩增系统中采用UTP代替TTP,产生大量U-DNA片段。
UNG酶特异识别U-DNA片段中含UTP的位点并进行切割,U-DNA被降解后不能作为再次扩增的模板,系统选择性的扩增天然的核酸分子,从而防止了PCR扩增产物的污染。
2.4 质量控制原理为监控实验进行,保证实验结果的准确,在每次检测过程依靠阳性、阴性质控品以及内标进行监测。
2.4.1阴性质控品监控系统性假阳性,如果阴性质控品检测结果为阳性,说明实验存在假阳性的风险,因此实验中的阳性结果需复查。
PCR-反向点杂交法检测乙型肝炎病毒的基因耐药变异与基因分型

出血临床 观察 [ J ] . 中国当代 医药, 2 0 1 0 , 1 7 ( 1 ) : 4 3 — 4 4 .
[ 1 O ] 林道浙 , 徐定银 , 陈积 贤. 泰绫 在 甲状 腺手术 中的应用 [ J ] . 中
华普外科手术学杂志 , 2 0 1 0, 4 ( 2) : 2 0 0 - 2 0 3 . [ 1 1 ]S i l v e v s t e i n ME, C h v a p i l M.E x p e r i me n t a l a n d c l i n i c a l e x p e i r e n c e s w i s h c o l l a g e n l f e e c e a s a h e mo s t a t i c a g e n t [ J ] .J T r a u m a , 1 9 8 1 , 2 1
[ 7 ]刘远成 , 叶伟 明, 沈 奎. 痔术 后出血 的预 防及 治疗 [ J ] . 中医药
临床杂志 , 2 0 1 0, 2 2 ( 3 ) : 2 5 4 - 2 5 5 . [ 8 ]贺平 , 谢敏江 , 张桢, 等. 地奥 司 明用 于痔外 剥 内扎 术后 4 7 ( 9) : 1 0 8 1 - 1 0 8 2 . [ 9 ]卢本银 , 李扬轶 , 赖彪 , 等. 痔上动脉缝 扎术预 防外 剥 内扎术后
血绫是 由纯天然再 生纤维素经化学变性后而成 , 无 毒、 无害 , 不 含任何 药 物 , 遇 血后 与 手 术 创 面 贴 敷 严
密, 然后 逐渐 溶化膨 胀 成半 透 明凝胶 样 , 具 有很 好 的 物理 、 生理 、 化 学 止血 功 效 , 除用 于一 般 止 血 外 , 还用 于 创 面 广 泛 渗 血 和 体 内 某 些 特 殊 部 位 的 止 血 。本研 究 显示 , 治疗 组术 后 1 、 3 、 5 d出血 症状
《乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒(1+2型)核酸检测试剂盒(PCR-荧光法)操作规程》

乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒(1+2型)核酸检测试剂盒(PCR-荧光法)操作规程1.目的规范核酸检测试验操作,确保检测结果的准确性。
2.原理2.1 汇集:吸取8份(或以下)样品到指定的汇集管。
2.2提取:病毒核酸提取的方法为磁珠法。
试剂盒提供之内对照(IC)为不具感染性的假病毒,在进行样品核酸提取前加入样品中,监控提取、扩增和分析的全过程。
标本经裂解液处理后会将病毒外鞘膜破坏,蛋白质变形,使病毒裂解释放出病毒基因组核酸。
加入表面包被有二氧化硅的磁珠颗粒,在高盐环境下带负电荷的核酸吸附到带正电荷的的磁珠颗粒表面。
洗液可以洗去未结合的物质,如变性的蛋白、细胞碎片、PCR抑制物等并降低盐浓度。
纯化的病毒在特定的环境下从磁珠颗粒表面洗脱下来成为扩增的模板。
2.3扩增:采用PCR扩增TaqMan荧光探针标定技术同时对HBV(DNA)、HCV(RNA)、HIV(RNA)进行检测。
在反转录酶的作用下HCVRNA、HIVRNA反转录成cDNA,再与HBVDNA一同通过TaqDNA聚合酶的作用扩增病毒核酸的保守区域,TaqDNA聚合酶5`—3`外切酶活性切割反应系统中带荧光标记的TaqMan探针,随着PCR的进行,荧光信号不断积累。
通过PCR仪的检测血液标本达到和超过荧光阈值的信号给出样品的阴阳性结果。
选择性PCR扩增:采用UNG-dUTP抗污染系统。
在PCR扩增系统中采用UTP代替TTP,产生大量U-DNA片段。
UNG酶特异识别U-DNA片段中含UTP的位点并进行切割,U-DNA被降解后不能作为再次扩增的模板,系统选择性的扩增天然的核酸分子,从而防止了PCR扩增产物的污染。
2.4 质量控制原理为监控实验进行,保证实验结果的准确,在每次检测过程依靠阳性、阴性质控品以及内标进行监测。
2.4.1阴性质控品监控系统性假阳性,如果阴性质控品检测结果为阳性,说明实验存在假阳性的风险,因此实验中的阳性结果需复查。
乙肝病毒(HBV)PCR检测

试剂盒组成
DNA提取液:裂解病毒蛋白外壳,使病毒DNA游离
PCR反应管:含有扩增HBV特异DNA片段的引物、 dNTPs、Taq酶、PCR缓冲液、Mg2+等,只需加入 模板即可进行扩增反应。
阳性模板:纯化的HBV -DNA,无病毒外壳,无 感染性,直接加入PCR反应管扩增后用作阳性对照。
加好样的PCR反应管放入PCR扩增仪的反应板上, 扩增程序:
(1)93ºC 3分钟 预变性 (2)三步循环:
93ºC 45秒(变性) 55ºC 45秒(复性) 共35个循环 72ºC 1分钟(延伸)
(3)72ºC 保温5分钟 (防止延伸不完整)
3. 电泳检测: 直接取PCR反应产物加入2%琼脂糖凝胶上电泳 20分钟,EB染色后在紫外灯下观察,若在314bp 处(与阳性对照处于同一位置)出现条带,则怀 疑为HBV阳性。
1. 标本处理: 每六人一组,取血清40ul加入0.5离心管,再加入 40ulDNA提取液,沸水浴10分钟,10000rpm离心 5分钟,上清用于扩增反应。
2. PCR反应: 每两人一组 其中一人取一PCR反应管,取1步骤离心后的上清2ul, 加入PCR反应管底层溶液中,6000rpm离心数秒。 另一人取一PCR反应管,取阳性模板2ul加入加入 PCR反应管底层溶液中,6000rpm离心数秒。
扩增人ß – actin特异片段
每两人一组ห้องสมุดไป่ตู้在一0.5离心管中加入以下组分:
模板
4ul
引物
2ul
dNTPs
1ul
Taq酶
0.5ul
10×PCR缓冲液 2.5ul
ddH2O
15ul
(反应体系为25ul)
(所发0.5ml离心管已加好除模板以外的所有组分,请 加入4ul昨日所提取的基因组DNA溶液即可进行扩增)
乙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针法)操作说明

1 弱阳性血清对照 100μl/管 0 1 定量校准品 1 号 15μl/管 7 1 (7.5×10 IU/ml) 1 定量校准品 2 号 15μl/管 6 2 (7.5×10 IU/ml) 1 定量校准品 3 号 15μl/管 5 3 (7.5×10 IU/ml) 1 定量校准品 4 号 15μl/管 4 4 (7.5×10 IU/ml) 1 定量校准品 5 号 15μl/管 3 5 (7.5×10 IU/ml) 注:不同批号试剂盒中各组份不能互换。 自备实验耗材:适用规格的离心管、微量移液器等。
乙型肝通用名称:乙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针法) 英文名称:Diagnostic Kit for Quantification of Hepatitis B Virus DNA (PCR-Fluorescence Probing) 【包装规格】 32 人份/盒 【预期用途】 乙型肝炎病毒是乙型病毒性肝炎的病原体,具有较强传染性,传播途径复杂,流行面广,发病率高等特点,可导 致急慢性乙型肝炎,淤胆型肝炎,严重的可导致急性肝衰竭,临床上主要表现为肝功能损害,部分患者可有黄疸。隐形感 染较为常见。 目前临床上常用的 HBV 检测方法主要有酶免疫法、化学发光法检测 HBV 标志物和核酸检测 HBV DNA 方法。本试剂 盒定量检测人血清和血浆样本中的乙型肝炎病毒 DNA,主要是通过对乙肝患者血中 HBV DNA 基线水平和变化情况的监测, 用于评估抗病毒治疗的应答和治疗效果监测。检测结果仅供临床参考,不能作为患者病情单独的评价指标,必须结合临床 表现和其他实验室检测指标对患者病情进行评价,亦不能作为血液筛查 HBV 病毒的筛查试剂使用。 【检验原理】 本品基于 TaqMan 探针实时荧光 PCR 技术。在 PCR 反应过程中,同时利用 Taq 酶的 5’→3’聚合酶活性和核酸外 切酶活性, 使得 TaqMan 探针降解, 荧光报告基团和淬灭基团分离使得荧光信号发射, FAM 荧光检测乙型肝炎病毒, JOE/RED 610 nm 波长通道检测内参。 本品使用外源性内参,可以监控和避免由于样本中的 PCR 抑制物或操作不当引起的“假阴性”结果。 【主要组成成份】 每个反应 组份名称 装量 主要成份 中的用量 1 2 3 4 5 6 7 8 9 核酸提取液 A 核酸提取液 B 内参 MgCl2 PCR缓冲液A Taq酶 HBV引物探针 阴性对照 阳性血清对照 3×1.1ml/管 2×1ml/管 160μl/管 450μl/管 480μl/管 160μl/管 320μl/管 100μl/管 100μl/管 100μl 50μl 3μl 13μl 15μl 5μl 10μl - - - 7 μl 7 μl 7 μl 7 μl 7 μl 聚 乙 二 醇 、 NaCl NaOH、SDS、Tween-20、 Chelex-100 合成病毒 MgCl2 Buffer、dNTPs Taq酶、UNG酶 HBV 引物和探针,内参 引物和探针 HBV 阴性血清 HBV 阳性血清 HBV 阳性血清 寡核苷酸片段 寡核苷酸片段 寡核苷酸片段 寡核苷酸片段 寡核苷酸片段 【储存条件及有效期】-20℃保存12个月。探针若单独储存,应注意避光。 【适用仪器】 本品适用于 AB 7300/7500/Mx3000P/LightCycler 480/SLAN 实时荧光定量 PCR 仪。 【样本要求】 用一次性的针筒抽取病人静脉血 1ml,置于灭菌的一次性试管中室温自然凝固或 800~1600g 离心 20 分钟,取分离出的 血清 0.2ml 左右送检。血清标本 2~8℃可放置 72 小时,-70℃可长期保存,标本不宜反复冻融。 【检验方法】 1. 试剂配制 按样本数(样本数=待检血清样本数+血清对照品 3 个+定量校准品 5 个)n 配制反应液: 取 PCR 缓冲液 A n×15μl、HBV 引物探针 n×10μl、Taq 酶 n×5μl、MgCl2 n×13μl 至于一离心管中混匀;低速离
乙肝dna检测的操作规程

乙肝dna检测的操作规程
乙肝DNA检测的操作规程主要包括以下步骤:
1. 采集血液样本:通过抽取受检者的静脉血液来获取样本。
建议在空腹状态下进行抽血,以提高检测的准确性。
2. 提取DNA片段:利用特定的设备和技术,如EV卸电泳、PCR等,从血液样本中提取出乙肝病毒的DNA片段。
这一步骤是检测的关键环节,需要使用精密的仪器和专业的操作。
3. 比对和分析:将提取出的DNA片段与标准样本进行比对,通过特定的检测方法,如荧光定量PCR、基因测序等,分析DNA片段的特性和序列,以确定乙肝病毒的种类和复制程度。
4. 得出检测结果:根据比对和分析的结果,得出乙肝病毒DNA的定量或定性检测结果。
通常情况下,检测结果会以数字或阴阳性方式呈现。
5. 报告与解读:将检测结果整理成书面报告,并提供给医生或受检者。
医生根据检测结果判断受检者是否感染乙肝病毒,以及病毒的复制程度和传染性。
受检者应遵循医生的建议进行相应的治疗或监测。
需要注意的是,乙肝DNA检测是一项高技术含量的实验,需要由经过专业培训的医务人员进行操作。
同时,乙肝病毒的检测结果解读需要结合其他相关检查结果和临床表现进行综合分析,因此最好在医生的指导下进行。
HBV-DNA检测标准操作程序

2.3 吸取已编号的待测血清或血浆样本、试剂盒中的阴性对照、强阳性对照、临界阳性对照及定量标准品(1→)各200μl,分别加入到1.5ml离心管中,在离心管上编好号,振荡混匀。
2.4 56℃温浴15-2Omin,期间颠倒混匀数次。
2.5 加入200Ul无水乙醇,充分混匀,将全部液体转入装有2ml收集管的硅胶柱中,IoOoorPm离心Imin,倒掉收集管中的废液,将硅胶柱重新放入收集管中。
2.6 在硅胶柱中加入500Ul溶液Wl(使用前先检查是否加入相应体积的无水乙醇),1000OrPm离心Imin,倒掉收集管中的废液,将硅胶柱重新放入收集管中。
2.7 在硅胶柱中加入500Ul溶液W2(使用前先检查是否加入相应体积的无水乙醇),1000OrPm离心Imin,倒掉收集管中的废液,将硅胶柱重新放入收集管中。
2.8 在硅胶柱中加入500Ul溶液W2(使用前先检查是否加入相应体积的无水乙醇),IoOOOrPm离心Imin,倒掉收集管中的废液。
2.9 将硅胶柱放入收集管中,1200OrPm空管离心3min,丢弃收集管。
2.10 将硅胶柱放入新的1.5ml离心管中,开盖静置L2min,往硅胶柱中心加入80Ul 的TE洗脱液,静置2-5min,1200OrPm离心2min,丢弃硅胶柱,盖好离心管盖,做好相对应的编号。
(注意:TE洗脱液的体积应不少于50ul,体积过小影响回收率。
为增加基因组DNA的回收率,可将TE洗脱液稍微加热。
获得的DNA应保存在-20°C,以防DNA降解。
)3 .加样(在样本处理区进行)3.1 向设定的n个PCR反应管中分别加入步骤1处理好的样品DNA、强阳性对照、临界阳性对照、阴性对照以及定量标准品(4个)各20μ∣,盖紧管盖,稍做离心。
3.2 将PCR反应管转移到检测区,放入相应的荧光PCR检测仪内,记录样品摆放顺序。
4 .PCR扩增(检测区)4.1 循环条件设置使用ABI7500和Line-Gene9660荧光PCR检测仪时循环程序设置如下:1150℃2min无2195℃9min无34595℃15sec无58℃50sec单次采集荧光4138℃10sec无■阴性对照无定量值出现,且内标Ct值W40;■强阳性对照检测值范围(3.16X105-3.16X106),临界阳性对照检测值范围(3.16×101-3.16×102),且内标Ct值W40。
乙肝病毒核酸扩增荧光检测标准操作程序

人乳头瘤病毒基因分型定量检测试剂盒(PCR 双色荧光探针法)检测标准操作规程1.目的:保证HPV实时检测及分型试剂盒检测结果的准确、可靠。
2.适用范围:适用于定量检测生殖泌尿道分泌物、生殖道刮片、组织活检标本等样本受感染细胞中人乳头瘤病毒(HPV) HPV16,18和45型,31型,次要高危型(33,52,58,67型) DNA 含量。
3.职责实验室操作人员应严格按照本规程进行实验,室负责人监督管理。
本规程的改动,可由任一使用本规程的工作人员提出,并报经下述人员批准签字:室负责人、科主任。
4.试剂来源:意大利人乳头瘤病毒基因分型定量检测试剂盒(PCR 双色荧光探针法);5.质控物:阴性、阳性对照及阳性参考品系列均来源于试剂合6.样本的采集,操作,预处理:6.1细胞样本细胞学标本包括宫颈取样棒,子宫细胞等。
用宫颈刷或细胞刷取标本,收集到的细胞放入适当的收集液中送检(1XPBS,生理盐水或其他介质)盛放样本容器可以在2-80C条件下保存,最长可达48h,这期间应进行核苷酸提取。
如不能在短时间里提取样本,标本应在-200C保存。
①细胞样本的前处理在提取DNA前,如果样品的细胞数太少,应当进行相应的离心来浓缩样本。
无菌的PBS可用来作离心标本悬浮液。
该步骤可去掉可能存在的粒液细胞或红细胞。
6.2 组织标本组织样本包括新鲜的冷冻的或福尔马林固定的石蜡包埋的活检样品。
新鲜的活检样品须在很短的几分钟内处理或用液氮快速冷冻。
并在-800C保存直到用无菌机械捣碎,接着用蛋白酶K消化。
在活检标本被固定和石蜡包埋的情况下,建议用PH为7的含有10%钠盐和钾盐的福尔马林缓冲液,作为清洁液,如组织固定没有采用有上述缓冲液的福尔马林,而是采用Bouin,Holland或其它酸性固定物质的(譬如锇酸)福尔马林液,则该组织标本不适用于DNA的提取,因为这些试剂会导致组织间的相互交联,使组织标本不能被分解。
①组织样本的前处理在组织样本新鲜或冷冻状态下(多至50mg),用一个无菌的捣碎机快速地将样本机械破碎。
HBV、HCV检测规程

乙型肝炎病毒核酸定量检测1原理本试剂盒用一对乙型肝炎病毒特异性引物和一条乙型肝炎病毒特异性荧光探针配以PCR反应液、耐热DNA聚合酶(TAQ酶)、核苷酸单体(DNTPS)等成分,用PCR体外扩增法定量检测乙型肝炎病毒DNA。
2 标本种类及收集要求2.1 标本采集2.1.1标本种类:血清或血浆。
2.1.2标本要求:血清——用一次性无菌采血针抽取受检者静脉血2ml,注入无菌的干燥生化管,使用水平离心机,3000rpm离心10min;吸取上层血清,转移至1.5ML进口灭菌管。
血浆——用一次性无菌采血针抽取受检者静脉血2ml,注入含EDTA(乙二胺四乙酸二钠)抗凝剂管,立即轻轻颠倒玻璃管混合5~10次,使抗凝剂与静脉血充分混匀,3000rpm离心10min;吸取上层血浆,转移至1.5ML 进口灭菌管2.2 标本储存:标本可立即用于测试,也可以保存与—20℃待测,保存期为6个月。
2.3标本运输:密封,室温运输。
2.4标本拒收标准:污染、标本量不足、严重溶血或脂血标本不宜作此项检测。
3试剂3.1 试剂名称:乙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针法)3.2 试剂生产厂家:中山大学达安基因股份有限公司。
3.3 包装规格:20人份/盒3.4 试剂盒组成DNA浓缩液,DNA提取液,PCR反应管,HBV临界阳性质控品,HBV强阳性质控品,阴性质控品,HBV阳性定量参考品(1.0×104IU/ml、1.0×105 IU/ml、3.5试剂储存条件及有效期:-20℃避光保存,有效期6个月。
4 仪器设备4.1 仪器名称:生物安全柜(Ⅱ级)、高速冷冻离心机、荧光定量PCR仪、恒温金属浴。
4.2 仪器厂家:上海培清、美国NUAIR公司、美国eppendorf、美国ABI生物技术公司、广州达安基因有限公司。
4.3 仪器型号:ABI7300、DA7600。
5 操作步骤5.1 DNA提取:5.1.1 标本处理(血清和血浆标本处理相同)-取100ul血清加入等量DNA浓缩液,振荡器振荡混匀5sec;12,000rpm离心10min;去上清,沉淀中加入30ul DNA 提取液,振荡器剧烈振荡混匀5-10sec,瞬时离心数秒,100℃恒温处理10±1min;12,000rpm离心5min,备用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙型肝炎病毒基因分型检测标准操作规程(PCR-反向斑点杂交法)
1.目的:乙型肝炎病毒基因分型检测标准操作规程,保证检测结果的准确性。
2.应用范围: PCR实验室。
3.职责:
3.1 文件编写:实验室技术员。
3.2 文件审核:实验室主管。
3.3 文件审批:实验室主任。
3.4 执行:PCR实验室所有工作人员。
4. 参考文献:
4.1《中山大学达安基因股份有限公司乙型肝炎病毒基因分型检测试剂盒说明书》
4.2 中山大学达安基因股份有限公司核酸扩增荧光检测系统DA7600型使用说明书
5. 内容:
5.1 检测方法:PCR-反向斑点杂交法。
5.2 实验原理:选取人乙型肝炎病毒基因组中编码表面抗原的S基因的编码区为扩增区域,设计特异性引物及B,C,D型特异性探针,预先将特异性探针包被在尼龙膜上,再利用生物素标记的引物对靶片段进行PCR扩增,PCR产物和膜条上的特异性探针杂交,靶标中的型特异性片段会和特异性探针结合,未结合的PCR 产物通过洗膜去除,最后进行显色和结果分析,可检测HBV B、C、D三种基因型DNA.
5.3 标本采集:由合作单位按照以下要求进行采集。
5.3.1 标本类型:血清。
5.3.2 标本采集:用一次性无菌注射器抽取受检者静脉血2ml,注入无菌的干燥玻璃管,室温(22~25℃)放置30~60 min,全血标本可自发完全凝集析出血清,或直接使用水平离心机,1,500 rpm离心5min;吸取上层血清,转移至1.5ml灭菌离心管。
5.3.3 标本保存:标本采集后保存于2~8℃。
5.3.4 运送条件:标本运送采用冰壶。
5.3.5 标本拒收标准:污染、严重溶血、脂血类或肝素抗凝剂标本。
5.4 设备和试剂:
5.4.1 设备: DA7600 PCR仪、低速水平离心机、生物安全柜、台式高速离心机、移液器、混匀器、恒温水浴箱/干式恒温器、冰箱(4℃、-20℃)、移动/固定紫外灯、冷冻离心机。
5.4.2 试剂:
5.4.2.1 试剂品牌:中山大学达安基因股份有限公司乙型肝炎基因分型检测试剂盒
5.5.2.2 试剂组成:DNA 浓缩液(2,000μL/管)1 管;DNA 提取液(500μL/管)1 管;HBV 基因分型突变反应管(未贴标签管)10 人份;HBV 基因分型阳性质控品(50μL/管)1管,HBV 基因分型突变阴性质控品(50μL/管)1管,杂交液Ⅰ浓缩液(50ml/瓶)1瓶,杂交液Ⅱ浓缩液(30ml/瓶)1瓶,溶液Ⅰ(100
μL/管)1管,溶液Ⅱ浓缩液(25ml/瓶)1瓶,溶液Ⅲ(1ml/管)2管,溶液Ⅳ(100μL/管)1管,杂交膜条(10人份/袋)1袋。
5.5.2.3 试剂包装规格:单管单人份,10人份/盒。
5.5.2.4 试剂保存和有效期:PCR试剂保存于-20±5℃,应避免反复冻融,反向点杂交试剂保存于2-8℃。
试剂盒有效期为6个月。
5.6 操作过程:
5.6.1 血清标本的处理:
5.6.1.1 打开恒温水浴箱或干式恒温器,设定温度100℃。
5.6.1.2 从试剂盒中取出DNA提取液、DNA浓缩液,让其在室温下完全融化。
5.6.1.3 取100ul DNA浓缩液,分别加到1.5ml的离心管中并编号。
5.6.1.5 往装有100ul DNA浓缩液的离心管中加入待测样本血清100μL,用振荡器振荡混匀5s。
5.6.1.6 12,000 rmp离心10min。
5.6.1.7 去上清液,沉淀中加入25μLDNA提取液,振荡器震荡均匀5-10s,100℃恒温处理10±1min。
5.6.1.8 12,000rpm离心5min,4℃保存备用(如需长期保存请放置-20℃)。
5.6.2 PCR扩增:
5.6.2.1 取反应管若干,并编号,加入处理好的样品上清液5μL,2,500rpm离心一分钟,放入仪器样品槽。
5.6.2.2 按下列条件扩增:
50℃→3min;93℃→5min;93℃ 30s→58℃ 40s→72℃ 45s→10个循环;93℃ 30s→56℃ 40s→72℃ 45s →10个循环93℃ 30s→55℃ 40s→72℃ 45s→25个循环最后72℃保温7min。
5.6.3 杂交:
5.6.3.1 杂交前准备:打开振荡水浴箱,调节温度至45℃,将杂交液Ⅰ和Ⅱ放入45℃水浴中溶解待用,准备好实验所需的15ml离心管若干个待用。
杂交前试剂配制:
杂交液Ⅰ:将杂交液Ⅰ浓缩液50℃水浴溶解,充分摇匀后用去离子水(浓缩液与去离子水体积比为1:4)稀释。
室温储存,使用前充分溶解混匀。
杂交液Ⅱ:将杂交液Ⅱ浓缩液50℃水浴溶解,充分摇匀后用去离子水(浓缩液与去离子水体积比为1:4)稀释。
室温储存,使用前充分溶解混匀。
溶液Ⅱ:将溶液Ⅱ浓缩液用去离子水稀释而成(溶液Ⅱ浓缩液与水体积比为1:4)
溶液Ⅳ:稀释而成,如:10μL+90μL去离子水
结合液现用现配(1人份):100μL溶液Ⅰ+2mL充分溶解混匀的杂交液Ⅰ(按此比例配制,如10人份1000μL溶液Ⅰ+20mL充分溶解混匀的杂交液Ⅰ)
显色液现配现用(1人份):1mL溶液Ⅱ+100μL溶液Ⅲ+0.5μL稀释10倍后的溶液Ⅳ×2(按此比例,根据具体情况配制)。
