3.1化学反应速率
无机化学第三章化学反应速率和化学平衡ppt课件

ppt课件
5
反应进度 0=∑νBB B
对于化学计量方程式
dξ = dnB /νB
nB——B的物质的量 ξ的单位为mol νB——为B的化学计量数
改写为 dnB = νB dξ
开始时ξ0=0, 、 nB =0 反应进度为ξ时: nB =νBξ
ppt课件
6
反应进度
nB =νBξ
基元反应:反应物一步就直接转变为产物
如:
2NO2→ 2NO + O2
NO2 + CO →NO + CO2
非基元反应:反应物经过若干步(若干个
基元反应步骤)才转变为产物。
如 又如
2NO + 2H2 → N2 + 2H2O ① 2NO + H2→N2+ H2O2 ② H2O2 + H2 → 2H2O
ቤተ መጻሕፍቲ ባይዱ
0.3mol L1 s1
v NH3
cNH3
t
0.4 0.0mol L1 2 0s
0.2mol L1 s1
v N2 : v H2 : v NH3 1: 3 : 2
●瞬间速率:某瞬间(即t0)的反应速率
vNH3
dcB,则得:
v 1 dcB B dt
ppt课件
11
对于上述 N2 3H2 2NH3 化学计量方程式 :
v 1 d 1 dcB V dt B dt
1 dcN2 1 dcH2 1 dcNH3
1 dt
3 dt 2 dt
aA + bB
反应 2W+X Y+Z 哪种速率表达式是正确的?
第三章 化学反应速率
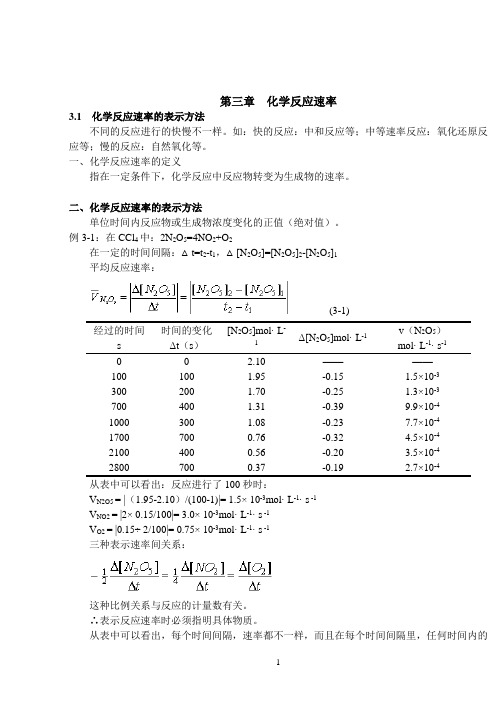
第三章化学反应速率3.1化学反应速率的表示方法不同的反应进行的快慢不一样。
如:快的反应:中和反应等;中等速率反应:氧化还原反应等;慢的反应:自然氧化等。
一、化学反应速率的定义指在一定条件下,化学反应中反应物转变为生成物的速率。
二、化学反应速率的表示方法单位时间内反应物或生成物浓度变化的正值(绝对值)。
例3-1:在CCl4中:2N2O5=4NO2+O2在一定的时间间隔:△t=t2-t1,△[N2O5]=[N2O5]2-[N2O5]1平均反应速率:(3-1)经过的时间s 时间的变化Δt(s)[N2O5]mol· L-1Δ[N2O5]mol· L-1v(N2O5)mol· L-1· s-10 0 2.10 ————100 100 1.95 -0.15 1.5×10-3300 200 1.70 -0.25 1.3×10-3700 400 1.31 -0.39 9.9×10-41000 300 1.08 -0.23 7.7×10-41700 700 0.76 -0.32 4.5×10-42100 400 0.56 -0.20 3.5×10-42800 700 0.37 -0.19 2.7×10-4从表中可以看出:反应进行了100秒时:V N2O5 = |(1.95-2.10)/(100-1)|= 1.5× 10-3mol· L-1· s -1V NO2 = |2× 0.15/100|= 3.0× 10-3mol· L-1· s -1V O2 = |0.15÷ 2/100|= 0.75× 10-3mol· L-1· s -1三种表示速率间关系:这种比例关系与反应的计量数有关。
∴表示反应速率时必须指明具体物质。
大学无机化学课件03化学反应速率

反应速率越大。
26
反应进程势能图
1.ΔH = E正 – E逆
2. 微观可逆性原理
27
实验活化能
❖ 反应物分子须经过一个活化中间状态才能 转化为产物,该中间状态即活化分子。
❖ 由普通反应物分子转变为活化分子需吸收 的能量即活化能Ea。
❖ 根据活化能的大小,和反应能量变化曲线, 可以知道反应是吸热的还是放热的,以及 反应速率的相对快慢。
30
3.3 浓度对反应速率的影响
一、基元反应、简单反应与复合反应
➢ 基元反应(elementary reaction) :反应物分子一步 作用直接转化成产物的反应。由一个基元反应构 成的化学反应称为简单反应。 例:N2O4 = 2NO2 是基元反应,也是简单反应。
➢ 非基元反应:由两个或两个以上基元反应组成的 化学反应,又称复合反应(complex reaction) 、 总反应(overall reaction)。
2. 当具有足够能量的分子以适当的空间取向靠近 时,要进行化学键重排,能量重新分配,形成 一个过渡状态的活化配合物。
3. 过渡状态的活化配合物是一种不稳定状态。 可形成生成物,也可回到反应物。
23
3.2 反应速率理论简介
二、过渡态理论
如: A+ B-C [A…B…C] = A-B +C 反应物 活化配合物 产物
化学反应涉及两个基本问题: ①反应的方向和限度: 反应热力学
反应是否自发,自发的方向和程度 ②反应的速率和具体步骤: 反应动力学
研究途径和速率问题
3
研究反应速率的意义
反应速率
快 ,如爆炸反应,中和反应。 慢,金属的锈蚀,食品的腐烂,
高中化学反应速率与化学平衡

高中化学反应速率与化学平衡在高中化学中,反应速率和化学平衡是两个重要的概念。
本文将就这两个概念进行讨论,并探讨它们之间的关系。
1. 反应速率反应速率指的是化学反应中产物生成或反应物消耗的速度。
反应速率的快慢与反应物的浓度、温度、催化剂等因素密切相关。
1.1 浓度的影响反应速率与反应物的浓度成正比,浓度越高,反应速率越快。
这是因为浓度高时,反应物分子之间的碰撞更频繁,增加了反应的可能性。
1.2 温度的影响反应速率与温度成正比,温度升高可以增加反应物分子的平均动能,使反应物分子更容易克服活化能,从而加快反应速率。
1.3 催化剂的影响催化剂是能够改变反应速率但不参与反应的物质。
催化剂通过提供新的反应路径,降低反应过程中的活化能,从而加快反应速率。
2. 化学平衡化学平衡指的是在封闭系统中,反应物转变为产物和产物转变为反应物的速率相等的状态。
在化学平衡下,反应物和产物的浓度保持不变,但它们之间仍然存在着反应。
2.1 平衡常数对于一个化学平衡反应,我们可以定义一个平衡常数(K),它表示在平衡态下反应物浓度与产物浓度的比值。
平衡常数与反应物浓度和温度有关。
2.2 影响平衡的因素平衡常数的大小受到温度的影响,温度升高会导致平衡常数增大或减小,取决于反应是否放热或吸热。
此外,浓度、压力也可以改变反应的平衡位置。
3. 反应速率与化学平衡的关系反应速率和化学平衡是两个不同的概念,但它们之间有一定的联系。
3.1 反应速率与平衡态在化学反应初期,反应速率往往很快,但随着时间的推移,反应速率逐渐减慢。
最终,反应速率会达到一个平衡态,此时反应物和产物的浓度不再变化,达到化学平衡。
3.2 平衡位置与反应速率在化学平衡下,反应速率并不为零,虽然反应物和产物的浓度不再变化,但仍然存在着微小的反应过程。
平衡位置取决于反应物和产物之间的速率,而不是速率本身。
3.3 影响化学平衡的因素对反应速率的影响改变反应条件,如温度、浓度等,可以影响化学平衡的位置。
第三章化学动力学初步

限速步骤(定速步骤):在一连串的反应中,较慢的基元反应限 制 了整个反应的速率,这一步骤称为限速步骤。
4
3.2 反应速率理论简介 速率理论简介 论简
3.2.1有效碰撞理论
1.反应速率正比于反应物分子的碰撞次数υ∝Z0c(NO)c(O3) 2.反应物分子必须定向碰撞才可能发生反应 有效碰撞
无效碰撞
υ∝PZ0c(NO)c(O3)
10
3.4 反应速率与温度的关系
3.4.1 范特霍夫 范特霍夫(Van’t Hoff)近似规则 近似规则 近似
反应体系的温度每升高10 K,化学反应速率将增加到原来的 k T + n ⋅10 2~4倍。 k T + 10 =γn =γ
kT
kT
γ:温度系数;一般为2~4,k:各温度下的反应速率常数。
9
表3.2 cA和cB及反应速率v
∴根据实验结果可知:m = 2,n = 1 反应的速率方程为υ =kcA
2c D
反应的级数:m + n =
3
说明 (1)常见反应级数:零、一、二级反应,三级反应少见,三级以上 反应无。 (2)反应级数可为零、正整数、分数, 反应级数不同K的单位不同。 (3)复合反应可由限速步骤写出速率方程。
单位是J·mol-1 。
上式两边取自然对数,得:
Ea ln k = ln A − RT
Ea lg k = lg A − (3.6) 2.303RT
【例3-1】对下列反应C2H5Cl(g)→C2H4(g) + HCl(g),已知 A=1.6×1014,Ea=246.9 KJ·mol-1,求700 K时的速率常数。如果 反应温度升高到710 K时,计算速率常数,并与700 K时的速率常 数做比较。
化学中的化学反应速率(化学知识点)

化学中的化学反应速率(化学知识点)化学反应速率是指单位时间内反应物消失或产物生成的速率。
反应速率的快慢对于化学反应的研究和应用具有重要的意义。
本文将介绍化学反应速率的定义、影响因素以及如何测定反应速率。
一、化学反应速率的定义化学反应速率是指在一定条件下,反应物消失或产物生成的速率。
一般情况下,反应速率可以通过反应物消失的速率来描述,以此来衡量反应进行的快慢。
化学反应速率可以用如下公式来表示:速率= ΔC/Δt其中,ΔC表示反应物浓度的变化量,Δt表示时间的变化量。
速率的单位可以是摩尔/升·秒(mol/L·s)、分子/升·秒(molecules/L·s)等。
二、影响化学反应速率的因素化学反应速率受到多种因素的影响,主要包括以下几个方面。
1.反应物浓度:当反应物浓度增加时,反应物之间的碰撞频率增加,从而增加了反应的可能性,使得反应速率加快。
2.温度:提高温度会增加反应物的动能,使反应物之间的碰撞更加频繁且具有更高的能量。
因此,温度升高会加快反应速率。
3.催化剂:催化剂可以降低反应的活化能,使反应物更容易发生反应。
催化剂的存在可以提高反应速率,而不参与反应本身。
4.表面积:反应物的表面积越大,反应物颗粒之间的碰撞频率就越高,反应速率也会增加。
5.反应物的物理状态:气相反应相较于固相反应和液相反应具有更高的反应速率,因为气态分子之间的自由运动能带来更频繁的碰撞。
三、测定反应速率的方法测定反应速率是研究反应动力学的重要手段,常用的方法有以下几种。
1.逐点法:在反应过程中,定时取样,通过测定不同时间点上反应物消失或产物生成的量来计算反应速率。
2.连续监测法:利用分光光度计、电导计等仪器对反应过程进行实时监测,获得反应物浓度的变化曲线,从而计算反应速率。
3.消失溶液平行测定法:将相同溶液分装到多个容器中,分别对不同容器中的反应液进行逐点法测定并计算平均速率,以提高测定结果的准确性。
第三章-化学反应速率

k1cA
dcA cA
k1dt
不定积分式
dcA
cA
k1d t
ln cA k1t 常数
定积分式
cA dcA
c cA , 0
A
t
0 k1dt
ln cA,0 cA
k1t
一级反应的特点
1. 速率系数 k 的单位为时间的负一次方,时间 t可 以是秒(s),分(min),小时(h),天(d)和年(a)等。
小结:
● 化学反应等温方程式
rG
m
(T)
r
G
m
(T)
RT
ln
B
pB p
B
1.反应速率定义
v 1 d
V dt
恒容体系:
1 B
dcB dt
反应商
2.反应的反应速率方程 υ = k{c(A)}a ·{C(B)}b
反应级数
n=a+b
1.一级反应(first order reaction)
第三章 化学反应速率
§3.1 化学反应速率的表示 §3.2 化学反应速率的测定 §3.3 影响化学反应速率的因素 §3.4 影响多相化学反应速率的因素 §3.5 链反应
化学热力学的研究对象和局限性
研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如:
2. ln cA与 t 呈线性关系,斜率为-k。
v 1 d V dt
cA dcA
c cA , 0
A
t
0 k1dt
第三章化学反应速率_大学化学

。通常将它定义为:单位体积的反应系统中,反应进度 随时间的变化率,用符号表示。对于反应
aA + fF = gG + dD (3.1)
化学反应速率的定义式为:
=
1 d V dt
式中V为系统的体积, 按(2.8)式:
L · s 。 v 的单位常用mol·
加快2~4倍。
kT 10 K 24 kT
1.阿仑尼乌斯公式
阿仑尼乌斯根据实验,提出反应速率与温度的定量关
系:
k=Ae-Ea/RT
式中的A是指前因子;Ea叫做反应的活化能,单位是 kJ· mol-1。A与Ea都是反应的特性常数,当反应的温度区间 变化不大时,其值不随温度而改变,均可由实验求得。
活化能越高,活化分子数越少,反应速率越慢。活化能的大小取
决于反应物的本性,它是决定化学反应速率的内在因素。 活化能小于40kJ· mol-1反应,其反应速率非常大,反应可瞬间完 成;活化能大于400kJ· mol-1的反应,其反应速率非常小。前面提到的 汽车尾气NO治理反应活化能611kJ· mol-1,因此看不到该反应的进行。
Ea和A 是两个非常重要的动力学参量。由于Ea在指数
位置,所以它对k 的影响很大。 微分形式:
d ln k Ea 2 dt RT Ea Ea 积分形式 ln k2 ln A ln k1 ln A RT2 RT1 k2 Ea 1 1 ln ( ) k1 R T1 T2
例如的半衰期为8×108年,223Fr(钫)的半衰期为22 分钟,14C的半衰期为5730年等。某些放射性同位素的蜕变
可以作为估算古代化石、矿石、陨石以及地球年龄的基
础。如通常用于陨石和矿石年龄的估算,14C用于确定考古 学发现物和化石的年龄。 1947~1949年间美国科学家利比确立用14C确定地球年 代的概念与方法。为此他获得了1960年诺贝尔化学奖。
化学复习资料化学反应速率与平衡常数

化学复习资料化学反应速率与平衡常数化学复习资料:化学反应速率与平衡常数化学反应速率与平衡常数是化学领域中两个重要的概念。
本文将围绕这两个主题展开,介绍它们的定义、影响因素以及相关计算方法。
同时,我们还将探讨如何改变反应速率和平衡常数,以及它们在实际应用中的意义和应用场景。
1. 速率的定义与影响因素1.1 速率的定义速率是指化学反应物质在单位时间内转化的量。
一般情况下,我们用反应物的消失速率或产物的生成速率来表示反应速率。
反应速率可以通过化学方程式中反应物浓度的变化来确定。
1.2 影响因素反应速率受多种因素的影响,最主要的因素包括温度、浓度、催化剂和表面积等。
温度的升高可以加快反应速率,因为温度升高会增加反应物的动能,促使更多的分子具有足够的能量来克服反应的活化能;浓度的增加也可以提高反应速率,因为浓度的增加会增加有效碰撞的频率;催化剂可以降低反应的活化能,从而增加反应速率;而表面积的增大也有助于提升反应速率,因为更多的反应物可以接触到其他反应物,增加反应的机会。
2. 平衡常数的定义与计算2.1 平衡常数的定义平衡常数是指在化学反应达到平衡时,反应物与产物各自浓度或压力之比的平方根。
平衡常数可以定量地描述一个反应在平衡态下的碰撞概率。
2.2 平衡常数的计算平衡常数的计算依赖于反应方程式中各物质的摩尔系数。
以一般的反应方程式aA + bB → cC + dD为例,平衡常数表达式为Kc =[C]^c[D]^d / [A]^a[B]^b,其中方括号表示浓度。
若方程式中各物质为气体,则可以用压力代替浓度,平衡常数表达式为Kp = PC^cPD^d /PA^aPB^b,其中P表示压力。
3. 改变反应速率与平衡常数的方法3.1 改变反应速率的方法为了改变反应速率,我们可以通过以下方法进行控制:3.1.1 温度控制:提高温度可以加快反应速率,降低温度则会使反应速率变慢。
3.1.2 浓度控制:增加反应物浓度可以提高反应速率,减少反应物浓度则会使反应速率降低。
化学反应的速率

解:
(1)求平均反应速率
2N2O5(g)→4NO2(g)+O2(g)
r 1Δc(N2O5) r Δt
(0.51.0)00.1m 2 o L1lmi1n 2(20)
第3章 化学反应速率
§3.1 反应速率的定义
y1 浓度(N2O5) 作图法求瞬时反应速率
0.92 1 y2
2
时间t
0
x1
x2 4.2 N2O5分解的c-t曲线
例:N2O5的分解反应: 2N2O5(g)→4NO2(g)+O2(g)
在340K测得实验数据为
t /min
012345
c(N2O5)/(mol·L-1) 1.00 0.70 0.50 0.35 0.25 0.17
求反应在2分钟内的平均速率及1分钟时的瞬时速
率。
第3章 化学反应速率
§3.1 反应速率的定义
r ∝ c2(NO) r = k c2(NO) c(H2) n = 1+2=3
第3章 化学反应速率
§3.4 反应物浓度与时间的关系
§3.4 反应物浓度与时间的关系 利用速率方程可以进行许多类型的计算。
3.4.1 零级反应
对于零级反应: A= H
r dc(A) k dt
c( A) c( A0 ) kt
同一反应,可用不同物质的浓度的变
化表示反应速率,其值可能不同。
rN 2-(0 .8 2 -1 )0 .1m o lL -1S -1 rH 2-(2 .4 2 -3 )0 .3m o lL -1S -1 rN H 3(0 .4 2 -0 )0 .2m o lL -1S -1
第3章 化学反应速率
§3.1 反应速率的定义
——为零级反应速率方程的积分表达式
化学反应速率方程式

2 I (g) +H2 (g) =2H I (g)
(快) (慢)
中间产物I2可被光谱检测到,但是没有从混 合物中分离出来。
控制步骤有慢反应决定
反应机理的研究是一个十分复杂而艰难 的任务。
意义:若清楚反应是如何进行的,则可 以有效控制反应的快慢,以获得期望产物。
一般的过程是:采用分子光谱等研究手 段检测反应过程中的中间产物,据此推断反 应历程,再以实验获得的速率方程验证。
一个合理的反应机理应满足:
• 全部基元反应的加和应为化学计量反应方程式 • 由反应机理得出的速率方程应与实验所得一致
例题:一氧化氮被还原为氮气和水:
2NO(g) 2H2 (g) N2 (g) 2H2O(g)
根据光谱学研究提出的反应机理是:
① 2 NO
k1 k-1
N2O2
(快,
平衡)
②N2O2 H2 k2 N2O H2O (慢)
第三章 化学反应速率
§3.1 化学反应进度与化学反应速率 §3.2 浓度对反应速率的影响
—速率方程式 §3.3 温度对反应速率的影响
—Arrhenius方程式 §3.4 反应速率理论和反应机理简介 §3.5 催化剂和催化作用
§3.1 化学反应进度与化学反应 速率
3.1.1 化学反应进度的概念 3.1.2 化学反应速率的表示方法 3.1.3 化学反应速率的测定 3.1.4 反应机理与基元反应
3.1.4 反应机理与基元反应
反应机理:化学反应过程中经历的真 实反应步骤的集合。
基元反应:由反应物一步生成生成物 的反应,没有可用宏观实验方法检测到的 中间产物。
意义:通过实验一旦证实某一有确定 反应物和生成物的反应为基元反应,就可以 根据化学反应计量方程式直接写出其速率 方程式。 例如:
化学反应速率的定义、影响因素和反应级数的确定

义式。当反应速率
ห้องสมุดไป่ตู้
υ=2.0×10-3 mol·L-1·s-1 时,求 d c ( I )和
dc
(SO
2- 4
)。
dt
dt
解:
d c ( S 2 O 8 2 - ) 1 d c (I ) 1 d c ( S2 4 - ) O d c (I - 3) d t 3d t 2 d t d t
d c ( I ) 3 3 2 .0 1 3 0 6 .0 1 3 ( m 0L - 1 o s - 1 ) l d t
N2 1/2 , H2 3/2 , NH3 1
表明合成氨反应中,每消耗 1/2 mol N2和3/2 mol H2则一定生成
1 mol NH3。
虽然以上两种表示方法表示了相同的意义,但在不同的 化学反应方程式中。化学计量数不同。
因此,化学反应计量数(v)一定要与一定的化学反应方程 式相对应,v 取决于反应方程式的形式,单纯说某物质的化 学计量数是多少没有意义。
3.2.1 基元反应
化学反应从微观上看是基于反应物分子的相 互碰撞而实现的。 化学反应按其反应历程来分类,可分为基元 反应和复杂反应。
一、基元反应和非基元反应
1、定义:反应物分子在有效碰撞中一步直接转化为产 物分子的反应称为基元反应,否则为非基元反应。
例如: NO2(g) + CO(g) == NO (g) + CO2 (g) (1)
2.反应进度 反应进度用符号表示,它表示化学反应进行的程度。
反应进度的定义是: 对于反应
0 BB B
dB 1dnB (3.2)
dnB表示某物质在一定时间内物质的量的变化,vB表示化 学计量数,即对于反应
化学反应速率与浓度关系

化学反应速率与浓度关系化学反应速率是指单位时间内化学反应转化物质的量。
在化学反应中,反应物的浓度对反应速率有着重要的影响。
本文将探讨浓度对化学反应速率的影响,并阐述浓度与反应速率之间的关系。
1. 反应速率的定义在化学反应中,反应速率可以用反应物消失的速度或生成物出现的速度来描述。
一般来说,反应速率与反应物或生成物的浓度成正比。
2. 浓度与反应速率的关系2.1 反应物浓度越高,反应速率越快根据反应速率与浓度的关系,我们可以得出结论:反应物浓度越高,反应速率越快。
这是因为反应物浓度增加会导致反应物之间的碰撞频率增加,进而增加反应发生的机会,从而加快了反应速率。
2.2 反应速率与浓度的指数关系反应速率与浓度之间的关系可以使用化学反应速率方程来描述。
对于一般的化学反应A + B → C + D,反应速率方程可以表示为:v = k[A]^m[B]^n其中,v表示反应速率,k表示反应速率常数,[A]和[B]分别表示反应物A和B的浓度,m和n分别表示反应物A和B的反应速率与浓度的反应级数。
3. 浓度对反应速率的影响思考通过对浓度与反应速率的关系进行思考,我们可以得出以下结论:3.1 浓度与反应速率的指数关系根据反应速率方程可以看出,反应速率与浓度之间的关系往往是非线性的,并且与反应物的反应级数相关。
这意味着在一定浓度范围内,反应速率可能出现显著的变化。
3.2 一定浓度下的反应速率当反应物的浓度高于一定阈值时,反应速率往往会趋于饱和,此时进一步增加反应物的浓度对反应速率的影响会变得较小。
这是因为反应物之间的碰撞频率已经达到饱和状态。
4. 应用与展望研究浓度与反应速率的关系在化学工程、生物化学等领域具有重要的应用价值。
通过深入了解反应速率与浓度的关系,可以优化化学反应条件,提高反应效率,加快反应速度。
此外,浓度对反应速率的影响也在药物设计、催化剂开发以及环境保护等方面具有重要意义。
总之,浓度是影响化学反应速率的重要因素之一。
基础化学之化学反应速率

定义:
Ea E * E k
E*
Ek
上页 下页 目录 返回
Ea 与 △rH 的关系
★ 反应物的能量必 须爬过一个能垒 才能转化为产物 ★ 即使是放热反应 (△rH为负值), 外界仍必须提供 最低限度的能量, 这个能量就是 反应的活化能
上页 下页 目录 返回
energy
O 3 (g) NO(g) NO 2 (g) O 2 (g), r H 199 .6 kJ mol 1
图的方法得到,例如对
于反应(45 ℃ ): 2N2O5 →4NO2+O2
v=2.7×10-4 mol · -3 ·-1 dm s
400
800
dc(N2O5) v dt
1200 1600 时间(s)
2000
lim v
t 0
c(N2O5)/mol· -3 v/mol ·dm-3 ·-1 dm s 0.90 0.45 5.4×10-4 2.7×10-4
上页 下页 目录 返回
3.3.1 浓度对化学反应速率的影响:元 反应的速率方程
在温度恒定情况下, 增加反 应物的浓度可以增大反应速率。
白磷在纯氧气中和在空气中的燃烧
用来表示反应速率与反应物浓度之间定量的关系式 叫速率方程(比率相等)又叫速率定律(比率定律)。 反应速率∝碰撞次数∝反应物浓度
4次碰撞
● 对有些物种而言,碰撞的几何方位要适当
上页 下页 目录 返回
对 HCl 和 NH3 的气相反应,显然 HCl 的 H 端只能通过狭窄的“窗口”接近孤对电子, 发生有效碰撞的机会自然小多了。
上页 下页 目录 返回
Question 2
Solution
对应2HI H2+I2,若每次碰撞都反应, T=500℃,c(HI)=1.0×10–3mol· -3, d (HI) dm = 4.0×10–10m。则理论碰撞次数和实际碰 撞次数各为多少?
3.1 化学反应速率及其表示方法

vN2O5
c(N2O5 ) 1.5 10-2 mol L-1 s1
t
不同物质表示的反应速率的数值是不同的
4
大学化学
传统定义的反应速率中,以反应物表示的为消 耗速率,以产物表示的为生成速率,具体选用何物质, 主要取决于在实验过程中哪个物质的浓度最易测定。
5
大学化学
平均速率
某一有限时间间隔内浓度的变化量。
起始浓度(molL-1) 2.0 3.0
0
2s末浓度(molL-1) 1.8 2.4
0.4
反应速率:
1 dcB B dt
1 dc(N2 ) 1 dc(H2 ) 1 dc(NH3) -1 dt - 3 dt 2 dt
1 (1.8 - 2.0) 1 (2.4 - 3.0) 1 (0.4 - 0)
大学化学
3.1 化学反应速率 及其表示方法
1
大学化学
大西洋底泰坦尼克号 船首的腐蚀过程
2
大学化学
NO (g) + CO(g) → 1/2N2 (g) + CO2 (g) ΔrGmθ =−344 kJ⋅ mol−1 Kθ = 1.9× 1060 (298.15 K)
实际上,尽管该反应的限度很大,但反应速率 极慢,不能付诸实用。研制该反应的催化剂是人们非 常感兴趣的课题。
例:某温度时,在1升容器内进行下列反应 2A(g) + B(g) → C(g) 已知,
0″ 2.0mol 1.0mol 10″ 1.0mol 0.5mol2
22
0.1mol L-1 s-1
对于一般的化学反应:
aA + bB
yY + zZ
dcA dcB dcY dcZ
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
标准一致,单位统一
比较反应速率大小时,不仅要看反应 速率数值本身的大小,还要结合化学方程 式中物质的化学计量数的大小来说明。
小结:影响化学反应速率的外因
影响 外因 增大反应 物浓度
分子总数
单位体积内
活化分子 数 活化分子 百分数
化学 有效碰 反应 撞次数 速率
增加 增加 加快 加快
增加 增加
增加 增加
4:当A、B两种气体物质的浓度比相同时,在 不同温度下进行反应:A+2B=3C,10℃时测得 反应速率vB=0.2mol· S-1,50℃时测得反应速 l-1· 率vA=25.6mol· S-1若温度每升高10℃,该反 l-1· 应的反应速率增大到原来的n倍,则n约为( ) A 3 B 3.5 C 4 D 4.5 分析:解此题的关键是把不同物质表示的反应 速率换算为同一物质表示的反应速率,然后代 经验公式。 A V 由 于 V 1 2
注意问题∶
(1) 在同一反应中用不同物质来表示时,其数值 可以不同,但都表示同一个反应的速率.因此, 表示化学反应的速率时,必须说明反应物中哪 种物质做标准.不同物质的速率的比值一定等 于化学方程式中相应的化学计量数之比. (2)一般来说,化学反应速率随反应的进行而逐 渐减慢.因此,某一段时间内的反应速率,是平 均速率,而不是指瞬时速率.
(3)化学反应速率一般不能用固体或纯液体表示。
外在条件对反应速率的影响——综合
——理论分析类
增大反应物的浓度使反应速率加快的主要原因( A ) 对于气体参与体系增大压强使反应速率加快的主要原因 是( A ) 升高温度使反应速率加快的主要原因是( C) 使用催化剂使反应速率加快的主要原因是( D) A、活化分子百分数不变,但提高单位体积内活化分子的 总数 B、 增大分子的运动速率而使有效碰撞增加 C、 升高反应物分子的能量,使活化分子的百分数增加 D、降低反应所需的能量,使活化分子百分数增加
=反应物(或生成物)浓度的变化/反应时间
v(i)=︱c(i)1 -c(i)2︳/︳t2-t1︳=Δc/Δt t:时间,s, min, h.
v(i)反应速率mol/(L*s),
c(i),浓度,mol/L. mol/(L*min) mol/(L*h)
4、单位: mol/(L﹒S) , mol/(L ﹒ min) mol/(L ﹒ h)等 5 、计算化学反应速率的步骤: 起始浓度c(起始) 变化浓度Δ c 终了浓度c(终了) ---- 三部曲
第一节 化学反应速率
化学反应速率是用来衡量化学反 应进行快慢程度的一个物理量。
一化学反应速率的表示方法
回忆在物理学中对运动速率的定义 单位时间、某物理量的变化
1、概念: 化学反应速率是用来表示化学反 应快慢的物理量。 2、表示方法: 通常用单位时间内反应物浓度的减小或生 成物浓度的增加来表示。v(i)(化学反应速率) 3、数学表达式:化学反应速率
1 决定化学反应速率的主要因素是 A.反应物的浓度 B.反应温度 C.使用催化剂 D.反应物的性质 2 下列说法正确的是(D ) A、一定条件下,增大反应物的量会加快化学反应速率。 B、增大压强,肯定会加快化学反应速率。 C、活化分子间所发生的碰撞为有效碰撞。 D、能够发生有效碰撞的分子叫活化分子 3在C(固)+CO2(气)=2CO(气) 的反应中。现采取下列措施: (1)增大压强 ;(2)增加碳的量 (3)通入CO2;(4)恒容下充入N2; ( 5)恒压下充入N2 哪些措施能够使反应速率增大?为什么? 答案:(1)(3)
二 影响反应速率的因素
(1)内因(主要因素) :参加反应物质 本身的性质 化学反应的本身性质:
反应物分子中的化学键断裂、生成物分子中 的化学键形成过程
——旧键断裂,新键生成—— (2)外因: ①浓度:②压强:③温度:④催化剂:
⑤其他因素:光、颗粒大小、溶剂等(太小可忽略不计)
例1:
对于反应A+3B=2C+2D,下列数据表示不同 条件的反应速率,其中反应进行得最快的是 ( ) A. v (A) =0.15mol/(L· S) C. v (C) =1mol/(L · S) B. v (B) =0.6mol/(L · S) D. v (D) =2mol/(L · min)
现实生活中,汽车的尾气里会发生如下反应
2CO+ 2NO = 2CO2 + N2 但反应速度非常缓慢, 2H2 + O2 = 2H2O,反应在常温下就有发生的 趋势,但反应速度太小,将氢气和氧气放在同 一容器中,长久也看不到生成水的迹象。 化学反应是否是越快越好呢?举 例说明? 橡胶老化,钢铁生锈。
问题2
我们得到的速率是指什么时候的速率?
结论2、我们所说的速率是指在整个过程中的平均速率。且 均为正值
▲一个化学反应的速率用不同的反应物或生 成物来表示,数值可能不同但含意是一致 的 ,速 率之比等 于该反应方程式中对应物 质的系数之比。 所以:在表示某反应速率时应注明是 用哪种物质表示的。
试证明对于反应aA+bB=cC+dD, v(A): v(B): v(C): v(D)=a:b:c:d
v(H2)= (1.5-1.2)/2=0.15 mol/L· s
问题1
观察并回答,分别用三种物质表示的反应速率之间 有什么关系?
结论1
同一个反应,用不同的物质来表示反应速率,数值 是不一样的,所以应注明是由哪种物质表示的。 同一反应中,各物质的速率之比等于他们在化学方 程式中的化学计量数之比。 如在N2 + 3H2 = 2NH3 中, v(N2):v(H2):v(NH3)=1:3:2
8: 设NO+CO2 2CO(正反应吸热)反应 速率为v1;N2+3H2 2NH3(正反应放热) 反应速率为v2。对于前述反应,当温度升高 时,v1和v2变化情况为( ) A、 同时增大 B、 同时减小 C、 √ v1减少,v2增大 D、 v1增大,v2减小
9、在N2+3H2 2NH3合成氨反应 中,分别采取以下措施,不能使反应速 率加快的是 C A.适当升高温度 B.增大氮气浓度 C.扩大容器体积 D.使用催化剂
6、几点说明
(1)化学反应速率是标量,无正负号。 (2)一般来说,化学反应速率随反应的进行而逐渐减慢.因 此,某一段时间内的反应速率,是平均速率,而不是指瞬 时速率。 (3)在同一反应中用不同物质来表示时,其数值可以不同, 但都表示同一个反应的速率。因此,表示化学反应的速 率时,必须说明反应物中哪种物质做标准。不同物质的 速率的比值一定等于化学方程式中相应的化学计量数 之比。 (4)化学反应速率一般不能用固体或纯液体表示。
不变 不变
增大压强
升高温度 使用催化 剂
不变
不变
增加
增加
增加
增加
Hale Waihona Puke 增加增加加快
加快
小结:
掌握化学反应速率的概念,数学表 达式及计算步骤; 理解化学反应速率是一段时间内 的平均速率,不同物质表示的同一反 应的反应速率之比等于化学方程式的 计量数之比。比较化学反应的快慢应 以同一种物质表示的化学反应速率为 标准,还应注意单位的统一。
B
10
V2 V1
C时 V
t 2 t1 10
A
0 . 1 m ol l
25 .6 0 .1
1
n
n
50 10 10
n=4
5:对于在溶液间进行的反应,对反应速率影响最小的因 素是( C ) A、温度 B、浓度 C、 压强 D、催化剂
6下列条件的变化,是因为降低反应所需的能量而增加单 位体积内的反应物活化分子百分数致使反应速率加快的 是( D ) A、增大浓度 B、增大压强 C、升高温度 D、使用催化剂 7、下列哪些方法可以加快铁与盐酸的化学反应速率? Fe+2HCl=FeCl2+H2↑ ①不断的补充铁 ②盐酸改用浓硫酸 ③加入铜片 ④加入CuSO4溶液 ⑤通入HCl气体 ⑥不用铁片改用铁粉 ③④⑤⑥
10、0.1mol/LNa2S2O3溶液和 0.1mol/LH2SO4溶液各5mL分别跟10mL水 混合后,反应速率为v1mol/(L.s); 0.2mol/LNa2S2O3溶液和0.2mol/LH2SO4溶 液各5mL分别跟20mL水混合后,反应速率 为v2mol/(L.s),则在相同条件下,v1和v2的关 B 系是 A.v1>v2 B.v1=v2 C.v1<v2 D.不能确定
11、对于反应N2+O2=2NO在密闭容 器中进行,下列条件哪些不能加快 该反应的化学反应速率( DE ) A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大
C、体积不变充入 O2使压强增大 D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大
作
业
1,填空题 (1)化学反应速率通常用单位时间内——的减少或_____的增加 来表示。 (2)在某一化学反应中,反应物B的浓度在5s内从2.0mol/L变 成0.5mol/L,则在这5s内B的化学反应速率为________。 2,选择题 (1)决定化学反应速率的主要因素是( ) A. 反应物的浓度 B. 反应物的性质 C. 反应的压强 D. 所有的催化剂 (2)在下列过程中,需要加快化学反应速率的是( ) A. 钢铁锈蚀 B.食物腐败 C. 炼钢 D. 塑料老化 3,将相同质量的锌粒分别投入足量的1mol/L和0.1mol/L的HCL溶液 中,哪一个产生氢气的速率快?如果分别投入相同浓度的热盐酸和 冷盐酸中,那一个产生氢气的速率快?简述理由。
第三章 化学反应速率和化学平衡
回顾上节内容 1物质的量浓度 2物质的量浓度的计算 C=n/V
n=m/M
由常见几种的现象导入本课
比较等物质的量浓度的盐酸和醋酸与大
理石反应的快慢。 不同的化学反应快慢是不一样的。 怎么样来比较和描述不同反应的快慢 呢? 化学反应速率是用来衡量化学反应进 行快慢程度的一个物理量。
