2019高考全国Ⅰ卷化学试题(解析版)(最新整理)
2019年高考全国卷Ⅰ化学高清版及答案解析

2019年高考全国卷Ⅰ化学高清版及答案解析可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A .“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2- 苯基丙烯(右图),下列说法正确的是A .不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A .向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置 b 中的液体逐渐变为浅红色C.装置 c 中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl 气体分子在253 K 冰表面吸附和溶解过程的示意图。
下列叙述错误的是A .冰表面第一层中,HCl 以分子形式存在B.冰表面第二层中,H +浓度为5×10- 3 mol ·L- 1(设冰的密度为0.9 g ·c m- 3)C.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H + +Cl -11.NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A 的- 3 ,K - 6)溶液,混合溶液的相对导电能力变化K a1=1.1 ×10 a2=3.9 ×10曲线如图所示,其中 b 点为反应终点。
下列叙述错误的是A .混合溶液的导电能力与离子浓度和种类有关+与A 2- 的导电能力之和大于HA - 的B.NaC.b 点的混合溶液pH=7+)>c(K+)> c(OH - ) D.c 点的混合溶液中,c(Na12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV 2+/MV +在电极与酶之间传递电子,示意图如下所示。
2019年全国统一高考化学试卷(新课标Ⅰ)-试题及详解

2019年全国统一高考化学试卷(新课标Ⅰ)一、单选题(本大题共7小题,共7.0分)1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是()A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点【答案】A【解析】【分析】本题考查陶瓷有关知识,掌握相关的硅酸盐产品的生产原料、产品组成、性质以及硅酸盐的概念是解答本题的关键,注意基础知识的积累掌握,题目难度不大。
【解答】A.瓷器着色如雨过天晴,为青色,瓷器的原料高岭矿或高岭土中普遍含有铁元素,青瓷的烧制过程就是将含有红棕色氧化铁的色釉在火里烧,再经过还原形成为青色,此时铁不再是三价铁,而是二价铁,故A错误;B.陶瓷的传统概念是指所有以黏土等无机非金属矿物为原材料,经过高温烧制而成的产品,闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成,故B正确;C.以含硅元素物质为原料通过高温加热发生复杂的物理、化学变化制得硅酸盐产品,传统硅酸盐产品包括:普通玻璃、陶瓷、水泥,是用物理化学方法制造出来的最早的人造材料,一万多年以前,它的诞生使人类由旧石器时代进入了新石器时代,故C正确;D.陶瓷有日用陶瓷、卫生陶瓷、建筑陶瓷、化工陶瓷和电瓷、压电陶瓷等,共性为具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等优点,故D正确。
故选A。
2.关于化合物2−苯基丙烯(),下列说法正确的是()A. 不能使稀高锰酸钾溶液褪色B. 可以发生加成聚合反应C. 分子中所有原子共平面D. 易溶于水及甲苯【答案】B【解析】解:A.含有碳碳双键,所以具有烯烃性质,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A错误;B.含有碳碳双键,所以能发生加聚反应生成高分子化合物,故B正确;C.苯分子中所有原子共平面、乙烯分子中所有原子共平面,甲烷分子为正四面体结构,有3个原子共平面,该分子中甲基具有甲烷结构特点,所以该分子中所有原子不能共平面,故C错误;D.该物质为有机物,没有亲水基,不易溶于水,易溶于甲苯,故D错误;故选:B。
2019年高考理综化学真题试卷(全国Ⅰ卷)(含答案及过程详解)

绝密★启用前2019年普通高等学校招生全国统一考试(全国卷Ⅰ)理科综合能力测试(化学)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 mg24 s32 fe56 u64一、选择题(共7题;共42分)1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是()A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点2.关于化合物2−苯基丙烯(),下列说法正确的是()A. 不能使稀高锰酸钾溶液褪色B. 可以发生加成聚合反应C. 分子中所有原子共平面D. 易溶于水及甲苯3.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是()A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开KB. 实验中装置b中的液体逐渐变为浅红色C. 装置c中的碳酸钠溶液的作用是吸收溴化氢D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯4.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是()A. 冰表面第一层中,HCl以分子形式存在B. 冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C. 冰表面第三层中,冰的氢键网格结构保持不变D. 冰表面各层之间,均存在可逆反应HCl ⇌H++Cl−5.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
2019年高考化学真题及解析(全国卷Ⅰ卷)

__________ 姓名:__________ 班级:__________一、选择题1.(2019·长郡中学高三月考)科学家从化肥厂生产的(NH 4)2SO 4中检测出组成为N 4H 4(SO 4)2的物质。
经测定,N 4H 4(SO 4)2易溶于水,在水中以SO 2-4和N 4H 4+4两种离子形式存在。
植物的根系极易吸收N 4H 4+4,N 4H 4+4遇到碱时会生成一种形似白磷的N 4分子,N 4分子不能被植物吸收。
下列有关说法正确的是( ) A .N 4与N 2互为同系物 B .14N 与14C 互为同位素C .N 4H 4(SO 4)2与草木灰混合使用,可增强肥效D .在反应8NH 3+4CsOH===N 4+4CsNH 2+6H 2+4H 2O 中,每生成5.6 g N 4时转移1.2 mol 电子2.在给定条件下,下列选项所示的物质间转化均能实现的是A.FeCl 2−−−→点燃FeCl 2→NaOHFe(OH)2B.S 2O −−−→点燃2SO 22H O −−−→H 2SO 4 C.CaCO 3−−−→高温CaO 2SiO −−−→高温CaSiO 3 D.NH 32O −−−→催化剂NO 2H O−−−→HNO 33.化学与生活密切相关。
下列说法错误的是( ) A.分类回收垃圾有利于节约资源和保护环境 B.石油分馏得到的汽油、煤油和柴油都是混合物 C.利用可持续发展的理念对海洋资源进行合理开发利用 D.聚乙烯塑料的主要成分为聚乙烯,其化学式为22CH CH = 4.下列离子方程式正确的是A. 大理石与醋酸反应:CO 32-+2CH 3COOH==2CH 3COO -+H 2O+CO 2↑B. 高锰酸钾与浓盐酸制氯气的反应:MnO 4-+4Cl -+8H +==Mn 2++2Cl 2↑+4H 2OC. 漂白粉溶液吸收少量二氧化硫气体:SO 2+H 2O+ClO -=SO 42-+Cl -+2H +D. 氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH -+Ca 2++HCO 3-==CaCO 3↓+H 2O 5.控制变量是科学研究重要方法。
2019年全国卷Ⅰ理综化学高考真题(含答案)

绝密★启用前2019年普通高等学校招生全国统一考试理科综合能力测试化学注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Cu 64一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2−苯基丙烯(),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C.冰表面第三层中,冰的氢键网络结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl−11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
2019年高考全国卷Ⅰ化学高清版及答案解析

2019年高考全国卷Ⅰ化学高清版及答案解析可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A .“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2- 苯基丙烯(右图),下列说法正确的是A .不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A .向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置 b 中的液体逐渐变为浅红色C.装置 c 中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl 气体分子在253 K 冰表面吸附和溶解过程的示意图。
下列叙述错误的是A .冰表面第一层中,HCl 以分子形式存在B.冰表面第二层中,H +浓度为5×10- 3 mol ·L- 1(设冰的密度为0.9 g ·c m- 3)C.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H + +Cl -11.NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A 的- 3 ,K - 6)溶液,混合溶液的相对导电能力变化K a1=1.1 ×10 a2=3.9 ×10曲线如图所示,其中 b 点为反应终点。
下列叙述错误的是A .混合溶液的导电能力与离子浓度和种类有关+与A 2- 的导电能力之和大于HA - 的B.NaC.b 点的混合溶液pH=7+)>c(K+)> c(OH - ) D.c 点的混合溶液中,c(Na12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV 2+/MV +在电极与酶之间传递电子,示意图如下所示。
2019高考全国Ⅰ卷化学试题(解析版)

2019年普通高等学校招生全国统一考试(全国卷I)化学试题一、选择题:本题共7个小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系,下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的兵马俑是制品,由粘土经高温烧结而成C.瓷是应用较早的人造材料,主要化学成分是硅酸盐D.瓷化学性质稳定,具有耐酸碱侵蚀,抗氧化等优点【答案】A【解析】A 项氧化铁即三氧化二铁,红棕色。
瓷器青色一般不来自氧化铁。
故A错。
8.关于化合物2-苯基丙烯(),下列说确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯【答案】B【解析】分子中存在双键,可以使高锰酸钾溶液褪色,A错;可以发生加成聚合反应,B正确;分子中存在甲基,所有原子不可能共平面,C错;分子中碳原子数较多,且不存在亲水基团所以不易溶于水,D错。
9.实验室制溴苯的装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中Na2CO3的作用是吸收HBrD.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯。
【答案】D。
【解析】溴苯常温下为液体,反应后的混合液经稀碱溶液洗涤、分液,得到无色的溴苯。
10.固体界面上强酸的吸附和离解是多向化学在环境、催化、材料科学等领域研究的重要课题。
下图为为少量HCl气体分子在253K冰表面吸附和溶解过程的示意图,下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10-3mol·L-1(设冰的密度为0.9g·cm-3)C.冰表面第三层中冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl-【答案】D。
【解析】由图像可知第一层中HCl均以分子形式存在,A正确。
2019年高考全国I卷化学试题(含解析)

2019年高考全国I卷理综化学试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
相对原子质量:H:1;C:12;N:14;O:16;S:32;Cl:35.5;K:39;Ti:48;Fe:56;I:127一、选择题(本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)7、下列生活用品中主要由合成纤维制造的是A. 尼龙绳B. 宣纸C. 羊绒衫D. 棉衬衣【答案】A【解析】A.尼龙是聚酰胺,故它是合成纤维,故A正确;B.宣纸原料为木浆,主要成分为天然纤维(纤维素),故B错误C.羊毛的主要成分为蛋白质,故C错误D.棉花的主要成分为天然纤维,故D错误【考点】常用合成高分子材料的化学成分及其性能;天然高分子蛋白质、纤维素等;【专题】有机化合物的获得与应用。
【点评】本题考查常见高分子材料的分类及应用,题目难度不大,明确常见有机物组成、性质及分类为解答关键,注意掌握合成纤维与纤维素、蛋白质等区别.8、《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之”,文中涉及的操作方法是A. 蒸馏B. 升华C. 干馏D. 萃取【答案】B【解析】蒸馏即将液体转化为气体,再冷凝为液体。
升华是将固体直接转化为气体,再通过凝华转为固体。
结合生砒原本为固态及题意中的“如针”,题目中的状态转化为固-气-固,故选B升华。
【考点】物质的分离、提纯的基本方法选择与应用。
【专题】物质的分离提纯和鉴别。
【点评】本题考查物质的分离、提纯,为高频考点,侧重考查学生的分析能力和实验能力,有利于培养学生良好的科学素养,注意把握题给信息以及常见分离方法,难度不大.C H,下列说法正确9、化合物(b)、(d)、(p)的分子式均为66的是A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种C. b、d、p均可与酸性高锰酸钾溶液反应D. b 、d 、p 中只有b 的所有原子处于同一平面【答案】D【解析】A.(b )的同分异构体不止两种,如,故A错误 B.(d )的二氯化物有、、、、、,故B 错误C.(b )与(p )不与酸性4KMnO 溶液反应,故C 错误D.(d )2与5号碳为饱和碳,故1,2,3不在同一平面,4,5,6亦不在同一平面,(p )为立体结构,故D 正确。
2019年高考全国卷Ⅰ化学高清版及答案解析
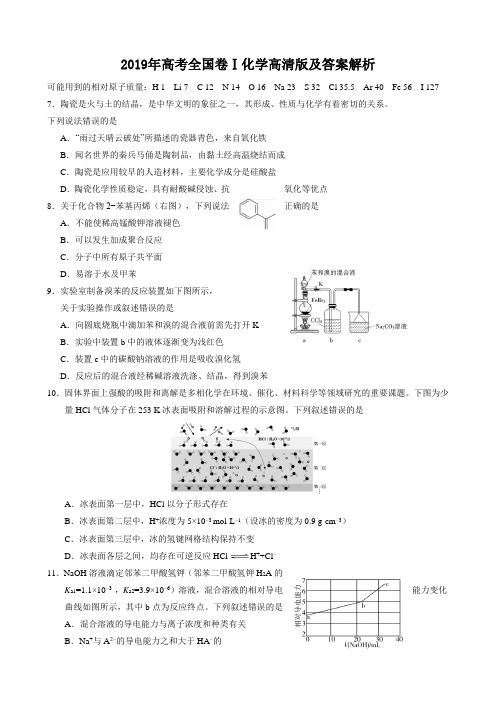
2019年高考全国卷Ⅰ化学高清版及答案解析可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2−苯基丙烯(右图),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl−11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2−的导电能力之和大于HA−的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
2019年高考全国卷Ⅰ化学高清版及答案解析

2019年高考全国卷Ⅰ化学高清版及答案解析可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2−苯基丙烯(右图),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl−11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2−的导电能力之和大于HA−的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
(完整版)2019年高考全国卷Ⅰ化学高清版及答案解析
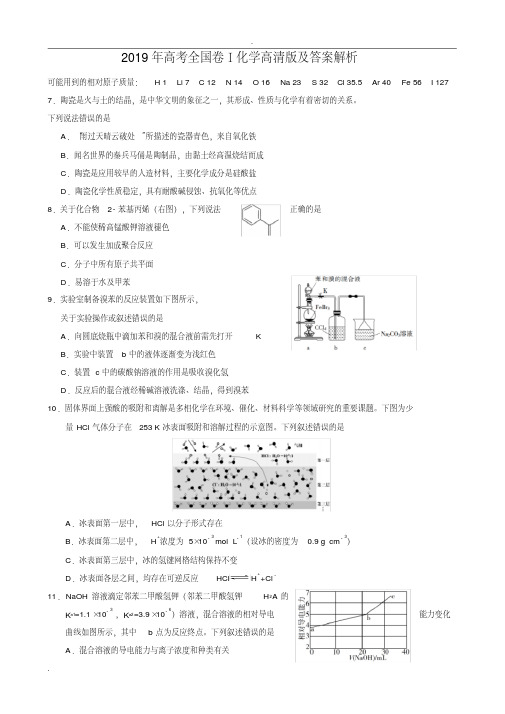
2019年高考全国卷Ⅰ化学高清版及答案解析可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2-苯基丙烯(右图),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10-3 mol·L-1(设冰的密度为0.9 g·cm-3)C.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl-11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10-3 ,K a2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2-的导电能力之和大于HA-的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
2019高考全国Ⅰ卷化学试题解析版

2019年普通高等学校招生全国统一考试(全国卷I)化学试题一、选择题:本题共7个小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系,下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由粘土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀,抗氧化等优点【答案】A【解析】A 项氧化铁即三氧化二铁,红棕色。
瓷器青色一般不来自氧化铁。
故A错。
8.关于化合物2-苯基丙烯(),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯【答案】B【解析】分子中存在双键,可以使高锰酸钾溶液褪色,A错;可以发生加成聚合反应,B正确;分子中存在甲基,所有原子不可能共平面,C错;分子中碳原子数较多,且不存在亲水基团所以不易溶于水,D错。
9.实验室制溴苯的装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中Na2CO3的作用是吸收HBrD.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯。
【答案】D。
【解析】溴苯常温下为液体,反应后的混合液经稀碱溶液洗涤、分液,得到无色的溴苯。
10.固体界面上强酸的吸附和离解是多向化学在环境、催化、材料科学等领域研究的重要课题。
下图为为少量HCl气体分子在253K冰表面吸附和溶解过程的示意图,下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10-3mol·L-1(设冰的密度为0.9g·cm-3)C.冰表面第三层中冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl-【答案】D。
(完整word版)2019年高考全国卷Ⅰ化学高清版及答案解析

2019年高考全国卷Ⅰ化学高清版及答案解析可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2−苯基丙烯(右图),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl−11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2−的导电能力之和大于HA−的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
2019年高考全国卷Ⅰ化学高清版及答案解析

2019年高考全国卷Ⅰ化学高清版及答案解析可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl Ar 40 Fe 56 I 1277.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2苯基丙烯(右图),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为g·cm3)C.冰表面第三层中,冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应HCl H++Cl11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=×103 ,K a2=×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2的导电能力之和大于HA的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH)12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019 年普通高等学校招生全国统一考试(全国卷I)化学试题一、选择题:本题共 7 个小题,每小题 6 分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系,下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由粘土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀,抗氧化等优点【答案】A【解析】A 项氧化铁即三氧化二铁,红棕色。
瓷器青色一般不来自氧化铁。
故 A 错。
8.关于化合物2-苯基丙烯(),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯【答案】B【解析】分子中存在双键,可以使高锰酸钾溶液褪色,A 错;可以发生加成聚合反应,B 正确;分子中存在甲基,所有原子不可能共平面,C 错;分子中碳原子数较多,且不存在亲水基团所以不易溶于水,D 错。
9.实验室制溴苯的装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需打开KB.实验中装置b 中的液体逐渐变为浅红色C.装置 c 中Na2CO3的作用是吸收HBrD.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯。
【答案】D。
【解析】溴苯常温下为液体,反应后的混合液经稀碱溶液洗涤、分液,得到无色的溴苯。
10.固体界面上强酸的吸附和离解是多向化学在环境、催化、材料科学等领域研究的重要课题。
下图为为少量HCl 气体分子在253K 冰表面吸附和溶解过程的示意图,下列叙述错误的是A.冰表面第一层中,HCl 以分子形式存在B.冰表面第二层中,H+浓度为5×10-3mol·L-1(设冰的密度为0.9g·cm-3)C.冰表面第三层中冰的氢键网格结构保持不变D.冰表面各层之间,均存在可逆反应H++Cl-【答案】D。
【解析】由图像可知第一层中HCl 均以分子形式存在,A 正确。
第三层中冰的氢键网格结构保持不变,C 正确。
B 选项中设氯离子为10-4mol,则水为1mol,所以水的质量为18g,再根据密度求得水的体积为20mL,即0.02L,溶液的体积就近似0.02L,所以溶液中氢离子的浓度近似等于氯离子的浓度为10-4mol÷0.02L=5×10-3mol·L-1。
HCL 是强电解质,在水中电离不可逆,第一层以分子形式存在,第二层中完全电离,所以D 错误。
11. NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 H 2A 的 K a1=1.1×10-3,K a2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中 B 点为反应终点。
下列叙述错误的 是A. 混合溶液的导电能力与离子浓度和种类7Ïà 6¶Ô µ¼ 5 有关B. Na +与 A 2-的导电能力之和大于 HA -的C .b 点的混合溶液 pH=7µç ÄÜ 4 Á¦ 32 0102030 40V(NaOH)/mLD .C 点的混合溶液中 c (Na +)>c(K +)>c(OH -)【答案】C【解析】溶液的导电能力与离子的电荷浓度有关,故 A 正确;随 NaOH 溶液滴入,溶液导电能力增强,故 B 正确;b 点的混合溶液邻苯二甲酸根水解显碱性,故 C 错误;b 点 c (Na+)=c(K+),C 点 c (Na+)>c(K+),a-b 段消耗的氢氧化钠的体积大于 b-c 段,C 点 c(K+)>c(OH-),故 D正确。
12. 利用生物燃料电池原理研究室温下氨的合成,电池工作时 MV 2+/MV +在电极与酶之间传递电子,下列说法错误的是交换膜A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能B .阴极区,在氢化酶作用下发生反应 H 2+2MV 2+=2H ++2MV +C .正极区,固氮酶为催化剂,N 2 发生还原反应生成 NH 3D .电池工作时,质子通过交换膜由负极区向正极区移动 【答案】B【解析】本题考查了电化学基础知识原电池原理合成氨的条件温和,同时还可提供电能,故 A 正确;阴极区即原电池的正极区, 由图可知,在固氮酶作用下反应,故 B 错误;由图可知 C 正确;电池工作时,阳离子通过电 MV +H 2 电极MV 2+极 氢化酶H + 2+ 固氮酶 MV NH 3 MV + N 2abc+交换膜由负极区向正极区移动,故D 正确。
13.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z 为同一短周期元素,Z核外最外层电子数是X 核外电子数的一半,下列叙述正确的是A.WZ 的水溶液呈碱性B.元素非金属性的顺序为X>Y>ZC.Y 的最高价氧化物的水化物是中强酸D.该新化合物中Y 不满足8 电子稳定结构【答案】C【解析】本题考查了元素周期律的基本知识Z Y Z-W XXZ ZZ Z由题意YX2Z6—中Z 只有一个价键,X 有四个价键,Z 核外最外层电子数是X 核外电子数的一半,可推知W 为Na,X 为Si,Y 为P,Z 为Cl。
NaCl 的水溶液呈中性,故A 错误;非金属性由强到弱为Cl>P>Si,故B 错误;P 的最高价氧化物的水化物是H3PO4,是中强酸,故C 正确;该新化合物中P 显-3 价,满足8 电子稳定结构,故D 错误。
三、非选择题:(一)必考题:26. (14 分)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。
一种以硼镁矿(含Mg2B2O3•H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:(NH)SO℃℃℃℃ 1℃℃℃℃H3BO32 MgCO℃℃℃℃℃NH4HCO3 ℃℃回答下列问题:(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。
(2)“滤渣I”的主要成分有。
为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。
(3)根据H3BO3的解离反应:H3BO3+H2O H++B(OH4)-,K a=5.81×10-10,可判断H3BO3℃℃3 2 2 3 3 3 2 2 3 2 是酸;在“过滤 2”前,将溶液 pH 调解至 3.5,目的是 。
(4)在“沉镁”中生成 Mg(OH)2•MgCO 3 沉淀的离子方程式为 ,母液经加热后可返回 工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是。
【答案】(1) NH 4HCO 3+NH 3=(NH 4)2CO 3 (2) SiO 2、Fe 2O 3、Al 2O 3KSCN(3) 一元弱 转化为 H 3BO 3,促进析出(4)2Mg 2++3CO 2—+2H O=Mg(OH) •MgCO ↓+2HCO — (或 2Mg 2++2CO 2—+H O=Mg(OH) •MgCO ↓+CO ↑)溶浸 高温焙烧【解析】本题考查了化工生产过程及相关元素性质由题目已知硼镁矿(含 Mg2B2O3•H2O 、SiO2 及少量 Fe2O3、Al2O3)加入硫酸铵溶液溶浸时产生的气体只有 NH3,气体被 NH4HCO3 溶液吸收,发生的反应为NH4HCO3+NH3=(NH4)2CO3。
而硼镁矿溶浸后的滤渣 1 为 SiO2、Fe2O3、Al2O3;检验 Fe3+ 离子的试剂通常为 KSCN 溶液。
由题目给出的 H3BO3 的解离反应,只存在一步解离平衡, 由此判断为 H3BO3 一元弱酸;又且由于 Ka 小,即酸性弱目的是使 B(OH)4—转化为 H3BO3, 促进析出;(也可由生产过程中目标为 H3BO3,由硼镁矿生产时硼元素应在过滤 1 后存在于溶液中,pH 调解至 3.5 而生产 H3BO3,其目的是转化为 H3BO3,促进析出);在“沉镁”中 Mg2+遇到吸收 NH3 气体后的(NH4)2CO3 溶液,产物为 Mg(OH)2•MgCO3,故离子方程式为 2Mg2++3CO32—+2H2O=Mg(OH)2•MgCO3↓+2HCO3—(或 2Mg2++2CO32—+H2O = Mg(O H)2•MgCO3↓+CO2↑); 工业生产为提高原料利用率,将母液循环使用,母液是在产生 H3BO3 和 Mg(OH)2•MgCO3 两沉淀后所得,即为两物质的饱和液,故需从溶浸工序开始循环;碱式碳酸镁制备轻质氧化镁的方法高温焙烧,使碱式碳酸镁分解生成氧化镁。
27. 硫酸铁铵(NH 4Fe(SO 4)2·x H 2O )是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:℃℃℃ ℃ ( NH 4) 2SO 4 ℃ ℃ ℃ ℃℃ ℃℃ ℃ ℃ ℃℃ ℃ ℃ ℃℃H 2S O 4, 80- 90℃℃ ℃ ℃ ℃ ℃ ℃℃ ℃5%H 2O 2回答下列问题:(1)步骤①的目的是去除废铁屑表面的油污,方法是。
(2)步骤②需要加热的目的是,温度保持80-95℃,采用的合适加热方式是。
铁屑中含有少量的硫化物,反应产生的气体需要净化处理,合适的装置为(填标号)。
水水A B C NaOHD(3)步骤③中选用足量的双氧水,理由是,分批加入双氧水,同时为了,溶液要保持pH 值小于0.5。
(4)步骤⑤的具体实验操作有,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃的时候,失掉1.5 个结晶水,失重5.6%,硫酸铁氨晶体的化学式为。
【答案】(1)碱煮水洗(2)加快反应;热水浴;C(3)将Fe2+全部氧化为Fe3+,不引入杂质;防止(抑制)Fe3+的水解。
(4)加热浓缩,冷却结晶,过滤(洗涤)(5)NH4Fe(SO4)2·12H2O【解析】本题考查了实验操作及相关元素性质废铁屑表面油污需选用在碱性溶液加热,去污,而后水洗。
铁屑遇硫酸想得到FeSO4 溶液,加热的目的为加快反应;控温在80-95℃,采用的合适方式是热水浴加热;铁屑中含有少量的硫化物,反应产生的气体含H2S,需用碱液吸收处理,由于酸碱反应迅速,需考虑防倒吸问题,故选C。
本实验目的是制备硫酸铁氨,滤液中的Fe2+需氧化为Fe3+,步骤③中选用足量的双氧水即为将Fe2+全部氧化为Fe3+,双氧水还原产物为水,不引入杂质;由于Fe3+ 易水解,需控制pH 值,保持在较强酸性中,抑制Fe3+的水解。
步骤⑤的实验是将硫酸铁氨从溶液中结晶,实验操作为加热浓缩,冷却结晶,过滤(洗涤),干燥得到硫酸铁铵晶体样品。
