高中化学知识点图表
高中化学全套思维导图(高清版)

高中化学全套思维导图(高清版)第一章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第三章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第四章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第五章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第六章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第七章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第八章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第九章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十一章:物质的量与物质的量浓度1. 物质的量物质的量的定义:摩尔物质的量的计算:摩尔质量、物质的量浓度2. 摩尔体积摩尔体积的定义:摩尔体积摩尔体积的计算:气体摩尔体积、液体摩尔体积、固体摩尔体积第十二章:化学反应速率与化学平衡1. 化学反应速率化学反应速率的定义:速率影响化学反应速率的因素:温度、浓度、催化剂、表面积2. 化学平衡化学平衡的定义:平衡状态化学平衡的建立:平衡常数、平衡反应物和物的浓度第十三章:氧化还原反应与电化学1. 氧化还原反应氧化还原反应的定义:氧化剂、还原剂氧化还原反应的类型:单一置换反应、复分解反应、合成反应、分解反应2. 电化学电化学的定义:电流、电极电化学反应:原电池、电解池第十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十九章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二十章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第二十一章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第二十二章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第二十三章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第二十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第二十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第二十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第二十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第二十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用。
高中化学全套思维导图(高清版)

2020-2-269:09:5【老师】俸・KH 高中化経套思“.版).pdf (18.11MB )髙中化学全套思谁导图(高清版),pdf}来目群文件打开打开文骸 转发三1【老师】俸自己没有思维导图的可以借鉴。
1 /43高中化学 第一章 从实验学化学第一节化学实验基础知识取用固体取用液体防火与灭火常见危险与安全措施了解实验安全常识及意外事故处理方法学法指导操作的先后顺序 操作的注意事项 操作的目的 适用范围化学与人类健康 不溶性固体与液体的分萬 实验安全化学与环境保护分离溶于溶液中的固体溶质适用范围1 .蒸发过程不断搅拌I 注意事项蒸发是否易潮解.物质的提纯是将混合物中的少 量杂质除去而得到纯净物质将物质的分 萬与提纯混淆吸取少量液体用滴管 (专用,垂直悬滴,不倒置)实验基本操作物质分离提 纯必须遵循注意防火、防爆炸、防倒吸不増、不减、易分离、易复原2.当大量固体析岀时,停止加热,余热蒸干知识 梳理 化学实解通过动手实验,熟练掌握常用化学 仪器的使用方法和操作注意事项 较多液体用倾倒法 (瓶塞倒放,标签向手心,抓住物质的特性寻找突破口物质检验和实验综合题块状固体用锻子 粉末状用药匙中及故取用药 品的仪器的意的热覗分离 仪器热源,温度可达400 - 500 r酒劈/龜精不超过2/3,不少于1/4,用外 / 5,不对火,不吹灯,先灭后添酒精喷灯温度可达I 000 X ) 水浴漏斗loop 以下 普通漏斗长颈漏斗分液 漏斗主要 用途萃取,分液, 反应加液体用器常仪冷凝管 洗气瓶于燥管注意事项用前先检査是否漏液, 分液时上层液体从上口倒岀,下层液体从下层放出,放液时应打开分液漏斗上玻璃塞或将塞 上的凹槽对准上口小孔。
使漏斗内外大气压相等反应器1 是否易被氧化 是否易燃、易爆 是否易与空W 中某些成分作用 是否易挥发、,1 尹华 是否具有毒性、 腐蚀度便于取用 防止变质 防独、防爆等 细口瓶、产口瓶、 通瓶 塑料瓶、赢r 笑是器等剂质试性则原仪器据依学剂保化试的存密封:水封、 油封、蜡封方式/开放式存放阴凉、避光处(干燥器中存放利用沸点不同,除去难挥发和不挥发的杂质适用范围1.蒸憎烧瓶加热要垫石棉网,温度、 计的水银球与支管口下缘位于同一水平线注意事项2.冷水是下口进,上口出3.要加碎瓷片,防暴沸在互不相溶的溶剂里溶解度差别较大的溶质适用范围1 .溶液总量不超过漏斗容积的3/4 2.把分液漏斗放在铁架台上静置、分层注意事项蒸饌分液3.打开塞子,先从下口放出下层 液体,再从上口倒出上层液体其他基本 操作计量仪器玻璃仪器的洗涤药品的取用药品的保存 装置气密性检验溶液的配勉气体的收集和体积的测量量筒试管、柑垠、隔网可加热或液浴烧杯、烧瓶、 蒸憎烧瓶、锥形瓶 乂_不能加热集气瓶、试剂瓶、滴瓶、 启普发生器主要用途粗略量取液体,精度0.1 mL刻度由下而上增大,无0刻度线, 读数平视。
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
新人教版高中化学高一化学必修二知识点思维导图

高一化学必修 第二册化工生产中的重要非金属元素硫及其化合物氮及其化合物无机非金属材料硫二氧化硫硫酸不同价态含硫物质的转化硫元素位于元素周期表的第三周期第VIA族硫黄为黄色晶体,难溶于水,微溶于酒精,易溶于二硫化碳具有氧化性、还原性二氧化硫为无色气体,有刺激性气味的有毒气体,密度比空气大易溶于水,其水溶液显酸性二氧化硫具有漂白作用,但生成的化合物不稳定工业上常用二氧化硫来漂白纸浆,毛,丝等,此外,也可用于杀菌消毒,还有一种食品添加剂硫酸是重要的化工原料,可用于生产化肥,农药,炸药,染料和盐类等稀硫酸浓硫酸常见的硫酸盐硫酸根离子检验具有酸的通性溶于水完全电离可与酸碱指示剂作用可以活泼金属碱、碱性氧化物及其盐反应吸水性:能够吸收气体、液体中的水分,故常作干燥剂脱水性:能把有机物中的氢元素和氧元素按水的组成比脱去强氧化性与金属反应与非金属反应(加热)常温下能使铁,铝发生钝化硫酸钙,硫酸钡,硫酸铜硫酸根离子和钡离子反应生成不溶于稀盐酸的白色硫酸钡沉淀通过氧化还原反应可实现不同价态含硫物质的互相转化利用氧化剂,可将硫元素从低价态转化到高价态利用还原剂,可将硫元素从高价态转化到低价态氮气氮的固定一氧化氮二氧化氮氨铵盐硝酸酸雨及防治无色无味,难溶于水的气体化学性质不活泼,通常情况下难以与其他物质发生化学反应具有还原性和氧化性含义:将大气中游离态的氮转化为氮的化合物的过程自然固氮:如豆科植物的根瘤固氮,雷电作用人工固氮:如工业合成氨无色无味有毒性气体,且不溶于水一氧化氮不能和碱反应,是不成盐氧化物,不是酸性氧化物一氧化氮和氧气反应生成二氧化氮是红棕色有刺激性气味的有毒气体,易溶于水和碱反应生成硝酸根离子和亚硝酸根离子,不是酸性氧化物和水反应生成硝酸和一氧化氮无色有刺激性气味的气体,密度比空气小,易液化极易溶于水'且与水的水溶液呈碱性浓盐酸与氨反应生成氯化氨晶体;氨的催化氧化是工业制硝酸的基础氨气和二氧化碳在催化剂加热的条件下生成一氧化氮和水氯化铵和氢氧化钙在加热的条件下生成氨气和氯化钙和水湿润的红色石蕊试纸→变蓝氨盐在碱和加热的条件下生成氨气浓盐酸→白烟硝酸是无色,易挥发,有刺激性气味的液体酸性:在水中能电离不稳定性:浓硝酸见光或受热会分解产生二氧化氮是大气中的氮氧化物与硫氧化物以及他们在大气中发生反应后的生成物溶于雨水形成的直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀防治强氧化性铜与稀硝酸反应生成硝酸铜和一氧化氮和水铜与浓硝酸反应生成硝酸铜和二氧化氮和水浓硝酸与炭在加热的条件下生成二氧化氮和二氧化碳和水调整能源结构,发展清洁能源研究煤的脱硫技术,减少二氧化碳和氮氧化物的排放加强工厂废气的回收处理改进汽车尾气的处理技术,控制尾气排放铵盐是无色或白色的晶体,绝大多数易溶于水;农业上常用做化肥,如硫酸铵,碳酸氢铵,硝酸铵等;氯化铵受热分解生成氨气和氯化氢;氯化氨溶液与氢氧化钠溶液共热生成氨气和水和氯化钠硅酸盐材料新型无机非金属材料硅:高纯硅广泛用于信息技术和新能源技术等领域,以及光伏电站、人造卫星、硅太阳能电池二氧化硅:可用来生产光导纤维新型陶瓷:不再限于传统的硅酸盐体系,在光学,热学,电学,磁学等方面具有很多新的特性和功能碳纳米材料:主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广泛的应用前景第五章 化工生产中的重要非金属元素化学反应与能量化学能与热能在任何的化学反应中总伴有能量的变化当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量主要原因一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小E反应物总能量 > E生成物总能量,为放热反应;E反应物总能量 < E生成物总能量,为吸热反应常见的放热反应和吸热反应常见的放热反应所有的燃烧与缓慢氧化酸碱中和反应金属与酸反应制取氢气大多数化合反应特殊:C+CO₂=加热=2CO是吸热反应常见的吸热反应以C、H₂、CO为还原剂的氧化还原反应C(s)+H₂O(g)=加热=CO(g)+ H₂(g)铵盐和碱的反应Ba(OH)₂·8H₂O+NH₄Cl=BaCl₂+2NH₃↑+10H₂O大多数分解反应KClO₃、KMnO₄、CaCO₃的分解等能源的分类一次能源常规能源可再生资源不可再生资源新能源可再生资源不可再生资源二次能源一次能源经过加工、转化得到的能源称为二次能源电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等化学能与电能化学能转化为电能的方式火力发电化学能→热能→机械能→电能缺点:环境污染、低效原电池将化学能直接转化为电能优点:清洁、高效原电池原理概念把化学能直接转化为电能的装置叫做原电池原电池的工作原理通过氧化还原反应(有电子的转移)把化学能转变为电能构成原电池的条件电极为导体且活泼性不同两个电极接触(导线连接或直接接触)两个相互连接的电极插入电解质溶液构成闭合回路电极名称及发生的反应负极较活泼的金属作负极,负极发生氢化反应电极反应式:较活泼金属-ne⁻=金属阳离子负极现象正极较不活泼的金属或石墨作正极,正极发生还愿反应电极反应式:溶液中阳离子+ne⁻=单质正极的现象:一般有气体放出或正极质量增加原电池正负极的判断方法依据原电池两极的材料较活泼的金属作负极(K,Ca,Na太活泼,不能作电极)较不活泼金属或可导电非金属(石墨)、氧化物(MnO₂)等作正极根据电流方向或电子流向(外电路)的电流由正极流向负极电子则由负极经外电路流向原电池的正极根据内电路离子的迁移方向阳离子流向原电池正极,阴离子流向原电池负极根据原电池中的反应类型负极正极原电池电极反应的书写方法原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应①写出总反应方程式②把总反应根据电子得失情况,分成氧化反应、还原反应③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应原电池的应用原电池的总反应式一般把正极和负极反应式相加而得加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快比较金属活动性强弱设计原电池金属的腐蚀化学电源基本类型干电池活泼金属作负极,被腐蚀或消耗充电电池燃料电池两极都参加反应的原电池,可充电循环使用两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应水能、风能、生物质能煤、石油、天然气等化石能源太阳能、风能、地热能、潮汐能、氢能、沼气核能失电子,发生氧化反应,现象通常是电极本身消耗,质量减小得电子,发生还原反应,现象是常伴随金属的析出或H₂的放出负极溶解,负极质量减少第六章 化学反应与能量化学反应与能量化学反应的速率和限度化学反应的速率概念化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示计算公式v(B)=|Δc(B)|/Δt=|Δn(B)|/V·Δt单位mol/(L·s)或mol/(L·min)B为溶液或气体,若B为固体或纯液体不计算速率以上所表示的是平均速率,而不是瞬时速率重要规律速率比=方程式系数比变化量比=方程式系数比影响化学反应速率的因素内因由参加反应的物质的结构和性质决定的(主要因素)外因温度:升高温度,增大速率催化剂:一般加快反应速率(正催化剂)浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)压强:增大压强,增大速率(适用于有气体参加的反应)其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、 原电池等也会改变化学反应速率化学反应的限度——化学平衡基本情况在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态影响因素可逆反应温度、反应物浓度、压强等催化剂只改变化学反应速率,对化学平衡无影响在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应通常把由反应物向生成物进行的反应叫做正反应;而由生成物向反应物进行的反应叫做逆反应在任何可逆反应中,正方应进行的同时,逆反应也在进行可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0特征逆:化学平衡研究的对象是可逆反应动:动态平衡,达到平衡状态时,正逆反应仍在不断进行等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。
高考化学知识点分布表

高考化学知识点分布表一、无机化学知识点(占50%)1. 元素及元素周期表(占10%)- 常见元素的符号、名称及性质- 元素周期表的结构、规律和应用2. 化学键与分子结构(占10%)- 化学键的种类和特性- 分子的结构类型及其特点3. 物质的性质与变化(占10%)- 平衡与不平衡态的区分- 物质的物理性质、化学性质及其变化规律4. 化学反应与反应速率(占10%)- 化学反应的类型与特点- 化学反应速率与速率常数的计算5. 酸碱与盐(占10%)- 酸、碱和盐的定义及常见性质- 酸碱中和反应式的平衡计算6. 氧化还原与电解(占10%)- 氧化还原反应的基本概念与应用 - 电解过程及电解产物的判断二、有机化学知识点(占30%)1. 有机物的结构与性质(占15%)- 烃类、醇类和醛酮类的命名与性质 - 有机化合物的结构式与同分异构体 2. 有机反应与应用(占15%)- 反应类型及反应机理的了解与分析 - 有机物的合成与工业应用三、化学计算与实验(占20%)1. 化学计算(占10%)- 化学方程式的计算与应用- 摩尔质量与分子式的计算2. 化学实验(占10%)- 实验操作技能的掌握与运用- 实验数据的处理与分析总结:高考化学知识点主要集中在无机化学、有机化学和化学计算与实验三个方面。
其中,无机化学占据了50%的比重,涵盖了元素及元素周期表、化学键与分子结构、物质的性质与变化、化学反应与反应速率、酸碱与盐、氧化还原与电解等内容;有机化学占据了30%的比重,重点关注有机物的结构与性质以及有机反应与应用;化学计算与实验占据了20%的比重,强调了化学方程式的计算与应用以及实验操作技能和数据处理与分析。
通过合理的分布表格,学生可以清晰地了解到高考化学考试中各个知识点的权重和重点,帮助他们在备考过程中有的放矢,有针对性地提升对重点知识点的掌握和理解。
同时,对于教师和家长来说,该分布表也是一个参考工具,可以指导他们在教学或辅导过程中对知识点的选择和重点的突出,提高学生的学习效果和成绩。
(完整)高中化学知识结构图

或 4OH-—4e H2O+O2↑
金属电极做阳极,电极本身被氧化 M-n氧e→化 Mn+
第三部分:元素化合物转化关系
Na2S C2H5ONa
Na2O
NaOH
NaCl
Na
Na2O2
Na2CO3
NaCl
CH3COONa
NaHCO3
N2 Mg3N2
CO2 MgO
H2O Mg(OH)2
X2 MgX2
煅烧
O2 Mg
Ⅷ族
0族
比较
类型
构成晶体微粒
形成晶体作用力
熔沸点
硬度
物 理
导电性
性 质
传热性
延展性
溶解性
典型实例
离子晶体 阴、阳离子
离子键 较高
硬而脆 不良 水熔溶融液.导电
不. 良 不良 易溶于极性溶剂
NaCl,KBr
原子晶体 原子 共价键 很高 大
绝缘体(半导体) 不良 不良
不溶于任何溶剂 单质:金刚石、SiC、
H2O MgO
Mg(OH)2
H2O MgCO3
△
HCl
△
Cl2
HCl NaOH H2O HCl
或
电解
CO2 OH-
HCl
MgCl2
Mg(HCO3)2
CaCl2 HCl Cl2 或 HCl
Na2CO3 HCl
CaCO3
HCl CO2
CO2+H2O
△
O2 Ca
CaO H2O
H3PO4 Ca(OH)2
CaHPO4
CaC2
Ca(OH)2
CaO
非金属:按照化合价寻找各类物质,主要有氢化物、
单质、氧化物、含氧酸、及其盐
高中化学知识点总结含知识框架图

必修1知识点1 认识化学科学考点1 化学科学考点2 物理变化与化学变化考点3 化学反应基本类型知识点2 物质的量及其计算考点1 物质的量考点2 气体摩尔体积考点3 阿伏加德罗定律及推论知识点3 常用仪器和基本操作考点1 常用仪器形状、名称和使用考点2 化学实验基本操作知识点4 化学实验安全常识考点1 药品的安全存放考点2 化学实验安全常识和操作知识点5 配制一定物质的量浓度的溶液考点1 一定物质的量浓度的配制考点2 配制一定物质的量浓度误差分析考点3 物质的量浓度与溶质质量分数的换算知识点6 常见物质的检验、分离和提纯考点1 常见气体、离子的检验考点2 物质分离和提纯知识点7 化学实验设计考点1 化学实验方案设计的基本要求考点2 物质检验的实验设计知识点8 分散系考点1 胶体的性质及应用考点2 有关溶解度的计算知识点9 离子反应考点1 电解质与电离考点2 离子方程式的书写及正误判断考点3 离子共存知识点10 氧化还原反应考点1 氧化还原反应的概念考点2 氧化性、还原性强弱的判断考点3 氧化还原反应的规律考点4 氧化还原反应方程式的配平考点5 氧化还原反应的计算知识点11 钠及其化合物考点1 钠考点2 氧化钠与过氧化钠考点3 碳酸钠与碳酸氢钠考点4 碱金属元素知识点12 镁及其化合物考点1 镁及其化合物考点2 海水中提取镁知识点13 铝及其化合物考点1 铝考点2 铝的化合物考点3 铝的冶炼知识点14 铁及其化合物考点1 铁考点2 铁的冶炼考点3 铁的化合物知识点15 铜及其化合物考点1 铜及其冶炼考点2 铜的化合物知识点16 氯及其化合物考点1 氯气的性质考点2 氯气的制法考点3 卤素知识点17 氮及其化合物考点1 氮气的性质及用途考点2 氮的氧化物的性质考点3 氨气的性质及制法考点4 铵盐的性质考点5 硝酸的性质知识点18 硫及其化合物考点1 硫的存在及性质考点2 硫的氧化物考点3 硫酸的性质考点4 硫酸的工业制备知识点19 硅及其化合物考点1 硅的性质及制法考点2 二氧化硅和硅酸盐性质考点3 硅酸盐工业必修2知识点1 物质结构基础考点1 原子结构考点2 元素周期律考点3 元素周期表考点4 化学键知识点2 化学能与热能考点1 反应热考点2 燃烧热和中和热考点3 热化学方程式考点4 盖斯定律知识点3 化学能与电能考点1 原电池工作原理考点2 常见的化学电源考点3 金属的腐蚀与防护考点4 电能转化为化学能——电解知识点4 化学反应速率和限度考点1 化学反应速率考点2 影响化学反应速率的因素考点3 化学反应限度与化学平衡知识点5 有机物基础知识考点1 有机物的结构特点和性质考点2 同系物和同分异构体知识点6 烃的分类考点1 甲烷的结构和性质考点2 烷烃的结构和性质考点3 乙烯和烯烃考点4 苯及其同系物知识点7 化石燃料的综合利用考点1 石油的炼制考点2 煤的综合利用知识点8 烃的衍生物的分类考点1 乙醇的结构和性质考点2 乙酸的结构与性质考点3 酯和油脂的结构与性质考点4 糖类的结构与性质考点5 蛋白质的结构与性质知识点9 有机高分子材料考点1 有机高分子化合物考点2 三大合成材料知识点10 资源的综合利用和环境保护考点1 自然资源的开发和利用考点2 环境污染及保护选修1 化学与生活知识点1 化学与健康考点1 糖类考点2 油脂考点3 氨基酸与蛋白质考点4 维生素和微量元素考点5 饮食中食物及食品添加剂考点6 常见药物的成分及疗效知识点2 生活中的材料考点1 金属与合金考点2 金属的腐蚀和防护考点3 玻璃、陶瓷和水泥考点4 塑料、纤维和橡胶知识点3 化学与环境保护考点1 大气污染及治理考点2 水污染及其污水处理考点3 土壤污染与垃圾资源化选修2 化学与技术知识点1 化学与资源开发利用考点1 接触法制硫酸考点2 纯碱的生产考点3 化石燃料的综合利用考点4 海水的综合利用知识点2 化学与材料的制造、应用考点1 金属材料考点2 无机非金属材料考点3 高分子化合物与材料知识点3 化学与工农业生产考点1 获取洁净的水考点2 人工固氮技术——合成氨考点3 化肥与农药考点4 精细化学品选修3 物质结构与性质知识点1 原子结构与元素的性质考点1 原子结构的构造原理考点2 原子结构与元素的性质知识点2 化学键与物质的性质考点1 共价键考点2 分子的立体结构知识点3 分子间作用力与物质的性质考点1 键的极性与分子的极性考点2 分子间作用力知识点4 晶体类型考点1 分子晶体与原子晶体考点2 金属晶体考点3 离子晶体选修4 化学反应原理知识点1 化学反应的热效应考点1 化学反应的焓变考点2 热化学方程式考点3 盖斯定律考点4 反应焓变与标准摩尔生成焓知识点2 原电池原理及其应用考点1 原电池的工作原理考点2 化学电源考点3 金属的腐蚀及防护知识点3 电解的原理及其应用考点1 电解的工作原理考点2 电解的应用——电镀、电解精炼、电冶金考点3 氯碱工业知识点4 化学反应速率和化学平衡考点1 化学反应速率考点2 影响化学反应速率的因素考点3 化学反应进行的方向考点4 化学平衡考点5 影响化学平衡的因素考点6 合成氨的适宜条件及选择依据知识点5 溶液中的离子平衡考点1 弱电解质的电离考点2 水的电离和溶液的酸碱性考点3 盐类水解的规律考点4 盐类水解的应用考点5 沉淀溶解平衡选修5 有机化学基础知识点1 有机化合物的组成与结构考点1 有机化合物的分类考点2 同分异构体考点3 有机化合物的命名考点4 有机物常用分离、提纯的方法考点5 有机物分子式的确定知识点2 烃的性质考点1 烷烃考点2 烯烃考点3 炔烃考点4 芳香烃知识点3 烃的衍生物的性质考点1 卤代烃考点2 乙醇和醇类考点3 苯酚和酚类考点4 乙醛和醛类考点5 羧酸和酯考点6 有机合成知识点4 糖类、氨基酸和蛋白质考点1 糖类考点2 蛋白质和核酸知识点5 合成高分子化合物考点1 合成高分子化合物的基本方法考点2 高分子材料选修6 实验化学知识点1 化学实验基础考点1 物质的分离和提纯考点2 物质的检验与鉴别考点3 物质的制备和合成方法考点4 中和滴定法测定食醋中的醋酸的含量知识点2 化学实验探索考点1 常见性质实验方案的设计考点2 化学实验设计与评价高中化学知识框架一、化学基本概念和基本理论(一)物质的分类(二)组成原子的粒子间的关系核电荷数(Z)=核内质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)(三)元素周期律与周期表(四)化学键与分子结构(五)晶体类型与性质(六)化学反应类型(七)氧化还原反应的有关概念的相互关系(口诀:升失氧化还原剂,降得还原氧化剂)(八)离子反应(九)化学反应中的能量变化(十)溶液与胶体(十一)化学反应速率(十二)化学平衡1、化学平衡化学平衡常数的计算:对于可逆化学反应m A+n B⇋pC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:在书写平衡常数表达式时,要注意以下问题:②化学平衡常数表达式与化学方程式的书写方式有关。
高一化学知识点思维导图

高一化学知识点思维导图一、基本概念与原理1. 物质的组成- 原子与分子* 原子的结构:原子核与电子云* 分子的构成:化学键的概念- 元素与化合物* 元素的定义与分类* 化合物的特征与命名规则- 离子与化学式* 离子的形成:电离与价电子* 化学式的书写与意义2. 化学反应- 反应类型* 合成反应与分解反应* 置换反应与复分解反应- 化学方程式* 方程式的书写规则* 化学反应的计量关系- 反应条件与催化剂* 温度、压力、浓度对反应的影响* 催化剂的作用与分类3. 物质的性质- 物理性质与化学性质* 物理性质的分类与特点* 化学性质的分类与特点- 酸碱性* 酸碱的定义与性质* pH值的概念与计算- 氧化还原反应* 氧化还原对的概念* 氧化还原反应的特征与识别二、重要物质与实验操作1. 常见物质的性质与变化- 金属元素* 金属的通性与特性* 金属的氧化与腐蚀- 非金属元素* 非金属的通性与特性* 非金属的氧化与还原- 气体* 常见气体的性质与用途* 气体的收集与储存2. 实验基本操作- 实验器材的使用* 常见实验器材的名称与用途 * 实验器材的正确操作方法 - 实验安全与事故处理* 实验安全规则* 常见事故的预防与应急处理三、化学计算与数据分析1. 物质的量与浓度- 摩尔概念的引入* 物质的量的定义与单位* 摩尔质量的计算- 溶液的浓度* 质量分数与体积分数* 摩尔浓度的计算与转换2. 化学反应的计算- 反应物与生成物的计算* 根据化学方程式进行计算* 限制性反应的分析- 溶液的配制与稀释* 溶液的配制方法* 溶液稀释的计算四、化学与生活1. 化学元素与健康- 人体必需的微量元素* 微量元素的种类与作用* 微量元素缺乏与过量的症状- 化学物质与食品安全* 食品添加剂的种类与使用* 食品安全的化学检测方法2. 化学与环境保护- 环境污染的化学原因* 大气污染与水污染的化学原理* 土壤污染的化学影响- 绿色化学与可持续发展* 绿色化学的原则与实践* 可持续发展的化学策略通过以上的思维导图,我们可以系统地梳理和复习高一化学的主要知识点。
化学高一知识点归纳图表

化学高一知识点归纳图表化学作为一门自然科学,是研究物质组成、性质、结构、变化规律的学科,对于高中学生来说是必修课程之一。
在高一的学习过程中,学生会接触到许多不同的化学知识点。
为了帮助学生更好地掌握这些知识点,本文将通过一张归纳图表的形式,以清晰、简洁的方式概括高一化学的主要知识点。
一、物质的分类物质是构成一切事物的基本单位,根据其组成和性质可分为纯物质和混合物两大类。
纯物质又可分为单质和化合物,混合物则可以分为均相混合物和不均相混合物。
二、元素周期表元素周期表是化学家们根据元素的电子结构和性质整理而成的表格,其中最常见的元素周期表是门捷列夫周期表。
元素周期表按照元素的原子序数从小到大排列,化学家们通过周期表的特点与规律,可以预测元素的性质与排列。
三、化学式与化合价化学式是用来表示化合物中元素种类与原子数量比例的方法,其中最常见的是分子式和简式。
化合价则是元素与其他元素结合时所出现的价格,通过化合价可以预测化合物的结构与性质。
四、化学反应与化学方程式化学反应是指物质之间发生变化以形成新物质的过程,化学方程式则是化学反应过程中物质的表示方法。
化学方程式包括反应物、生成物和反应物和生成物的化学式,通过化学方程式可以预测反应物与生成物的数量比例。
五、离子与离子方程式离子是指在溶液中或熔融状态中失去或获取了电子的物质,离子方程式则是用离子符号表示离子在溶液中的反应过程。
通过离子方程式可以预测溶液中离子的生成和消失。
六、酸碱中和反应与盐酸碱中和反应是指酸和碱之间通过化学反应形成水及盐的过程,其中盐是一类离子化合物。
通过酸碱中和反应可以预测盐的生成和性质。
七、氧化还原反应氧化还原反应是指物质中的电子在化学反应中从一种物质传递给另一种物质的过程,其中一个物质被氧化,另一个物质被还原。
通过氧化还原反应可以预测物质的氧化态和还原态。
八、化学键与分子式化学键是化学元素之间强烈相互作用形成的化学结合力,包括共价键、离子键和金属键等。
(人教版)高中化学必修一章节思维导图集

(人教版隔中化学必修一苹节思维导图集(人教版)化学必修一章节复习思维导图集(人教版隔中化学必修一苹节思维导图集"虑归禽国体和液体的泯台体11头除去液体中不溶性IS体。
(前、删、诫璃棒、強杯〉不紆蜕拌・有雄B品体时就应血疝•余热蒸发至干•顾防迅热而迸硒壬把稀沁5含际漏g干,①液体体稅©加热方式歸度计水说球位置©冷却師水流方向©陆液体累沸1-化字实3木方法蒸谓<利用弗卓不叵陥去液体温台物中瞼擇岌或不慄发的金底<?®rgiw.、泗菇灯・温阳•冷蓝官•怯液楚•<锂形财》棊BR剤:原涓竅中的泪剤互不相:审g>则滔旗的滔解度夷远大于原溶剤■ g>裘易于挥股O鯉利用沼质在互不相洽的洛利里洛斛度的不冋•用一种泪剖把^痕从它与月一落於所测的浴滋里提取出来的幔作•主要仪器:分液帚耳分取5叱轉S上口吗------ <把互不相淄的初种濒休分开削抿作,与萃取趾合fife用的物殆的量实际上表示含片一定数目較子的集体物质的EB的单位标准协况STP 座尔戒里Moc禾H标淮夭气压吓4 mol任问韧灰含的細嗽目那是6.02肚02九伽d任何物辰毀燮是在数低上相对欣虽伯帯气你摩尔你枳Vm imolff何气体的标淮状况下的体初邯约为2241网伏加待罗定徉(由PV-nRT^ail同温同压下同体敦的住何气体有同分子菽初质M瞒更m m=M«n n=mfM M=m/n标淮状況气体体积v v=n«vm n^VJVm vm=v/n物质餉粉子對H N-NAxn n -N/NA NA-N/nJ物欣的里浓ISCB与濬质的欣里分埶3k汨液稀押观徉C《浓〉Q/《浓〉-C《嵇)*V(tt)2化学计現蠶实验中的应用咲物联的里为中心"浓敗厂逊中頤含郴nm林颐麵弊填第用托盘天平《或里冏〉、曲杯、玻璃祷、昔里疏、哌头昵函制一走物底的里沬度的溶液主要步猱:⑴计算G)称圮(如忌液体就用漓定世里取)①滔解(少更水・抗拌•注怠:令却〉⑷转液(脊虽頑要先檢漏•瑛菇棒引流〉⑸先滦(洗涤液一并倍移到咨里航中〉⑹际扭⑺宝吝⑻捉匀G孟田瓯卜XRfRPainRl玮a 6玄I9UX卜口右初I召炜(人教版隔中化学必修一苹节思维导图集3OS化合眩娜恥7游肚斟翘gggg巫U郦鮒—不皑咖■理单分衆離胡鞠M单特塹砸鎭輔丰皱单质单氏二、苗磁黴生粽件苗方肘jij丁苗处瞬輔:性蟻分縣二、分額軀分类⑴細类3"化阴师轴迤加NaO吒強脑師胡棚麴悯®6®嫌菇钱魯丹戯呦帼0吒雜育红鹉断滋加KSCN;隸出恥1*1色! f矽耐潴©tONaOK谢直舫绥j憨购磯轨舱级QK£C怔縣测酚駄酬血I色畫刑蝶(瞬腿却般勅1HCI无腮.帥B3血溯祕于勵睫鞍Ch加I •辭墙并酮N03師HNO3碱育不潘干碣E酥斜0肉艳诉敵&、耙無彻阚瞬子8漑屈后协少數谧押几砌片诫劑玮醐協铀(N02)一、顾碗魏念磁应潞甌单腺義腳輸和釧推.聪子、(铀八枚还原、发扭阪应趨匝•純5二财純關丫 --------------- ------------------------------------------------------一还輔矽补潮汕失电孑、(個八師化、匙轍反鹹《化带_ • - _ _. _ … .一一一一化飯広不一定是轲城原负宓-綃棘缴曲比合離轎帧自湖洲反应才霹烦褪庄[朋廳不-報轲拡販宓-繍輛鉤m飯齟髀馬諭般融才騙临簸庄空輕丄胡踰-定題畑麵夏朋蚯一定不是氨化西融S7.73%««够加I与二輸铀融誓名(游h小腐)幽陳(碑1痫側)」曲気气申融(抽P2=2Na2O> \ -、銀畀金辎融舰磺申除(血+02咖3202) f ;―从仏金裁化制擴苗俣师---------------- 2、谶旳瀾觀*臊翱*.翔的站询与熾融(2阳 + 2H2O = 3hOH*H2)筋金辭枚(干励土双)二錄顷机蝴融丿三、隣翻师脇越]心物魅對化抄肚牌蝴朗耒竝附Z合细擁2、几殛脏靴合协二、路軽北纲三、賂重要比纳诡醍滋W飙肌是聽鈕靛f耽翎砥创S申熾狀熾埶魏搦飜毎湖a靑加髦1解麟細球朽Ca越色際辟邛Cu瑕腑韵黔-黝帧麵誌化的申碗前:化删牖靴除、靴味醱化戋及舷用仃師伽不苗棚石水甌\ 5ME一十(刼畑朋翊:化扶2、黝諒㈱$ ---------------------------------------- 彌莎「肆般臓就二倉化區舵态 石朿的昌佐皱枪 物理和化学性能 与氢氟親勺反应氨在自建畀空磚在与强阙勺反应;硅麼的性贞 氛气3玻现和徧认 篠版的应用 辻酸腋体的制肛田琏、氧、金传元弄组成的化台物的总称结构复杂化学盾起宝 炭筲甲的运删雀闽钠.水沼複佰称朮城瑪二 5^ 纯诚、石加石、石英熔和制得 玻找 輕陽盐产品 魁土 S 石融石融 > 再加入石吉 水淀 験化莊(佰祢金沏砂〉 確钢」 连橡脸分子蘇(拾硅谧)单质琏有品沐和元定前两种物理性质三、硅虫质化学性质・弓豆敦化钠反应良好的半导体林料氨的校理性质—、冕工止乱艺殆耘1、无机非金国射料的圭曲毛3 -.師和或的氧化物/氮气的枷連性底 五气勻金匡的丘应| 一、詹茨的苗錄色气惋•颌气—— ------------- ---------2、冨集在縛水中曲元素话厂------------- 尊氟气与丰鈿的反应•氢气杀苗;原理氟加、注桁蒂、猱白液、瀝白粉二、我窑子笛総验僅用祜骸困落克,并用溶5«翊瞬干扰离子大台污染物谦的迭炮 二冠化谥戒理性质 一、二氧化琏和三毎化磽二氧化&祸財< 反应二筑化躺猱白性 二氧化违伸 气反应 三氧化磕租水反应 三範化说獅性氧代枷反应 三氧化硫和址阪应 陨代氢t 旗及其吉性 一至化藏户生I 一氧化豆与筆气反应二、二氧化誌一虽北氮」二氧化敝物理性质二笔化觅与木反范曲二甲盼年燧料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
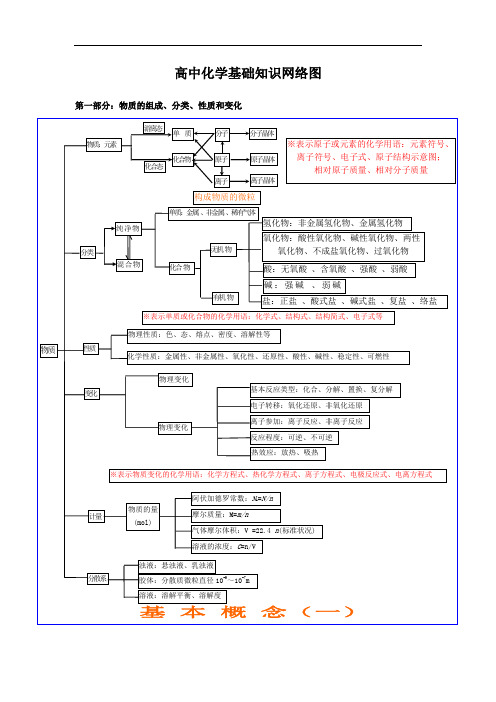
1.化学基本概念和基本理论
一、物质的分类
二、组成原子的粒子间的关系
三、元素周期律与周期表
四、化学键与分子结构
六、化学反应类型
七、离子反应
八、氧化还原反应的有关概念的相互关系
九、化学反应中的能量变化
十、溶液与胶体
十一、化学反应速率
十二、化学平衡
十三、弱电解质的电离平衡
十四、溶液的酸碱性
十五、盐类的水解
十六、酸碱中和滴定
十七、电化学
2.元素与化合物
一、钠及其化合物
二、碱金属
三、氯及其化合物
四、卤素
五、氧族元素
六、硫的重要化合物
七、碳及其化合物
八、硅及其化合物
九、材料
十、氮族元素
十一、氮和磷
十二、氨
十三、硝酸
十四、镁和铝
十五、铁及其化合物
十六、铜及其化合物
3.有机化学基础
一、烃
二、不饱和链烃
三、芳香烃
四、烃的衍生物
五、烃的衍生物结构、通式、化学性质鉴别
六、代表物质转化关系
七、糖类
八、油脂
九
十、合成材料(有机高分子化合物)
4.化学计算
一、物质的量及气体摩尔体积的计算
二、相对原子质量、相对分子质量及确定化学式的计算
三、物质溶解度、溶液浓度的计算
四、pH及有关氢离子浓度、氢氧根离子浓度的计算
五、化学反应方程式的有关计算
5.化学实验
一、化学实验基本操作
二、常见气体及其他物质的实验室制备
三、气体发生装置
四、常见气体的制备
五、气体的干燥
干燥是用适宜的干燥剂和装置除去气体中混有的少量水分。
常用装置有干燥管(内装固体干燥剂)、洗气瓶(内装液体干燥剂)。
所选用的干燥剂不能与所要保留的气体发生反应。
常用干燥剂及可被干燥的气体如下:
(1)浓硫酸(酸性干燥剂):N2、O2、H2、Cl2、CO、CO2、SO2、HCl、NO、NO2、CH4、C2H4、C2H2等(不可干燥还原性或碱性气体)。
(2)P2O5(酸性干燥剂):可干燥H2S、HBr、HI及浓硫酸能干燥的气体(不可干燥NH3等)。
(3)无水CaCl2(中性干燥剂):可干燥除NH3以外的其他气体(NH3能与CaCl2反应生成络合物
CaCl2·8NH3)。
(4)碱石灰(碱性干燥剂):可干燥NH3及中性气体(N2、O2、H2、CO、NO、CH4、C2H4、C2H2等)。
不能干燥酸性气体。
(5)硅胶(酸性干燥剂):可干燥Cl2、O2、H2、CO2、CH4、C2H4、C2H2(硅胶能吸附水,也易吸附其他极性分子,只能干燥非极性分子气体)。
(6)其他:如生石灰、NaOH也可用于干燥NH3及中性气体(不可干燥有酸性或能与之作用的气体)。
七、化学分离提纯
化学法要同时考虑到各组成成分及杂质的化学性质和特点,利用它们之间的差别加以分离提纯。
一般原则是:①引入试剂一般只跟杂质反应;②后续试剂应能除去过量的前一试剂;③不引进新杂质;④杂质与试剂生成的物质易与被提纯物分离(状态类型不同);⑤过程简单,现象明显,纯度要高;⑥尽可能将杂质转化为所需物质;⑦除去多种杂质时应考虑加入试剂的合理顺序;⑧如遇到极易溶解于水的气体时,应防止倒吸现象发生。
在进行化学分离提纯时,进行完必要的化学处理后,要适时实施某些物理法操作(如过滤、分液等)。
试剂的选择或采取的措施是最为关键的,它要根据除杂的一般原则,分析杂质的状态类型来确定。
①原物质和杂质均为气体时,一般不选用气体作为除杂的试剂,而选用固体或液体试剂;②原物质和杂质均为可溶于水的固体(或溶液)时,杂质的除去,要根据原物质与杂质中阴阳离子的异同,选择适当试剂,把杂质中与原物质不相同的阳离子或阴离子转变成沉淀、气体、水或原物质。
试剂一般选用可溶于水的固体物质或溶液,也可选用气体或不溶于水的物质;③原物质和杂质至少有一种不溶物时,杂质的除去一般不选用固体试剂,而是选用气体或液体试剂,也可采用直接加热、灼烧等方法除去杂质。
(1)加热分解法:如NaCl中混有少量NH4HCO3,加热使NH4HCO3分解。
(2)氧化还原法:利用氧化还原反应将杂质或氧化或还原,转化为易分离物质。
如除去苯中的少量甲苯,就可利用甲苯与酸性高锰酸钾反应,生成苯甲酸,再加碱生成水溶性苯甲酸钠,从而与苯分离;又如,除去CO2中的少量O2,可将气体通过热的铜网。
(3)沉淀法:将杂质转变为沉淀除去的方法。
如除去CO2中的H2S气体,可将混合气体通入到CuSO4
溶液中,除去H2S气体。
(4)汽化法:将杂质转变为气体使之除去的方法。
如除去NaCl固体中的Na2CO3固体,可加入HCl将其中的转变为CO2气体。
(5)酸、碱法:利用杂质和酸或碱的反应,将不溶物转变成可溶物;将气体杂质也可转入酸、碱中吸收来进行提纯。
如除去CuS中的FeS就可采用加入盐酸,使之充分溶解,利用FeS和盐酸反应而不与CuS 反应的特点来使两者分离。
(6)络合法:有些物质可将其转化为络合物达到分离目的。
如BaSO4中的AgCl可通过加入浓氨水,使AgCl转化为可溶的[Ag(NH3)2]Cl除去。
(7)转化法:利用某些化学反应原理,将杂质转化为所需物质,如NaHCO3溶液中含Na2CO3可通足量CO2转化,CaO中含CaCO3,可加热使之转化等。
有机物的分离一般不用此法,如除去乙酸乙酯中混有的乙
酸,如果采用加入乙醇及催化剂(稀硫酸)并加热的方法,试图将乙酸转化为乙酸乙酯,这是适得其反的。
其一是加入的试剂难以除去;其二是有机反应缓慢、复杂,副反应多,该反应又是可逆反应,不可能反应到底将乙酸除尽。
(8)水解法:当溶液中的杂质存在水解平衡,而用其他方法难以除之,可用加入合适试剂以破坏水解平衡,使杂质转化为沉淀或气体而除去。
如:MgCl2中的FeCl3,可用加MgO、Mg(OH)2、MgCO3等,降低H+浓度,促进Fe3+水解为Fe(OH)3↓,而不能加NaOH和NH3·H2O等。
(9)其他:如AlCl3溶液中混有的FeCl3,可利用Al(OH)3的两性,先加过量氢氧化钠溶液,过滤,在滤液中通足量CO2,再过滤,在滤渣[Al(OH)3]中加盐酸使其溶解。
此外还有电解法精炼铜;离子交换法软化硬水等。
多数物质的分离提纯采用物理--化学综合法。
八、物质的检验
6.化学工业知识
一、合成氨
二、石油化工
三、氯碱工业
四、硫酸的工业制法。
