浙江省义乌三中高一化学《从微观结构看物质的多样性--不同类型的晶体》课件2(苏教版必修2)
合集下载
高中化学专题1微观结构与物质的多样性第3单元从微观结构看物质的多样性第2课时不同类型的晶体课件苏

解析:干冰由分子构成,二氧化硅、金刚石由原子构成; 氧化钠由离子构成,金刚石由原子构成,氯化氢由分子构成; 碘由分子构成,石墨由原子构成,氯化钠由离子构成;二氧化 硅、金刚石、晶体硅由原子构成。故选 D。
【答案】 D
考查:知识点一
【例 2】 下表列出的对晶体的说明中,有错的是( )
选项
A
B
C
D
晶体名称 碘化钾
干冰
石墨碘Leabharlann 晶体中 的粒子阴、阳离子
分子
原子
分子
粒子间 的作用
离子键
分子间 作用力
共价键
分子间 作用力
【解析】 碘化钾是离子晶体,阴、阳离子通过离子键结 合,A 正确;干冰和碘均是分子晶体,分子间存在分子间作用 力,B、D 正确;石墨晶体呈层状结构,层与层之间为分子间作 用力,层内碳原子间形成共价键,C 错。
电,熔融或 的溶于水时
电,有的是
溶于水时导 导电,其余
半导体
电
不导电
金属晶体 差别较大 差别较大
良导体
休息时间到啦
同学们,下课休息十分钟。现在是休息时间,你们休 睛,
看看远处,要保护好眼睛哦~站起来动一动,久坐对 哦~
晶体类型 离子晶体 分子晶体 原子晶体 金属晶体
导热性
不良
不良
不良
良
一般难溶于
[目标导学] 1.熟知晶体的类型及其分类依据,学会判断晶体类型的方法。 2.知道晶体类型与物质性质的关系。 3.会比较晶体的熔、沸点。
[背诵经典导学] 1.四种晶体的含义: (1)离子晶体:阴、阳离子按一定的方式有规则地排列形成的晶 体; (2)分子晶体:由分子构成的物质所形成的晶体; (3)原子晶体:原子间通过共价键结合而成的空间网状结构的晶 体; (4)金属晶体:由金属单质或合金形成的晶体。
2019高中化学专题1微观结构与物质的多样性第三单元从微观结构看物质的多样性第2课时不同类型的晶体课件苏教

归纳总结 四种晶体的判断方法 (1)根据晶体的概念判断 (2)根据物质类别判断 ①离子化合物(强碱和大多数盐)都是离子晶体; ②共价分子(单质或化合物)是分子晶体; ③常见的原子晶体,如二氧化硅、碳化硅、金刚石、晶体硅等。
(3)根据微粒间作用力判断 ①离子晶体一定有离子键,可能有共价键,如Na2O2、NaOH等。 ②分子晶体一定有分子间作用力(包括氢键),一定无离子键,有些可能在 分子内存在共价键,如干冰。 ③原子晶体一定有共价键,一定没有离子键。 ④金属晶体一定有金属键,一定没有离子键。
专题1 第三单元
从微观结构看物质的多样性
第2课时 不同类型的晶体
[学习目标]
1.熟知晶体的类型及其分类依据,学会判断晶体类型的方法。
2.知道晶体类型与物质性质的关系,会比较晶体的熔、沸点。
[核心素养]
1.宏观辨识与微观探析:能从宏观与微观结合的视角对物质进行分类。
2.证据推理与模型认知:能依据构成微粒及微粒间作用,判断晶体类型,
并解决相应问题。
内容索引
新知导学 达标检测
新知导学
一、不同类型的晶体结构 1.晶体 (1)晶体具有 规则 的几何外形,构成晶体的微粒有 离子 、 分子 、 原子 。 (2)常见的晶体类型有 离子 晶体、 分子 晶体、 原子 晶体和 金属 晶体。 (3)晶体 有 固定的熔、沸点。
2.离子晶体 右图为氯化钠晶体结构示意图,回答下列问题:
仅供学习交流!!!
归纳总结 晶体熔、沸点的比较
(1)若晶体类型不同时,一般为原子晶体>离子晶体>分子晶体。
(2)若晶体类型相同时:
①离子晶体中,离子半径越小,离子所带电荷数越多,熔、沸点越高。
②原子晶体中,原子的半径越小,共价键的键长越短,熔、沸点越高。
从微观结构看物质的多样性PPT课件

温度: 500℃ 左右
催化剂:铁触媒做催化剂
回答下列问题:
1、合成氨生产时,为什么不采用尽可能高的压强?通 常采用2×107~5 ×107Pa 的压强?
2、实际生产中,为什么温度不能太高而采用适当高温 ( 500℃ )?
3、在高温高压下,为什么还要使用催化剂?
4、你认为合成氨中,氮气和氢气的体积比为多少最佳, 为什么?
熔点
沸点
干 冰(CO2) SiO2
-78.4℃ 1723℃
-56.2℃ 2230℃
Si
o
共价键 返回
三、原子晶体
定义:这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。
实例:如二氧化硅晶体、金刚石 常见的原子晶体:
石英(SiO2) 、金刚石、 晶体硅
共价键 返回
整理与归纳
H
C(S)+H2O(g)
CO(g)+H2(g)
CO(g)+H2O(g)
CO2(g)+H2(g)
合成氨的工业流程演示
N2、H2 混合气
N2、H2、液 氨、混合物
N2、H2 混合气
氨
分
离
NH3
器
N2、H2
合成塔
流程演示 化学原理
N2、H2 混合气
课堂练习
液 氨
复习小结:
工业制硫酸可以用几个“三”来表
且向循环气中不断补充 N2、H2(1:3)。
二、合成氨工业简述:
1、主要流程:
原料气制取 净化 压缩 合成 分离 液氨
2、原料气制取: 制氮气:
压缩
空气 碳
蒸发
液态空气
N2(先逸出) 物理方法
分离出CO2
催化剂:铁触媒做催化剂
回答下列问题:
1、合成氨生产时,为什么不采用尽可能高的压强?通 常采用2×107~5 ×107Pa 的压强?
2、实际生产中,为什么温度不能太高而采用适当高温 ( 500℃ )?
3、在高温高压下,为什么还要使用催化剂?
4、你认为合成氨中,氮气和氢气的体积比为多少最佳, 为什么?
熔点
沸点
干 冰(CO2) SiO2
-78.4℃ 1723℃
-56.2℃ 2230℃
Si
o
共价键 返回
三、原子晶体
定义:这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。
实例:如二氧化硅晶体、金刚石 常见的原子晶体:
石英(SiO2) 、金刚石、 晶体硅
共价键 返回
整理与归纳
H
C(S)+H2O(g)
CO(g)+H2(g)
CO(g)+H2O(g)
CO2(g)+H2(g)
合成氨的工业流程演示
N2、H2 混合气
N2、H2、液 氨、混合物
N2、H2 混合气
氨
分
离
NH3
器
N2、H2
合成塔
流程演示 化学原理
N2、H2 混合气
课堂练习
液 氨
复习小结:
工业制硫酸可以用几个“三”来表
且向循环气中不断补充 N2、H2(1:3)。
二、合成氨工业简述:
1、主要流程:
原料气制取 净化 压缩 合成 分离 液氨
2、原料气制取: 制氮气:
压缩
空气 碳
蒸发
液态空气
N2(先逸出) 物理方法
分离出CO2
不同类型的晶体PPT课件 苏教版优质课件

均摊法确定晶体的化学式
①处于立方体顶点的微粒同时为8个晶胞所共有, 每个微粒有1/8属于晶胞。
②处于立方体棱上的微粒同时为4个晶胞所共有, 每个微粒有1/4属于该晶胞。
③处于立方体面上的微粒同时为2个晶胞所共有, 每个微粒有1/2属于该晶胞。
④处于立方体内部的微粒,完全属于该晶胞。
在NaCl晶体中:
Si O
原子晶体的主要性质:王后雄P36
离子晶体: 离子化合物(大多数盐、强碱、活泼 金属氧化物)
原子晶体: 金刚石、单晶硅(Si)、二氧化硅、
晶体
金刚砂(SiC)
金属晶体: 所有金属
分子晶体: 决大多数共价化合物王后雄P35
15 、甘其食,美其服,安其居,乐其俗。邻国相望,鸡犬之声相闻,民至老死,不相往来。 17 、当你周围都是米的时候,你很安逸;当有一天米缸见底,才发现想跳出去已无能为力。有一种陷阱,名叫安逸!别在最能吃苦的年纪选择安逸!没有危机!是最大的危机!自己不上进,危机无处不 在吞噬你的理想和灵魂,混下去很容易,混上去太难了! 10 、聆听不代表沉默,有时安静也是一种力量。 14 、不为失败找借口,只为成功找方法。 15 、机遇是难求的,失去了就不会再来,把握好现有的机会,努力进取,那么你将会得到不菲的收获。 17 、不要轻易用过去来衡量生活的幸与不幸!每个人的生命都是可以绽放美丽的,只要你珍惜。 5 、再苦再累,只要坚持往前走,属于你的风景终会出现;只要是自己选择的,那就无怨无悔,青春一经典当,永远无法赎回;过去只可以用来回忆,别沉迷在它的阴影中,否则永远看不清前面的 路;不要期望所有人都懂你,你也没必要去懂所有人;聚散离合是人生的规律,无须伤春悲秋。 18 、成功就是坚韧不拔,直到成功,靠的都是强烈的成功欲望!“,by松下幸之助。---我可以说我接触过无数成功人士。凡是大成之人,都有这种坚韧不拔的好胜心和成功欲望。钱对他们来说只是 竞争过程中的一小部分,真正吸引他们的还是成功以及其带来的满足感和影响力! 20 、新人新工作,要有新气象:工作要认真,遇事莫要慌,见人懂礼貌,微笑挂脸上,心态要摆正,前辈是榜样,听从领导话,虚心又自强,注意讲卫生,衣着要端庄。祝你早日适应工作,成 为国家栋梁。
高中化学专题1微观结构与物质的多样性132不同类型的晶体

第十二页,共二十九页。
一、四种类型晶体的比较和微粒
晶体类型
离子晶体
原子 晶体
分子晶体
构成微粒
阴、阳离子 原子 分子
金属晶体
金属阳离子、自由 电子
微粒间 作用
离子键
共价 键
分子间作 用力
(或氢键)
金属键
2021/12/6
第十三页,共二十九页。
物理 性质
熔、 沸点 硬度
导电 性
导热性
溶解 性
机械加 工性能
(2)大多数非金属单质(金刚石、石墨、晶体硅、晶体硼等除外)、非金属氢化物、部分 非金属氧化物(SiO2 等除外)、酸、绝大多数有机物(有机盐除外)是分子晶体。
2021/12/6
第十六页,共二十九页。
(3)常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有 SiC、 SiO2、AlN、BN 等。
部分溶于水后能导电;金属晶体是电的良导体。
2021/12/6
第十七页,共二十九页。
5.依据硬度和机械性能判断 (1)离子晶体的硬度较大或硬而脆。 (2)原子晶体的硬度大。 (3)分子晶体的硬度较小且质脆。 (4)金属晶体具有延展性,硬度差异大。
2021/12/6
第十八页,共二十九页。
2021/12/6
【答案】 (1)原子 共价键 (2)金属 (3)分子 分子间作用力、共价键 (4)②④
2021/12/6
第二十七页,共二十九页。
2021/12/6
第二十八页,共二十九页。
内容 总结 (nèiróng)
01 微观(wēiguān)结构与物质的多样性。典例导析
No Image
12/6/2021
第二十九页,共二十九页。
一、四种类型晶体的比较和微粒
晶体类型
离子晶体
原子 晶体
分子晶体
构成微粒
阴、阳离子 原子 分子
金属晶体
金属阳离子、自由 电子
微粒间 作用
离子键
共价 键
分子间作 用力
(或氢键)
金属键
2021/12/6
第十三页,共二十九页。
物理 性质
熔、 沸点 硬度
导电 性
导热性
溶解 性
机械加 工性能
(2)大多数非金属单质(金刚石、石墨、晶体硅、晶体硼等除外)、非金属氢化物、部分 非金属氧化物(SiO2 等除外)、酸、绝大多数有机物(有机盐除外)是分子晶体。
2021/12/6
第十六页,共二十九页。
(3)常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有 SiC、 SiO2、AlN、BN 等。
部分溶于水后能导电;金属晶体是电的良导体。
2021/12/6
第十七页,共二十九页。
5.依据硬度和机械性能判断 (1)离子晶体的硬度较大或硬而脆。 (2)原子晶体的硬度大。 (3)分子晶体的硬度较小且质脆。 (4)金属晶体具有延展性,硬度差异大。
2021/12/6
第十八页,共二十九页。
2021/12/6
【答案】 (1)原子 共价键 (2)金属 (3)分子 分子间作用力、共价键 (4)②④
2021/12/6
第二十七页,共二十九页。
2021/12/6
第二十八页,共二十九页。
内容 总结 (nèiróng)
01 微观(wēiguān)结构与物质的多样性。典例导析
No Image
12/6/2021
第二十九页,共二十九页。
高中化学 专题1 微观结构与物质的多样性 从微观结构看物质的多样性(第2课时)不同类型的晶体课件

(
)
D.固态不导电、熔融态导电的一定是离子晶体 解析:部分分子晶体的水溶液也能导电,如 HCl 晶体,A 错
误;金属单质在熔融态导电,但不是离子晶体,B 错误;共价 化合物形成的晶体可能是分子晶体, 如干冰, 也可能是原子晶 体,如石英晶体,C 错误;固态不导电、熔融态导电是离子晶 体区别其他晶体的性质,D 正确。 答案:D
离子晶体与分子晶体
1.晶体
2.晶体的结构与性质特点
3.离子晶体 (1)概念: 离子化合物中的阴、阳 离子按一定的方式有规则 地排列形成的晶体。 (2)性质: ①熔点较高 、硬度较大 。 ②固态时不导电,在熔融状态下或水溶液中能够导电 。
(3)实例——NaCl 的晶体结构:
+ 构成氯化钠晶体的微粒是 Na 和 Cl ,微粒间的相互作
原子晶体与金属晶体
1.原子晶体 (1)概念:原子间以共价键结合并以一定方式有规则排列成 空间网状结构的晶体。 (2)性质:熔点高 、硬度大、不能导电。
(3)实例——石英晶体的结构
①构成石英晶体的微粒是 硅原子和 氧原子。微粒间的相互 作用力是共价键 ,晶体类型是原子晶体 。 ②石英晶体的空间结构是正四面体型 的空间网状结构。 ③在石英晶体中,不存在 SiO2 分子,SiO2 表示的意义是晶 体中硅原子与氧原子的个数比为 1∶2 。
2.下表中是几种物质的熔点。
物质 熔点/℃ Na2O NaCl 920 801 AlF3 1 291 AlCl3 190 BCl3 Al2O3 CO2 SiO2 I2
1.下列不属于晶体的特点的是 A.具有规则的几何外形 B.具有固定的沸点 C.具有固定的熔点 D.一定是无色透明的固体
(
)
解析:晶体有规则的几何外形,有固定的熔、沸点,但却不 一定是无色的,如紫黑色晶体碘及蓝色的硫酸铜晶体。 答案:D
高中化学专题1微观结构与物质的多样性第3单元从微观结构看物质的多样性(第2课时)不同类型的晶体课件苏教

常见晶体的构成 [基础·初探]
2.四类晶体的构成 (1)离子晶体 含义:离子化合物中的 阴、阳离按子一定的方式有规则地排列形成的晶体。 ①构成微粒: 阴、阳离子;②微粒间作用力: 离子键。 (2)分子晶体 含义:由 分子构成的物质所形成的晶体。 ①构成微粒: 分子 ;②微粒间作用力: 分子间作用力。
知 识 点 一
第2课时 不同类型的晶体
学 业
分
层
测
评
知 识 点 二
1.了解构成氯化钠、金刚石、足球烯、干冰、石英的微观粒子的排列方式, 知道晶体可以分成离子晶体、分子晶体、原子晶体、金属晶体。 (重点)
2.初步形成“结构决定性质、性质反映结构”的观念。 3.知道四类晶体的主要特性。 (重点)
1.晶体
大部分易 溶于水
不溶于任 何溶剂
机械加 工性能
不良
不良
不导电
不良 部分能 溶于水
不良
多数高, 少数低
有的较大, 有的较小
导电
良好
不溶于水
良好
四类晶体的比较
1.四类晶体的比较
[核心·突破]
晶体类型 构成微粒
微粒间 作用
离子晶体 阴、阳离
子
离子键
原子晶体 原子
共价键
分子晶体
分子
分子间 作用力 (或氢键)
金属晶体 金属阳离 子、自由
电子
金属键
熔沸点 较高
很高
低
硬度 较大、脆 很大
较小
物理性质
导电性
溶解或熔 化时导电
ቤተ መጻሕፍቲ ባይዱ
不导电
导热性 不良
不良
溶解性
每个 Na+周围等距紧邻的 Cl-有 6 个,每个 Cl-周围等距紧邻的 Na+有 6个, 晶体中 Na+与 Cl-的个数比为 1∶1。
化学课件《从微观结构看物质的多样性》优秀ppt2 苏教版

――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
从微观结构看物质的多样性PPT课件2

原子晶体的物理性质:
熔沸点很高,硬度很大,难溶于水, 一般不导电。 常见的原子晶体:
金刚石、金刚砂(SiC)、 晶体硅、石英(SiO2)
不同类型的晶体
小结
1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:
晶体类型 结 构 构成晶体 的粒子 微粒间的 相互作用 硬度 性 质 熔点 导电性 离子晶体 阴、阳离子 离子键 较大 较大 熔融或溶 液导电 分子晶体 分子 分子间 作用力 小 小 溶液有 些导电 原子晶体 原子 共价键 大 高 不导电 金属晶体 金属阳离 子和自由 移动电子 金属键 差距大 差距大 导电
返回
1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。14、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更5、别着急要结果,先问自己够不够格,付出要配得上结果,工夫到位了,结果自然就出来了。 6、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 7、别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 8、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给时间来定夺。 9、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡慕那些总能撞大运的人,你必须很努力,才能遇上好运气。 10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚 14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛。
熔沸点很高,硬度很大,难溶于水, 一般不导电。 常见的原子晶体:
金刚石、金刚砂(SiC)、 晶体硅、石英(SiO2)
不同类型的晶体
小结
1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:
晶体类型 结 构 构成晶体 的粒子 微粒间的 相互作用 硬度 性 质 熔点 导电性 离子晶体 阴、阳离子 离子键 较大 较大 熔融或溶 液导电 分子晶体 分子 分子间 作用力 小 小 溶液有 些导电 原子晶体 原子 共价键 大 高 不导电 金属晶体 金属阳离 子和自由 移动电子 金属键 差距大 差距大 导电
返回
1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。14、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更5、别着急要结果,先问自己够不够格,付出要配得上结果,工夫到位了,结果自然就出来了。 6、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 7、别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 8、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给时间来定夺。 9、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡慕那些总能撞大运的人,你必须很努力,才能遇上好运气。 10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚 14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛。
浙江省金华市高中化学 专题2 第三单元 从微观结构看物质的多样性课件 苏教版必修2

2.(1)CH3CH2CH2CH2CH3 与
互为_同__分__异__构_;体
(2)已知 CH2==CHCH3 中含碳量为 85.7%,试求
中含碳量为___象和同分异构体
2.实例 (1)正丁烷和异丁烷
分子式相同,均为 C4H10 ,
分子结构不同,结构式分别为
2.实例 (2)乙醇和二甲醚 分子式相同,均为 C2H6O ,
H、D、T
O2、O3;红磷、白 正丁烷和异丁烷 磷;金刚石、石墨
练习1:
有下列各组物质:
162C与163C、金刚石与石墨、乙醇与二甲醚、冰和水以及
CH3
CH3
CH3CHCH2CH3
CH3 -C-CH3
(1)互为同位素的是
CH3
(2)互为同素异形体的是
(3)互为同分异构体的是
(4)属于同一化合物的是
是否互为同分异构体?
乙醇
二甲醚
比较:乙醇与二甲醚
乙醇
二甲醚
碳原子数目 氢原子数目 氧原子数目
分子式
原子间的
2 6 1
C2H6O
2 6 1
C2H6O
连接方式
(结构式)
思考:
物质 正丁烷 异丁烷
乙醇 二甲醚
互为同分异构体的物质,它们 的性质相同吗?
分子式
C4H10 C4H10 C2H6O C2H6O
第三单元 从微观结构看物质的多样性
【学习目标】
1.了解同分异构现象,能判断同分异构 体。
2.从同分异构现象认识物质的多样性与 微观结构的关系。
活动与探究
观察下图中丁烷的球棍模型,写出它们的 结构式,并比较它们的碳原子、氢原子的
数目,你发现了什么?
正丁烷
【全版】浙江省届高三化学第单元讲从微观结构看物质的多样性课件推荐PPT

晶体中存在的作用力 【例2】有关晶体的下列说法中正确的是( B )
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高 C.冰融化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏 【解释】晶体中分子间的作用力越大,说明晶体的熔 沸点越高,而分子的稳定性取决于化学键的强弱和体 系能量的高低,故A选项错误。冰融化时水分子中部分 氢键断裂,共价键不断裂。氯化钠熔化时离子键被破 坏。故正确答案是B。
二、晶体结构的构成
各类晶体的构成
构成微粒 阴、阳离子 阳离子和电子
原子 分子
作用力 离子键 (可能还含有共价键)
金属键 共价键 分子间的作用力 (范德华力和氢键)
晶体类型 离子晶体 金属晶体 原子晶体 分子晶体
三、晶体的性质
1.晶体的熔点高低:以第三周期的单质和氧化物
的熔点变化来看
单质
Na
Mg
Al
体,为_离___子__晶__体_。晶体能导电且随着温度的升高导电性降 低的晶体,为_金__属__晶___体_。水溶液能够导电,而熔融状态下 不能够导电的晶体,为分___子__晶__体__。原子晶体一般__不__导__电___。
四、同素异形体与同分异构体
1.同素异形现象
____同___一__种__元___素__能__够___形__成__几___种__不__同___的__单__质______ , 这 种 现
Si P4 S8 Cl2
Ar
熔点℃ 97.8
651
660
141 0
44
112.8 -101 -189.2
晶型 金属晶体 原子晶体 分子晶体
氧化物 熔点℃ 晶型
Na2O 920 离子晶体
不同类型的晶体(2
思考:
①晶体中有没有单个小分子? ②构成晶体的微粒是什么? ③分子晶体中微粒间的作用是什么? ④分子晶体物理性质有什么特点? ⑤哪些物质属于分子晶体?
2、分子晶体
定义:
分子间通过分子间作用力相结合按一定规则排列而成的晶体,叫做分子晶体
特点:有单个分子存在,化学式就是分子式。
物理性质:熔、沸点低,硬度小,固态和液态均不导电。
B
A.BaCl2
B.干冰
C.晶体硅(原子晶体) D.氯化钠
熔点高低:
原子晶体>离子晶体>分子晶体
【小试牛刀】
4、氮化硅(Si3N4)是一种新型的耐高温耐磨 材料,在工业上有广泛的应用,它属于
()
A
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
苏教版必修第一册
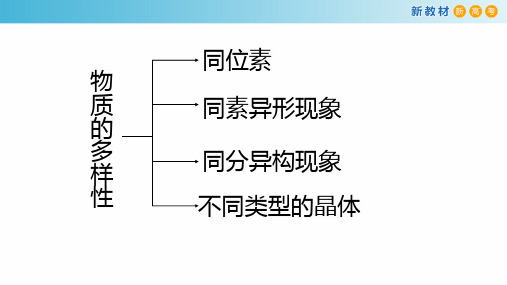
同位素
物
质
同素异形现象
的
多 样
同分异构现象
性
不同类型的晶体
专题1 微观结构与物质的多样性
第三单元 从微观结构看物质的多样性
三、不同类型的晶体
水
干冰
晶
氯 化 钠
雪花 金刚石
【问题探究1】
晶体为什么具有规则的几何外形呢?
宏观
决定 反映
微观
晶体规则的几何外形是其内部构成微粒有规则排列的 结果
你知道吗
4.下列物质性质的变化规律,与共价键的键能大小有关 的是( BC)
A.F2、Cl2、Br2、I2的熔沸点逐渐升高 B.HF、HCl、HBr、HI的稳定性依次减弱 C.金刚石的硬度、熔沸点都高于晶体硅 D.NaF、NaCl、NaBr、NaI的熔点依次 降低
【小试牛刀】
3、下列物质中,熔点较低的是( )
高中化学微观结构与物质的多样性从微观结构看物质的多样性时不同类型的晶体PPT课件

D [由表中所给熔、沸点数据,可知 SiCl4 的熔、沸点最低,应为分子晶 体;单质 B 的熔、沸点最高,因此为原子晶体;AlCl3 的沸点低于熔点,故可 升华;NaCl 的熔点高于 MgCl2 的熔点,表明 NaCl 中离子键的强度比 MgCl2 中的大。]
晶体类型的判断方法 (1)根据构成晶体的微粒和微粒间的作用力判断。 (2)根据各类晶体的特征性质判断,一般来说: ①低熔沸点的化合物属于分子晶体。 ②熔沸点较高,且在水溶液中或熔融状态下能导电的化合物为离子晶体。 ③熔沸点很高,不溶于一般溶剂的物质为原子晶体。 ④能导电、传热、有延展性的为金属晶体。
2.下列物质中,属于分子晶体的化合物是( ) A.石英 B.硫磺 C.干冰 D.食盐
C [本题主要考查通过晶体的结构判断晶体的类型。分子晶体是由分子 通过分子间作用力结合而成的晶体,石英是原子晶体,食盐是离子晶体,而 硫磺、干冰是分子晶体,但硫磺是单质,干冰是化合物。故正确答案为 C。]
题组 2 晶体的构成与性质 3.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
【导学号:13572036】
A.C(金刚石)和 CO2
B.NaBr 和 HBr
C.CH4 和 H2O
D.Cl2 和 KCl
C [各物质中的化学键和所属晶体类型如下:
金刚石 CO2 NaBr HBr CH4 H2O Cl2 KCl 化学 共价 共价 离子 共价 共价 共价 共价 离子 键 键 键键键键键键键 晶体 原子 分子 离子 分子 分子 分子 分子 离子 类型 晶体 晶体 晶体 晶体 晶体 晶体 晶体 晶体
【答案】 (1)× (2)× (3)× (4)√
2.下列叙述正确的是 ( ) 【导学号:13572035】
2020版高中化学专题1微观结构与物质的多样性第三单元第2课时不同类型的晶体课件苏教版必修2

2.离子晶体、分子晶体、原子晶体物理性质比较
晶体类 型
离子晶体
分子晶体
原子晶体
主要特 性
熔、沸点较 高,略硬而 脆
熔、沸点低, 硬度小
熔、沸点很 高,硬度很 大
熔化或溶于 部分溶于水导
导电性
水导电
电
不导电
3.晶体熔、沸点的比较 (1)若晶体类型不同时,一般为原子晶体>离子晶体>分子晶体。 (2)若晶体类型相同时: ①离子晶体中,离子半径越小,离子所带电荷数越多,熔、沸点越高。 ②原子晶体中,原子的半径越小,共价键的键长越短,熔、沸点越高。 ③分子晶体中,若分子结构相似,相对分子质量越大,熔、沸点越高(若形成氢键, 其熔、沸点反常高)。 (3)常温常压下状态: ①熔点:固体物质>液态物质; ②沸点:液态物质>气态物质。
4.如图为石英晶体结构示意图。
(1)构成石英晶体的微粒是 Si 原子和 O 原子。微粒间的相互作用力是 共价键 ,晶 体类型是原子晶体 。 (2)在石英晶体中,每个硅原子与 4 个氧原子结合,每个氧原子形成 2 个 Si—O 键。
(3)石英晶体的空间结构是 正四面体型的空间网状结构 。 (4)在石英晶体中,不存在 SiO2 分子,SiO2 表示的意义是晶体中 Si 原子和 O 原子个数比为 1∶2。
第 2 课时 不同类型的晶体
1.熟知晶体的类型及其分类依据,学会判断晶体类型的方法。(重点) 2.知道晶体类型与物质性质的关系,会比较晶体的熔、沸点。
知识点 不同类型的晶体
1.晶体的特点 (1)具有规则的 几何外形 。 (2)晶体内部构成晶体的微粒在空间呈 有规则的重复排列 。
2.如图为氯化钠晶体结构示意图。 (1)构成氯化钠晶体的微粒是 Na+和 Cl- ,微粒间的相互作用力是 _离__子__键____,晶体类型是 离子晶体 。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a、组成微粒:原子 b、微粒间作用力:共价键 2、存在形式:某些非金属单质、部分共价化合物。 3、原子晶体不存在独立的分子。无真正的 分子式,只有最简式。
4、原子晶体的物理性质: 熔沸点很高,硬度很大,难溶于一般溶剂, 固态和熔融态都不导电。 规律:原子晶体的熔沸点与共价键的强弱有关,并随 共价键的增强而增高。一般来说,形成共价键的原子 半径越小,共价键越强。
5、实例:金刚石、晶体硅、二氧化硅、金刚砂(SiC)等
1、金属晶体有哪些共同的物理特性?
金属光泽、能导电、传热、
具有延展性等
2、比较离子晶体、分子晶体和原 子晶体三者的熔沸点大小?
原子晶体>离子晶体>分子晶体
1、下列物质属于分子晶体的化合 B 物是__________; 属于原子晶体 D 的单质是__________. A石英 B干冰 C食盐 D金刚石 E二氧化硅 2、下列物质的晶体中不存在分子 的是( A ) A二氧化硅 B二氧化碳 C二氧化硫 D二硫化碳
3、请将下列物质的沸点按由低 到高的顺序排列: ②< ① <③ ① 氯化钠②氯气 ③ 二氧化硅 4、下列各组物质的晶体中化学 键类型相同,晶体类型也相同的
是( B ) (A)SO2和SiO2
(C)NaCl和HCl
(B)CO2和H2 (D)CCl4和KCl
5、能与氢氧化钠溶液反应 的原子晶体是( D ) A、铝 B、金刚石 C、二氧化碳 D、二氧化硅
ClNa+ Cl-
Na+ Na
ClCl+
Na
Na+
Cl+
NaCl晶体
-同时 每个Cl
+ 吸引6个Na
每个Na+同时吸引6个Cl-
一、离子晶体
1、定义
离子间通过离子键结合而成的晶体叫做离子晶体。 a、组成微粒:阴、阳离子 b、微粒间的作用力:离子键
2、存在形式:离子化合物
3、离子晶体中不存在独立的分子,只存在离子, 表示的化学式实为最简式,无分子式。 4、物理性质: 具有较高的熔沸点,硬度较大,在熔融状态或 水溶液中能导电,有些离子晶体溶于水,有些 难溶于水。 5、实例:
2、存在形式:大部分共价化合物、大部分非金属单
质、稀有气体的固态 3、分子晶体中存在独立的分子,分子式能表示其 真实组成。只有分子晶体才有真正的分子式。
4、物理性质:
熔、沸点低,硬度小,在水中的溶解度存在很大的差异。 5、实例: H2、Cl2、He 、HCl 、H2O、CO2、P4等
6、判断依据:
(1)根据熔沸点较高,熔融状态能导电的性质 可判断是离子晶体。
(2)根据熔沸点较低, 由有限个原子组成的分子 或具有分子式的晶体可判断是分子晶体。如: C2H2、P4、C60、N60等。
讨论:
CO2和SiO2的一些物理性质如下表 示,通过比较判断SiO2晶体是否属 于分子晶体。 熔 点 沸 点
干 冰(CO2)
SiO2
-78.4℃
1723℃
-56.2℃
2230℃
[思考3]:石英晶体中存在哪些微粒?如何结合 成晶体的?
Si o
SiO2晶体的结构示意图
Si
o
共价键
晶体的硬度
金刚石
食 盐
三种晶体的熔点
金刚石
食 盐
干 冰
三、原子晶体
1、定义: 相邻原子通过共价键结合而形成空间网状结构 的晶体,叫做原子晶体。
专题一
微观结构与物质的多样性
第三单元
从微观结构看物质的多样性
不同类型的晶体
雪花晶体
明矾晶体
单质硫
金刚石
雪花
氯化钠
水晶
食盐(晶体)的形成 [思考1]:NaCl晶体中存在哪些微粒?如何结合 成晶体的?
ClCl+ Na Na Cl- Na+ + ClCl+ Cl+ Na ClNa+ Na Na+ ClNa+ Na+
离子化合物:大多数盐类、金属氧化物及强碱 NaCl、CsCl、KOH 、CuSO4、 NH4Cl 、 CaO等
[思考2]:干冰晶体中存在哪些微粒?如何结合 成晶体的?
干冰晶体的结构示意图Βιβλιοθήκη 共价键分子间作用力
二、分子晶体
1、定义:
分子间通过分子间作用力相结合的晶体, 做分子晶体。 a、组成微粒:分子 b、微粒间作用力:分子间作用力
4、原子晶体的物理性质: 熔沸点很高,硬度很大,难溶于一般溶剂, 固态和熔融态都不导电。 规律:原子晶体的熔沸点与共价键的强弱有关,并随 共价键的增强而增高。一般来说,形成共价键的原子 半径越小,共价键越强。
5、实例:金刚石、晶体硅、二氧化硅、金刚砂(SiC)等
1、金属晶体有哪些共同的物理特性?
金属光泽、能导电、传热、
具有延展性等
2、比较离子晶体、分子晶体和原 子晶体三者的熔沸点大小?
原子晶体>离子晶体>分子晶体
1、下列物质属于分子晶体的化合 B 物是__________; 属于原子晶体 D 的单质是__________. A石英 B干冰 C食盐 D金刚石 E二氧化硅 2、下列物质的晶体中不存在分子 的是( A ) A二氧化硅 B二氧化碳 C二氧化硫 D二硫化碳
3、请将下列物质的沸点按由低 到高的顺序排列: ②< ① <③ ① 氯化钠②氯气 ③ 二氧化硅 4、下列各组物质的晶体中化学 键类型相同,晶体类型也相同的
是( B ) (A)SO2和SiO2
(C)NaCl和HCl
(B)CO2和H2 (D)CCl4和KCl
5、能与氢氧化钠溶液反应 的原子晶体是( D ) A、铝 B、金刚石 C、二氧化碳 D、二氧化硅
ClNa+ Cl-
Na+ Na
ClCl+
Na
Na+
Cl+
NaCl晶体
-同时 每个Cl
+ 吸引6个Na
每个Na+同时吸引6个Cl-
一、离子晶体
1、定义
离子间通过离子键结合而成的晶体叫做离子晶体。 a、组成微粒:阴、阳离子 b、微粒间的作用力:离子键
2、存在形式:离子化合物
3、离子晶体中不存在独立的分子,只存在离子, 表示的化学式实为最简式,无分子式。 4、物理性质: 具有较高的熔沸点,硬度较大,在熔融状态或 水溶液中能导电,有些离子晶体溶于水,有些 难溶于水。 5、实例:
2、存在形式:大部分共价化合物、大部分非金属单
质、稀有气体的固态 3、分子晶体中存在独立的分子,分子式能表示其 真实组成。只有分子晶体才有真正的分子式。
4、物理性质:
熔、沸点低,硬度小,在水中的溶解度存在很大的差异。 5、实例: H2、Cl2、He 、HCl 、H2O、CO2、P4等
6、判断依据:
(1)根据熔沸点较高,熔融状态能导电的性质 可判断是离子晶体。
(2)根据熔沸点较低, 由有限个原子组成的分子 或具有分子式的晶体可判断是分子晶体。如: C2H2、P4、C60、N60等。
讨论:
CO2和SiO2的一些物理性质如下表 示,通过比较判断SiO2晶体是否属 于分子晶体。 熔 点 沸 点
干 冰(CO2)
SiO2
-78.4℃
1723℃
-56.2℃
2230℃
[思考3]:石英晶体中存在哪些微粒?如何结合 成晶体的?
Si o
SiO2晶体的结构示意图
Si
o
共价键
晶体的硬度
金刚石
食 盐
三种晶体的熔点
金刚石
食 盐
干 冰
三、原子晶体
1、定义: 相邻原子通过共价键结合而形成空间网状结构 的晶体,叫做原子晶体。
专题一
微观结构与物质的多样性
第三单元
从微观结构看物质的多样性
不同类型的晶体
雪花晶体
明矾晶体
单质硫
金刚石
雪花
氯化钠
水晶
食盐(晶体)的形成 [思考1]:NaCl晶体中存在哪些微粒?如何结合 成晶体的?
ClCl+ Na Na Cl- Na+ + ClCl+ Cl+ Na ClNa+ Na Na+ ClNa+ Na+
离子化合物:大多数盐类、金属氧化物及强碱 NaCl、CsCl、KOH 、CuSO4、 NH4Cl 、 CaO等
[思考2]:干冰晶体中存在哪些微粒?如何结合 成晶体的?
干冰晶体的结构示意图Βιβλιοθήκη 共价键分子间作用力
二、分子晶体
1、定义:
分子间通过分子间作用力相结合的晶体, 做分子晶体。 a、组成微粒:分子 b、微粒间作用力:分子间作用力
