无机化学-硼族、碳族元素-卤化物
无机化学-第六章-硼族元素

1
3
4
2
5
6
9
8
10
7
11
12
23-мар-22
无机化学
硼的化学性质
晶体硼较惰性
(1)无定形硼较活泼,高温下能与N2、O2、 S、X2发 生反应,显还原性。
R.T. 973K
2B(s) + 3F2(g) ══ 2BF3 4B(s) + 3O2(g) ══ 2B2O3
B-O Si-O C-O 键能/kJ·mol-1 560-690 > 452 > 358
CuBO2
红
Cu(BO2)2
蓝
Fe(BO2)2
绿
Fe(BO2)3
棕
23-мар-22
无机化学
(1) BX3结构:
硼的卤化物
B:sp2杂化
(2) BX3性质:
BF3
室温下 聚集态
g
熔点/( /℃) -127.1
沸点/( /℃) -100.4
23-мар-22
BCl3 g
-107 12.7
BBr3
BI3
23-мар-22
无机化学
硼的制备 ➢ -菱形硼 12 BI3 = B12(s) + 18 I2(g) ➢无定形硼 Na2B4O7·10H2O+ 2HCl=4H3BO3+ 2NaCl+ 5H2O 2H3BO3 = B2O3 + 3H2O (800K) B2O3 + Mg = 3MgO + 2B (800K)
结构: B:sp2杂化
硼酸 H3BO3
引 导 语 : 心得 体会是 指一种 读书、 实践后 所写的 感受性 文字。 语言类 读书心 得 同 数 学 札 记相近 ;体会 是指将 学习的 东西运 用到实 践中去 。下面 是小编 为你带 来 的 医 生 的 岗前培 训心得 体会, 希望对 你有所 帮助。 从 那 天 起 ,我们 开始了 胸 科 医 院 的 培训, 前三天 的课程 让我懂 得了很 多以前 在书上 学不到 的东西 ,有院 领 导 的 亲 身 经历和 他们的 所见所 闻,对 医院的 故障制 度有了 一定认 识。这 次培训 中 我 学 到 了 很多知 识,但 感触最 深的是 每一位 领导基 本上都 提到一 个要求 ,那就 是 学 习 、 学 习、再 学习。 一刻也 不能放 松,不 仅要钻 研本专 业的知 识,还 要了解 其 他 专 业 的 知识, 比如说 我自己 ,就应 该多了 解医学 影像诊 断及技 术等方 面的知 识 ,这样 有利于 我提高 工作效 率与质 量。此 外,就 是希望 能尽快 地进入 工作状 态, 做 好 思 想 意 识的转 变,从 受者转 变成施 者。我 认为我 在这方 面做得 也比较 到位, 经 过 学 习 和 互动, 感觉现 在也慢 慢走上 正轨了 ,希望 我们能 脚踏实 地的工 作,养 成 良 好 的 工 作与生 活习惯 ,为自 己积累 资本、 为医院 创造价 值。 通 过 第 四和 第 五 天 的 培 训我明 白了什 么是沟 通,沟 通就是 人们在 互动过 程中通 过某种 途径将 一 定 的 信 息 从发送 者传递 给接收 者,并 获得理 解的过 程,双 方互动 的过程 。我们
1到12族元素-概述说明以及解释

1到12族元素-概述说明以及解释1.引言1.1 概述概述:元素是构成物质的基本组成单位,根据元素在周期表中的位置不同,可以分为不同的族。
本文将重点介绍1到12族元素,这些元素在化学性质上具有一定的相似性。
1到12族元素分别是氢、碱金属、碱土金属、硼族、碳族、氮族、氧族、氟族、稀有气体、过渡金属、镧系元素和锕系元素。
通过对这些族元素的了解,可以帮助我们更深入地理解元素之间的关系,预测它们的化学性质,以及应用它们在各种领域中的重要性。
本文将对1到12族元素的性质、用途以及未来研究方向进行综述,为读者提供更全面的知识。
1.2 文章结构文章结构部分的内容如下:文章结构部分将重点介绍本文的组织结构和内容安排。
本文将分为引言、正文和结论三个部分。
在引言部分,将对1到12族元素进行概述,并介绍本文的目的和结构。
接着,在正文部分将详细探讨1到4族元素、5到8族元素和9到12族元素的特点和性质。
最后,在结论部分将总结1到12族元素的特点,并提出未来可能的研究方向和结论。
通过以上结构安排,读者将能够系统全面地了解1到12族元素的相关信息,同时也能为今后的研究和探讨提供一定的参考依据。
1.3 目的:本文旨在系统地介绍1到12族元素的特点和性质,帮助读者全面了解这些元素在化学和物理方面的表现。
通过对这些元素进行分类和比较,我们可以更好地理解它们在元素周期表中的位置以及它们之间的关系。
同时,通过对不同族元素的性质和行为进行探讨,我们还可以更深入地探讨元素周期表的规律性和周期性。
最终,我们希望读者能够通过本文对1到12族元素有一个清晰的认识,为进一步研究和应用这些元素打下基础。
2.正文2.1 1到4族元素1到4族元素是元素周期表中的第一至第四主族元素,它们包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)、铍(Be)、镓(Ga)、铟(In)、铊(Tl)、硼(B)、铝(Al)、镧(La)等元素。
无机化学-硼族、碳族元素-氢化物 (1)

COCl2 光气 1 ; HCN 氰化氢
10
1
乙硼烷的成键特征
最简单的硼烷是B2H6 2BH3(g) = B2H6(g) △H=-148kJ·mol-1
HH HCCH
HH
HH
? H B B H?
HH
C has 4 valence e, H has 1, so C2H6 has enough electrons (8+6) for 7 (2c2e) bonds.
3.6 氢化物
组成:
BnHn+4
BnHn+6 [BnHn]2-
硼烷
共20多种
缺电子性
命名:同碳烷
B2H6 乙硼烷 ( B1~B10 甲、乙、…辛、壬、癸)
B16H20
十六硼烷 (B11以上:十一 …)
若原子数目相同,而H原子数目不同:
B5H9 B5H11
戊硼烷-9 戊硼烷-11
毒性大
空气中允许的最高浓度10-6(ppm) 0.1
Brust, M.; Walker, M.; Bethell, D.; Schiffrin, D. J.; Whyman, R. J. Chem. Soc.,Chem. Comm. 1994, 801-802.
Wuelfing, W. P.; Gross, S. M.; Miles, D. T.; Murray, R. W. J. Am. Chem. Soc.Байду номын сангаас1998, 120, 12696-12697.
B2H6 only has 6+6=12 electrons,
making an
ethane-like
structure impossible.
元素化学 硼族、碳族元素

(2)B、C族元素的成键特征 ) 、 族元素的成键特征
元素 B 成键特征 Al3+ sp CO、CO2 、 sp2
石墨, 石墨,大π
Al
C
Si
离子键
sp2 BF3 共价键
sp2 AlCl3
sp3 SiO2 硅氧四面体, 硅氧四面体, 巨型分子
缺电子特征: 缺电子特征: 桥键 配位键
(作为中心离子) 作为中心离子)
(1)性质 )
大多数硼烷易挥发(但B10H14的熔、沸点都较高 大多数硼烷易挥发( 的熔、 在常温下为固体) , 在常温下为固体); • 所有挥发性硼烷都有毒; 所有挥发性硼烷都有毒 有毒; 稳定性很 • 多氢的硼烷BnHn+6热稳定性很低; 多氢的硼烷B • 少氢的BnHn+4对热较稳定; 少氢的B 对热较稳定; • 几乎所有硼烷都对氧化剂极为敏感; 几乎所有硼烷都对氧化剂极为敏感; • 除B10H14 不溶于水且几乎不与水作用外 , 其他 不溶于水且几乎不与水作用外, 所有硼烷在室温都与水反应而产生硼酸和氢 ; •BnHn2 - 阴离子的化学性质比相应的中性硼烷稳 B 定。
2.B、Al的缺电子性质及对比: 、 的缺电子性质及对比 及对比: • 单质 的多中心键(缺电子之故); 单质B的多中心键 缺电子之故); 的多中心键( • 硼烷中的氢桥键与多中心少电子键; 硼烷中的氢桥键与多中心少电子键; • 硼酸的酸式电离: 硼酸的酸式电离: OH
B(OH)3 +H2O → [HO-B ← OH]- +H+
OH • 卤化硼和卤化铝的特征:为路易斯酸,可以形 卤化硼和卤化铝的特征:为路易斯酸, 成加合物。酸性: 成加合物。酸性:BF3>BCl3>BBr3>BI3(?)
无机化学课件第十章_p区元素

NaI+H2SO4(浓) == NaHSO4+HI↑ 8HI+H2SO4(浓) == H2S↑+4I2+4H2O
采用无氧化性、高沸点的浓磷酸代替浓硫酸即可。
(2)卤化氢的性质
Cl
Cl
Cl
Cl Cl
HH
O
N Cl
Cl Cl
-Cl -HO
H
.. N
Cl Cl
卤素含氧酸的酸性
各类卤素含氧酸根的结构(X 为 sp3 杂化)
氧化值: +1
HXO 次卤酸
+3 HClO2 亚卤酸
+5 HXO3 卤酸
+7 HXO4 高卤酸
以Cl的含氧酸和含氧酸盐为代表,将这些规律总结在下表: 氯的含氧酸和氯的含氧酸钠盐的性质变化规律
(3) 氢卤酸
氢卤酸强弱顺序为:HI>HBr>HCl>HF
HF 酸性最弱是因为F-是一种特别的质子接受体, 与 H3O+ 通过氢键结合成强度很大的离子对:即使在 无限稀的溶液中,它的电解度也只有15%,而HX 中 I- 半径最大,最易受水分子的极化而电离,因而HI是 最强的酸。
氢氟酸具有与二氧化硅或硅酸盐(玻璃的主 要成分)反应生成气态的SiF4特殊性质:
3、氧化数: ⑴常具有多种氧化数, 除正氧化数外,还有负氧化 数。
(2)IIIA~VA 从上到下低氧化数化合物的稳定 性增强(指氧化还原稳定性),高氧化数化合物的 稳定性减弱,位于下面的元素的高价化合物在一定 条件下表现强氧化性,低价表现弱还原性,这种现 象称“惰性电子对效应”。
碳族及硼族元素

可看作:PbO· PbO2
氧化铅:(PbO):橙黄色
小结:
氧化性减弱,酸性增强 Pb(OH)4 Sn(OH)4 PbO2 酸 性 增 强 Sn(OH)2 碱性增强,还原性减弱 碱 性 增 强 Pb(OH)2
4 锡、铅的盐类
水解:
BX3 3H 2 O H 3 BO3 3HX (X Cl, Br, I) 4BF3 3H 2 O H 3 BO3 3H[BF4 ] BF3 HF HF BF3
2 卤化硅 SiX4 SiF4 聚集态 分子量 g 小 SiCl4 l SiBr4 l SiI4 s 大
2PbS + 3O2 PbO + C Sn + CO2 2PbO + 2SO2 Pb + CO
1 锡、铅的氢氧化物
Sn
2
适量OH-
H+
适量OH-
Sn(OH)2 (s,白) Pb(OH)2 (s,白)
过量OH-
[Sn(OH)4 ]
[Pb(OH) ] 3
2-
P b2 Sn
过量OH-
HNO3或HAc
红宝石(Cr3+) 蓝宝石(Fe3+,Cr3+) 黄玉/黄晶(Fe3+)
2 氢氧化铝:Al(OH)3 两性, 在碱性溶液中存在[Al(OH)4]-或[Al(OH)6]33 简便书写为AlO2 或AlO3
3 铝的卤化物
AlF3 离子键 AlCl3 AlBr3 共价键 AlI3
共价分子:熔点低,易挥发,易溶于有机溶剂。
C60的制备
二 硼族元素概述
硼族(ⅢA):B, Al, Ga, In, Tl 价电子构型:ns2np1 缺电子元素:价电子数<价层轨道数 缺电子化合物: 成键电子对数<价层轨道数 例如:BF3,HBF4 特点:a. 易形成配位化合物HBF4 HF BF3
化学主族的名词解释

化学主族的名词解释化学主族是指元素周期表中IA、IIA、IIIA、IVA、VA、VIA、VIIA七个元素家族,它们分别是碱金属、碱土金属、硼族、碳族、氮族、氧族和卤族。
这七个家族具有一些共同的性质和特征,下面将对这些主要的化学主族进行逐一讨论。
1. 碱金属:碱金属主族包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素在周期表中位于第一群,它们都是最活泼的金属元素,通常以单质的形式存在。
它们具有低离化能、高电化学活性以及在水中放出氢气的特性。
由于活泼性很高,碱金属只存在于自然界中的化合物形式,如氯化钠和碳酸钠等。
2. 碱土金属:碱土金属主族包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素在周期表中位于第二群,它们的性质与碱金属相似,但比碱金属更稳定。
碱土金属具有高熔点和难溶于水的特性,因此常以氧化物或硫酸盐的形式存在。
3. 硼族:硼族主族包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)和镓(Nh)。
这些元素在周期表中位于第三族,它们的最外层电子配置为ns2np1。
硼族元素在化合物中通常表现为酸性物质,在水中具有一定的溶解性。
铝和铟是工业上广泛应用的金属,而硼则以它在玻璃和陶瓷制造中的应用而闻名。
4. 碳族:碳族主族包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和矾(Fl)。
这些元素位于周期表中的第四族,它们的最外层电子配置为ns2np2。
碳族元素在自然界中以广泛的形式存在,如碳是生命的基础,硅是地壳中第二丰富的元素。
碳素的特殊性质使得它形成了无数的有机化合物,使有机化学成为化学的重要分支。
5. 氮族:氮族主族包括氮(N)、磷(P)、砷(As)、锑(Sb)、锗(Bi)和鉅(Mc)。
这些元素位于周期表中的第五族,它们的最外层电子配置为ns2np3。
氮族元素的特点是在氧化还原反应中容易获取或丢失三个电子,因此它们在生物体系中起着重要的作用,如氮在蛋白质和核酸的构建中起着重要的作用。
大学无机化学—硼族元素备课笔记

可以 看出,硼族元 素的性质大都 是呈现出规律 性的变化,但 也有些异常现 象。电子亲和 能的异常变化 与卤素、氮族 元素以及碳族 元素类似,这
硼族元素原子的价电子层结构为 ns2np1,常见氧化态为+3 和+1,随原子序数的递增,ns2 电子对趋于稳定,特别是 6s 上的 2 个电子稳定性特别 强。使得从硼到铊高氧化数(+Ⅲ)稳定性依次减小,即氧化性依次增强;而低氧化数(+I)稳定性依次增强,其还原性依次减弱。例如:Tl(Ⅲ)是很强的 氧化剂,而 Tl(Ⅰ)很稳定,其化合物具有较强的离子键特性。
共熔
高温下下有氧化剂存在时,与碱反应; 2B + 2NaOH + 3KNO3
2NaBO2 + 3KNO2 + H2O
14.2.2.3 镓、铟、铊
镓、铟、铊都是比铅还要软的金属。液态镓的熔沸点差别是所有单质中最大的(m.p=29.78,b.p=2403).将液态镓充填在石英管中做成
的温度计,测量温区大。液态镓中有 Ga2 存在,所以其密度大于固态镓。镓和 As、Sb 作用形成的 GaAs、GaSb 是优良的半导体材料。稀散元素, 不存在独立的矿石,而与其它矿共生。这三种元素都由各自的光谱发现。
3 过滤、洗涤、干燥氢氧化铝,灼烧分解的到氧化铝;2Al(OH) 3 = Al2O3 + 3H2O
4 高温下点解由 Al2O3、冰晶石 Na3AlF6﹙2%-8%﹚及助熔剂萤石 CaF2﹙约 10%﹚的混合熔液制的单质铝;
14.2.1.3 单质镓的制备
镓是分散元素,通常以提取铝或锌“废弃物”为原料。如在用碱处理铝矾土时,镓转化为可溶的 Ga(OH) 3,由于其酸性强于 Al(OH)3,因此 在通 CO2 时 Al(OH)4先于 Ga(OH)4和 CO2 反应生成 Al(OH)3 沉淀, Al(OH)3 在 pH=10.6 时沉淀,而 Ga(OH) 3 开始沉淀的 pH=9.7,控制 pH 使 Al(OH)4 沉淀而 Ga(OH)4仍留在溶液中。这样 COH 就在溶液中富集,最后可得含 0.2%Ga2O 3(相当于 0.15%的 Ga)的 Al2O3
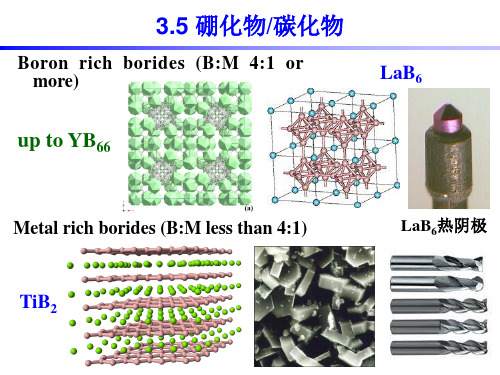
无机化学-硼族、碳族元素-硼化物、碳化物
碳化钨
C4-
6ห้องสมุดไป่ตู้位
N
Ph2P
N
N
Au
Au PPh2
Ph2P Au C Au PPh2
Au
Ph2P
Au
N
N
PPh2
N
+2Ag+ +2Cu+
王泉明 课题组
N
Ph2P
N
Ag
Au
N
Au PPh2
Ph2P Au C Au PPh2
Au
Ph2P N
Au
N
Ag
PPh2
N
Ph2P N
N
Cu
N
Ph2P
Au
Au
C Au
Au
PPh2 PPh2
Au
Ph2P N
Au
Cu
N
PPh2
N
CaO (s) + 3C (s) CaC2 (s) + CO (g) 2000oC Ca (l) + 2C(s) CaC2 (s) >2000oC 2Na (am) + C2H2 (g) Na2C2(s) + H2 (g)
碳化物
(2)共价型碳化物
B 和 Si 与碳形成机械硬度很大的共价型固体化合物 。 碳化硼和碳化硅是原子型晶体,都是硬质材料 。
(3)金属型碳化物
金属型碳化物具有金属的导电性和光泽。许多d区元素和f区 元素能形成金属型碳化物。 从价键的观点看,C 原子实际上进入金属原子空的d轨道而形 成的,金属原子空的d轨道越多,该金属与碳的结合力就越强, 它们的机械硬度和许多性质都表明存在强的M – C键 。 金属型碳化物是很有前途的硬质材料,但目前只有钨和钛的 碳化物 。
安徽高中化学竞赛-无机-11-第十一章 碳族和硼族元素(共321页PPT)

硼
硼砂
B
Na2B4O7•10H2O
硼镁矿 Mg2B2O5•H2O 等 硼在地壳中的质量分数 为 1.0 10-3 %
铝 Al 铝矾土 Al2O3•n H2O 铝硅酸盐矿物 铝在地壳中的质量分数
为 8.2 % 第3位
镓 Ga,铟 In,铊 Tl 分散、无富矿,
以硫化物形式存在
在地壳中的质量分数
固体 NaOH 吸收,得 CO。
工业上将空气和水蒸气交替 通入红热炭层,以制取含有 CO
气体的燃料气。
通入空气时发生的反应是 2 C + O2 —— 2 CO △rHm = - 221 kJ•mol-1
得到的气体体积组成为 CO 25%,
CO2 4%,N2 70% 。
这种混合气体称为发生炉煤气。
通入水蒸气时,发生另一反应
C + H2O —— CO + H2
△rHm = 131 kJ•mol-1
得到的气体体积组成为 CO 40%, CO2 5%,H2 50%。
这种混合气体称为水煤气。
发生炉煤气 CO 25%,CO2 4%,N2 70% 水煤气
CO 40%,CO2 5%, H2 50%
发生炉煤气和水煤气都是工
第十一章
碳族和硼族元素
碳 C
单质
石墨
金刚石
无机化合物 CO2 白云石 MgCa (CO3) 2 石灰石、大理石、方解石 CaCO3
有机化合物
动植物体中的含碳物质
煤,石油,天然气
碳在地壳中的质量分数
为 0.048 % 列第 15 位
硅
Si (曾叫做矽)
多以 Si-O-Si 键的化合态存在,
水晶、石英、SiO2
课件(温老师)-碳族硼族元素

溶剂热法 CCl4(l) + Na(s)
700℃ Ni-Co-Mn合金催化剂
非晶碳的金刚石
➢无定形碳(低结晶度碳) 炭黑(年产超过8×106t,94%用于橡胶制品的填料) 活性炭(高比表面积:400~2500 m2·g-1) 碳纤维(每架波音-767飞机需用1t 碳纤维材料)
形面,每个五边形均与5个六边形共边,而六边形则将12个五边形彼此
隔开. 与石墨相似,C60分子中每个C原子与周围三个C原子形成3个σ键 ,剩余的轨道和电子共同组成离域π键,可简单地将其表示为每个C原
子与周围3个C原子形成2个单键和1个双键。
(2)性质:金刚石的化学性质极稳定。石墨的化学性质总体
看来比较稳定,能形成类似 K+C8-这类化合物。 C60 室温下为 分子晶体(面心立方结构),能隙为1.5eV,这意味着固体 C60 为半导体。C60 的活泼性与分子中存在双键有关。用纯石墨作 电极,在 Ne 中放电,电弧中产生的碳烟沉积在水冷反应器的
感并用作润滑剂,但石墨是电
的良导体而后者是绝缘体。
石墨
B3N3H6 (无机苯) 立方氮化硼 六方氮化硼
8、自然存在和丰度
C,N,P是生物体的重要元素,C 与 O、H 形成的化合物 构成生物圈的主体 Si、O 形成的化合物构成地壳岩石圈的主体 。C以单质存在,其余大多以矿物形式存在,是 “稀散元素” 。
分子筛的功能和用途 离子交换功能 吸附功能 分离功能 催化功能
一个钠沸石笼
➢硅无机高分子
当今发展中的无机高分子材料有三大类:
R
R
O Si n
R
NP R
聚硅氧烷
聚磷腈
组成硅氧烷的基本结构单元为:
无机化学第十三章硼族元素

B2O3+ 3 H2O
2 H3BO3 (aq)
若水量不充足,如遇到热的水蒸气或潮气时
B2O3 + H2O ( g )
2 HBO2 ( g ) 18
硼酸具有片层状结构,层与层之间以分子间 力联系在一起。因此硼酸晶体有解理性,可作为 润滑剂。
H O
O B OH H
B:SP2杂化;存在分子间氢键
19
OH OH
铟
镓
铊
5
13 - 1 硼单质及其化合物
13 - 1 - 1 硼单质
1、 硼的同素异形体
α-菱形硼(B12)结构: 正二十面体
无定形硼
晶形硼
棕色粉末
黑灰色
化学活性高
硬度大
熔点,沸点都很高
6
3 硼单质的制备
工业上采用碱法分解硼镁矿制备硼单质
Mg2B2O5 H2O 2NaOH 2NaBO2 2Mg(OH )2 4NaBO2 CO2 10H2O Na2B4O7 10H2O Na2CO3 Na2B4O7 H2SO4 5H2O 4H3BO3 Na2SO4 2H3BO3 B2O3 3H2O B2O3 3Mg 2B 3MgO
11
⑤硼的氮化物
B2H6与NH3在873K反应,可生成BN
BN与C2是等电子体,结构相似,性质相似: BN有三种晶型: •无定形 (类似于无定型碳) •六方晶型 (类似于石墨) 作润滑剂
•立方晶型 (类似于金刚石)
作磨料、坩埚材料 12
2、 硼烷的结构
最简单的硼烷是 B2H6
2 BH3(g) = B2H6(g) △rH = -148 kJ·mol-1
H3BO3是Lewis酸,是一元酸。
OH
B
+ H2O
主族元素速记方法

主族元素速记方法主族元素是指周期表中1A到8A族的元素,也称为典型元素。
它们的化学性质相对固定,所以学习主族元素的速记方法对于化学学习非常重要。
下面将介绍一些常用的主族元素速记方法。
1. 1A族元素(碱金属)1A族元素包括锂、钠、钾等,它们的电子层中只有一个电子。
我们可以用“鲁钠钦”来记忆它们的顺序,即锂(Li)、钠(Na)、钾(K)。
这个速记方法的关键词“鲁钠钦”与元素符号“LiNaK”谐音,很容易记忆。
2. 2A族元素(碱土金属)2A族元素包括镁、钙、锶等,它们的电子层中有两个电子。
我们可以用“蚂蚁蜀黍”来记忆它们的顺序,即镁(Mg)、钙(Ca)、锶(Sr)。
这个速记方法的关键词“蚂蚁蜀黍”与元素符号“MgCaSr”谐音,容易记忆。
3. 3A族元素(硼族元素)3A族元素包括硼、铝、镓等,它们的电子层中有三个电子。
我们可以用“北鹿公”来记忆它们的顺序,即硼(B)、铝(Al)、镓(Ga)。
这个速记方法的关键词“北鹿公”与元素符号“BAlGa”谐音,方4. 4A族元素(碳族元素)4A族元素包括碳、硅、锗等,它们的电子层中有四个电子。
我们可以用“瓜瓜豆”来记忆它们的顺序,即碳(C)、硅(Si)、锗(Ge)。
这个速记方法的关键词“瓜瓜豆”与元素符号“CSiGe”谐音,容易记忆。
5. 5A族元素(氮族元素)5A族元素包括氮、磷、砷等,它们的电子层中有五个电子。
我们可以用“你普舒”来记忆它们的顺序,即氮(N)、磷(P)、砷(As)。
这个速记方法的关键词“你普舒”与元素符号“NPAs”谐音,简单易记。
6. 6A族元素(氧族元素)6A族元素包括氧、硫、硒等,它们的电子层中有六个电子。
我们可以用“氧狗三”来记忆它们的顺序,即氧(O)、硫(S)、硒(Se)。
这个速记方法的关键词“氧狗三”与元素符号“OSSe”谐音,容易记忆。
7. 7A族元素(卤素)7A族元素包括氟、氯、溴等,它们的电子层中有七个电子。
我们可以用“风气洞”来记忆它们的顺序,即氟(F)、氯(Cl)、溴(Br)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
AlCl3的成键特征
AlCl3中铝为sp3杂化
AlCl3路易斯酸
(GaCl3)2 (InCl3)2 (AlBr3)2 (AlI3)2 (GaBr3)2 除B的卤化物及ⅢA的氟化物以外, 均形成二聚体
4
含低价Ga、In、Tl的卤化物
GaCl2 InCl2 反磁
Ga+[Ga+3Cl4] ||
4s2 4s04p0
SnCl4+4NH3 + 4H2O → Sn(OH)4 + 4NH4Cl
2. 用于制作FTO导电玻璃, FTO玻璃可以做为ITO导电 玻璃的替换用品.
SnCl4+2 H2O SnO2+4HCl
SnCl4 + 2 HCl H2SnCl6
7
共价化合物的水解性
(1)影响共价化合物水解因素
① 中心原子价层结构(中心原子所处周期、配位情 况、空轨、半径大小等)。
② 空间效应(中心原子半径、配体的大小和数量)。 ③ 电负性效应(中心原子与配体电负性的差异)。
(2)机理
8
CCl4 不水解 SiCl4水解 SiCl4+H2O → H4SiO4+4HCl
+H2O
-HCl
H2O +HCl
四步水解 H4SiO4+4HCl
9
NF3 不水解; PF3水解
→ + H2O
Tl+类似于K+与Ag+
TlAl(SO4)2·12H2O TlI黄红沉淀
Tl2CO3与K2CO3同晶 TlBr黄沉淀
TlOH 强碱
TlCl白沉淀
惰性 电子对效应 Tl(Ⅲ)不稳定
5
SiCl4 / GeCl4
硅常见的卤化物有SiCl4 、SiF4,它们均强烈水解: 3SiF4+4H2O = H4SiO4+4H++2SiF62SiF4 +2HF = H2SiF6 SiCl4+H2O = H4SiO4+HCl
3.7 卤化物
BX3(X = F, Cl, Br,I) 的成键特征
熔点(K)
BF3 (g) 146
BCl3 (l) 166
BBr3(l) 227
沸点(K)
172
285
364
键长(pm)(实测) 131
174
189
共价半径和(pm) 153
180
195
键能(kJ·mol-1) 646
444
368
BI3(s) 316 483
210 214 267
1
BX3
BX3是以形成大∏键来满足对电子的要求 由于有空轨道,可接受外来电子,均为路易斯酸
Π
6 4
BF3+NH3=F3B:NH3; BF3+ HF = H+[BF4]-
2
三氯化铝的制备与性质
无水AlCl3的制备 2Al+3Cl2→2AlCl3 2 Al + 6 HCl → 2 AlCl3 + 3 H2 Al2O3+3C+3Cl2→2AlCl3+3CO
性质: 1) 共价分子不仅溶于水也溶于几乎所有的有机溶剂; 2) AlCl3在水中强烈水解,甚至空气中遇水会强烈冒烟。 常430c温-04℃e下键时纯(气A椅l态C式l3A结为lC构无l3)具色,有晶在双体80聚,0分℃加子时热缔双到合原18结子0℃构分时。子升其即华中完,有全在两分个 解,发生水解作用 并析出锡酸,继续加蒸馏水生 成五水合四氯化锡,溶于水,电 离产生[Sn(H2O)5]4+离子
无水SnCl4是强Lewis acid
锡酸: SnO2的水合物 H2SnO3的一种形式
1. 氯化锡蒸气与氨、水汽混合,生成氢氧化锡及氯化 铵之微粒而呈浓烟状 烟幕弹。
H2O
→
BCl3 水解
P(OH)3+3HF
SF4 水解 SF4(g)+H2O → H2SO3+4HF
SF6 不水解
冷水
TeF6 水解 TeF6+6H2O
H6TeO6+6HF
10
