考前复习方略 专题5 两类重要反应的考法归纳_图
2024年高考化学复习都有重点知识网络图一目了然

2024年高考化学复习都有重点知识网络图一目了
然
同学们在学习化学的时候最重要的还是思维导图的建立,每时每刻都在脑海中构建自己的知识脉络,下面给大家介绍一些高中化学知识网络专题,希望大家可以将自己的知识串联,汇总成自己的知识殿堂。
一、化学实验
二、溶液和胶体
三、物质的分类
四、化学反应类型
五、元素及其化合物
六、物质结构与元素周期律
七、化学用语和化学计量
八、化学计算
九、化学反应速率和化学平衡
十、电解质溶液
十一、有机化合物。
高考热点课化学反应速率和化学平衡图像解题方法课件高考化学创新复习优秀课件

第 高7考章热点高课考化热学点反课应5 速化率学和反化应学速平率衡和图化像学解平题衡方图法像课解件题高方考法化学课创件新复20习21优届秀高考 p p化t课学件创新复习(共61张PPT)
速率变化图像 1.速率—时间图像“断点”分析 当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,都可能 使速率—时间图像的曲线出现不连续的情况,即出现“断点”。根据“断 点”前后的速率大小,即可对外界条件的变化情况作出判断。如图,t1 时刻 改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质 的量不变的反应)。
第 高7考章热点高课考化热学点反课应5 速化率学和反化应学速平率衡和图化像学解平题衡方图法像课解件题高方考法化学课创件新复20习21优届秀高考 p p化t课学件创新复习(共61张PPT)
解析
第 高7考章热点高课考化热学点反课应5 速化率学和反化应学速平率衡和图化像学解平题衡方图法像课解件题高方考法化学课创件新复20习21优届秀高考 p p化t课学件创新复习(共61张PPT)
解析
[答案] (1)A+3B 2C (2)vⅠ(A)>vⅡ(A)>vⅢ(A) (3)0.05 mol·L-1·min-1
答案
(全国卷Ⅱ)在容积为 1.00 L 的容器中,通入一定量的 N2O4,发 生反应 N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
在 0~60 s 时段,反应速率 v(N2O4)为________mol·L-1·s-1。
答案 0.0010 解析 由题图可知,0~60 s 时段,N2O4 的物质的量浓度变化为 0.060
mol·L-1,v(N2O4)=0.060 mol·L-1=0.0010 mol·L-1·s-1。
解析 答案
高考化学反应方程式的记忆方法

高考化学反应方程式的记忆方法对于即将参加高考的学生来说,化学学科中的化学反应方程式是一个重要且具有一定难度的部分。
掌握好化学反应方程式,不仅对于理解化学原理至关重要,也是在考试中取得高分的关键。
然而,记忆这些方程式并非易事,需要运用一些有效的方法。
首先,理解反应原理是基础。
很多同学在记忆方程式时,只是死记硬背,这样不仅效率低下,而且容易遗忘和混淆。
要真正记住一个化学反应方程式,必须理解其背后的反应原理。
比如,氧化还原反应中电子的转移、酸碱中和反应中氢离子和氢氧根离子的结合等。
以铁与硫酸铜溶液的反应为例,Fe + CuSO₄= FeSO₄+ Cu,我们要明白铁的还原性比铜强,所以铁能够将铜离子从溶液中置换出来,生成亚铁离子和铜单质。
当我们理解了这样的反应本质,记忆方程式就会变得更加轻松和牢固。
分类归纳是一种非常实用的方法。
化学中的反应方程式种类繁多,我们可以将它们按照不同的类型进行分类。
比如,可以分为化合反应、分解反应、置换反应、复分解反应等。
在每一类反应中,又可以进一步细分。
例如,在氧化还原反应这一大类中,再分为金属与非金属的氧化还原反应、金属与盐溶液的氧化还原反应等。
通过分类归纳,我们能够发现不同反应之间的规律和相似之处,从而有助于记忆。
制作记忆卡片也是一个不错的选择。
将每个化学反应方程式写在一张卡片上,一面写方程式,另一面写反应的条件、现象以及相关的知识点。
这样,我们可以随时随地拿出来进行复习。
在复习的时候,可以先看方程式,尝试回忆反应条件和现象等内容,然后再翻面进行核对。
这种反复的记忆强化,能够让我们更加深刻地记住这些方程式。
多做练习题也是巩固记忆的重要途径。
通过做题,我们能够更加熟悉各种化学反应方程式的应用场景。
在做题的过程中,我们会不断地运用所学的方程式来解决问题,从而加深对它们的理解和记忆。
而且,做题还能够帮助我们发现自己在记忆和理解方面的不足之处,及时进行查漏补缺。
联想记忆法也能发挥很大的作用。
化学图像知识清单 一二本冲刺的关键秘诀

化学图像知识清单 一二本冲刺的关键秘诀!一、“v ~ t ”图:以反应 mA(g)+nB(g)pC(g)+qD(g)△H 为例 反应开始的瞬间,V(正)反应速率最大,V(逆)反应速率从零开始,随着反应的进行,V(正)逐渐减小,V(逆)速率逐渐增大,因为 。
一下为改变某一外界条件所造成的影响,请根据图像,写出改变的具体条件,和平衡移动方向。
1、改变浓度图1 图2 图3图4 图5 图62、改变温度图7 图8 图9图103、改变压强(需表明系数的关系)图11 图12 图13图14 图154、“v ~ T(或P)”图,以反应mA(g)+nB(g) pC(g)+qD(g) △H 为例:△H 0二、转化率(或百分含量)-温度(或压强)图对于反应mA(g)+nB(g) pC(g)+q(g) △H 根据以下两个图,判断正反应方向为放热或吸热,并比较m+n 与p+q 的关系。
三、转化率(或百分含量)-时间-温度(或压强)图:对于反应mA(g)+nB(g) pC(g)+q(g) △H 判断正反应方向为放热或吸热,并比较m+n 与p+q 的关系。
例一、对于反应mA(g)+nB(g) pC(g)+qD(g)例二:反应2X(g)+Y(g) 2Z(g);△H<0,在不同温度(T1和T2)及压强(P1和P2)下,产物Z 的物质的量n(Z)与反应时间t 的关系如图所示,下述判断正确的是( )A 、T1<T2,P1<P2B 、T1<T2,P1>P2C 、T1>T2,P1>P2D 、T1>T2,P1<P2例三:如图所示,a 曲线表示一定条件下可逆反应:X(g)+Y(g) 2Z(g)+W(s) △H <0的反应过程中X 的转化率和时间的关系.若使a 曲线变为b 曲线,可采取的措施是( )T T T t •正反应 热 m+np+q •正反应 热t m+n p+qA.加入催化剂B.增大Y 的浓度C.降低温度D.增大体系压强例四:同压、不同温度下的反应:A (g )+B (g ) C (g )△H ;其中 A 的含量和温度的关系如图3所示,下列结论正确的是 ( )A .T1>T2, △H <0B .T1<T2, △H <0C .T1>T2, △H >0D .T1<T2, △H >0例五:对于2A(g)+B(g) C(g)+3D(g)(正反应吸热图中Y 轴可能表示:( ) A 、B 物质的转化率B 、正反应的速率C 、平衡体系中的A%D 、平衡体系中的C%例六:1)写出化学反应方程式:2)求反应物的转化率:例七:如图表示反应N2(g)+3H2(g) 2NH3(g); △H<0 在某一时间段中反应速就率与反应过程的曲线关系图,则图中氨的百分含量最低的时间段是:( ) A .t0-t1 B .t2-t3C .t3-t4D .t5-t6例八:可表示为可逆反应2A(g)+B(g) 2C(g) △H < 0的图象是( )tTP 3A B C tct t t t t t。
中考复习专题常见的化学反应类型

2016中考复习专题 常见的化学反应类型反应类型 概念举例表达式 化合反应 两种或两种以上的物质,生成一种物质的反应CaO +H 2O Ca(OH)2A+B→AB 分解反应一种物质生成两种或两种以上物质的反应2KMnO 4K 2MnO 4+MnO 2+O 2↑AB→A+B置换反应一种单质和一种化合物生成另一种单质和另一种化合物的反应Zn+H 2SO 4ZnSO 4+H 2↑A+BC→AC+B复分解反应两种化合物互相交换成分,生成另外两种化合物的反应NaCl+AgNO 3AgCl↓+NaNO 3AB+CD→AD+CB二、其他反应类型 1.非基本反应类型(1)氧化反应 有机物的燃烧:CH 4+2O 2点燃CO 2+2H 2O(2)非氧化反应 碱和非金属氧化物的反应:Ca(OH)2+CO 2CaCO 3↓+H 2O (3)氧化-还原反应 一氧化碳还原金属氧化物:CuO +CO Cu +CO 22.中和反应(属于复分解反应) NaOH +HClNaCl +H 2O类型1 基本反应类型(2015·宜宾)下列有关化学反应,对其反应类型的判断,正确的是( ) ①CuO +2HCl===CuCl 2+H 2O ②3CO +Fe 2O 3=====高温2Fe +3CO 2 ③Cu +2AgNO 3===Cu(NO 3)2+2Ag ④C +CO 2=====高温2COA .①是分解反应B .②是置换反应C .③是复分解反应D .④是化合反应思路点拨:①属于复分解反应;②属于氧化还原反应,不属于基本反应类型;③属于置换反应;④属于化合反应。
通式 特点 化合反应 A +B +…=C 多变一 分解反应 C =A +B +… 一变多 置换反应 A +BC =B +AC 单换单 复分解反应AB +CD =AD +CB双交换,价不变类型2 中和反应关于中和反应的说法,错误的是( )A .一定没有沉淀生成B .一定有氧化物生成C .一定是放热反应D .一定是复分解反应思路点拨:运用中和反应是酸和碱反应生成盐和水的反应,盐有可能是沉淀;水属于氧化物;中和反应会放出热量;两种化合物相互交换成分生成另外两种化合物的反应是复分解反应,中和反应属于复分解反应。
高考化学知识地图-化学反应与能量-概念图-备考攻略
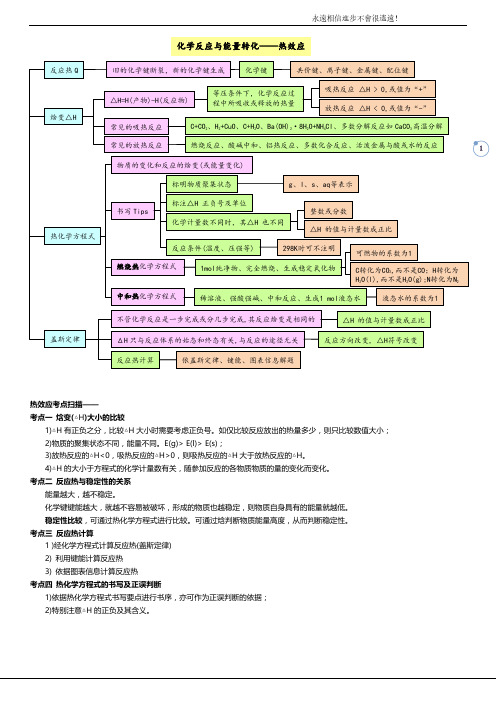
化学反应与能量转化——热效应
热效应考点扫描——
考点一焓变(△H)大小的比较
1)△H有正负之分,比较△H大小时需要考虑正负号。
如仅比较反应放出的热量多少,则只比较数值大小;
2)物质的聚集状态不同,能量不同。
E(g)> E(l)> E(s);
3)放热反应的△H<0,吸热反应的△H>0,则吸热反应的△H大于放热反应的△H。
4)△H的大小于方程式的化学计量数有关,随参加反应的各物质物质的量的变化而变化。
考点二反应热与稳定性的关系
能量越大,越不稳定。
化学键键能越大,就越不容易被破坏,形成的物质也越稳定,则物质自身具有的能量就越低。
稳定性比较,可通过热化学方程式进行比较。
可通过焓判断物质能量高度,从而判断稳定性。
考点三反应热计算
1 )经化学方程式计算反应热(盖斯定律)
2) 利用键能计算反应热
3) 依据图表信息计算反应热
考点四热化学方程式的书写及正误判断
1)依据热化学方程式书写要点进行书序,亦可作为正误判断的依据;
2)特别注意△H的正负及其含义。
化学反应与能量转化——电解。
高考化学:最全的高中化学思维导图,学霸都是这样复习的!

高考化学:最全的高中化学思维导图,学霸都是这样复习的!
临近高考,许多孩子不知道怎么处理最后的时间,觉得这点时间复不复习对自己最后的成绩影响不大。
老师要告诉家长的是,其实不然,最后的复习时间如果能好好利用,效果一定是之前的3到4倍。
因为这段时间,孩子的神经处于高度紧绷。
人在专注力集中的时候无论做什么事,效率都比以前做同样的事高很多。
化学,有点类似理科中的文科,有很多公式需要记忆,无归纳性的死记硬背,不但容易忘,还会在做题时运用得很慢。
高考做题的时间都是分秒必争的。
我们通过一定的方法(思维导图记忆法),整体记忆这些公式,考试时看到题就能想起,可以节省非常多的时间。
同学们还能利用剩余时间对之前做的题进行检查。
如此一来,分数自然领先旁人。
下面分享22张化学思维导图,同学好好记忆理解抓紧最后时间提升自己!
预祝同学们高考顺利,接下来我还会分享高考的知识归纳总结,另:
如果您的孩子存在记忆力差,学习成绩难以提升,学习方法不正确,严重偏科等这些问题,都可以通过下面的微信找我。
作为一名资深老师,我在朋友圈每天都会分享一些关于教育、学习方法、记忆训练的文章,帮您分析孩子学习过程中的问题。
