工程热力学2 温度与热力学第零定律详解共23页
第二章 热力学第零定律和温度(2011)

pC = f BC ( pB ,VB ,VC )
此时,若 C 与 A 热接触的状态和与 B 接触的状态没有改变的化,则由热平衡定律可知,A 与 B 也是处于热平衡状态的,故有
f AC ( pA,VA,VC ) = f BC ( pB ,VB ,样一件事,即 A 与 B 是处在热平衡状态的,它们是等当的,故VC 应消去,因此有
θ(X) = X θ ( X tr ) X tr
由于规定了θ ( X tr ) = 273.16 K ,所以
至此我们可以确定常数 a
θ ( X ) = 273.16 K X X tr
a = 273.16 K X tr
注意:如果规定某一物质的某种属性随温度作线性变化,从而建立了温标,则其他测温属性 一般不再与温度成严格的线性关系。
in thermal equilibrium with each other。
比较:两块铁 A,B 都能被磁铁 C 相吸引,但 A 和 B 并不一定能相吸引。
2.2.3 温度的概念
温度——宏观性质:
热力学第零定律为建立温度概念提供了实验基础,这个定律反映出,处于同一热平衡态
的所有热力学体系都具有某一共同的宏观性质(就象液体体系的体积这一宏观性质一样,若
两物体的状态可以完全独立地改变的隔离物称为绝热壁(adiabatic wall),相反,两物体的 状态参量之间不能独立变化的隔离物称为透热壁(diathermic wall)。
p1,V1
p2 ,V2
绝热壁
p1,V1
p2 ,V2
透热壁 2.2.2 热力学第零定律
实验表明:一般说来,两个物体进行热接触,其平衡态都会受到破坏,状态也会发生变 化。但经过足够长时间之后,它们的状态便不再发生变化,而达到一个共同的平衡态,此时,
《工程热力学》第二章—热力学基本定律

五、功量与热力过程直接相关
在既定的始、终状态之间,可以有许多过程途径。 在既定的始、终状态之间,可以有许多过程途径。不同 过程中的功量交换是完全不同的。 过程中的功量交换是完全不同的。即:功的大小除与过程的 有关——功 初、终状态有关外,还与描述过程的函数p=f(v)有关 终状态有关外,还与描述过程的函数 有关 功 过程量。 而不能用dw表示 是一个过程量 微元过程功只能用δw而不能用 表示, 是一个过程量。微元过程功只能用 而不能用 表示,即
在孤立系统中,能的形式可以相互转换, ● 在孤立系统中,能的形式可以相互转换,但能 的总量保持不变。 的总量保持不变。 第一类永动机是不可能制成的。 ● 第一类永动机是不可能制成的。 ● 工程热力学中常以热力系统为对象来研究能量 的传递、转换和守恒。 的传递、转换和守恒。 对任一热力系统,热力学第一定律可表述为: ● 对任一热力系统,热力学第一定律可表述为: 进入系统的能量 - 离开系统的能量 = 系统中储存能量的变化
无论哪一种情况, 无论哪一种情况,当系统与外界发生功量 交换时,总与系统本身所经历的过程有关。 交换时,总与系统本身所经历的过程有关。
三、功量交换的基本表达式
δW = F • dx
W = ∫ F ( x)dx
x1
x2
热力学最常见的功——容积功 容积功 热力学最常见的功
δW = F • dx = pA • dx = pdV
宏观位能(位能):系统在外力场作用下, ):系统在外力场作用下 ◆ 宏观位能(位能):系统在外力场作用下,相对于 某参考坐标系中某一位置所具有的能量。 某参考坐标系中某一位置所具有的能量。
E p = mgz
二、内能
储存于系统内部的能量称为内能 内能, ● 储存于系统内部的能量称为内能,内能与物质 的分子结构和微观运动形式有关。 的分子结构和微观运动形式有关。 ● 对于闭口系统来说,工质经历一个循环之后又 对于闭口系统来说, 回复到原来的状态, 回复到原来的状态,所以系统储存能量的变化为 零,即:进入系统的能量(吸热量)等于离开系 进入系统的能量(吸热量) 统的能量(对外做功量)。 统的能量(对外做功量)。
工程热力学2 温度与热力学第零定律详解23页PPT

▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
工程热力学2 温度与热力学第零定律 详解
51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用的 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律 的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!
23
《高等工程热力学》02热力学温标
,
t3
)
Q1 Q3
= ψ (t1,t3 )
Q2 T2
C
WC
Q1 = Q1 Q2 Q3 Q2 Q3
ψ (t1, t3 ) = ψ (t1, t2 ) ×ψ (t2 , t3 )
Q2
WB B Q3
Q3
因此有:ψ (t1,t2 ) =
f (t1 ) f (t2 )
ψ (t2 , t3 ) =
f (t2 ) f (t3 )
国际温标的发展
1976年0.5 K到30 K的暂行温标(EPT-76)
z 明显减小了原有定义中30 K以下温度的偏差; z 填补了5.2 K到13.8 K之间的空隙; z 设计了11个参考点和一个热力学内插仪器; z 但由于缺乏内部一致性,各复现之间可能出现
细微的含糊。
18
温度与热力学第零定律
1990年国际温标(ITS-90)
z 调整了多个固定点的取值和内插公式; z 定义了0.65 K以上全部温度范围,全量程均非常接近
于热力学温度的最佳估计值,但远比直接测量热力学 温度方便得多。
19
温度与热力学第零定律
1990年国际温标(ITS-90)
主要特点:
z 规定了多个固定点温度; z 0.65到5.0K的蒸气压测量 ; z 从3.0到24.5561K用氦气定容温度计测量 ; z 13.8033到1234.93K用按照技术规范在表中的固
2016-9-7
温度和热力学第零定律
温度与热力学第零定律
温度的定义
人们的经验:温度是表征物体冷热程度的 物理量
z 同样温度,不同人感觉不同; z 冬天相同温度下,铁比木头凉,人的感觉还和
导热系数等因素有关;
(NEW)毕明树《工程热力学》(第2版)笔记和课后习题详解

理论基础。
② 这些转换过程都是借助特定的工质(工作介质)实现的,不同的 工质具有不同的性质,能量转换条件及结果也有差异,因此必须研究工 质的热力性质。
③ 能量间的转换是通过各种设备(压缩机、合成塔等)实现的,能 量装置的设计过程首先要进行装置的能量衡算,因此对典型过程及循环 进行热力分析与计算是工程热力学的重要内容。
② 广度参数
在给定状态下,与系统内所含物质数量有关的参数称为广度参数, 如容积、能量、质量等。这类参数具有加和性,即整个系统的广度参数 等于各子系统同名广度参数之和。无论系统均匀与否,广度参数具有确 定的值。
通常,广度参数以大写字母表示,而由它们转化而来的比参数以相 应的小写字母表示。习惯上常把比体积以外的其他比参数的“比”字省 略。
5.1 复习笔记 5.2 课后习题详解 第六章 热力循环 6.1 复习笔记 6.2 课后习题详解 第七章 溶液热力学与相平衡基础 7.1 复习笔记 7.2 课后习题详解 第八章 热化学与化学平衡 8.1 复习笔记 8.2 课后习题详解
绪 论
0.1 复习笔记
【知识框架】
【重点难点归纳】 一、热能及其利用 1.热能 (1)一次能源。指自然界中以自然形态存在的可资利用的能源,如 风能、水力能、太阳能、地热能、燃料化学能、核能等。这些能量,有 些可以以机械能的形式直接被利用,有些需经过加工转化后才能利用。 (2)二次能源。指由一次能源加工转化后的能源。各种能源及其转 换和利用情况大致如图0-l所示。 由图0-1可见,热能是由一次能源转换成的最主要形式,而后再由 热能转换成其他形式的能量而被利用。据统计,经热能这个环节而被利 用的能量在世界上占85%以上。
量,压力计的指示值为工质绝对压力与压力计所处环境绝对压力之差。 一般情况下,压力计处于大气环境中,受到大气压力pb的作用,此时压 力计的示值即为工质绝对压力与大气压力之差。当工质绝对压力大于大 气压力时,压力计的示值称为表压力,以符号pg表示,可见
热力学第零定律

§1 热力学系统概述 §2 热力学第零定律 §3 物态方程
§1 热力学系统概述
一、热力学系统
由大量微观粒子组成的、有明确界面的连续介质系统。
(界面可以是真实的,也可以是虚拟的,即认为划定的。)
系统 外 界
孤立系统: 无能量、物质交换。
封闭系统: 有能量交换、无物质交换
开放系统: 能量、物质交换。
p 0 V m 0/xR T
xm 0 R T 0
p 0 V
m R p V Tm p 0 R 0 V T 0p p 0 T T 0m 0
由题意, T T0
m p p 0 m 0 1 .0 5 1 .3 0 2 5 1 0 1 4 0 5 1 .0 g 0 .4 9 3 g
三、实际气体的物态方程 1、范德瓦耳斯方程 考虑到分子间的引力和斥力作用,把理想气体方程 进行了修正。
3、 热力学温标 与具体的测温物质的属性无关,是一种理论温标。 在理想气体温标适用的温度范围内,理想气体温 标是热力学温标的具体实现方式。(第三章介绍)
4、国际温标
1927年开始建立国际实用温标.几经修改,现在国际 上采用的是1990年国际温标(ITS--90)。
1K定义为水的三相点温度的1/273.16。
T = t+273.15(k)
§3 物态方程之间满足一定的函 数关系。
处于热平衡的热力学系统具有确定的温度,而且温 度是状态参量的函数:
T = T(x、y) 上式可改写为: f(T、x、y)= 0
系统的物态方程
一、气体定律(实验定律)
1.玻意耳定律(1662) PVC
3、各向同性固体与液体的物态方程
各向同性固体和液体同气体一样,也可以用p,V作 状态参量描述一定质量的系统状态。
ch.1-2 热力学第零定律和温度

例如,对用摄氏温标标度的水银温度计来说, (a)测温物质:水银; 测温属性:水银的体积随温度的变化特性 (b)规定固定点: 按照摄氏温标的标度法,取标准大气压下溶解着的冰的 温度为0“度”,标准大气压下沸腾的纯净水的温度为 100“度”。 (c)对测温属性随温度的变化关系作出规定: 冰点和汽气点之间100等分。这种标度方法实际上是假 定了水银的测温属性随温度的变化关系是线性的。
1854年,开尔文(Kelvin,lord )在热力学第二定律的 基础上引入了一种不依赖于任何具体物质特性的温标,称 为开尔文温标或热力学温标。 由于这种温标取热力学上所能达到的最低温度为零度, 所以又称为绝对热力学温标或简称绝对温标。 热力学温标已成为热力学理论和近代科学广泛使用的标 准温标。应当指出,热力学温标只是一种理论温标。 可以证明,理想气体温标在其可以使用的温度范围内与 热力学温标是一致的,所以可用理想气体温标来实现热力学 温标。
(2)理想温标
理想温标是指与测温物质和测温属性无关的温标,理 想气体温标和热力学温标(也称开尔文温标或绝对温标) 便属于这类温标。
1)理想气体温标 (a)定容气体温度计 理想气体温标是通过气体温度计来实现的。气体温度 计有定容和定压两种,实践上多使用定容气体温度计。定 容气体温度计保持气体的体积不变,以气体的压强作为测 温属性。
(b)理想气体温标
实验表明,当气体温度计测温泡中的气体压强降 低时,不同测温物质和不同测温属性引起的差别将逐 渐消失。在压强趋于零的极限下,它们趋于一个共同 的极限温标,这个极限温标称为理想气体温标,由它 计量的温度用T来表示。
p T 273.16K lim ptr 0 p tr
(1.2.9)
我们把表征达成平衡的诸热力学系统的共同性质的物 理量叫做温度。 显然,一切互为热平衡的系统应当具有相同的温度。 热力学第零定律不仅给出了温度的概念,也给出了比 较不同物体的温度的方法。由于处于热平衡的物体具有相 同的温度,所以在比较两个物体的温度时不需要两物体直 接进行热接触,只需取热容量较小的第三个物体作为衡量 标准,让它分别与两个待测物体进行热接触就行了。这个 被取为衡量标准的物体就是温度计。
工程热力学第二章教材

First Law Of Thermodynamics
第一章内容回顾
一、本章基本公式列表于1-1,在学习中应熟练掌握。
表1-1 第一章的基本公式
v V m m v p pb p e p pb p v t T 273.15K W1 2. Q1 2 或 或 或 T t 273.15K w1 2 q1 2
二、迁移能——功量和热量
功量和热量都是系统与外界相互作用所传递的能量,而不 是系统本身所具有的能量(如热力学能、宏观动能和重力
位能等),其值并不由系统的状态确定,而是与传递时所
经历的具体过程有关。 功量和热量不是系统的状态参数,而是与过程特征有关的过 程量,称为迁移能。
三、功量
热力系与外界发生功的作用有多种形式,包括容积功、 推动功、流动功等。
pb
f
传热(不需要物体的宏观位移):当热源与工质接触时,接
触处两个物体中杂乱运动的质点进行能量交换,结果高 温物体把能量传递给低温物体
作功过程往往伴随着能量形态的转化:
工质膨胀过程:热力学能→机械能 工质压缩过程:机械能→热力学能 热能转化为机械能的过程包括两类过程: (1)能量转换的热力学过程:由热能传递转变为工质的热 力学能,然后由工质膨胀把热力学能变为机械能,转换过 程中工质的热力状态发生变化,能量的形式也发生变化; (2)单纯的机械过程:由热能转换而得的机械能再变成活 塞和飞轮的动能,若考虑工质本身的速度和离地面高度的变 化,则还变成工质的宏观动能和位能,其余部分则通过机器 轴对外输出。
第二章 热力学第一定律
First Law Of Thermodynamics
本章的基本要求
深入理解热力学第一定律的实质; 掌握能量、储存能、热力学能、迁移能、焓的概念及计算式; 掌握体积变化功、推动功、轴功和技术功的概念及计算式; 熟练掌握热力学第一定律的基本能量方程式(闭口系统和开口 系统),能够正确、灵活地应用热力学第一定律表达式来分析 计算工程实际中的有关问题。
热力学第零、一、二、三定

热力学第零、一、二、三定热力学第0定律:热力学共有四大定律,其中热力学第0定律是莱布尼茨定律或熵-热量定律,它提出,万事万物的状态、过程以及环境所可取得的熵积累都是不变的,也就是所谓的熵守恒定律,这是热力学的基础定律。
如果将物质的原子、分子等基本组成空间的状态比较自由,那么其自发地向熵增大的方向发展,即自发地进入更高的熵状态,直至某一极限,它就会变成完全混乱的状态,最终只剩下温度、压强、物质的量以及流量等大量物理量,熵就变成不变的数量,即守恒定律。
热力学第一定律:热力学第一定律是费米定律,即热量律定律。
它表明,热力学过程中总的热量Q受外界工作W的作用,总的能量不变,即Q+W=const。
即在实验室中,若有受外界工作所引起的热量改变时,只有两种可能:可能是A物质中物质的能量减少,同时导致B物质中物质的能量增加,或者A物质中物质的能量减少,而B物质中物质的能量不变。
由此可见,热力学第一定律告诉人们,这些热力学过程的总的能量保持不变,或者说,这些热力学过程的总的热量是不变的。
热力学第二定律:热力学第二定律指的是利维-默尔定律,或熵定律,也称为费米-利维定律,它表明:在热力学过程中只有当整个热力学系统的所有热力学过程都是单向的时候,整个系统的熵才会增加。
熵理论的本质是紊乱的概念,它意味着一个系统越是紊乱,它的熵就越大,普遍而言,当热力学系统不再能够进行无穷小的处理的时候,就表明熵的最终极限或热量的最终极限已达到,由此看来,热力学第二定律是热力学中非常重要的一个环节。
热力学第三定律:热力学第三定律是著名的原文森-洛伊德定律,即热力学“有效等温”定律,它表明:热力学系统处于有效等温的时候,在特定的压强下,任何物质的状态都是有限的,温度只能达到一个特定的水平,温度不可能永远保持在特定的水平上,而是有极限的水平可以,它将温度运算由极端极限变成无穷小或无穷大,当将一具体物质加热到一定温度时,当它冷却到一定温度,它的温度也不会再升,这说明了物质所具有的温度有一个极限值,以满足有效等温的定律。
工程热力学 课后习题答案 可打印 第三版 第二章

第二章 热力学第一定律
2-1 一辆汽车 1 小时消耗汽油 34.1 升,已知汽油发热量为 44000kJ/kg ,汽油密度 0.75g/cm3 。
测得该车通过车轮出的功率为 64kW,试求汽车通过排气,水箱散热等各种途径所放出的热量。
解: 汽油总发热量 Q = 34.1×10 −3m3 × 750kg/m3 × 44000kJ/kg = 1125300kJ
汽车散发热量 Qout = Q −W × 3600 = (1125300 − 64× 3600)kJ/h = 894900kJ/h
2-2 1kg 氧气置于图 2-13 所示气缸内,缸壁能充分导热,且活塞与缸壁无磨擦。初始时氧气压
力为 0.5MPa,温度为 27℃,若气缸长度 2 l ,活塞质量为 10kg。试计算拔除钉后,活塞可能
即每生产 1 公斤压缩空气所需技术功为 252kJ。
(3)压气机每分钟生产压缩空气 10kg,即1/ 6kg/s ,故带动压气机的电机功率为
N
=
q m wt
=
1 6
kg/s × 252kJ/kg
=
42kW
9
第二章 热力学第二定律
2-10 某蒸汽动力厂中锅炉以 40T/h 的蒸汽供入蒸汽轮机。进口处压力表上读数是 9MPa ,蒸 汽的焓是 3441kJ/kg 。蒸汽轮机出口处真空表上的读数是 0.0974MPa ,出口蒸汽的焓是
的室内空气每小时温度的升高值,已知空气的热力学能与温度关系为 ∆u = 0.72∆TkJ/kg 。
解 室内空气总质量 m = pV = 0.1×106 Pa ×15m2 × 3.0m = 52.06kg RgT 287J/(kg ⋅ K) × (28 + 273.15)K
工程热力学2 温度与热力学第零定律详解

温度通常指的是物体的冷热程度。
这一概念来源于人们对于冷热现象的经验感觉,譬如通过触觉,可以把各种
物体按冷、凉、温、热等作一排列。但感觉不能成为科学概念,感觉往往也 可能会是错觉。
常与热的概念混淆-- 物体“冷热”的热与物体间传递“热量”的热是同一个字,不
像英语中可分别用Hotness和Heat区分,但此热非彼热也。人们用手触摸物体感受其温 度时,他所感到的实际上是单位时间物体传给他的热量。诚然,热量源自于温差,即 外界物体的温度越高,势差也越大,传给我们手的热量也越多,这种感觉似乎也能指 示物体的温度。但要知道物体所传的热量不仅和温差有关,还和物体本身材料的导热 性质又称导热系数有关。触摸处于相同环境同一温度的铁与木头,冬天你会觉得铁比 木头冷,夏天又可能会觉得铁比木头热。
上述证明很易推广到任意多个系统处于热平衡且每个系统有任意独立
变量个数的情况。
这一结果表明:任何系统均有一个状态函数存在,它对于所有相互处于 热平衡的系统数值相同。我们将这个状态函数定义为温度,作为判断 一个系统与其它系统是否处于热平衡的宏观性质。一切处于热平衡的 系统,其温度均相等。
在我们的温度感觉可以信赖的范围内,所有各个物体相互接触一段足够 长的时间之后,这些物体的冷热程度都将变得相同。因此,这个温度 概念与我们日常估量系统冷热程度的温度概念是一致的。
2. 温度测量--温度计与温标
我们已得到了热力学第零定律的一个重要推论——状态参数温度存在。
现将温度这一性质定量化。若要判断两个系统温度是否相等,根据 热力学第零定律,可用第三个系统分别与它们接触,如果都是处于热平 衡的,即没有热的相互作用,则这两个系统也处于热平衡,它们的温度 相等。如果第三个系统和其中一个热平衡而和另一个有热的相互作用, 则这两系统温度不等。对于一般第三个系统和它们可能均达不成热平衡 的情况,我们进一步推想,若选的第三个系统的热容相对很小,它与其 它系统接触时,即使有热的相互作用,对它们的状态也几乎没有影响, 而自己的状态却有明显的改变,那么当其与第一个系统达成热平衡处于 某一状态后,若与第二个系统达不成热平衡,状态继续变化,则这两系 统温度不等。这里比较两个系统的温度,它们无须接触,第三个系统状 态参数的变化可指示温度的异同。因此,我们得到了热力学第零定律的 另一个重要推论--温度计存在。
2_高等工程热力学2014秋 [兼容模式]
![2_高等工程热力学2014秋 [兼容模式]](https://img.taocdn.com/s3/m/b9c4d9290722192e4536f6e7.png)
第一章热力学基础定律(1)温度及热力学第零定律Temperature & the zeroth law of thermodynamics机械与储运工程学院刘强C 物体A B 一定热平衡物体物体热力学第零定律:当两个系统(A ,B)各自与第三(C)处于热平衡时,则这两个系统彼此也处个系统()处于热平衡时,则两个系统彼处于热平衡。
3温度的热力学定义:处于同热平衡状态的各个热处于同一热平衡状态的各个热力系统,必定有某一宏观特征彼此相同,用于描述此宏观特征的物理量为温度。
宏观特征的物理量为温度热力学第零定律为温度测量提供了科学基础:即被测物体与温度计处于热平衡时,就可以从温度计的读数确定被测物体的温度值。
4温度的测量温度计的工作原理:当一个物体的温度改变时,物体的其它性质也随之改变,可根据这些性质中也随之改变可根据这些性质中的某些参数测量物体的温度,指明温度的数值。
温度计的分类:气体温度计、膨胀式温度计、电阻温度计热电偶和光学温度计等阻温度计、热电偶和光学温度计等。
5温度计测温参数测温范围/℃气体温度计压力或体积-270-1100膨胀式温度计体积-200~750(液)接触式测温-30~600(固)电阻温度计电阻-200~800热电偶热电动势-200~1300非接触式测温光学温度计辐射强度-50-2000一等标准铂电阻温度计其精度可达000160.001℃工程中一般采用热电偶测温,如:电厂过热器、再热器的壁温测量理想气体温标气体压力p→0时,呈现理想气体特性,利用理想气体定压下体积随温度变化的特性或定容下压力随温度变化的特性,作为度量温度变化的标准,这种温标称为理想气体温标。
(利用理想气体性质与热力学温度的关系) 热力学温标等价的基准方法,仍是经验温标。
仍是理想气体温度计是测量温度的标准仪器。
理想气体温度计有定容式(应用更广)和定压式。
9理想气体温标23′′′气体的维里方程为:T(1)pV RT B p C D p p =++++"所有气体当→0pV 气体Ap 时,p 性质都趋于相同的特性。
热力学第零定律

在工程中,热力学第零定律是传热设计和分析的基础,可以 帮助工程师理解和优化传热过程,提高设备的效率和安全性 。
05
CATALOGUE
热力学第零定律的实验验证
实验验证的方法
01
02
03
热量测量
通过测量热量交换量来验 证热力学第零定律,确保 热量交换过程中温度保持 不变。
温度测量
使用温度计或其他测量仪 器,准确测量系统内各部 分的温度,以验证温度的 一致性。
这个温度可以作为它们各自的热力学温度。
03
这意味着我们可以使用热平衡状态下的物体来测量和
标定温度,从而为温度提供了一个客观的物理标准。
02
CATALOGUE
热平衡和温度
热平衡的定义
热平衡定义总结
热平衡是指两个或多个物体在没 有外界热交换的情况下,通过内 部热量交换达到的热状态平衡。
热平衡条件
当两个物体在没有外界热交换的 情况下,如果它们的温度相同, 则它们处于热平衡状态。
等温过程
等压过程
等容过程
04
CATALOGUE
热力学第零定律的应用
在热力学第一定律和第二定律中的应用
热力学第一定律
热力学第零定律为热量传递的方向和 大小提供了基础,是热力学第一定律 中能量守恒和转换的基础。
热力学第二定律
热力学第零定律对于判断系统状态变 化的方向和可能性非常重要,是热力 学第二定律中熵增加原理的基础。
简单来说,如果两个物体温度相同, 则它们之间没有热交换。
定律的数学表述
热力学第零定律的数学表述涉及到温 度的标定和热平衡状态下的热容。
VS
在数学上,如果两个热力学系统在某 个温度下达到热平衡,则它们的热容 相等。
热力学第零定律温度的定义

热力学第零定律温度的定义在我们探索热力学这个神秘而又实用的领域时,热力学第零定律就像一把关键的钥匙,为我们打开了理解温度本质的大门。
那么,究竟什么是热力学第零定律温度的定义呢?让我们一起来揭开它的神秘面纱。
想象一下,在一个寒冷的冬日,我们走进一间温暖的房间,很快就能感受到温暖,身体逐渐适应新的环境温度。
而在炎热的夏天,当我们从户外走进空调房,那种凉爽的感觉也会迅速传递给我们。
这其中,温度的变化是显而易见的,但温度到底是什么呢?要理解热力学第零定律中温度的定义,我们首先得明白什么是热平衡。
当两个物体相互接触时,如果它们之间没有热量的交换,也就是说它们的状态不发生改变,我们就说这两个物体处于热平衡状态。
假设我们有三个物体 A、B 和 C。
如果物体 A 和物体 B 分别与物体C 接触时,都处于热平衡状态,那么根据热力学第零定律,物体 A 和物体 B 彼此接触时也会处于热平衡状态。
这个定律看似简单,却蕴含着对温度深刻的定义。
在这种情况下,我们就可以说物体 A、B 和 C 具有相同的“某种性质”,而这个“某种性质”就是温度。
换句话说,温度是决定物体是否处于热平衡的一个物理量。
如果两个物体的温度相同,它们相互接触时就不会有热量的传递,因为它们在热的方面已经达到了一种平衡状态。
而如果两个物体的温度不同,热量就会从温度高的物体流向温度低的物体,直到它们达到相同的温度,实现热平衡。
举个例子,我们把一杯热水和一杯冷水混合在一起。
热水温度高,具有较多的内能,而冷水温度低,内能较少。
当它们混合时,热水中的热量会自动传递给冷水,直到两者的温度变得相同,达到一个共同的中间温度。
温度的概念在我们的日常生活中无处不在。
我们用温度计来测量温度,无论是测量气温、水温还是人体的体温。
温度计的工作原理,其实也是基于热力学第零定律。
常见的温度计,比如水银温度计,利用了水银的热胀冷缩性质。
当温度计接触到一个物体时,它会与该物体达到热平衡。
热力学第零定律

热力学第零定律引言热力学是研究热量和能量转化的科学,它起源于18世纪末的工业革命时期。
在热力学中,有一个基本原理被称为热力学第零定律。
这个定律为我们提供了一个基本的基准,用于测量物体之间的温度差异。
在本文中,我们将详细介绍热力学第零定律的定义、原理和应用。
一、热力学第零定律的定义热力学第零定律是用来定义物体的热平衡的一个基本定律。
它表明,如果两个物体分别与第三个物体处于热平衡状态,那么这两个物体之间也将处于热平衡状态。
具体来说,当两个物体通过导热或者其他方式接触时,它们将会达到相同的温度,从而实现热平衡。
二、热力学第零定律的原理热力学第零定律的原理可以通过一个简单的实验来解释。
假设我们有三个热水壶,分别标记为A、B和C。
我们将A和B分别与C进行接触,并观察它们之间的温度变化。
首先,我们将A和C放在一起接触一段时间后,然后分别测量它们的温度。
接着,我们将B和C放在一起接触一段时间后,再次测量它们的温度。
如果A和B之间的温度差异很小,而A和C以及B和C之间的温度差异也很小,那么可以得出结论,A和B之间也处于热平衡状态。
这个实验可以推广到更多的物体之间,只要它们通过导热或者其他方式相互接触,它们就有可能达到热平衡状态。
这是因为热量会自由地从一个物体传递到另一个物体,直到它们达到相同的温度。
这个过程被称为热传导。
三、热力学第零定律的应用热力学第零定律在实际应用中有着广泛的应用。
首先,它为测量物体的温度提供了一个基准。
例如,在实验室中,我们可以使用温度计来测量物体的温度,而这个温度计是根据热力学第零定律设计的。
此外,热力学第零定律还可以帮助我们理解和解释一些热学现象。
例如,我们知道热量是从高温物体流向低温物体的。
根据热力学第零定律,当两个物体接触时,它们将交换热量,直到它们达到热平衡。
这个现象被广泛应用于热工学和能源转换等领域。
热力学第零定律还有助于我们理解热学平衡的概念。
在热平衡状态下,物体之间没有净热量传递,即它们的温度保持不变。
热力学第零定律、温度
热力学第零定律、温度1. 热力学第零定律热力学第零定律是有关热平衡的基本公理。
根据这条定律可以引出温度的概念。
现在,我们从考察热平衡现象入手来说明这个问题。
当一个单相系统与环境之间只有一种形式的功作用〈这样假定纯粹是为了讨论的方便〉,例如只有体积变化功、电功或磁功等之一时,经验表明,只要两个独立的热力学参数便可以完全地确定它的状态。
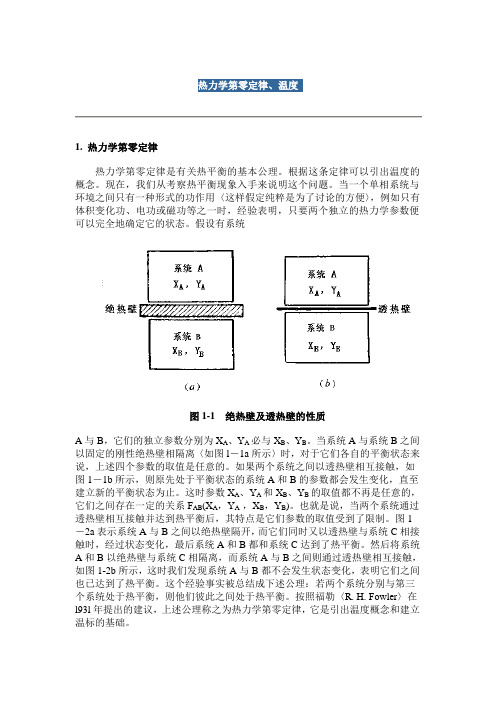
假设有系统图1-1 绝热壁及透热壁的性质A与B,它们的独立参数分别为X A、Y A必与X B、Y B。
当系统A与系统B之间以固定的刚性绝热壁相隔离〈如图l-1a所示〉时,对于它们各自的平衡状态来说,上述四个参数的取值是任意的。
如果两个系统之间以透热壁相互接触,如图1-1b所示,则原先处于平衡状态的系统A和B的参数都会发生变化,直至建立新的平衡状态为止。
这时参数X A、Y A和X B、Y B的取值都不再是任意的,它们之间存在一定的关系F AB(X A,Y A ,X B,Y B)。
也就是说,当两个系统通过透热壁相互接触并达到热平衡后,其特点是它们参数的取值受到了限制。
图1-2a表示系统A与B之间以绝热壁隔开,而它们同时又以透热壁与系统C相接触时,经过状态变化,最后系统A和B都和系统C达到了热平衡。
然后将系统A和B以绝热壁与系统C相隔离,而系统A与B之间则通过透热壁相互接触,如图1-2b所示,这时我们发现系统A与B都不会发生状态变化,表明它们之间也已达到了热平衡。
这个经验事实被总结成下述公理:若两个系统分别与第三个系统处于热平衡,则他们彼此之间处于热平衡。
按照福勒〈R. H. Fowler〉在l93l年提出的建议,上述公理称之为热力学第零定律,它是引出温度概念和建立温标的基础。
图1-2 热力学第零定律示意图2. 温度当系统A与C处于热平衡时,它们参数间的限制关系为F AC(X A,Y A,X C,Y C)=0(1-1)同样,若系统B与系统C也处于热平衡,则有F BC(X B,Y B,X C,Y C)=0 (1-2)将这两个关系写成Y C的显式,可得Y C=f AC(X A,,X C) (1-3)及Y C=f BC(X B,X B,X C) (1-4)将式(1-3)与式(1-4)合并,消去变量Y C,得f AC(X A,X B,X C)= f BC(X B,Y B,X C)(1-5)根据热力学第零定律,当系统A和系统B分别与系统C处于热平衡时,它们之间也处于热平衡,因此有F AB(X A,Y A,X B,Y B)=0 (1-6)方程(1-5)与(l-6)描述的是同一个现象,因而应该是等同的,但后者没有包含参数只能取以下形式:X C。
热力学第零定律内容和意义

热力学第零定律内容和意义热力学是物理学中一门重要的学科,它主要研究热能和工作之间的转换,拥有重要的理论及实际应用价值。
它的基础是由拉格朗日提出的三项定律,其中包括热力学第一定律、热力学第二定律和热力学第零定律。
以下将着重讨论热力学第零定律的内容和意义。
热力学第零定律是由维克多萨班宁(Victor S.B.)在1961年提出的,它指出,一个热系统的熵增量,等于在这个热系统中加热所发出的热量,除以当时的绝对温度。
由此可以得出热力学第零定律公式:ΔS=Q/T其中,ΔS是热系统熵的增量,Q发出的热量,T是当时的绝对温度。
此定律可以说是热力学的基础定律,它为其他定律提供了支撑,如:热力学第二定律和热力学第一定律。
热力学第一定律是比较了热系统的熵,即热系统可能性的变化,热力学第二定律则把这种变化表示为熵的增量,而而热力学第零定律则提供了这种熵增量计算的具体方法。
热力学第零定律最重要的意义是它可以用来衡量热系统的活性。
它可以让我们在任何情况下计算出热系统中的热量,从而衡量活性的变化,从而推进微观热力学、熵温度曲线及热工程的应用。
而在某些情况下,如制备冷却剂等,热力学第零定律也可以用来衡量不同密度的工质的活性。
热力学第零定律还可以应用在经济方面,特别是在热机设备如蒸汽机等发电设备和冷却设备等工业加工行业中有着重要的应用。
它可以帮助我们计算出不同工质和不同形式下的热量存储量,从而控制发电机和冷却器的工作性能,并提高系统的经济效率。
总之,热力学第零定律是热力学学科中一项重要的基础定律,它可以计算出热系统的活性,衡量不同的热量存储量,为工业加工提供参考,提高系统的经济效率,是物理学中一门重要的学科,也是热力学学科中重要的定律。
5.1 热力学第零定律 温度

T3 273.16K
(三相点温度)
热力学温度是国际计量大会决定采用的SI制 中的七个基本单位之一 ,是一个理论温标,热力
学温度T的单位是开尔文中文代号为K.
5.1.4 摄氏温标和华氏温标
t T 273.15 规定: 热力学温度 273.15K为摄氏温标的零点 (t 0),摄氏温度的单位为摄氏度, 写成 C
5.1 热力学第零定律 温度
5.1.1 5.1.2 5.1.3 5.1.4 热力学第零定律 温度和温标 热力学温标 摄氏温标和华氏温标
5.1.1 热力学第零定律
如果两个热力 学系统中的每一个 都与第三个热力学 系统处于热平衡, 则他们彼此也必定 处于热平衡. 热力学第零定律.
A B C B A C
B与C热隔绝,却 同时与 A 热接触
B与C也发定系统热平衡的宏观性质的物理量. 温标 温度的数值表示,包括测温性质和温度间 函数关系的选择以及温度计的分度法称为温标. 温度
5.1.3 热力学温标
与测温物质和测温属性都无关的温标. 选择水的三相点为标准温度点.根据国际协 议,指定水的三相点值为273.16K,作为温度计
