四川省成都市经开实验中学高一化学3.2.3 铁的重要化合物课件
合集下载
人教版必修1化学:3.2.3《铁的重要化合物》课件

2019/9/2
6
4.铁盐和亚铁盐
(1)Fe3+的检验
①试剂: KSCN溶液
②现象:含Fe3+的溶液变成红色
感谢您下载包图网平台上提供的PPT作品,为了您和包图网以及原创作者的利益,请勿复制、传播、销售,否则将承担法律责任!包图网将对作品进
行维权,按照传播下载次数进行十倍的索取赔偿!
(2)Fe 和 Fe 的转化 3+
氧化剂氧化为 Fe ,如 Fe+S==△===FeS, 2+ Fe+2Fe3+===3Fe2+。
(2)Fe 能被 Cl2等强氧化剂氧化为 Fe3+, 点燃
如 2Fe+3Cl2=====2FeCl3。
2019/9/2
11
2.Fe2+既具有氧化性又具有还原性,可 以被氧化为Fe3+,也可以被还原为Fe
氧化物,与
盐酸反应的化ibaotu学.com 方程式分别为:FeO+
2HCl===FeCl2+H2O,Fe2O3+ 6HCl===2FeCl3+3H2O。
(3)用途
Fe2O3常用作红色油漆和涂料,赤铁矿 (主要成分是Fe2O3)是炼铁原料。
ห้องสมุดไป่ตู้
2019/9/2
5
3.铁的氢氧化物
颜色
Fe(OH)2 白色
2+
①Fe3+―较―强―还―原―剂→Fe2+
。
如FeCl3溶液中加入铁粉,反应的离子 方程式为:2Fe3++Fe===3Fe2+。
2019/9/2
7
②Fe2+―较―强―氧―化―剂→Fe3+
如向FeCl2溶液中滴加氯水,反应的离子方 感谢您下载包图网平台上提供的PPT作品,为了您和包图网以及原创作者的利益,请勿复制、传播、销售,否则将承担法律责任!包图网将对作品进
高中化学3.2.3铁的重要化合物课件新人教版必修1

过程2需加入适当的还原剂。
第十三页,共21页。
[实验] 在盛有氯化铁溶液的试管中,加入少量铁粉,振荡
(zhèndàng),充分反应后,滴加几滴KSCN溶液,有什么 现象?再加几滴氯水又发生什么变化?
第十四页,共21页。
实验现象: 溶液(róngyè)由黄色变为淡绿色,加KSCN溶
液(róngyè)没有明显变化,加氯水后溶液(róngyè) 实变验为(血sh红íy色àn。)结论:
Fe3+ + 3OH-
====Fe(OH)3↓
FeSO4
先有白色(báisè)的沉 淀, 迅速变成灰绿色, 最后变成红褐色
Fe2+ + 2OH- ====Fe(OH)2↓ 4Fe(OH)2+O2+2H2O====
4Fe(OH)3
第九页,共21页。
【想一想】
Fe(OH)2 由于易被空气中的氧气(yǎngqì)氧化, 在制备 Fe(OH)2时应采取哪些措施防止其被氧化? 【提示】(1)在溶液上加入保护层(如植物油),隔绝 (géjué)氧气。 (2)将胶头滴管(dī ɡuǎn)尖端插入试管 底部。 (3)用煮沸过的蒸馏水配制溶液。
第十六页,共21页。
一、铁的氧化物
二、铁的氢氧化物 (qīnɡ yǎnɡ huà wù)
4Fe(OH)2+O2+2H2O====4Fe(OH)3
三、铁盐和亚铁盐
1.检验
(jiǎnyàn)
Fe、Cu
2.转化
Fe2+
Fe3+
(zhuǎnhuà)
Cl2、H2O2、KMnO4
第十七页,共21页。
1.将下列(xiàliè)四种铁的化合物溶于稀盐酸,滴加
第十三页,共21页。
[实验] 在盛有氯化铁溶液的试管中,加入少量铁粉,振荡
(zhèndàng),充分反应后,滴加几滴KSCN溶液,有什么 现象?再加几滴氯水又发生什么变化?
第十四页,共21页。
实验现象: 溶液(róngyè)由黄色变为淡绿色,加KSCN溶
液(róngyè)没有明显变化,加氯水后溶液(róngyè) 实变验为(血sh红íy色àn。)结论:
Fe3+ + 3OH-
====Fe(OH)3↓
FeSO4
先有白色(báisè)的沉 淀, 迅速变成灰绿色, 最后变成红褐色
Fe2+ + 2OH- ====Fe(OH)2↓ 4Fe(OH)2+O2+2H2O====
4Fe(OH)3
第九页,共21页。
【想一想】
Fe(OH)2 由于易被空气中的氧气(yǎngqì)氧化, 在制备 Fe(OH)2时应采取哪些措施防止其被氧化? 【提示】(1)在溶液上加入保护层(如植物油),隔绝 (géjué)氧气。 (2)将胶头滴管(dī ɡuǎn)尖端插入试管 底部。 (3)用煮沸过的蒸馏水配制溶液。
第十六页,共21页。
一、铁的氧化物
二、铁的氢氧化物 (qīnɡ yǎnɡ huà wù)
4Fe(OH)2+O2+2H2O====4Fe(OH)3
三、铁盐和亚铁盐
1.检验
(jiǎnyàn)
Fe、Cu
2.转化
Fe2+
Fe3+
(zhuǎnhuà)
Cl2、H2O2、KMnO4
第十七页,共21页。
1.将下列(xiàliè)四种铁的化合物溶于稀盐酸,滴加
铁的重要化合物--说课ppt

1、随着人们生活节奏的加快,方便的小包装食品已 被广泛接受。为了延长食品的保质期,防止食品氧化 变质,在包装袋中可以放入的化学物质是( ) A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰 2、一般的酸、碱很难腐蚀铜,而刻制印刷铜质线路 版时,要用FeCl3溶液作为“腐蚀液”。表明FeCl3具 有 性质,请写出反应的离子方程式。
总结: 常用KSCN溶液检验Fe3+的存在
探究 Fe3+、Fe2+的相互转化
学生探究实验(取上步骤试验后的溶液)
探究一: ①往呈红色的溶液中加入适量铁粉, 振荡,静置。观察记录发生的现象。 探究二:
②取①反应后的溶液中加入适量氯水, 振荡,静置。观察记录发生的现象。
环节五:巩固与应用
< 感悟新知 >
环节五:巩固应用
〈学有所用的体验〉
1、为什么补铁性药品要密闭保存? 2、补铁性药品要与维生素C同服 ,为什么? 3、配制FeSO4溶液时常常要加入少量铁粉 或铁钉,你知道这是为什么吗?
〈课堂探究的延续〉
实践活动:铝盐和铁盐的净水作用
板书设计
铁的重要化合物 1、铁的氧化物:FeO 、Fe2O3、Fe3O4 2、铁的氢氧化物:Fe(OH)3、Fe(OH)2 ⑴制备Fe(OH)3:Fe3+ + 3OH- == Fe(OH)3↓ ⑵制备Fe(OH)2:Fe2+ + 2OH- == Fe(OH)2 ↓ 4Fe(OH)2+O2+2H2O=4 Fe(OH)3↓ ⑶Fe(OH)3、Fe(OH)2的碱性:Fe(OH)3+3H+=Fe3++3H2O Fe(OH)2+2H+=Fe2++2H2O ⑷Fe(OH)3的热稳定性:2Fe(OH)3 == Fe2O3 + 3H2O 3、铁盐和亚铁盐 (1)Fe3+、Fe2+的检验方法:加KSCN溶液 ⑵ Fe3+ 、Fe2+的相互转化:
总结: 常用KSCN溶液检验Fe3+的存在
探究 Fe3+、Fe2+的相互转化
学生探究实验(取上步骤试验后的溶液)
探究一: ①往呈红色的溶液中加入适量铁粉, 振荡,静置。观察记录发生的现象。 探究二:
②取①反应后的溶液中加入适量氯水, 振荡,静置。观察记录发生的现象。
环节五:巩固与应用
< 感悟新知 >
环节五:巩固应用
〈学有所用的体验〉
1、为什么补铁性药品要密闭保存? 2、补铁性药品要与维生素C同服 ,为什么? 3、配制FeSO4溶液时常常要加入少量铁粉 或铁钉,你知道这是为什么吗?
〈课堂探究的延续〉
实践活动:铝盐和铁盐的净水作用
板书设计
铁的重要化合物 1、铁的氧化物:FeO 、Fe2O3、Fe3O4 2、铁的氢氧化物:Fe(OH)3、Fe(OH)2 ⑴制备Fe(OH)3:Fe3+ + 3OH- == Fe(OH)3↓ ⑵制备Fe(OH)2:Fe2+ + 2OH- == Fe(OH)2 ↓ 4Fe(OH)2+O2+2H2O=4 Fe(OH)3↓ ⑶Fe(OH)3、Fe(OH)2的碱性:Fe(OH)3+3H+=Fe3++3H2O Fe(OH)2+2H+=Fe2++2H2O ⑷Fe(OH)3的热稳定性:2Fe(OH)3 == Fe2O3 + 3H2O 3、铁盐和亚铁盐 (1)Fe3+、Fe2+的检验方法:加KSCN溶液 ⑵ Fe3+ 、Fe2+的相互转化:
【人教版】必修一:3-2-3《铁的重要化合物》ppt课件

◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
知识点1
知识点2
知识点3
解析:A项中现象可以证明存在Fe3+,但无法确定Fe2+是否存在,A 项错误;B项中现象可以证明通入Cl2后存在Fe3+,但原溶液是只存在 Fe2+,还是只存在Fe3+或Fe2+、Fe3+均含有,不能确定,B项错 误;Fe(OH)3是中学应掌握的唯一红褐色沉淀,C项正确;Fe(OH)2转化 为红褐色Fe(OH)3时会干扰其他白色沉淀的观察,所以当含Fe2+的溶 液中含有其他能与碱反应生成白色沉淀的离子时,也同样出现D项 所述现象,D项错误。 答案:C
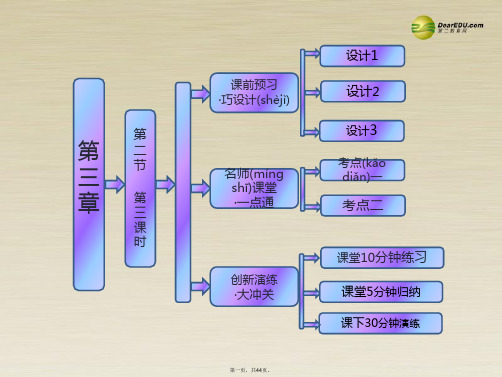
第3课时
铁的重要化合物
1.能记住铁的重要化合物的主要性质并了解其应用。 2.了解Fe2+、Fe3+的检验方法及其相互转化。 3.能说出Fe(OH)2、Fe(OH)3的制备方法。
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
一
二
三
四
铁的氧化物 存在
用途
氧化亚铁 氧化铁 四氧化三铁 不稳定,在空 气中受热易 赤铁矿 磁铁矿 被氧化成 Fe3O4 红色油漆和涂 — 炼铁、磁性材料 料、炼铁原料
一
二
三
四
能否通过化合反应制备 Fe(OH)3?若能,写出反应的化学方程式。 提示:能。化学方程式为 4Fe(OH)2+O2+2H2O 4Fe(OH)3。
课件8:3.2.3 铁的重要化合物

第三章 金属及其化合物 第二节 几种重要的金属化合物
第3课时 铁的重要化合物
知识梳理
一、铁的氧化物
1.物理性质
2.化学性质
(1)铁的氧化物的共性
①与酸反应,其中 FeO、Fe2O3 为 碱性
氧化物。
如:FeO、Fe2O3、Fe3O4 与盐酸反应的化学方程式:
FeO+2HCl===FeCl2+H2O
【答案】(1)Fe3+、Cu2+ 一定 (2)Fe、Cu 一定
探究点二 Fe(OH)2 的制备
1.操作 将吸有 NaOH 溶液的胶头滴管插入新制备的亚铁盐(以 FeSO4 为 例)溶液的液面以下,缓慢挤出 NaOH 溶液。
2.原理 Fe2++2OH-===Fe(OH)2↓ 3.注意事项 (1)Fe2+必须是新制的并放入 Fe 粉,以防 Fe2+被氧化成 Fe3+;(2)除去溶液中溶解的 O2,其方法是加热煮沸 NaOH 溶液; (3)滴管末端插入试管内的液面以下;(4)必要时可实验,要求亚铁溶液是新制备的, 其中不含铁离子,实验时吸取碱液的胶头滴管一定要伸入到亚铁 盐溶液中,然后再将碱液滴入,以尽可能地隔绝空气,避免亚铁 离子以及生成的 Fe(OH)2 被氧化。
【解析】方法一:(1)由于 Fe2+具有水解性,Fe2++2H2O⇌Fe(OH)2 +2H+而使溶液变浑浊,故在配制 FeSO4 溶液时,常将其溶于稀硫 酸中,同时由于 Fe2+具有较强的还原性易被氧化为 Fe3+,故在配 好的溶液中常加一枚铁钉(或铁屑)以防止其氧化。(2)由于气体的溶 解度随温度升高而迅速减小,故可用加热的方法除去蒸馏水中溶解 的 O2。(3)空气中含有大量的 O2,为防止生成的 Fe(OH)2 沉淀与空 气接触,需将吸取的 NaOH 溶液的试管放入液面以下后再挤出。 方法二:(1)由所给试剂及装置特点知,试管Ⅰ为封闭系统,应为 产生 H2 并赶尽溶液中的空
第3课时 铁的重要化合物
知识梳理
一、铁的氧化物
1.物理性质
2.化学性质
(1)铁的氧化物的共性
①与酸反应,其中 FeO、Fe2O3 为 碱性
氧化物。
如:FeO、Fe2O3、Fe3O4 与盐酸反应的化学方程式:
FeO+2HCl===FeCl2+H2O
【答案】(1)Fe3+、Cu2+ 一定 (2)Fe、Cu 一定
探究点二 Fe(OH)2 的制备
1.操作 将吸有 NaOH 溶液的胶头滴管插入新制备的亚铁盐(以 FeSO4 为 例)溶液的液面以下,缓慢挤出 NaOH 溶液。
2.原理 Fe2++2OH-===Fe(OH)2↓ 3.注意事项 (1)Fe2+必须是新制的并放入 Fe 粉,以防 Fe2+被氧化成 Fe3+;(2)除去溶液中溶解的 O2,其方法是加热煮沸 NaOH 溶液; (3)滴管末端插入试管内的液面以下;(4)必要时可实验,要求亚铁溶液是新制备的, 其中不含铁离子,实验时吸取碱液的胶头滴管一定要伸入到亚铁 盐溶液中,然后再将碱液滴入,以尽可能地隔绝空气,避免亚铁 离子以及生成的 Fe(OH)2 被氧化。
【解析】方法一:(1)由于 Fe2+具有水解性,Fe2++2H2O⇌Fe(OH)2 +2H+而使溶液变浑浊,故在配制 FeSO4 溶液时,常将其溶于稀硫 酸中,同时由于 Fe2+具有较强的还原性易被氧化为 Fe3+,故在配 好的溶液中常加一枚铁钉(或铁屑)以防止其氧化。(2)由于气体的溶 解度随温度升高而迅速减小,故可用加热的方法除去蒸馏水中溶解 的 O2。(3)空气中含有大量的 O2,为防止生成的 Fe(OH)2 沉淀与空 气接触,需将吸取的 NaOH 溶液的试管放入液面以下后再挤出。 方法二:(1)由所给试剂及装置特点知,试管Ⅰ为封闭系统,应为 产生 H2 并赶尽溶液中的空
必修1课件:3.2.3铁的重要化合物

【解析】
A项,加入KSCN后呈红色,说明含Fe3 ,
+ +
但不能说明是否含有Fe2 。 B项,通入Cl2后再加入KSCN溶液变红色,说明所得的 溶液中含Fe3 ,而原溶液中是否含有Fe3 、Fe2 无法判断。
+ + +
C项,加NaOH得红褐色沉淀,说明含有Fe3 。
+
D项,当溶液中含有Fe2 和其他能与碱反应生成白色沉
下列离子的检验方法合理的是(
)
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ B.向某溶液中通入Cl2,然后再加入KSCN溶液,溶液 变红色,说明原溶液中含有Fe2
+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明 溶液中含有Fe3+ D.向某溶液中加入NaOH溶液,得白色沉淀,又观察 到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+ ,不含有 Mg2+
【解析】
(2)Fe2+和 Cu2+是生成物,且它们的物质的
+ + + +
量之比为 2∶ 1,又因为Cu2 和Fe3 浓度相等,则Fe2 和 Fe3
浓度之比 2∶ 1。 (3)再次加入Fe时,把铜置换出来,结合方 程式 Fe+ Cu2+ ===Cu+ Fe2+ 和题(1)方程式,则总反应为 2Fe3 + Fe===3Fe2 ,所以参加反应的Fe和与原 FeCl3的物质
的溶液变为红色,说明原溶液中一定含有SCN-。因原溶
液中加入含Fe2+的溶液后,无明显变化,说明Fe2+与 SCN- 不能形成红色物质。
【答案】 B
1.三色二性一现象: Fe2+ 、Fe3+、Fe(SCN)3溶 液分别为浅绿色、棕黄色、红色; Fe2 还原性较
+
强,Fe3 有较强氧化性。 Fe(OH)2转化为Fe(OH)3现
课时铁的重要化合物课件.ppt

课时铁的重要化合物课件
课时铁的重要化合物课件
制造印刷线路板,写出发生反应的化学方程式,显示了 FeCl3的什么性质?
课时铁的重要化合物课件
归纳总结:铁有+2价和+3价,铁遇到弱氧化剂,生成二价铁,遇强 氧化剂生成三价铁。 FeCl2既有氧化性,又有还原性,遇强氧化剂显示还原性,遇强 还原剂,显示氧化性。 FeCl3有氧化性,遇到铁、铜等还原剂能转化为FeCl2,通过适当 的氧化剂或还原剂可以使Fe、FeCl2、FeCl3之间发生转化。
还原为Fe
向盛有FeCl2溶液的试管 中滴加氯水,反应完后再 滴加KSCN溶液
ቤተ መጻሕፍቲ ባይዱ
溶液由浅绿色变为黄色,滴 入KSCN溶液变为红色
FeCl2 有还原性,被氯水 氧化为FeCl3, Fe3+ 与KSCN 溶液反应使溶液变为红色
课时铁的重要化合物课件
问题4:电子工业上 30% 的 FeCl3 溶液腐蚀敷在绝缘板上的铜箔,
3.没解决的问题组长及时反馈给老师, 新生成的问题组长记录好,
以便小组展示、质疑。
课时铁的重要化合物课件
高效展示
展示内容
1 探究点一:铁的氢氧化物 2 探究点二:Fe2+ 和Fe3+ 的检验方法
3 探究点三:铁、氯化亚铁、氯化铁的氧化性和还原性
要求:
1.展示同学书写工整、迅速,按时完成。 2.展示内容后写出小结(注意事项、方法规律、拓展内容)和新生成问
课时铁的重要化合物课件
问题3:从 FeCl2 溶液、Zn片 、氯水中选择试剂设计实验证明
FeCl2既有氧化性,又有还原性。
答案:见下表。
实验
现象
结论
足量Zn片放入盛有FeCl2 溶液的试管中
课时铁的重要化合物课件
制造印刷线路板,写出发生反应的化学方程式,显示了 FeCl3的什么性质?
课时铁的重要化合物课件
归纳总结:铁有+2价和+3价,铁遇到弱氧化剂,生成二价铁,遇强 氧化剂生成三价铁。 FeCl2既有氧化性,又有还原性,遇强氧化剂显示还原性,遇强 还原剂,显示氧化性。 FeCl3有氧化性,遇到铁、铜等还原剂能转化为FeCl2,通过适当 的氧化剂或还原剂可以使Fe、FeCl2、FeCl3之间发生转化。
还原为Fe
向盛有FeCl2溶液的试管 中滴加氯水,反应完后再 滴加KSCN溶液
ቤተ መጻሕፍቲ ባይዱ
溶液由浅绿色变为黄色,滴 入KSCN溶液变为红色
FeCl2 有还原性,被氯水 氧化为FeCl3, Fe3+ 与KSCN 溶液反应使溶液变为红色
课时铁的重要化合物课件
问题4:电子工业上 30% 的 FeCl3 溶液腐蚀敷在绝缘板上的铜箔,
3.没解决的问题组长及时反馈给老师, 新生成的问题组长记录好,
以便小组展示、质疑。
课时铁的重要化合物课件
高效展示
展示内容
1 探究点一:铁的氢氧化物 2 探究点二:Fe2+ 和Fe3+ 的检验方法
3 探究点三:铁、氯化亚铁、氯化铁的氧化性和还原性
要求:
1.展示同学书写工整、迅速,按时完成。 2.展示内容后写出小结(注意事项、方法规律、拓展内容)和新生成问
课时铁的重要化合物课件
问题3:从 FeCl2 溶液、Zn片 、氯水中选择试剂设计实验证明
FeCl2既有氧化性,又有还原性。
答案:见下表。
实验
现象
结论
足量Zn片放入盛有FeCl2 溶液的试管中
高中化学 3.2.3 铁的重要化合物课件 新人教版必修1
答案:(1)× (2)× (3)× (4)× (5)√
第二十三页,共44页。
第二十四页,共44页。
Fe、Fe2+、Fe3+的相互(xiānghù)转化—铁 三角
第二十五页,共44页。
1.Fe→Fe2+或Fe3+ (1)与弱氧化剂反应生成(shēnɡ chénɡ)Fe2+: 与S、Fe3+、Cu2+、H+等弱氧化剂反应生成(shēnɡ chénɡ)+2价铁,例如: Fe+2Fe3+===3Fe2+, Fe+Cu2+===Fe2++Cu, Fe+2H+===Fe2++H2↑。
第七页,共44页。
一、铁的主要(zhǔyào)化合物 1.铁元素的存在 地壳中金属元素的含量居前两位的是 、Al ,F铁e 元素
主要(zhǔyào)以 +2价 和 +3价的化合物形式存在。
第八页,共44页。
2.铁的氧化物 (1)物理性质(wùlǐ xìngzhì):
名称 化学式
俗名 铁的化合价 颜色、状态
[例1] 已知A是一种常见金属,F是一种红褐色沉淀 (chéndiàn)。试根据图中转化关系,回答下列问题。
第三十页,共44页。
(1)写出A、C、F、G的化学式 A、_______C、_______F、_______、G、_______。 (2)保存C溶液时要加固体A的原因________________ _________________________________________________。 (3)写出下列转化的离子(lízǐ)方程式或化学方程式。 ①E→F:___________________________________。 ②C→D:___________________________________。
第二十八页,共44页。
铁的重要化合物人教版高中化学必修一教学课件

铁的重要化合物课件人教版高中化学 必修一
铁的重要化合物课件人教版高中化学 必修一
实验3-9:在FeCl3和FeSO4溶液中分别加入NaOH溶液,观察并描述实验现象
1.Fe(OH)2 和Fe(OH)3的制备
FeCl3
FeSO4
加入NaOH溶 液产生的现象
生成红褐色沉淀
首先生成白色絮状沉淀, 然后迅速变成灰绿色, 最后变成红褐色
2Fe+3Cl2==2FeCl3, 2Fe+3Br2==2FeBr3 Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O 2Fe+6H2SO4(浓)==Fe2(SO4)3+3SO2↑+6H2O 5Fe+3MnO4-+24H+== 5Fe3++3Mn2++12H2O
铁的重要化合物课件人教版高中化学 必修一
铁的重要化合物课件人教版高中化学 必修一
3、Fe2+
Cl2、Br2、KMnO4、HNO3、O2等
2Fe2+ +Cl2==2Fe3++2Cl2Fe2+ +Br2==2Fe3++2Br5Fe2+ +MnO4-+8H+==5Fe3++Mn2++4H2O 3Fe2++4H++NO3-==Fe3++NO↑+2H2O
Fe3+
4、 Fe3+ Zn、Fe、Cu、H2S、HI、SO2
2Fe3++Cu==2Fe2++Cu2+
Fe2+
铁的重要化合物课件人教版高中化学 必修一
实验3-9:在FeCl3和FeSO4溶液中分别加入NaOH溶液,观察并描述实验现象
1.Fe(OH)2 和Fe(OH)3的制备
FeCl3
FeSO4
加入NaOH溶 液产生的现象
生成红褐色沉淀
首先生成白色絮状沉淀, 然后迅速变成灰绿色, 最后变成红褐色
2Fe+3Cl2==2FeCl3, 2Fe+3Br2==2FeBr3 Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O 2Fe+6H2SO4(浓)==Fe2(SO4)3+3SO2↑+6H2O 5Fe+3MnO4-+24H+== 5Fe3++3Mn2++12H2O
铁的重要化合物课件人教版高中化学 必修一
铁的重要化合物课件人教版高中化学 必修一
3、Fe2+
Cl2、Br2、KMnO4、HNO3、O2等
2Fe2+ +Cl2==2Fe3++2Cl2Fe2+ +Br2==2Fe3++2Br5Fe2+ +MnO4-+8H+==5Fe3++Mn2++4H2O 3Fe2++4H++NO3-==Fe3++NO↑+2H2O
Fe3+
4、 Fe3+ Zn、Fe、Cu、H2S、HI、SO2
2Fe3++Cu==2Fe2++Cu2+
Fe2+
高中化学3.2.3铁的重要化合物课件新人教版必修1ppt版本

解析: A 项中现象可以证明存在 Fe3+,但无法确定 Fe2+是否存在,A 项错 误;B 项中现象可以证明通入 Cl2 后存在 Fe3+,但原溶液是只存在 Fe2+,还是只 存在 Fe3+或 Fe2+、Fe3+均含有,不能确定,B 项错误;Fe(OH)3 是中学应掌握的 唯一红褐色沉淀,C 项正确;Fe(OH)2 转化为红褐色 Fe(OH)3 时会干扰其他白色 沉淀的观察,所以当含 Fe2+的溶液中含有其他能与碱反应生成白色沉淀的离子时, 也同样出现 D 项所述现象,D 项错误。
(离子方程式)
不稳定,受热易分解:
稳定性
不稳定,分解产物很复杂
_2_F_e_(O__H_)_3_=_=△_=_=_=_F_e_2_O_3_+__3_H_2_O__
可溶性亚铁盐与碱反应:Fe2++
制法 2OH-===Fe(OH)2↓
可溶性铁盐与碱反应:FeCl3+
FeSO4+2NaOH===Fe(OH)2↓+ 3NaOH===Fe(OH)3↓+3NaCl
[变式训练 2] 要证明某溶液中不含有 Fe3+而可能含 Fe2+,进行如下实验操
作时,最佳顺序是( )
①加入足量氯水 ②加入足量 KMnO4 溶液 ③加入少量 KSCN 溶液
A.①③
B.③②
C.③①
D.①②③
解析: 加入 KSCN 无红色物质产生证明无 Fe3+,再加氯水,若有 Fe2+,则 Fe2+可被氧化为 Fe3+,使 KSCN 变红色。KMnO4 也能氧化 Fe2+,但 KMnO4 本N 反应后溶液的颜色不易被观察。
A.A 为 Fe,B 为 FeO
B.C→D 溶液的颜色变化:由浅绿色到黄色 C.④的离子方程式:Fe+Fe3+===2Fe2+
D解.析⑤的:离子由方程红式褐:色4F固e(O体H),2+可O2知+2FH是2OF==e=(O4FHe(O)3H,)3从而得出A为
《铁的重要化合物》优质PPT课件

硝酸根离子在酸性条件下具有强氧化性,将Fe2+ 氧化为Fe3+。
随堂检测
(透过蓝色 钴玻璃)
3、根据上图所表示的物质间的变化情况:
确定它们的化学式。
A__F_e______B___F_e_C_l_2 ___C__K_C_l______ D__F_e_(_O_H_)_3 _E___F_e_C_l_3 ___G__K_O_H______
+3
四氧化三铁 Fe3O4
黑色晶体 磁性氧化铁
+2、+3
均难溶于水 Fe2O3+6H+=
2Fe3++3H2O
Fe3O4+8H+= Fe2+ +2Fe3++4H2O
【实验一】FeCl3、FeCl2分别与NaOH的反应
FeCl3溶结液 论
FeCl2溶液
铁盐和实亚验铁盐溶液生与成氢红氧褐化色钠沉溶淀液,反应生,成分的别灰生白成色了沉不淀同颜色的
1、要证明某溶液中不含Fe3+而可能含有Fe2+。 进行实验操作的顺序有:①加入足量氯水,② 加入足量高锰酸钾溶液,③加入少量硫氰化钾 溶液,其中顺序正确的是 ( )
✓ A.①③ B.③② C.③① D.①②③
随堂检测 2、某物质A的溶液有如下性质:
上述实验现象分析得出(用化学式表示) (1)A是 FeCl2 ,B是 AgCl ,C是 Fe(NO3)2 ; (2)加入盐酸变红的原因?
课后反思:
1.学习元素化合物化学性质的一般方法: 2. 你有哪些收获或疑惑的地方?
谢谢
名称
氢氧化铁
氢氧化亚铁
化学式 颜色 状态
稳定性
Fe(OH)3 不溶于水的红
随堂检测
(透过蓝色 钴玻璃)
3、根据上图所表示的物质间的变化情况:
确定它们的化学式。
A__F_e______B___F_e_C_l_2 ___C__K_C_l______ D__F_e_(_O_H_)_3 _E___F_e_C_l_3 ___G__K_O_H______
+3
四氧化三铁 Fe3O4
黑色晶体 磁性氧化铁
+2、+3
均难溶于水 Fe2O3+6H+=
2Fe3++3H2O
Fe3O4+8H+= Fe2+ +2Fe3++4H2O
【实验一】FeCl3、FeCl2分别与NaOH的反应
FeCl3溶结液 论
FeCl2溶液
铁盐和实亚验铁盐溶液生与成氢红氧褐化色钠沉溶淀液,反应生,成分的别灰生白成色了沉不淀同颜色的
1、要证明某溶液中不含Fe3+而可能含有Fe2+。 进行实验操作的顺序有:①加入足量氯水,② 加入足量高锰酸钾溶液,③加入少量硫氰化钾 溶液,其中顺序正确的是 ( )
✓ A.①③ B.③② C.③① D.①②③
随堂检测 2、某物质A的溶液有如下性质:
上述实验现象分析得出(用化学式表示) (1)A是 FeCl2 ,B是 AgCl ,C是 Fe(NO3)2 ; (2)加入盐酸变红的原因?
课后反思:
1.学习元素化合物化学性质的一般方法: 2. 你有哪些收获或疑惑的地方?
谢谢
名称
氢氧化铁
氢氧化亚铁
化学式 颜色 状态
稳定性
Fe(OH)3 不溶于水的红
人教版化学必修一3.2几种重要的金属化合物----铁的重要化合物(共13张PPT)

氯水,振荡
溶液变成红色
金属铜也能将Fe3+还原:
反应的离子方程式 2Fe3+ + Fe = 3Fe2+ 2Fe2+ + Cl2 = 2Fe3+ +2Cl¯
2FeCl3 + Cu == 2FeCl2+CuCl2 (氧化剂)(还原剂)
【本讲小结】
1.铁的三种氧化物 2.铁的两种氢氧化物的制备和性质 3. Fe2+和Fe3+在一定条件下相互转化
交流和讨论: 有哪些方法可以鉴别FeCl3溶 液和FeCl2溶液
Fe2+ 和Fe3+的鉴别方法 (1)颜色:Fe 2+ 浅绿色 Fe3+ 黄色 . (2)SCN- 法:滴入KSCN溶液或其他可溶 性硫氰化物的溶液,呈 红 色的是Fe 3+ (3)碱液法:分别加入碱液(或氨水),生 成 红褐 色沉淀是Fe3+溶液,先生成 白 色沉淀,又迅速转变为 灰绿 色,最后变 为红褐 色的是Fe2+溶液
不溶
Fe3O4+8H+=Fe2++ 2Fe3++4H2O
铁的氧化物的用途
Ⅰ.作为冶炼金属的原料,如 赤铁矿
高温
Fe2O3+3CO ═ 2 Fe+3CO2
Ⅱ.氧化铁常用于制造红色油漆 和涂料 Ⅲ、特制的磁性氧化铁可做录 音磁带和电信器材。
2.铁的氢氧化物
Fe(OH)3 可溶性铁盐+可溶性碱
Fe(OH)2 可溶性亚铁盐+可溶性碱
(2)Fe3+离子的氧化性
如何防止FeCl2溶液的Fe2+被氧化成Fe3+?
科学探究:在FeCl3溶液中加入足量Fe粉,振荡。再滴入 几滴KSCN溶液,观察现象;在以上所得到的FeCl2和 KSCN的混合溶液中,滴加氯水(Cl2),再观察现象。
课件4:3.2.3 铁的重要化合物

方法二:在如图装置中,用NaOH溶液、铁屑、 稀H2SO4等试剂制备。 (1)在试管I里加入的试剂是 H2SO4、铁屑 (2)在试管II里加入的试剂是 NaOH溶液 (3)为了制得白色Fe (OH )2沉淀,在试管I中加 入试剂,打开止水夹,塞紧塞子后的实验步骤是
检验试管II出口处排出的氢气的纯度。当排出的
讨论:用下面两种方法可以制得白色的Fe(OH)2沉淀。 方法一:用不含 Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的
NaOH 溶液反应制备。
(2)除去蒸馏水中溶解的O2常采用__煮__沸___的方法。 ( 3 ) 生 成 白 色 Fe(OH)2 沉 淀 的 操 作 是 用 长 滴 管 吸 取 不 含 O 2 的 NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操 作的理由是__避__免__生__成__的__F_e_(_O_H__)2_沉__淀__接__触__O__2________________。
2Fe(OH)3==Fe2O3+3H2O
白色灰绿色红褐色 4Fe(OH)2+2H2O+O2=4Fe(OH)3
与盐酸 反应
Fe(OH)3+3H+= Fe3++3H2O
Fe(OH)2+2H+=Fe2++2H2O
科学探究
如何长时间保留Fe(OH)2?
隔绝空气(氧气)
1、配制NaOH和FeSO4,应用煮沸后的蒸馏水 2、加入FeSO4溶液后,可加少量煤油或苯等 3、胶头滴管插入液面以下
讨论:如何鉴别Fe2+与FБайду номын сангаас3+?
鉴别方法
Fe2+
直接观色
人教版高中化学必修一课件3.2.3《铁的重要化合物》PPT(新-).pptx

向FeCl3和FeCl2溶液中分别滴入KSCN溶液
FeCl3溶液 FeCl2溶液
滴入KSCN溶液 溶液呈血红色 溶液颜色无变化
有哪些方法可以鉴别 FeCl3溶液和FeCl2溶液?
Fe2+和Fe3+的鉴别方法:
(1)颜色:Fe 2+ 浅Fe绿3+ 色 . 黄色
(2)KSCN法:滴入KSCN溶液,呈_血__红___ 色的溶液中含有Fe 3+
空白演示
在此输入您的封面副标题
3.2.3《铁的重要 化合物》
教学目标
知识与能力: 铁的氧化物的性质与比较;铁的氢氧 化物的性质与比较;Fe3+离子的检验; “铁三角”(即Fe. Fe2+ .Fe3+之间的 转化)
教学方法:
通过讨论、发现问题、实验探究、类 比、构建思维导图等方法
一、铁的氧化物
思考与交流
既然Fe(OH)2 容易被空气中的氧气氧化,那么在 制备Fe(OH)2时应采取哪些措施防止其被氧化?
三、铁盐和亚铁盐
1、常见的铁盐和亚铁盐 铁盐:FeCl3、 Fe2(SO4)3 、 Fe(NO3)3 亚铁盐:FeCl2 、Fe(SO4)2 、Fe(NO3)2
(1)、Fe3+离子的检验
Ⅰ.作为冶炼金属的原料
高温
Fe2O3+3CO===2Fe+3CO2
Ⅱ.氧化铁常用于制造红色油漆和涂料
氧化铁作外墙涂料
二、铁的氢氧化物
有两种:Fe(OH)3、Fe(OH) 2
如何制备Fe(OH)3、Fe(OH)2?
实验3-9
在FeCl3、FeSO4分别加入NaOH溶液
FeCl3
加入NaOH溶 液产生的现 产生红褐色的沉淀 象
3-2-3铁的重要化合物PPT58张

④开始铁与 H2SO4 反应产生的 H2,减少了 NaOH 溶液中 O2 的溶解并排净了试管内空气,铁片代替③中的铁粉,减少了 Fe 粉存在对 Fe(OH)2 的观察,并使白色沉淀保持较长时间,最 好是在④装置后再接一个③图后面的烧杯,用以隔离空气。
【典题例练 1】 下图中当容器 A 中的反应开始后,若分别 进行下列操作,请回答有关问题:
2.过程方法 (1)利用列表比较的方法,掌握铁的重要化合物的性质。 (2)通过实物展示、演示和学生实验相结合的方法,启发、诱 导学生突破难点、巩固重点。 3.情感态度价值观 (1)结合铁的重要化合物性质的教学,对学生进行辩证唯物主 义教育。 (2)通过启发、诱导、观察、动手、讨论,提高学生思维能力 和灵活分析、解决问题的能力。
【答案】 (1)容器 B 中的导管口有气泡冒出。 (2)容器 A 中溶液进入容器 B,有白色沉淀生成,沉淀迅速 变成灰绿色,最后变为红褐色。 2NaOH+FeSO4===Fe(OH)2↓+Na2SO4 4Fe(OH)2+O2+2H2O===4Fe(OH)3 (3)开始时容器 B 中的导管口有气泡冒出,弹簧夹 C 关闭后 容器 A 中溶液进入容器 B,有白色沉淀生成。
Fe2O3 红棕色粉末
Fe3O4 黑色晶体
溶解性
不溶于水
不溶于水
不溶于水
俗名
铁红
磁性氧化铁
与酸反应的 离子方程式 铁的化合价
FeO+2H+===Fe2+ +H2O +2
Fe2O3+6H+ ===2Fe3++3H2O
+3
+2、+3
重要用途
△ 6FeO+O2=====
2Fe3O4
制红色油漆和涂 料、炼铁
④打开止水夹使反应进行一段时间,然后关闭止水夹,则左 侧试管内 FeSO4 溶液沿导管进入右侧试管内 NaOH 溶液中,产 生白色 Fe(OH)2 沉淀。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C.只有①②③
D.全部
解析:本题涉及0价铁变为+3价铁、+2价铁变为+3价铁及+3价铁变为+2价铁,应从氧化 剂的强弱、反应条件及反应物间的相对量进行分析。
①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不 会将氯化铁还原。②中Fe与稀硫酸反应只能生成Fe2+。③在溶液中Fe2+被Cl2氧化生成 Fe3+。④中首先发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出 反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
实验操作
现象
解释
溶液的颜色: 由棕黄色变 为血红色
Fe3++3SCN-
Fe(SCN)3 (血红色)
结论 及应用 利用该 反应检 验 Fe3+ 的存在
溶液的颜色 无变化
2.Fe3+的氧化性
实验操作
实验现象
溶液由棕黄 色变为浅绿 色,再加入 KSCN 溶 液 时,溶液无明 显变化 加 入 KSCN 溶液后,溶液 无变化,再加 入氯水后,溶 液变成血红 色
FeO+CO
Fe+CO2。
3.Fe3+具有较强氧化性,可被还原为 Fe2+或 Fe
高温
高温
(1)Fe3+被 C、CO、Al 等还原为 Fe,如 Fe2O3+3CO
2Fe+3CO2,Fe2O3+2Al
2Fe+Al2O3。
(2)Fe3+被 Fe、Cu、I-等还原为 Fe2+,如 2Fe3++Cu 2Fe2++Cu2+。
(1)Fe 能被 S、Cu2+、H+等较弱氧化剂氧化为 Fe2+,如 Fe+S
FeS,Fe+Cu2+ Cu+Fe2+。
点燃
(2)Fe 能被 Cl2 等强氧化剂氧化为 Fe3+,如 2Fe+3Cl2
2FeCl3。
2.Fe2+既具有还原性又具有氧化性,可以被氧化为 Fe3+,也可以被还原为 Fe
(1)当 Fe2+遇到强氧化剂(如 Cl2)时,被氧化为 Fe3+,如 2Fe2++Cl2 2Fe3++2Cl-。 (2)当 Fe2+遇到 C、Al、Zn、CO 等还原剂时,可以被还原为 Fe,如 Fe2++Zn Zn2++Fe,
[查阅资料]硫酸和铁可能发生的反应:
6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2O,
Fe+H2SO4 FeSO4+H2↑
【提出猜想】 所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
【实验探究】
实验操作
预期现 象
结论
步骤①:取少量0.01
验证
mol/L酸性KMnO4溶 液,滴入所得溶液
答案:(1)Fe3+、Cu2+ 一定 (2)Fe、Cu 一定
【跟踪训练1】 已知硝酸能将Fe2+氧化为Fe3+。下列物质反应后一定有+3价铁生成的是 (B)
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中 A.只有①
B.只有①③
Fe(OH)2 白色固体 难溶于水
Fe(OH) 2 2H Fe2 2H 2O
Fe(OH)3 红褐色固体
难溶于水
Fe(OH) 3 3H Fe3 3H 2O
稳定性
不稳定,分解产物很 不稳定,受热易分解;
复杂
2Fe(OH)3 Δ
Fe2O3 3H2O
可溶性亚铁盐与碱 可溶性铁盐与碱反应:
制法
4Fe(OH)3(红褐色)
加盐 (SCN-)法
①现象:加入 KSCN 溶液 无明显现象,再滴入氯水
变成血红色溶液
②反应:2Fe2++Cl2
2Fe3++2Cl-
Fe3++3SCN-
Fe(SCN)3(血红色)
①现象:加入 KSCN 溶液,溶 液变为血红色 ②反应: Fe3++3SCN-
Fe(SCN)3
( 1 ) 若 铁 粉 有 剩 余 , 则 容 器 中 不 可 能 有 的 离 子 是 : ____________ ; 铜 单 质 ____________(填“一定”或“可能”)存在。
( 2 ) 若 氯 化 铁 和 氯 化 铜 都 有 剩 余 , 则 容 器 中 不 可 能 有 的 单 质 是 ____________ , Fe2+____________(填“一定”或“可能”)存在。
3.用途 Fe2O3常用做红色油漆和涂料,赤铁矿主要成分是Fe2O3,是炼铁原料。 【问题探究1】 Fe3O4与盐酸反应的产物是什么?
答案:Fe3O4 与盐酸发生反应:
Fe3O4+8HCl FeCl2+2FeCl3+4H2O,
产物为 FeCl2、FeCl3 和 H2O。
二、铁的氢氧化物
化学式 色态 溶解性 与盐 酸反应 (离子 方程式)
______ ______
__
__
猜想
【问题探究】 有同学步提骤出,②若:另外选用KSCN溶液,则仅利含用K有SCN和H2O2两种溶液
即可完成猜想的所有探究,请对该观点进行评价:____________________________。
____________
Fe3+
解析:属于实验探究题,铁与浓硫酸加热下反应,随着反应的进行,浓H2SO4减少,而 且生成水,造成溶液变稀,稀硫酸与铁反应放出H2。可用KMnO4溶液来检测Fe2+的存在, 用SCN-检验Fe3+的存在。
2Fe3++Fe 3Fe2+。
四、铜盐 1.铜化学性质不活泼,使用铜器皿比较安全。 2.铜属于重金属,铜盐溶液都有毒,因为 Cu2+与蛋白质作用,使蛋白质变性而失去生理活性。
3.铜绿的主要成分是 Cu2 (OH)2 CO3 。
要点一:Fe2+、Fe3+、Fe 的相互转变——“铁三角”
1.Fe 只具有还原性,可以被氧化剂氧化为 Fe2+、Fe3+
A.③①
B.③②
C.①③
D.①②③
解析:要证明溶液中不含Fe3+,必须首先用KSCN或NH4SCN检验(溶液不变血红);然 后加入氧化剂(适量氯水)将Fe2+氧化为Fe3+(溶液变血红色)。不宜采用KMnO4溶液 氧化Fe2+,因KMnO4溶液呈紫色,现象变化不明显。
(血红色)
特别提示:含Fe3+的溶液与含SCN-的溶液混合后的现象不是出现血红色沉淀,而是形 成血红色溶液。
【例2】 铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸 加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L酸性 KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究 所得溶液和气体的成分。
特别提示:(1)不同价态的铁及铁的化合物在相互转化时,要注意所用氧化剂和还原 剂的强弱不同。
(2)利用以上转化关系,可总结出铁及不同价态的Fe的化合物的性质、用途、试剂保 存、溶液配制、除杂等。如Fe2+的溶液中含有Fe3+,可加入Fe粉以除去Fe3+等。
【例1】 将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不 参与反应)。试判断下列情况下,溶液中存在的金属离子和金属单质。
反 应 : Fe2++2OH - FeCl3+3;3NaCl
化学 方程式
FeSO4+2NaOH
Fe(OH)2↓+2Na2SO4
4Fe(OH)2 O2 2H2O 4Fe(OH)3
转化 白色沉淀迅速变成灰绿色,最终变成红褐色。
(现象)
三、铁盐和亚铁盐 1.Fe3+的检验
解析:解答时应首先弄清物质间可能发生的反应。凡是相互间能发生反应的物质就不可能大量共存。
本题涉及的反应有:①Fe+2FeCl3 3FeCl2 ②Fe+CuCl2 Cu+FeCl2 ③Cu+2FeCl3 2FeCl2+CuCl2
(1)若铁粉有剩余,则容器中不可能有 Fe3+、Cu2+,因为它们能发生上述①②反应。 (2)若 FeCl3 和 CuCl2 都有剩余,则容器中一定没有 Fe、Cu,一定有 Fe2+。
第3课时 铁的重要化合物
一、铁的氧化物 1.物理性质
名称
氧化亚铁
化学式
FeO
俗名 铁的化合价 颜色、状态
溶解性
+2 黑色粉末
氧化铁
四氧化三铁
Fe2O3
铁红 +3 红棕色粉末 都不溶于水
Fe3O4
磁性氧化铁 +2、+3 黑色晶体
2.化学性质
(1)FeO 不稳定,在空气中受热易被氧化成 Fe3O4 。 (2)FeO 和 Fe2O3 属于碱性氧化物,与盐酸反应的离子方程式分别为:FeO 2H Fe2 H2O Fe2O3 6H 2Fe3 3H2O
答案:【实验探究】(从左往右,从上往下)溶液紫红色褪去 含有Fe2+ 另取少量所得 溶液,滴加KI和淀粉溶液 溶液变蓝色
【问题探究】 不正确 若溶液中含Fe3+则无法检验溶液中是否含有Fe2+
