FDA批准药品(2005)
FDA关于伪劣药品

结论
• 我们必须保护老弱病残 • 我们会对此进行监视 • 我们感谢你们的合作
30
6
未批准药品
• 使用与指定来源工厂原料不一致的原料 会导致伪劣品,但是 • 所生产的产品当然是“未批准新药”
7
示例
• 片剂看起来像“萎哥”但是 • 并不是由FDA批准的生产商生产,加工或 分销的
8
示例
• 由米兰厂家生产的乙酰氨基酚的药物 活性成份,但是 • 标识却标明产品为北京制造
9
示例
• 丁螺环酮药物活性成份为印度制造 • 美国的片剂生产商使用它来制造丁螺环 酮片剂,但是 • FDA批准的简略新药申请(ANDA) 指定的 片剂生产商为加拿大厂家
18
宗谱
• 现代技术 – 包装 – 装运 – 电子化
19
小结
• 伪劣药品是 – 在未知的条件和习惯下生产的 – 使用未知的工艺生产的 – 不能解决的不良产品事件(副作用, 产品缺陷,等) • 监管疏忽会影响工艺 • 缺乏(质量)保障
20
担心被证实了
• 事实: – 海地 1996 – 被污染的“对乙酰氨基酚糖浆”产 品 • 3%甘油 • 水,糖 • 80名儿童死亡
示例
• 一个中国企业在上海和天津有两个工厂 • 天津的工厂在一简略新药申请中获FDA 批准为头孢呋辛钠 的来源工厂 • 企业却提供上海工厂生产的头孢呋辛钠 – 企业建立的批记录标明此头孢呋辛钠 为天津制造
13
示例
• 一跨国企业在法国和意大利设有工厂;FDA 批准了意大利工厂所有头孢克洛化合物的 简略新药申请 • 企业要求法国的工厂生产指定的先导物并 将其送往意大利工厂 • 意大利工厂使用此先导物完成头孢克洛的 合成 • 意大利工厂将该头孢克洛送往美国 – 意大利工厂的批记录标明为全合成
美国FDA药品分类目录

美国FDA药品分类目录FDA是美国食品药品管理局的简称,药品分类目录就是将药物按照某个标准进行分类,通过其目录快速查找药品。
FDA药品分类目录包含了FDA药物的等级分类、FDA申请药品分类、FDA国家药品代码目录等信息,下面为大家一一解读。
一、FDA药物的等级分类及内容清单①等级分类美国食品药品管理局(FDA)根据药物对胎儿的影响情况,将药物对胎儿的危害性等级分为A、B、C、D、X等5个级别。
每个级别阐述如下:A级:经妇女临床对照研究,无法证实药物在妊娠早期与中晚期对胎儿有危害作用,对胎儿危害可能性最小,但仍存在远期胎儿受害的可能,是无致畸药物。
B级:经动物临床对照研究,未见对胎儿有危害作用,未得到有害证据,或不能证实。
C级:动物实验表明对胎儿有不良影响,只能在权衡利害情况下谨慎使用。
D级:有足够证据证明对胎儿有危害性,只有在孕妇有生命威胁或患严重疾患,而无其他有效药物情况下考虑使用。
X级:各种实验证实会导致胎儿危害,在妊娠期间禁止使用。
②分类等级的部分清单药品(1)分类A级:分类A等级的药物极少,维生素属于此类药物,如各种维生素B、C等。
(2)分类B级:分类B等级的药物亦不很多,日常用的抗生素均属此类。
如所有的青霉素族及绝大多数的头孢菌素类药物都是B 类药物,常用的氨苄青霉素、头孢拉定、头孢三嗪和重症感染时抢救用的头孢他定等都是B 类药。
另外,洁霉素、氯林可霉素、红霉素、呋喃妥因也是B 类药。
(3)分类C 级:分类C 等级的药物是较多的。
这一类药物或者问世时间不够长或者较少在孕妇中应用,主要在早期妊娠对胎儿是否会造成损害尚无报道,故难以有比较确切的结论。
如:抗病毒药,大多属于C类,如阿昔洛韦,即无环鸟苷及治疗AIDS病的齐多夫定。
部分抗癫痫药和镇静剂如乙琥胺、非氨脂巴比妥、戊巴比妥等。
在自主神经系统药物中,拟胆碱药、抗胆碱药均属C 类;至于拟肾上腺素药中部分属C类,如肾上腺素、麻黄素、多巴胺等。
盐酸考尼伐坦的研究进展

盐酸考尼伐坦的研究进展1、低钠血症治疗的研究概述低钠血症是临床最为常见的电解质紊乱,在住院患者中发生率可达15% - 30%[1]。
尽管大多数低钠血症患者症状轻微,但低钠血症的诊治在临床上是非常重要的,这是因为:(1)急性、严重的低钠血症可以导致极高的致死率;(2)基础病变为广泛的实质性疾病的患者,若伴有低钠血症病死率会更高;(3)过度快速纠正慢性低钠血症可以引发严重的神经性病变和死亡。
尽管早在20世纪中叶就有了对低钠血症的了解,然而由于它在不同的病理生理发病机制下有着多样的病因学,并且常常与很多实质性疾病相关,导致这一常见的电解质紊乱至今没有被很多的基层医疗机构完全认识。
正因为这些原因和急、慢性低钠血症的临床及症状学表现的显著不同,理想的治疗低钠血症的措施至今还没有完全建立。
由于抗利尿激素受体拮抗剂具有独特的促利尿功能,即可以选择性地增加肾脏可溶性水的排出,目前认为是治疗低钠血症的一种最为有效的方法[2]。
2005年美国食品药品管理局批准了一种这类药—conivaptan,这宣告了治疗低钠血症新时代的到来。
1.1低钠血症的症状和危害低钠血症引起血液低渗状态,此种情况在临床上极为常见,特别在老年人中[3,4]。
当血浆中钠离子浓度降低时,为了保持细胞内外的钠离子浓度平衡,细胞外的液体就会进入细胞内,这样细胞就会肿胀。
当脑细胞肿胀时,就会导致各种低钠血的症状出现。
包括头昏、虚弱、头痛、恶心、意识错乱以及意识减缩和惊厥发生。
严重的低钠血症会导致昏迷和死亡。
在美国每年有4%的住院患者深受这种疾病的困扰。
尽管很多低钠血症患者的症状都不明显,但严重时会导致脑水肿、呼吸停止甚至死亡⑸。
癌症、甲状腺功能减退、使用某些药物(如某些抗抑郁药)等,极易造成全身体液增加而钠不增加,出现低钠血症⑹。
低钠血症是增加充血性心力衰竭(CHF)患者死亡率的危险因素,是末期肝病肝移植前死亡的重要因素之一[7-9]。
盐酸考尼伐坦将对肝移植手术期血容量过多性低钠血症的治疗起到良好的作用。
全球批准的主要生物药
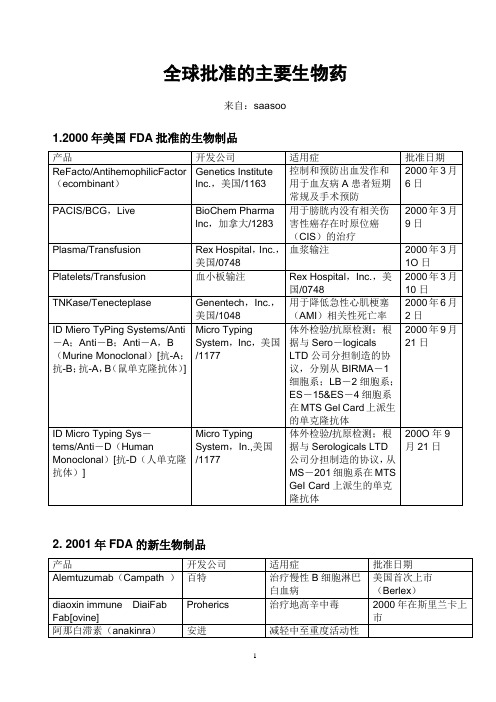
3.2002年FDA批准的生物技术药物所开发的小分子药物,组织工程产品,药物新剂型等。
4. 2003 年被批准上市的生物药物5.部分2004 年被FDA 批准上市的生物药物pramlintide(普兰林肽,Symlin)Amylin制药公司1、2型糖尿病2005年3月16日exenatide(Byetta)(肽类)Amylin制药公司控制2型糖尿病患者的血糖水平2005年4月28日galsulfase (Naglazyme)BioMarin 治疗遗传性疾病Ⅵ型粘多糖增多症2005年5月31日insulin detemir(地特胰岛素,Levemir)诺和诺德公司(Novo Nordisk)需要长效胰岛素治疗的1、2型糖尿病患者2005年6月16日mecasermin(人源化美卡舍明,Increlex)Tercica 治疗严重的原发性胰岛素样生长因子-1(IGF-1)缺乏导致的发育不足的儿童2005年8月30日hyaluronidase(透明质酸酶,Hydase)Primapharm公司作为皮下输液时的辅助药物以提高注射剂药物的吸收和分散;也作为皮下注射法尿路造影术时的辅助药物以提高造影剂的再吸收2005年10月25日abatacept(Orencia)百时美施贵宝公司中重度类风湿性关节炎2005年12月23日7. 2006年被FDA 批准上市的生物药物8.2007 年被FDA 批准上市的生物药物9. 2008年全球批准的新生物药品美国食品药品管理局(FDA)下属药物评价及研究中心(CDER)最终在2008年批准了21种新分子实体药物(NMEs)和3种新生物制品(BLAs)的上市申请,其数目创下了近411. 2010年度FDA批准的6种生物新药。
替加环素合理用药指南解读(完整版)

替加环素合理用药指南解读(完整版)替加环素(Tigecycline)作为首个(2005 年6 月)被美国食品和药品管理局(Foodand DrugAdministration,FDA)批准的新一代广谱的甘氨酰四环素类抗菌药物,能克服由细菌外排及核糖体保护所导致的四环素耐药性[1],对常见致病菌或多重耐药菌保持良好的抗菌活性,广泛覆盖G+ 球菌、G–杆菌、耐甲氧西林金黄色葡萄球菌(MRSA)、产超广谱β- 内酰胺酶(ESBLS)阳性的肠杆菌属、嗜麦芽窄食单胞菌及多药耐药的鲍曼不动杆菌。
由于其抗菌谱广,2010 年被美国感染协会及外科感染协会正式批准用于治疗成人复杂的腹腔感染及皮肤软组织感染。
2004 ~2010 年亚太区耐药菌耐药趋势(TEST)报告显示,替加环素对常见的耐药菌保持良好的抗菌活性,对G+ 的抗菌活性保持在99%以上,最低抑菌浓度(MIC)值在0.5 以下,对G–的抗菌活性保持在85% 以上。
2010 年发表于SouthAfrican Medical Journal(SAMJ)的《替加环素合理使用指南》由南非外科医师协会、南非重症医学会、南非感染性疾病学会、南非胸外科协会以及南非创伤学会等学术组织共同举办的全国性多学科学术会议制定,用以指导南非国内替加环素的合理使用[4]。
该指南虽未提出新的推荐意见,但汇总参考了当前国际现有的临床研究证据和专家共识,就替加环素的适应症、剂量疗程等若干重要问题进行了阐述。
该指南未明确给出证据质量分级,覆盖的文献不够全面,综合性有所欠缺;但作为替加环素的首个使用指南,对临床实践有一定的指导意义。
本文旨在介绍该指南的主要特点,就其重要内容和意见做进一步解读。
1 药理作用与代谢分布替加环素作为一种半合成的四环素类药物,是在米诺环素9 位分子上添加叔丁基甘氨酞胺基团而衍生的一种新型四环素类抗生素,能克服获得性的核糖体保护tet(M)和主动外排tet(A.E)这两个临床上产生耐药性的主要机制,从而导致细菌对替加环素产生显著耐药性的可能性很小,只有发生极其显著的突变才有可能导致细菌对替加环素的耐药。
替加环素研究新进展_钟雪 (1)

收稿日期:2015-01-08基金项目:国家科技部十二五重大新药创制-心脑血管疾病新药临床评价技术平台研究课题(No. 2012ZX09303-008-002)。
作者简介:钟雪,女,生于1988年,在读博士研究生,主要研究抗菌药物耐药机制。
E-mail: bhdxzhongxue@*通迅作者,胡欣,E-mail: huxinbjyy@ ;程刚,E-mail: chenggang63@文章编号:1001-8689(2015)11-0870-06替加环素研究新进展钟雪1,2 陈东科2 许宏涛2 程刚1,* 胡欣2,*(1 沈阳药科大学药学院, 沈阳 110016;2 北京医院药学部,北京 100730)摘要: 近年来随着广谱抗生素、免疫抑制剂、侵入性治疗的广泛应用,多重耐药菌、甚至泛耐药菌比例不断上升,给临床抗感染治疗带来了巨大困难。
替加环素这一具有对抗多种耐药机制的新型抗生素于2011年进入我国市场,为临床有效抗感染治疗带来了新的希望,也被誉为抗感染的最后一道防线。
随着国内外科研人员及临床医生不断探索,近些年对替加环素的认识又有了新的突破。
我们综述了近年来替加环素的研究进展,包括体外抗菌活性测定,耐药机制及应对措施,超适应症用药及使用剂量。
关键词: 替加环素;体外抗菌活性;耐药机制;适应症;剂量中图分类号:R978.1 文献标志码:A New advance in the study of tigecyclineZhong Xue 1,2, Chen Dong-ke 2, Xu Hong-tao 2, Cheng Gang 1 and Hu Xin 2(1 Department of Pharmaceutics, School of Pharmcy, Shenyang Pharmaceutical University, Shenyang 110016;2 Department of Pharmacy, Beijing Hospital, Beijing 100730)Abstract There is a huge challenge for clinical anti-infection treatment due to the increasing proportion of multidrug-resistant pathogens and pan drug-resistant pathogens caused by wide application of broad spectrum antibiotics, immunosuppressants and invasive treatment in recent years. Tigecycline, a new antimicrobial agent which can overcome multiple resistance mechanisms, was launched in China in 2011. It has brought new hope for clinical effective anti-infection treatment, and it has been known as the last line for anti-infection treatment. We have a new breakthrough understanding of tigecycline with continuously exploring by the domestic and foreign researchers and clinicians in recent years. In this article we reviewed advance of tigecycline in recent years, including antibacterial activity test in vitro , resistance mechanism and solutions, super indication and dosage.Key words Tigecycline; Susceptibility testing; Drug-resistance mechanism; Indication; Dosage 近年来耐药菌的检出率逐年增高,尤其是产超广谱β-内酰胺酶(ESBL)和AmpC 酶肠杆菌属及泛耐药的肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌的抗生素选择已成为世界抗感染治疗面临的严峻挑战。
索拉非尼的不良反应信号挖掘

索拉非尼的不良反应信号挖掘周健;陈力【摘要】目的为了挖掘分子靶向抗癌药索拉非尼的不良反应信号,为临床安全用药提供参考.方法利用比例失衡法中的报告比值比法(ROR)和比例报告比值法(PRR)对美国FDA不良事件报告系统(FAERS)2012年第四季度~2016年第四季度共17个季度的报告进行数据挖掘.结果使用ROR法与PRR法共得到索拉非尼不良反应信号777个,二次筛选后得到索拉非尼不良反应信号68个,主要集中在肿瘤、肝胆疾病、胃肠道疾病与皮肤疾病.结论本研究有效利用ROR法和PRR法挖掘出索拉非尼的不良反应信号;建议临床用药时,充分考虑索拉非尼可能导致的不良反应进行适合的用药.%Objective To excavate the adverse drug reaction signals of molecular targeted antitumor drug Sorafenib,in or der to provide references for safety medicinal practice.Methods Conduct data-mining on the reporting odds ratio (ROR) and proportional reporting ratio (PRR) in measures of disproportionality to the reports in 17 quarters (Q4,2012-Q4,2016) in FDA Adverse Event Reporting System (FAERS).Results Seven hundred and seventy-seven Sorafenib adverse drug reaction signals were obtained with ROR and PRR methods.After the secondary screening,68 Sorafenib adverse drug reaction signals were obtained,which were mainly concentrated in tumors,hepatobiliary,gastrointestinal and skin diseases.Conclusion In this study,ROR and PRR are effectively used to extract the adverse drug reaction signals of Sorafenib.It is recommended that the appropriate attentions should be paid to the possible adverse reactions caused by Sorafenib.【期刊名称】《中国医药导报》【年(卷),期】2018(015)014【总页数】5页(P111-115)【关键词】分子靶向药;不良反应信号;比例失衡法;索拉非尼【作者】周健;陈力【作者单位】成都市第三人民医院药剂科,四川成都610031;四川大学华西第二医院药学部,四川成都610041【正文语种】中文【中图分类】R979近年来,由于分子靶向药物只针对肿瘤细胞发挥作用,而对正常细胞的杀伤小,全身毒副作用较低,临床疗效显著的特点,其在肿瘤治疗临床实践中起到重要作用[1]。
美国专利到期的药物精选

美国专利到期的药物精选一、精神、神经系统药类1、郁复伸中文通用名:文拉法辛;别名:维拉法辛。
英文通用名:venlafaxine ;英文商品名:Effexor。
药品简介:文拉法辛是中枢神经系统药物,用于治疗精神失常、躁狂抑郁症和抑郁症。
由惠氏公司开发并于1994 年4 月首次在美国上市,此后相继在加拿大、丹麦、英国、意大利、澳大利亚等国上市。
文拉法辛具有临床疗效好、安全性高和治疗成本较低等特点,其2002 年全球销售约为21 亿美元,位列药品销售400 强的第21 位。
美国专利名称:2-苯基-2-(1-羟基环炔基或1-羟基环烷基-2-烯基) 乙胺衍生物(专利号:US4535186)专利权人:American Home Prod注:该专利到期日:2007 年12 月13 日(该专利申请日:1983 年10 月26 日;原来到期日:2002 年12 月13日;后被批准延长5 年) 。
该专利因获得美国儿科药市场独占,到期日延至2008 年6 月13 日。
同族专利: US4535186[1985208213 ]2、罗匹尼罗英文通用名:Ropinirole ;英文商品名:ReQuip 。
药品简介:罗匹尼罗于1997 年首次被批准用于帕金森病,是一种类似多巴胺的多巴胺激动剂,与第一代多巴胺激动剂不同的是其没有麦角林结构。
因为多巴胺激动剂较少引起运动不良反应,2001 年7 月,新的帕金森病治疗指南建议用多巴胺激动剂如葛兰素- 史克公司的罗匹尼罗(ropinirole ,ReQuip ○R ) 代替左旋多巴作为疾病早期的初始一线治疗用药。
2005 年美国食品药品管理局(FDA) 批准罗匹尼罗用于治疗中度到重度的多动腿综合征(RLS) 。
美国专利名称:42氨烷基22 (3H)2吲哚酮类化合物(专利号:US4452808 )专利权人: Smithkline Beckman Corp该专利到期日:2007 年12 月7 日(该专利申请日:1982 年12 月7 日;原来到期日:2002 年12 月7 日;后被批准延长5 年) 。
如何使用美国FDA数据库查询原研药品信息及其应用

如何使⽤美国FDA数据库查询原研药品信息及其应⽤⽂章来源:北京药研汇⼀、美国FDA药品数据库的建库⽬的及主要⽤途是什么?美国FDA药品数据库能够让你查询关于FDA批准的新药、仿制药和治疗性⽣物制品的官⽅信息。
美国FDA药品数据库的主要⽤途:1、寻找药品批准的标签/说明书2、寻找⼀个创新药的仿制药品3、寻找新药和仿制药的治疗等效产品4、寻找1998年以后批准药品的消费信息5、找到⼀个特定的活性成分对应的所有药品6、查看药品的审批历史记录⼆、美国FDA药品数据库包含哪些药品美国FDA药品数据库包含⽬前在美国批准上市的处⽅药(RX)、⾮处⽅药(OTC)和治疗性⽣物制品。
美国FDA药品数据库还包括撤市药品和化学类型6类(New indication [no longer used])。
美国FDA药品数据库包含了⼤多数1939年以来批准的药品。
对于1998年之后批准的药品,⼤多数的标签、批准书、历史回顾和其它信息都是可⽤的。
注意:美国FDA药品数据库并⾮包含所有的治疗性⽣物制品。
主要包括以下类型:a、单克隆抗体;b、细胞因⼦、⽣长因⼦、酶、免疫调节剂和溶栓。
c、从动物或微⽣物中提取的⽤于治疗⽬的蛋⽩质,包括这些产品的重组版本(除凝⾎因⼦)d、其他⾮疫苗的治疗性免疫疗法。
三、图⽂解读:⼿把⼿教你如何使⽤Drugs@FDA(FDA数据库)原研药品查询FDA的⽹站包罗万象,Drugs@FDA作为其中⼀个数据库主要可以帮助我们完成以下两项⼯作:1)了解药物审批历史和标签信息2)寻找新药或仿制药的治疗等效产品(仿制药)⼯欲善其事,必先利其器。
作为药学⼯作者,快速有效查询到相关的药品信成为⼀项必备技能,今天就利⽤Drugs@FDA这把利器,带⼤家熟悉美国上市药品信息的查询。
我们以查找抗癌药物Sorafenib (Nexavar)的药品说明书和审评历史为例。
1、⾸先,在Drugs@FDA的搜索栏输⼊活性成分名称“Sorafenib”或者商品名“Nexavar”,然后提交。
抗乙肝恩替卡韦 有“三绝”

抗乙肝恩替卡韦有“三绝”作者:来源:《家庭医药》2018年第08期恩替卡韦是继拉米夫定和阿德福韦酯之后第三个获批用于治疗慢性乙肝的药物。
然而,恩替卡韦最初问世的时候,是准备用来治疗疱疹病毒感染的。
结果发现,恩替卡韦对疱疹病毒的抑制作用一般,对乙肝病毒却有强大的抑制作用,歪打正着地成了专门抑制乙肝病毒的新药。
恩替卡韦于2005年3月被美国食品药品监督管理局(FDA)批准上市,同年10月份进入中国。
恩替卡韦是全球各大乙肝指南公认的一线抗乙肝病毒药物,其特点有“三绝”:绝大多数患者有效;绝少耐药;绝少不良反应。
绝大多数有效只要规范使用恩替卡韦,绝大多数的乙肝患者可以获得满意的疗效。
服用恩替卡韦满1年,90%的患者可以获得HBV-DNA(乙型肝炎病毒DNA)转阴的良好疗效,服用恩替卡韦满2年,99%的患者HBV-DNA定量低于检测下限。
长期使用恩替卡韦可以最大程度减轻肝脏炎症,逆转肝脏纤维化甚至肝硬化。
应用恩替卡韦治疗5年,肝脏组织学可见明显改善,88%的患者可以出现肝脏纤维化改善,40%可以有不同程度肝硬化逆转。
绝少耐药只要规范使用恩替卡韦,绝少发生耐药现象。
曾几何时,耐药成了慢性乙肝抗病毒治疗的最大障碍。
拉米夫定是人類历史上第一个抗乙肝病毒药物,其最大的缺点就是高耐药率,随着拉米夫定治疗时间的延长,病毒耐药突变发生率逐年增高,第1、2、3、4年分别为14%、38%、49%、66%。
恩替卡韦的横空出世,将乙肝抗病毒治疗带入低耐药率时代,使得“最大限度地长期抑制乙肝病毒复制”成为容易实现的目标,初次选择恩替卡韦治疗,5年耐药率仅仅1.2%。
绝少不良反应恩替卡韦长期治疗绝少不良反应。
长期服用替比夫定要担心肌肉毒性,长期服用阿德福韦酯会担心潜在的肾毒性,但是恩替卡韦长期治疗没有发现严重的不良反应。
原来担心恩替卡韦可能存在潜在的致癌风险,也被长期的临床观察所否定。
恩替卡韦目前被认为是最安全的抗乙肝病毒药物。
恩替卡韦适用于病毒复制活跃,血清ALT(谷丙转氨酶)持续升高或肝脏组织学显示有活动性病变的慢性成人乙型肝炎的治疗;也适用于治疗2~18岁慢性乙肝病毒感染代偿性肝病的核苷初治儿童患者,有病毒复制活跃和血清ALT水平持续升高的证据或中度至重度炎症和/或纤维化的组织学证据。
替加环素

• 2005年美国食品药品管理局( FDA)批准:替 加环素用于治疗18岁及以上患者敏感菌所 致感染,适应症包括:复杂腹腔内感染(如复杂 阑尾炎、烧伤感染、腹内脓肿、深部软组 织感染及溃疡感染)和复杂的皮肤及软组织 感染。
• 常见的不良反应有恶心、呕吐、眩晕,少 数有转氨酶升高,色素沉着等。2010年美 国FDA发布警告提醒替加环素静脉应用治 疗呼吸机性肺炎可能导致死亡风险,其原 因未明。
• 病情演变:患者入院后诊断为急性单核细 胞白血病,肺部感染,经积极治疗,患者 体温有所下降,但体温波动明显,并继续 高热,出现鼻部组织坏死,头面部肿胀, 肿胀以鼻翼部、蝶窦区明显,不完全肠梗 阻,心功能不全。
• 病情分析: 患者急性单核细胞白血病,多次化疗后, 未达PR,处于中性粒细胞缺乏状态,降钙 素原明显升高(1.02ng/ml)。患者此次入 院,发热明显,经实验室检查,考虑患者 发热根本原因为白血病未控制所致,对于 此类患者,应重拳出击。
替加环素治疗白血病发热1例
徐瑞荣 山东中医药大学附属医院血液病科
病情介绍
• 患者岳XX,女,27岁,诊断为急性单核细胞白血 病1年余,应用DA 、TAE 、 CAG 、FLAG等方 案化疗,未缓解,血象处于白细胞减少状态,体 温波动明显。患者曾多次于我科住院治疗,此次 患者以高热为主要症状入院。 • 既往患者有真菌感染病史(血象)。 • 入院情况:发热,峰值38.2℃ ,无咳嗽,心慌伴 胸闷,无出血倾向,听诊双肺呼吸音粗,双肺可 及少许湿罗音,心率95次/分,律齐,各瓣膜听诊 区未及病理性杂音,腹软,肝脾肋下未及。血常 规:白细胞0.95×10^9/l,血红蛋白59g/l,血小板 19×10^9/l。
• 5.最终治疗方案:根据患者病情,及血常规、 血生化、血培养、降钙素原、G/GM等,方 案为替加环素、卡泊芬净。 • 6.诊疗过程中多次组织院内会诊,均不排除 多药耐药可能,应用替加环素治疗。 • 7.治疗时并给予营养支持,提高免疫,输血 支持。并给予安宫牛黄丸、羚羊角粉等中 药治疗。
阿立哌唑口服液获美国FDA批准上市

阿立哌唑口服液获美国FDA批准上市
阿立哌唑口服液获美国FDA批准上市
黄琳
【摘要】2005年1月4日,百时美施贵宝公司和大冢制药有限公司向新闻媒体
宣布,他们研制的阿立哌唑(aripiprazole,Abilify)口服液已获美国FDA许可,并将于2005年2月在药房出售。
【期刊名称】《上海医药》
【年(卷),期】2005(026)002
【总页数】1页(P88)
【关键词】阿立哌唑;美国FDA;口服液;批准上市;药房;许可;制药;百时美施贵宝公司;出售;有限公司
【作者】黄琳
【作者单位】无
【正文语种】中文
【中图分类】医药卫生
美阁默克创药公司;£况袁松范自默克制药公司生产的类风湿性关节炎治疗药万洛由于心血管副作用而从全球召回后,受到波及的还有其它的 COX-2 抑制剂。
到2004 年 11 月底,默克制药公司已经面临475人的 1100 项上诉,其中,60%
在州法院,40% 在联邦法院。
默克制药公司曾谋求通过联邦法院一次性解决途径。
但是,由于各人情况不同,心脏病发病的因素也是多种多样,可能仍然需要采取
不同的方式解决,开庭时间可能最早也要在2005 年上半年,地点可能是德克萨。
印度来那度胺有几种规格?不同规格有什么不同?

印度来那度胺有几种规格?不同规格有什么不同?印度来那度胺剂量,副作用,版本,效果等相关问题交流微信thk298前言多发性骨髓瘤在我国的发病率低,但患病人数仍接近十万人。
肿瘤科医师李主任说过,我国多发性骨髓瘤病人的总生存期低于国外的大部分原因就是经济原因。
据了解,来那度胺进入医保后,一年将近30万,这让很多患者都采取的保守的治疗方法。
来那度胺治疗多发性骨髓瘤病的效果来那度胺是美国新基医药研发的抗肿瘤抑制剂,于2005年被美国食品药品监督局(FDA)的批准而上市。
来那度胺可治疗多发性骨髓瘤、增生异常综合征以及自身免疫性疾病等病症。
需要注意的是,来那度胺治疗多发性骨髓瘤需要与地塞米松合用。
在临床上,服用来那度胺的多发性骨髓瘤患者,中位生存期有2年,原治疗方案为6-9个月,且服用来那度胺的有效率有75%左右。
常见的不良反应大于40%的有疲乏、中性粒细胞减少和便秘,在20%~40%之中的有腹泻、肌肉痉挛、贫血、血小板减少和皮疹。
印度来那度胺印度来那度胺微号thk298和进口药物制剂中的生物利用度相同,即活性药物被人体利用的程度是等效的,包括了药物进入全身血液循环的浓度和速度。
生物利用度是衡量一些不同制剂疗效的一个重要指标。
在上个世纪60年代,虽然一些药物制剂符合该药品的规定,在化学成分和含量方面是一致的,但作用于人体时,血药浓度和吸收速率是不一样的,因而出现了生物利用度这一概念。
印度规格有5mg,10mg,15mg和25mg4种规格,产家是知名企业Natco公司。
来那度胺治疗多发性骨髓瘤的服用方法是按周期服用的,1个治疗周期为28天,第1~21天每天服用来那度胺的剂量为25mg,与其合用的地塞米松在前4个周期中的第1~4、9~12、17~20天每天服用1次地塞米松40mg;从第五个周期开始地塞米松调整为第1~4天每天服用1次地塞米松40mg,其它不变。
失眠症治疗药物雷美替胺的研究进展

失眠症治疗药物雷美替胺的研究进展作者:鲁雅梁刚锋徐佳宇来源:《科学与技术》 2019年第2期鲁雅1 梁刚锋2 徐佳宇2浙江师范大学行知学院摘要:雷美替胺,(S)-N-[2-(1,6,7,8-四氢-2H-茚并-[5,4-b]呋喃-8-基)乙基]丙酰胺,是一种选择性褪黑激素受体激动剂,于2005年获得美国食品药品监督管理局批准,用于治疗失眠症。
本文对失眠症产生原因、雷美替胺合成工艺以及应用研究进行了综述。
关键词:雷美替胺;研究进展;综述1 简介雷美替胺(Rozerem,Takeda Pharmaceuticals America,Inc.,Deerfield,IL(1))是美国食品和药物管理局(FDA)批准的第一种选择性褪黑激素受体激动剂[12]。
商品名:Rozerem,化学名:(S)-N-[2-(1,6,7,8-四氢-2H-茚并-[5,4-b]呋喃 -8- 基)乙基]丙酰胺。
它于2005年获得美国食品药品监督管理局的批准,用于治疗以失眠为特征的难以入睡的失眠,目前正在美国进行2期开发,用于治疗昼夜节律睡眠障碍。
雷美替胺在美国以外地区还没有上市,但它已在欧洲提交了审批申请,目前正在日本开发。
此药物可用于治疗难以入睡型失眠症,对慢性失眠和短期失眠也有确切疗效。
雷美替胺能选择性激动褪黑激素受体MT1和MT2,增加慢波睡眠(SWS)和快动眼睡眠(REW),从而减少失眠。
雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物[1]。
2 结构与理化性质3合成路线根据1964年Corey创立的逆合成分析法,雷美替胺可以由下图所示的两种关键中间体3-2和3-3合成[2],中间体又可以由原料1,2,6,7-四氢-8H-茚并[5,4-b]呋喃-8-酮(3-4)或6-甲氧基-1-茚酮(3-5)制得。
其中合成原料3-4最为重要,故对3-4的合成方案进行详细归纳[3-4]。
(1)6-甲氧基-1-茚酮为原料以6-甲氧基-1-茚酮为原料,首先在Br2/醋酸钠环境下进行溴的取代,然后用三溴化硼脱甲氧基得到3-7,3-7进行醚化反应、Claisen重排得到3-9,3-9进行低温臭氧化反应、催化氢解脱溴后得到物质3-11,最后与甲磺酰氯和吡啶反应得到原料3-4。
2005年全世界上市新药

2005年全世界上市新药
熊方武;吴佳
【期刊名称】《抗感染药学》
【年(卷),期】2006(3)4
【总页数】2页(P193-194)
【关键词】药学规划;上市新药;新药开发
【作者】熊方武;吴佳
【作者单位】<中国药师>编辑部;湖北省医科院信息中心
【正文语种】中文
【中图分类】R926
【相关文献】
1.2011年FDA批准上市新药及全球新药研究最新进展 [J], 陈玲;邹栩;黄文龙
2.开发中的候选新药第13讲抑郁症治疗药和癫痫治疗药part 2癫痫治疗药期盼已久的药品审评滞后(drug Iag)解除两种新药将在日本国内上市 [J], 伊藤胜彦
3.把好新药上市前的第一关——访国家上海新药安全评价研究中心 [J], 吴弼人
4.基于中美日新药上市现状对比的抗肿瘤新药发展策略研究 [J], 崔积钰;韩优莉
5.新药专项“三重”课题军民融合成功典范——国家战略性药品、抗超级耐药菌感染新药“替加环素(海正力星)”上市发布会在京举行 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
恩替卡韦药物报告

製造販売元/沢井製薬株式会社
製造販売/サンド株式会社
製造販売元/ブリストル?マイヤーズスクイブ株式会社
3
药物报告
Drug Report
商标名
エンテカビル錠 0.5mg 「タカタ」
エンテカビル錠 0.5mg 「CMX」
エンテカビル錠 0.5mg 「EE」
エンテカビル錠 0.5mg 「ファイザー」
エンテカビル錠0.5 mg「KN」
2
药物报告
Drug Report
【欧盟上市情况(79 条)】
编号
药品名称
活性成分
EMEA/H/C/000623
Baraclude
entecavir
EMEA/H/C/004377
Entecavir Mylan
entecavir monohydrate
EMEA/H/C/004458
Entecavir Accord
エーザイ株式会社販売提携/エーザイ株式会社 製造販売/ファイザー株式会社提携/マイラン製薬株式会
社 製造販売元/小林化工株式会社
販売元/株式会社陽進堂製造販売元/大興製薬株式会社
【主要上市国家/地区(14 条)】
国家名称
上市公司
商标名
Arg.
BMS
Baraclude
Austral.
BMS
Baraclude
Singapore
BMS
Baraclude
UK
BMS
Baraclude
USA
BMS
Baraclude
活性成分 Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir Entecavir
抗肿瘤药新制剂

市场调研MAR KET I N G I N VES T I GAT I O N抗肿瘤药新制剂黄胜炎 中图分类号:R979.1 文献标识码:C 文章编号:1006-1533(2005)05-0211-04 全球抗肿瘤药市场是继心血管药和中枢神经系统药后的第三大医药市场,目前正迅速发展。
据估计,2004年其销售额为400亿美元,2010年将增至600亿美元,年增长率逾10%。
2004年销售前20位抗肿瘤药在7个主要国家的药品市场上总销售额超过270亿美元,其中美国占67%,日本占12%,5个主要欧洲国家占21%。
全球前20位抗肿瘤药销售总额占抗肿瘤药市场77%的份额。
研发抗肿瘤释药系统是一种挑战。
肿瘤给药发展趋势不再是简单地开发不同给药途径的新制剂,而是病灶靶位给药。
这种较新的途径不仅是常规的化疗和放疗的补充,而且还能防止损伤正常组织和产生药物的耐药性。
一些用于肿瘤释药的新颖方法有采用微粒作为抗肿瘤药的载体,注入血液循环后以外加磁场引导药物靶位给药,聚乙二醇化注射剂可克服抗癌释药的障碍,其它载体还有脂质体、微球和单克隆抗体等。
释药的战略是根据肿瘤的类型和患病部位的不同进行靶位给药:卡莫司汀生物降解植入剂已用于治疗脑部恶性肿瘤;栓塞微球能阻塞对肿瘤、类纤维瘤和动静脉变形的血供,最终消灭肿瘤。
据预测,肿瘤释药系统市场将从2004年的40亿美元(单克隆抗体销售额约为10亿美元)增至2007年的154亿美元、2012年的235亿美元、2015年的250亿美元。
近来,新上市的抗肿瘤药剂型有方便用药的注射液、储库型控释注射剂、脂质体、纳米混悬剂释药系统、抗体复合物靶向给药系统、栓塞剂、植入剂和光动力学释药系统等。
1 方便用药的注射液2005年2月,赛诺菲-安万特公司将奥沙利铂冻干粉针剂型改成溶液型注射液并已在美国获准上市,商品名: El oxatin I N JECTI O N。
新制剂是一种澄清的、无防腐剂的无色溶液。
FDA批准阿奇霉素缓释型口服混悬剂

FDA批准阿奇霉素缓释型口服混悬剂
佚名
【期刊名称】《世界临床药物》
【年(卷),期】2005(26)8
【摘要】2005年6月,FDA批准辉瑞公司的一日1次阿奇霉素缓释型口服混悬剂(Zmax)上市,用于成人轻中度急性细菌性鼻炎(ABS)和社区获得性肺炎(CAP)的治疗。
【总页数】1页(P449-449)
【关键词】FDA;阿奇霉素缓释型口服混悬剂;急性细菌性鼻炎;社区获得性肺炎;治疗【正文语种】中文
【中图分类】R978.1;R95
【相关文献】
1.23-25 FDA批准克拉霉素缓释片用于社区获得性肺炎 [J],
2.FDA批准沙格列汀和二甲双胍复方缓释片治疗成人2型糖尿病 [J], 黄世杰
3.美FDA批准沙格列汀和缓释盐酸甲福明复合片剂Kombiglyze XR治疗2型糖尿病 [J], 马培奇
4.FDA批准Banzei口服混悬剂用于辅助治疗Lennox—Gastaut综合征 [J],
5.FDA批准克拉霉素缓释片用于社区获得性肺炎 [J], 霍玉;崔胜锐
因版权原因,仅展示原文概要,查看原文内容请购买。
聚乙二醇前药设计原理与应用研究进展

聚乙二醇前药设计原理与应用研究进展滕再进;马荔;王志强【摘要】聚乙二醇(polyethylene glycol,PEG)目前被广泛应用于肿瘤药物的修饰,当与药物分子偶联时,可以将其优良性质赋予修饰后的药物分子,改变药物的溶解性,在其修饰的药物周围产生空间屏障,减少药物的酶解,避免药物在肾脏的代谢中很快被消除,同时能被动靶向肿瘤细胞,降低药物毒性。
聚乙二醇是中性、无毒且具有独特理化性质和良好生物相容性的高分子聚合物,也是经美国食品药物管理局(FDA)批准的极少数能作为体内注射给药的合成聚合物之一,已得到市场的认可。
该文综述了近几年聚乙二醇修饰的前药研究进展,且就聚乙二醇修饰的原理、设计、运用及面临的挑战进行了论述。
【期刊名称】《中国药业》【年(卷),期】2014(000)015【总页数】4页(P1-3,4)【关键词】聚乙二醇;前药;被动靶向;修饰【作者】滕再进;马荔;王志强【作者单位】南京圣和药业有限公司,江苏南京210038;南京圣和药业有限公司,江苏南京 210038;南京圣和药业有限公司,江苏南京 210038【正文语种】中文【中图分类】R914.2聚乙二醇(polyethylene glycol,PEG)是中性、无毒且具有独特理化性质和良好生物相容性的高分子聚合物,也是经美国食品药物管理局(FDA)批准的极少数能作为体内注射给药的合成聚合物之一。
通过在Science Direct上检索发现,聚乙二醇修饰的大分子药物(如蛋白、多肽类)已有很多产品上市,如Adagen®,Oncaspar®,Pegasys®,Neulasta®等,但修饰小分子的前药目前仍处于临床研究阶段,而且国内对聚乙二醇的研究项目相对较少。
自2006年以来,美国FDA批准的新分子实体药物(NMEs)数量呈逐年下降趋势,原创新药的研发变得日益困难,使得风险相对较小的前药研究日益受到关注。
美国批准糠酸莫米松(Asmanex)用于治疗儿童哮喘

美国批准糠酸莫米松(Asmanex)用于治疗儿童哮喘吴佳(摘译);陈本川(校)【期刊名称】《医药导报》【年(卷),期】2008(27)12【摘要】美国食品药品管理局(FDA)批准先灵葆雅公司110μg糠酸莫米松(mometasone furoate)吸入式粉末剂(inhalation powder)Asmanex Twisthaler?用于预防性治疗4~11岁儿童哮喘患者。
FDA于2005年已批准了该药规格为220μg用于12岁及以上哮喘患者。
本品规格为110μg是第一个批准用于小至4岁儿童、每天用药1次的吸人性皮质类固醇制剂,为患有轻到中度持续性哮喘的儿童提供了一个重要的治疗选择。
本品的给药装置不用抛射剂,而是靠吸入用药,从而?肖除了用药时需要手揿一吸气协调动作的要求。
【总页数】1页(P1548-1548)【关键词】美国食品药品管理局;预防性治疗;糠酸莫米松;儿童哮喘;皮质类固醇制剂;吸入用药;哮喘患者;持续性哮喘【作者】吴佳(摘译);陈本川(校)【作者单位】【正文语种】中文【中图分类】R155.5;R720.597【相关文献】1.FDA拓展批准瑞戈非尼用于治疗肝癌/FDA批准midostaurin和化疗药结合治疗急性髓系白血病/FDA批准丙肝药物Sovaldi和Harvoni用于儿科患者 [J],2.FDA批准首例用于治疗巨细胞动脉炎药物Actemra/FDA批准首个治疗ADHD 仿制药/FDA批准Ceritinib用于一线治疗ALK阳性的转移性非小细胞肺癌 [J],3.Asmanex在美被批准用于哮喘 [J], 杨绍杰(摘)4.FDA批准糠酸莫米松干粉吸入剂用于哮喘治疗 [J],5.美国FDA批准Nurtec ODT作为可用于急性治疗/预防性治疗的偏头痛药物 [J],因版权原因,仅展示原文概要,查看原文内容请购买。
