医用有机化学第11章_胺-2011
医用有机化学答案

医用有机化学答案第1章绪论1.5.1什么是有机化合物?什么是有机化学?解:有机化合物是指碳、氢化合物及其衍生物。
仅由碳、氢两种元素组成的有机物称为烃类化合物,若还含有其他元素,则称为烃的衍生物。
有机化学是研究有机物的组成、结构、性质及其相互转化的一门科学。
1.5.2有机化合物的两种分类方法是什么?解:有机化合物一般是按分子基本骨架特征和官能团不同两种方法进行分类。
1.5.3σ键和π键是如何形成的?各自有何特点?解:由两个成键原子轨道向两个原子核间的联线(又称对称轴)方向发生最大重叠所形成的共价键叫σ键;由两个p轨道彼此平行―肩并肩‖重叠所形成的共价键叫π键。
σ键和π键主要的特点存在可以单独存在σ键π键不能单独存在,只与σ键同时存在成键p轨道平行重叠,重叠程度较小①键能小,不稳定;②电子云核约束小,易被极化;③成键的两个原子不能沿键轴自由旋转。
生成成键轨道沿键轴重叠,重叠程度大性质①键能较大,较稳定;②电子云受核约束大,不易极化;③成键的两个原子可沿键轴自由旋转。
1.5.4什么是键长、键角、键能及键的离解能?解:键长是指成键原子核间的平衡距离;键角是指两个共价键之间的夹角;当把一摩尔双原子分子AB(气态)的共价键断裂成A、B两原子(气态)时所需的能量称为A-B键的离解能,也就是它的键能。
但对于多原子分子来说,键能与键的离解能是不同的。
键的离解能的数据是指解离某个特定共价键的键能。
多原子分子中的同类型共价键的键能应该是各个键离解能的平均值。
键能是化学键强度的主要标志之一,在一定程度上反映了键的稳定性,相同类型的键中键能越大,键越稳定。
1.5.5用―部分电荷‖符号表示下列化合物的极性。
(1)CH3Br解:(2)CH3CH2OH(3)CH3O||COCH2CH3δ-O-+||δδC+OCH2CH3δδ+δ-(1)CH3-Br-δ+δδ+(2)CH3CH2-O-H(3)CH31.5.6键的极性和极化性有什么区别?解:极性是由成键原子电负性差异引起的,是分子固有的,是永久性的;键的极化只是在外电场的影响下产生的,是一种暂时现象,当除去外界电场后,就又恢复到原来的状态。
《医用有机化学》课后习题答案(总)
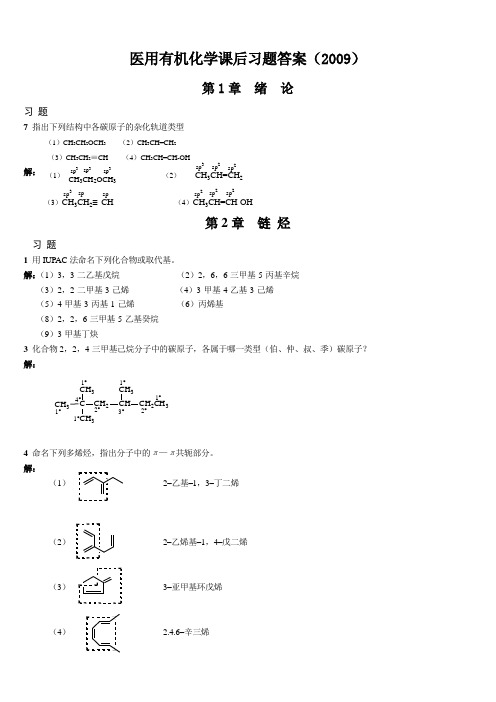
医用有机化学课后习题答案(2009)第1章 绪 论习 题7 指出下列结构中各碳原子的杂化轨道类型(1)CH 3CH 2OCH 3 (2)CH 3CH=CH 2 (3)CH 3CH 2≡CH (4)CH 3CH=CH-OH解:第2章 链 烃习 题1 用IUPAC 法命名下列化合物或取代基。
解:(1)3,3-二乙基戊烷 (2)2,6,6-三甲基-5-丙基辛烷 (3)2,2-二甲基-3-己烯 (4)3-甲基-4-乙基-3-己烯 (5)4-甲基-3-丙基-1-己烯 (6)丙烯基 (8)2,2,6-三甲基-5-乙基癸烷 (9)3-甲基丁炔3 化合物2,2,4-三甲基己烷分子中的碳原子,各属于哪一类型(伯、仲、叔、季)碳原子? 解:CH 3CCH 3CH 3CH 2CHCH 3CH 2CH 31°4°1°2°1°3°2°1°1°4 命名下列多烯烃,指出分子中的π—π共轭部分。
解:(1) 2–乙基–1,3–丁二烯(2) 2–乙烯基–1,4–戊二烯(3) 3–亚甲基环戊烯(4) 2.4.6–辛三烯spsp2sp 3sp 2sp 2spsp 2CH 3CH=CH 2sp 2(1) (2)(3)CH 3CH 2≡CH (4)CH 3CH=CH-OH CH 3CH 2OCH 3sp 3sp3sp 3sp 3(5)5–甲基–1.3–环己二烯(6)4–甲基–2.4–辛二烯9 将下列自由基按稳定性从大到小的次序排列: 解:(3)>(2)>(1)>(4)10 按稳定性增加的顺序排列下列物质,指出最稳定者分子中所含的共轭体系。
解:(1)d >b >c >a (2)d >c >b >a12下列化合物有无顺反异构现象?若有,写出它们的顺反异构体。
解:(1)无 (2)有C=CCH 3HH 2H 5C =CCH 3HHC 2H 5(3)有C =CHC =CH BrCl C 4H 9Br ClC 4H 9(4)有3C =CBrCl HCH 3C =CBr ClH(6)有C =CC 2H 5CH 3C 2H 5CHCH 3CH 3C =CC 2H 5CH 32H 5CHCH 3CH 314 经高锰酸钾氧化后得到下列产物,试写出原烯烃的结构式。
第11章 胺

第11章 胺11.1 基本要求● 熟练掌握胺类化合物的结构特点和理化性质。
●掌握重氮化合物、偶氮化合物、酰胺、碳酰胺的化学性质。
11.2 基本知识点11.2.1 胺的分类和命名胺可视作NH 3的烃基衍生物。
NH 3中的一个氢被烃基取代所得的化合物称为伯胺(1°胺),两个氢被烃基取代所得的化合物称为仲胺(2°胺),三个氢被烃基取代所得的化合物称为叔胺(3°胺)。
要注意的是:胺的伯、仲、叔的含义与醇的不同。
相当于NH 4+中的四个氢被烃基取代所得的离子称为季铵离子。
季铵离子与酸根结合形成季铵盐,与OH -结合形成季铵碱。
NH 3 RNH 2 R 2NH R 3N C 6H 5CH 2N(CH 3) 3ClArNH 2 Ar 2NH Ar 3N C 6H 5CH 2N(C 2H 5) 3OH氨 1°胺 2°胺 3°胺 季铵盐、季铵碱命名时,先写出连于氮上的烃基名,然后以胺字作词尾即可。
对于复杂的胺,则可将 H 2N —(称氨基)、RNH —(称烷胺基)、R 2N (称二烷胺基)视作取代基而命名。
11.2.2 胺的结构氮原子的外层电子构型为2s 22p 3,在形成NH 3时氮首先进行不等性sp 3杂化。
氮用三个不等性sp 3杂化轨道与三个氢的s 轨道重叠,形成三个sp 3-s σ键,氮上尚有一对孤对电子占据另一个sp 3杂化轨道,这样便形成具有棱锥形结构的氨分子。
胺类化合物具有类似氨的结构。
甲胺、三甲胺结构如下:在芳香胺中,氮上孤对电子占据的不等性sp 3杂化轨道与苯环π电子轨道重叠,原来属于氮原子的一对孤对电子分布在由氮原子和苯环所组成的共轭体系中,见下图所示。
CH 33具有较多p 轨道性质,但仍具有一定的s 成份³11.2.3 胺的性质 1. 碱性和成盐2. 烃基化3. 酰基化4. Hinsberg 反应(鉴别伯胺、仲胺、叔胺)5. 与HNO 2反应6. 季铵盐的Hoffmann 消去反应RNH 2质子酸盐RNH 2RX R 2NH 3NRX RX4NXArNH RXArNH R2RXRXArNR 3XR 4NO H 3OHRNH 2′R ′COCl 或酐、酯2NCOR ′R ′COCl 或酐、酯R 2NH R 3一)R ′COCl 或酐、酯NaOH 溶液溶于NaOH(RNS O 2Ph )Na(固体)R 2NH PhSO 2Cl R 2NSO 2P hNaOH 溶液不溶于NaOH(固体)R 3N PhSO 2Cl(一)RNH 2PhSO 2ClRNHSO 2P h RNH 2HNO 2[R N N ]H 2ON 醇等混合物ArNH 22Ar N NX (重氮盐)R 2NH HNO 2R 2NN O(N -亚硝基胺)ArNH HNO 2ArN NX (黄色油状物)NNR 2HNO 2ONNR 2(对亚硝基化合物)C C HNR 3OHC CR 3N + H 2O7. 重氮盐的反应 取代反应:偶联反应:还原反应:8. 酰胺和碳酰胺的性质酰胺和碳酰胺除了具有羧酸衍生物的一般性质外,还具有下述性质。
临床等各专业第一学期《医用有机化学》练习试题

临床等各专业第一学期《医用有机化学》练习试题一、单项选择题26、要使CH2=CHCOOH转变为CH2=CHCH2OH,可以选用下面哪个试剂()A、NaBH4B、LiAlH4C、Pt/H2D、无水ZnCl2 /浓HCl27、下列化合物按酸性强弱排序,正确的是()①丙酸、②β-羟基丙酸、③丙酮酸、④α-羟基丙酸。
A、④>③>②>①B、②>③>④>①C、③>④>②>①D、③>①>④>②28、下列化合物中的碱性顺序从大到小的排列正确的是()a、乙酰胺b、吡咯c、NH3d、二乙胺e、乙胺A、a>b>c>d>eB、d>e>c>a>bC、d>c >e>a>bD、e>d>c>a>b29、能与亚硝酸作用生成难溶于水的黄色油状物的化合物是()A、乙胺B、六氢吡啶C、苄胺D、N,N–二甲基酰胺30、下列化合物发生亲核加成反应,活性从大到小的顺序正确的是()①CH3CH2CHO ②O③C6H5COCH3④BrCH2CHOA、①>②>③>④B、②>①>④>③C、④>①>②>③D、④>①>③>②31、下列化合物发生氨解反应的最快的是()A、丙酰氯B、丙酸酐C、丙酸乙酯D、丙酰胺32、加热脱水生成α,β-不饱和酸的是()A、α-羟基丙酸B、β-羟基丁酸C、γ-羟基丁酸D、δ-羟基戊酸33、根据下列油脂的皂化值确定其平均相对分子质量最小的是( )A、豆油:189~195B、奶油:210~230C、牛油:190~200D、猪油:195~20334、与亚硝酸作用放出氮气的化合物是()A、H2NCONH2B、CH3NHCH2CH3C、C6H5CON(CH3)2D、(CH3)2NCH2CH335、加热后难以形成环酐的是()A、丙二酸B、丁二酸C、戊二酸D、顺丁烯二酸36、下列杂环化合物中没有芳香性的是()A、吡喃B、吡啶C、呋喃D、嘧啶37、关于结构命名正确的是( )A 、α-D-吡喃葡萄糖B 、α-D-吡喃半乳糖C 、β-D-吡喃葡萄糖D 、β-D-吡喃半乳糖38、丙氨酸的等电点pI=6.0,当pH=8.0时,构造式为( )A 、CH 3CHCOOH 2B 、 CH 3CHCOOH NH 3+C 、CH 3CHCOO -2D 、以上都不是39、不能发生酰化反应的是( )A 、 CH 3CH 2NHCH 3B 、 CH 3CH 2N(CH 3)2 40、下列化合物发生亲电反应的活性从大到小的顺序正确的是( )①吡咯 ②苯甲酸 ③苯A 、①>③>②B 、②>①>③C 、②>③>①D 、①>②>③41、下列哪个不是卵磷脂的水解产物 ( )A 、胆胺B 、胆碱C 、丙三醇D 、高级脂肪酸42、下列糖类分子水解可以得到D-果糖的是( )A 、纤维素B 、蔗糖C 、乳糖D 、淀粉43、既能和 FeCl 3 显色,又能发生碘仿反应的是( )H 3COCOCH 3H 3CO CHO CHO HOCOCH 3HO A. B.C. D.44、下列试剂可以鉴别甲醛、丙酮和苯乙酮的是( )A 、过量饱和的NaHSO 3溶液和Tollens 试剂B 、Tollens 试剂和Fehling 试剂C 、Benedict 试剂和Fehling 试剂D 、Tollens 试剂和Benedict 试剂45、加热不发生脱羧反应的是( )A 、 丁酸B 、 -丁酮酸C 、 草酰乙酸D 、 水杨酸二、双项选择题:(有两个正确答案,多选和少选均不给分。
有机化学11-1(1)

例: LDA的制备 LDA的制备
n-BuBr + Li H3C (H3C)2HC NH (H3C)2HC H3C CH H3C n-BuLi H3C CH
弱亲核性强碱 大体积) (大体积)
NLi +
n-BuH
本次课小结: 本次课小结: 胺的类型 各类胺的制备方法 Hofmann降解 Hofmann降解 胺类化合物的基本化学性质:碱性、亲核性、 胺类化合物的基本化学性质:碱性、亲核性、 叔胺的氧化、仲胺与烷基锂的反应等 叔胺的氧化、
脂肪胺 N 原子一 般为 sp3 杂化
R N
R" N
转180o "R
N R R' R"
R R'
对映关系,但无手性 对映关系,
手性胺或手性季铵盐
手性中心 手性中心
R1 N
N N
手性中心
R4
R3
R2
二. 胺类化合物的制备方法
1. 脂肪族伯胺的制备
氨的烷基化(卤代烷的取代,SN2 机理) 机理) 氨的烷基化(卤代烷的取代,
(氯磺酸) 氯磺酸)
AcNH
SO3H
HOSO2Cl -H2SO4
AcNH
SO2Cl
H2NR
AcNH
SO2NHR
H+ H2O
H2N
SO2NHR
3. 胺的氧化
伯胺和仲胺的氧化 伯胺和仲胺的氧化
[O] R NH2 R NHOH + R NO + R NO2
产物一般较为复杂,合成上意义不大 产物一般较为复杂,
+
R' C R"
No Reaction
3o 胺
与羧酸衍生物的亲核取代反应
医用有机化学之含氮有机物

命名下列化合物,并指出是哪一种胺:
(1)CH3CH2NH2 (2)C2H5NHC2H5 (3)(C2H5)3N (4)NH2CH2CH2NH2 (5)C6H5NH3+Br- (6)(CH3)4N+OH﹣ ) ( 7)
(1)乙胺(1°胺);(2)二乙胺(2°胺) (3)三乙胺(3°胺);(4)乙二胺(1°胺); ( 5 )溴化苯铵(伯胺铵盐);( 6 )氢氧化四甲铵(季铵盐); (7)N,N- 二甲基苯胺(3°胺)
(4) 脂肪族叔胺与亚硝酸反应产物盐不稳定,易水解, 加碱后可重新得到游离的叔胺。 芳香族叔胺与亚硝酸作用,易发生环上的亚硝化反 应,生成对亚硝基取代物: 碱性条件:绿色叶
片状结晶
• 利用亚硝酸与伯、仲、叔胺的反应不同,可以鉴别 伯、仲、叔胺。
亚硝酸(NaNO2+HCl)鉴别伯、仲、叔胺:
伯胺 脂肪族 N2 N2
第11章 胺 (Amine)
要求
1.了解胺的结构。 2.熟悉胺的碱性强弱变化规律。 3.掌握胺的命名、反应及鉴别方法。
11.1 胺的结构、分类和命名
11.1.1 胺的结构
• 氨分子中的氢原子被烃基取代后的衍生物称为胺。
季铵类
•胺分子中,N原子是 以不等性sp3杂化成 键的,其构型成棱锥 形。
sp
2 胺的酰化反应
(1) 伯胺、仲胺与酰基化试剂(酰氯、酸酐)发生酰基 化反应,生成N-烷基酰胺:
(2) 芳胺与酰氯或酸酐发生酰基化反应,生成芳胺的 酰基衍生物:
伯胺、仲胺可反应,叔胺不反应。 常用酰基化剂是酰氯或酸酐。
酰胺是具有一定熔点的固体,易水解生成胺。
在有机合成上常用来保护氨基。
H 2N
芳香胺:
N
有机化学11胺与酰胺

4、与亚硝酸的反应 、
叔胺与亚硝酸反应时, 伯、仲、叔胺与亚硝酸反应时,产物各不 相同,借此可区别三种胺。 相同,借此可区别三种胺。
脂肪伯胺
芳香伯胺
重氮盐
氯化重氮苯
反应胺
O
反应式
NaNO2,HCl
现象
+
脂肪1 脂肪 胺 RNH2 0~5OC -N2 得醇、 得醇、烯、卤代 R+ 烃等混合物 脂肪2 脂肪 O胺 R2NH
R-NH2 + Na 2CO3 + NaX + H2O
O CH 3 CH 2 CH C CH 3 NH 2
NaOCl OH CH 3 CH 2 CH NH 2 CH 3
6、脱水反应 、
RCONH2 + P2O5 RCN + 2 HPO3
酰胺与铵盐和腈的关系如下: 酰胺与铵盐和腈的关系如下:
NH3 HCl H2O H2O H2O H2O
NaNO2,HCl
R N N Cl
-
放出气体
R2N N O
SnCl2,HCl
R2N H [R3NH]+NO2-
出现黄色 油状物或 固体, 固体,加 酸,油状 物消失 发生成盐 反应, 反应,无 特殊现象
应用 a.根 根 据实 验现 象可 鉴别 伯、 仲、 叔胺
脂肪3 脂肪 O胺 R3N+HNO2
反应胺
O R-C-NH2 + HONO O R-C-OH + N2↑ + H2O
难水解酰胺可用此法水解。 取代酰胺无此反应 取代酰胺无此反应。 难水解酰胺可用此法水解。N-取代酰胺无此反应。
4、还原反应 、
酰胺不易被还原, 酰胺不易被还原,在高温高压下催化氢化 才还原为胺,但所得为混合物。 才还原为胺,但所得为混合物。强还原剂氢化 锂铝可将其还原为胺(伯胺、仲胺、叔胺)。 锂铝可将其还原为胺(伯胺、仲胺、叔胺)。
11.胺

亚硝酸(NaNO2+HCl)鉴别伯、仲、叔胺:
伯胺 脂肪族 N2 仲胺 黄色油状物 叔胺 可溶性盐
芳香族
N2
甲胺
黄色固体
苯胺
翠绿色结晶(OH—)
例如:
二甲胺
N-甲基苯胺
N,N-二甲基苯胺
三甲胺
4 、芳胺的取代反应
•氨基是很强的邻、对位定位基,容易发生亲电取代 反应:
第11章
胺
Amine
一、胺的结构、分类和命名
1. 胺的结构 NH3 R-NH2 氨 R2NH R3N
胺
2.分类
注意比较
伯胺
脂肪胺 芳香胺 CH3NH2
NH2
仲胺
(CH3)2NH
NHCH3
叔胺
(CH3)3N
N(CH3)2
(
) 2 NH
(
) 3N
官能团
NH2
NH
N
3.命名
简单胺的命名是在烃基名称后加胺字,称为某胺。
N
CH2CH2CH3 CH(CH3)2
N-甲基-N-乙基苯胺
CH3 N C12H25 CH3 + Br
-
CH2
苯扎溴铵(新洁尔灭)
溴化二甲基十二烷基苯甲(苄)铵
二、胺的化学性质
1.碱性: 胺与氨相似,它们都具有碱性。氮原子上有未共用电 子对,形成带正电荷铵离子的缘故: :NH3 + H+ NH4+
R-NH2 + H+
RNH3+
•胺溶于水,可发生离解反应: R-NH2 + H2O RNH3+ + OH-
医用有机化学教学大纲(吕以仙)

(一)理论教学内容第一章绪论掌握有机化合物及有机化学的概念,有机化合物的特性及其结构理论;共价键的断裂及化学反应类型;有机化合物结构式的写法。
熟悉共价键参数的意义与有机化合物结构的关系;有机化合物的分类。
了解有机化学的发展概况;有机化学与临床医学的关系;学习和研究有机化合物一般步骤和方法。
第二章烷烃掌握烷烃的命名、结构、SP3杂化;一、二、三、四级碳原子和σ键的特征;同分异构现象;烷烃的构象稳定性及取代反应,熟悉烷烃的游离基取代反应历程。
了解游离基的稳定性次序个别烷烃。
第三章烯烃和炔烃掌握烯烃、二烯烃、炔烃的命名和结构;SP2、SP杂化;π键的特点;•烯烃的亲电加成反应、马氏加成规则;诱导效应与共轭效应,π-π键共轭,P-π共轭;共轭二烯烃的加成反应。
第四章环烃掌握脂环的命名,分子结构,环烷烃的取代与开环的反应;苯的结构及芳香性,闭合共轭体系及大Π键,苯环的亲电取代反应及其定位法则,苯同系物的侧链卤代与氧化反应;萜类的定义与分类。
熟悉环完烃的优势构象,a键,e键,环烷烃的稳定性;萘,蒽,菲及环戊烷多氢菲的结构,萘的磺化与加氢反应。
了解十氢化萘的构象,苯及其主要同系物萘、蒽的化学性质。
第五章顺反异构和对映体掌握顺反异构产生的条件,顺/反与Z/E构型的命名法,物质的稳定性与结构的关系。
熟悉手性碳原子,手性分子,D/L和R/S构型命名法。
左旋体,右旋体,内消旋体,外消旋体,对映体,非对映体及比旋光度的概念;Fischer投影式的写法。
了解环己烷二元取代衍生物的顺反异构及构象,分子的对称因素。
第六章卤代烃掌握一卤代烷的亲核取代反应,消除反应,生成格氏试剂的反应SN1•与SN2反应的历程。
熟悉扎依切夫规则,影响亲核取代反应的因素,不同类型卤代烃反应活性规律及与销酸银醇溶液的反应。
了解格氏试剂的用途及个别的卤代烃。
第七章醇,酚,醚掌握醇的命名,分类(伯,仲,叔醇),结构与化学性质(氧化与脱氢,脱水成烯,与无机酸成酯,与卢卡斯试剂反应);酚的结构与化学性质(弱酸性,氧化反应,苯环上的取代反应,与氯化铁的反应)。
医用有机化学教学大纲

医用有机化学教学大纲(供五年制临床医学、口腔、麻醉、护理、影像等本科专业用)一.课程概述《有机化学》是医学院校的一门重要的基础课,适用于临床医学、口腔、麻醉、护理、影像等本科专业教学。
本课程对有机化合物的分类、结构、命名、物理性质和化学性质进行了详细的介绍,对映异构一章介绍了有机化合物的对映异构现象,及构型的表示方法。
并对氨基酸、蛋白质和核酸的结构及理化性质进行了介绍。
使学生学了这门课程后,对有机化学中有机化合物的分子结构、化学性质和基本理论能够掌握。
了解与医学和药学相关的内容。
为后续课程如生物化学、药理学、生物学、卫生化学等理论课奠定基础。
本课程总学时为98学时,理论课48学时,自学讨论14学时,实验课36学时。
二.正文第一章绪论(2学时)目标为系统学习有机化学准备必要的基础知识。
内容有机化学和有机化合物的概念。
有机化学与医学的关系。
有机化合物的结构和特性,碳原子的杂化轨道,共价键的类型,参数,键的极化。
有机反应的类型,有机化合物得分类。
要求能够说明(1)有机化合物的结构和特性;(2)有机化合物的反应类型;(3)有机化合物的分类。
能够概述有机化学和有机化合物。
第二章饱和烃(4学时)目标掌握饱和烃的结构,化学性质和异构现象。
内容饱和烃的结构和命名。
碳链异构、构象异构、环烷烃的结构、分类、命名、环己烷的构象,饱和烃的化学性质。
要求能够说明(1)饱和烃的结构命名;(2)饱和烃的构象异构;(3)饱和烃的化学性质;能够概述乙烷的构象,环己烷的构象。
第三章不饱和烃(4学时)目标掌握不饱和烃的结构,化学性质和异构现象,理解电子效应和反应机理等基础理论。
内容不饱和烃的结构和命名,位置异构,顺反异构。
不饱和烃的物理性质,不饱和烃的化学性质,亲电加成反应机理和电子效应。
要求能够说明(1)不饱和烃的命名;(2)烯烃的异构现象;(3)不饱和烃的亲电加成能够概述不饱和烃的电子效应。
第四章芳香烃(4学时)目标掌握芳香烃的结构命名和化学性质和亲电取代反应机理及定位规律。
第十一章 胺类药物的分析(2011) ppt课件

色谱条件:十八烷基硅烷键合硅胶为色谱填充柱;0.1%庚 烷磺酸钠的0.05mol/L磷酸二氢钾溶液(pH3.0)-甲醇 (68:32)为流动相;检测波长290 nm。 盐酸普鲁卡因对照品对照,浓度:0.02mg/ml。
药物 鉴别
检查
含量测定
盐酸普 鲁卡因
盐酸利 多卡因
对乙酰 氨基酚
肾上腺 素
重氮化-偶合反应 水解反应 氯化物反应 红外光谱法 与硫酸铜反应 氯化物的反应、红 外
三氯化铁反应 水解后重氮化-偶 合反应 IR
三氯化铁反应 过氧化氢反应
原料和注射液对氨基苯 亚硝酸钠滴定法(原
甲酸(HPLC法)
料药、注射剂,滴定
药物与三氯化铁试液反应与现象
药物
试验方法
现象
阿司匹林 加热水解后,与三氯化 紫堇色配位化合
铁试液反应
物
丙磺舒
加NaOH溶液,在 pH5.0~6.0时加三氯化 铁试液
对乙酰氨 直接与三氯化铁试液反
基酚
应
肾上腺素 加盐酸溶解,与三氯化
铁试液反应
米黄色沉淀
显蓝紫色
显翠绿色,加氨 试液显紫色
胺类药物的分析
取供试品约0.1g,加稀盐酸5ml,在水浴上加热40分钟,取 0.5ml加亚硝酸钠试液5滴和碱性-萘酚试液2ml,摇匀,即 显红色 A
取供试品约50mg,加稀盐酸1ml使溶解,加亚硝酸钠试液数 滴和碱性-萘酚数滴,生成橙色或猩红色沉淀 B
取供试品0.2g,加水20ml使溶解,分取10ml,加三硝基苯酚 试液10ml,即生成沉淀,滤过,沉淀用水洗涤,在105℃干 燥后,测定熔点为228℃232℃ C
11-胺

④ 季铵盐或季铵碱的命名是将其看作铵的 衍生物来命名。 [(CH3)4N]+I[CH3NH3]+Cl[(CH3)3NCH2CH3]+OH碘化四甲铵 氯化甲铵 氢氧化三甲乙铵
C 2H 5N H 2 乙 胺
NH
2 3
C 2 H 5 N HC 2 H 5 二 乙 胺
CH N
CH
邻甲基苯胺
3
N , N -二 甲 基 苯 胺
+ N N + OH
N N
OH
N N OH
pH9~11
N N O
-
+ H
+
pH11~13
2、与芳香胺的偶联反应:
+ N N HSO 4 + 中性或弱酸性 N(CH
3 )2
0℃
对二甲氨基偶氮苯
N N
N(CH
3 )2
偶氮芳烃分子中有偶氮键—N=N—,使两 个芳环共轭,扩展了π电子离域范围,使得该 化合物在可见光区域吸收光,因而往往有鲜艳 的颜色。
芳环上电子 云刻度越大越有利于偶联反应 的发生。
偶联反应
N
N
偶氮类化合物
N
N
OH
对-羟基偶氮苯
偶氮类化合物含-OH,NH2助色团,使染料的颜色加深, 若偶氮染料中含磺酸基,羟基,有助于染料在水中的 溶解度。甲基橙属于偶氮类染料。
1、与酚的偶联反应:
+ N N HSO 4 + 弱碱性 OH 0℃
对羟基偶氮苯
3
NH
2
NO
2
NO
2
O CH 3 NH
2
O Cl CH 3 NH C Cl
+ CH 3 C
第十一章 胺

NH 2
NHC CH 3
H3O
NO 2
NO 2
苯胺不能直接硝化,因为硝酸能把苯胺氧
化成苯醌。所以必须先将氨基“保护”起来, 再进行硝化反应。
磺酰化反应:(兴斯堡(Hinsberg)反应)
伯胺和仲胺能与磺酰氯作用生成磺酰胺,叔胺 因氮上无氢而无此反应。例如:
SO2Cl + NH2 SO2 NH
英文命名:
普通法:烃基+amine,或者是烃名称去-e
+amine.例如: methylamine(methanamine) 甲胺
二乙胺 苯胺
diethylamine(N-ethyl ethanamine)
benzenamine(aniline)
苄胺
benzylamiቤተ መጻሕፍቲ ባይዱe
N-甲基-N-乙基苯胺 N-methyl-N-ethyl aniline
3、季铵碱
R4N+OH-是典型的离子化合物,其碱性相当
于NaOH或KOH,是一种强碱。 所以,各类胺的碱性强弱为: 季铵碱 > 脂肪胺 > 氨 > 芳香胺
季铵碱能与酸作用生成季铵盐:
R4N OH + HCl
R4N Cl
+ H2O
季铵碱以外的胺都是弱碱,可与酸反应成
盐,其盐遇强碱又游离出原来的胺,所以 可以利用这一性质分离、提纯胺。
综合这些因素,当烷基相同时,仲胺的碱性 最强,伯胺和叔胺次之。
2、芳香胺的碱性
苯胺的碱性比氨小得多。因为氮上的未共用 电子对与苯环有共轭作用,使其电子云密度 降低,从而使其碱性大大减弱。
如碱性强弱顺序:苯胺
> 二苯胺 > 三苯胺 若苯环上有取代基,其碱性可以归纳为: 给电子基团使碱性增强,吸电子基团使碱 性减弱。如,碱性强弱顺序为: 对甲基苯胺 > 苯胺 > 对硝基苯胺
第11章胺525

二、胺 的 结 构
1) 氨和胺中的 是不等性的 sp3 杂化,未 氨和胺中的N是不等性的 杂化, 共用电子对占据一个sp 杂化轨道。 共用电子对占据一个 3杂化轨道。 sp3不等性杂化
三个轨道和3个其它原子形成 个 键 三个轨道和 个其它原子形成3个б键,另一个 个其它原子形成 轨道含有一对电子,在棱锥体的顶点, 轨道含有一对电子,在棱锥体的顶点,整个构 型呈棱锥形。 型呈棱锥形。
CH3NH3+Cl氯化甲铵
CH3 N CH3 ]+OHCH3 CH3 N CH2 CH3 ]+ClCH3
CH3NH2 HCl
甲胺盐酸盐
[ CH3
氢氧化四甲铵
[ CH3
氯化三甲乙铵
必须注意“ 字的用法, 必须注意“氨、胺、铵”字的用法, 氨用来表示气态氨(NH3 )或基团,如氨 或基团, 氨用来表示气态氨( )、亚氨基(=NH);胺用来 亚氨基(=NH); 基(—NH2)、亚氨基(=NH);胺用来 表示NH 的烃基衍生物; 表示NH3 的烃基衍生物;如CH3—NH2 甲胺; 甲胺; 铵用来表示胺的盐类及季铵类。 铵用来表示胺的盐类及季铵类。
三甲胺
142.5 °
125 °
在苯胺分子中,氮原子更接近于平面结构, 在苯胺分子中,氮原子更接近于平面结构, 氮原子 的杂化状态在sp 之间。且在苯胺分子中, 的杂化状态在 3与sp2 之间。且在苯胺分子中,CN 的键长也比甲胺中的短。 的键长也比甲胺中的短
对映异构现象
R3 N R2 R1 N R1 R2 R3
一、胺的分类和命名 (一)分类 1、按取代H原子的烃基数目分: 、按取代 原子的烃基数目分 原子的烃基数目分: 伯胺( ° 伯胺(1°胺) 胺 仲胺(2°胺) 仲胺( ° 叔胺( ° 叔胺(3°胺)
十一 含氮类化合物-胺类化合物(制药)

成盐反应
RNH2 + HX
RNH3+X- OH- RNH2
(应用于胺类化合物的分离纯化与保存)
O
+
(C2H5)2NCH2CH2OC H
普鲁卡因
NH2 Cl-
O
NN
N
S
HH
HCl
NO2
盐酸雷尼替丁
2. 亲核取代
(1) 烃基化反应
CH3NH2 + 3CH3I
CH2N+ (CH3)3I-
R NH2 + R' X
O COH COH O
O
C NCH2CH2CH3
OH- or H+
CH3CH2CH2NH2 +
C
O
盖布瑞尔(Gabriel,s.)法
• 磺酰化: 磺酰基取代胺氮原子上氢的反应
O 磺酰基:(Ar)R S
O
N
NH2 + H2N
N
SO2Cl
兴斯堡(Hinsberg)反应 用途: 分离鉴别一级、二级、三级胺
UV、IR、NMR、MS
(2) 化学方法
鉴别: N-甲基苯胺、苯胺、N,N-二甲基苯胺
(B)
CH3 N H
1. 生物碱
课外知识: 生物碱
RO
O R'O
H N
H
R=R'=H
CH3 R=CH3, R'=H, R=R'=COCH3
吗啡 可待因
海洛因
CH3 CH2CHNH2 苯异丙胺
CH3 CH2CHNHCH3 N-甲基苯异丙胺
大多数生物碱具有结晶性、旋光性;难溶于水,易溶于 有机溶剂;溶于稀酸生成盐。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(二)胺的命名 比较复杂的胺,常以烃类作母体,氨基作为取 代基来命名。例如:
CH3-CH-CH2-CH-CH3 NH2 CH3 CH3CH2-CH-CH2CH2CH2CH3 NHCH2CH3
2-氨基-4-甲基戊烷
3-( N-乙氨基)庚烷
(二)胺的命名 二元胺的命名:
NH2CH2CH2NH2 NH2(CH2)6NH2
内容提要:
一、胺的分类与命名
二、胺的结构
三、胺的物理性质(自学)
四、胺的化学性质
五、苯丙胺类药物与生源胺的概念(自学)
六、重氮盐与偶氮化合物
七、重氮盐的反应
一、胺的分类与命名 (一)胺的分类 胺可以看作是氨的烃基衍生物,根据氨分子 中氮上氢原子被烃基取代的数目分为: NH3 氨 NH4Cl RNH2 伯胺 NH4OH R2NH 仲胺 R4N+XR3N 叔胺 R4N+OH
(一)胺的碱性与成盐
一些胺(氨)在水溶液中的pKb值
NH3 (CH3)2NH CH3NH2 (CH3)3N pKb 4.76 3.27 3.38 4.21 C6H5NH2 (CH3CH2)2NH (CH3CH2)3N CH3CH2NH2 pKb 9.38 3.06 3.25 3.36
在水溶液中胺的碱性强弱次序为: 1° 脂肪胺(2°> 3°) > 氨 > 芳胺
CH3NH2·HCl
甲胺盐酸盐 (盐酸甲铵) (CH3)4N+Cl氯化四甲基铵 tetramethylammonium
CH3CH2NH2·AcOH
乙胺醋酸盐 (醋酸乙铵) (CH3)3N+(C2H5)OH氢氧化三甲基乙基铵 trimethylethylammonium
chloride
hydroxide
吡啶
RC—NHR O RC—NR2
酰化时,常加入NaOH,吡啶,三乙胺,二甲苯胺 等碱类,用以吸收反应放出的HCl,可避免它与胺成
盐消耗原料胺,且可促进反应的进行。
(二)酰化反应(Acylation)
O RNH2 R2NH O + (RC)2O RC—NHR O RC—NR2 O + RC-OH
(一)胺的碱性与成盐
芳香胺的碱性:
NH2
NH2 + HCl
NH2 HCl
注意:苯胺不能与醋酸成盐
按碱性强弱排序:苯胺 二苯胺 三苯胺
(一)胺的碱性与成盐 局部麻醉剂普鲁卡因转变为普鲁卡因盐酸盐后, 其药用性能有哪些改善?
H2N C O O C HC H2N(C2H5)2 2
HCl
普鲁卡因
H 2N C O O C HC H2N(C2H5)2. HCl 2
苯磺酰氯
对甲苯磺酰氯 (TsCl)
该反应用于伯、仲、叔胺的分离与鉴定。
(二)酰化反应(Acylation) 磺酰化反应现象:
伯胺 + 苯磺酰氯 沉淀 NaOH H+ 沉淀溶解
仲胺 + 苯磺酰氯
叔胺 + 苯磺酰氯
沉淀 (既不溶于酸又不溶于碱)
油状的叔胺 + 苯磺酸盐的水溶液 NaOH H+
油状的叔胺溶解
CH3NH2 (CH3CH2)2NH NH2 -NH2
甲胺 二乙胺 苯胺 methylamine diethylamine aniline
环己胺
当氮上连接烃基不同时:先小后大,先烷后芳。
CH3CH2NHCH3 CH3CH2NCH2CH2CH3 CH3 NCH2CH3 CH3
甲基乙胺
甲基乙基丙胺
甲基乙基环丙胺
(二)胺的命名 烷基连在芳胺氮原子上,则在烷基名称前加 “N”字母,以便与苯环取代物加以区别。
CH3 N CH3
CH3 N CH2CH3
N,N-二甲基苯胺
N-甲基-N-乙基苯胺
N,N-dimethylaniline N-ethyl-N-methylaniline
(二)胺的命名 胺盐和季铵化合物的命名:
N H 3C H
∠HNH 105.9°
N
H
H H
∠HNH 113 °
∠HNC 112.9 °
两平面夹角39.4°
N H H
苯胺中氮上的孤对电子与苯环发生了近似p~π共轭
(二)胺的结构 胺的立体化学:
N
3
N R1 R2 R1 R2 R3
R
两种异构体之间通过快速翻转(103~105/秒)相互 转化,因而不能分离。
磺胺嘧啶
N
若不将氨基保护起来,氨基将会优先与氯磺酸反应。
(3)酰化反应可增加药物脂溶性,降低毒性。
(二)酰化反应(Acylation) 磺酰化反应
——兴斯堡(Hinsberg)反应
定义:伯、仲、叔胺与芳香族磺酰氯(如苯磺酰氯、 对甲苯磺酰氯)的作用称为兴斯堡反应。
O S Cl O H3 C O S Cl O
(一)胺的碱性与成盐
R—NH2 + H—OH R—NH3 + OH
Kb =
[R+NH3][-OH] RNH2
pKb = - logKb
(1)产生碱性的原因: N上的孤对电子 (2)判别碱性的方法: pKb的值;或其共轭酸的
pKa的值;以及形成的铵正离子的稳定性。
(3)影响碱性强弱的因素: 电 子 效 应:3o胺 > 2o胺 > 1o胺 空 间 效 应:1o胺 > 2o胺 > 3o胺 溶剂化效应:NH3 > 1o胺 > 2o胺 > 3o胺
季铵碱是强碱,其碱性与氢氧化钠相近!
(一)胺的碱性与成盐
溶剂化效应是给电子的,N上的H越多,溶剂化效应 就越强(NH3 > 1o胺 > 2o胺 > 3o胺),形成的铵正 离子就越稳定:
H R N H O H O H H H O H H H
R1 H R N H R2 O H
1° 胺 3° 胺 胺在水溶液中碱性的强弱,是其电子效应、空间效 应以及溶剂化效应的综合体现。
盐酸普鲁卡因
稳定性增加,水溶性增大,挥发性减小。
(一)胺的碱性与成盐
芳胺: 当环上连有给电子基团时,其碱性增强;
当环上连有吸电子基团时,其碱性减弱。
碱性 CH3O— pKb: 8.66
—NH2
9.4
—NH2
O N—
2
—NH2
13
(一)胺的碱性与成盐
O N O NO2 H H N O N O
Learning Check:
Without looking at a table, Rank the structures in each set in order of decreasing basicity (#1 = strongest)
A.
O2N NH2 H C O NH2 NH2 Br
三、胺的物理性质(自学)
大多数芳胺具有毒性,苯胺可以导致再生障碍 性贫血,通过吸入,食入或透过皮肤吸收而致中 毒,食入0.25 mL就严重中毒。 β– 萘胺与联苯胺是能够引起恶性肿瘤的物质。
四、胺的化学性质 (一)胺的碱性与成盐
N R R R
N H H
学习胺的化学,要注意N上的孤对电子,胺的许多性 质都与它有关。
(二)胺的结构
若限制这种翻转就能够得到两种对映体。1944年 Prelog就将 Troger碱 拆分得到其左旋体和右旋体。
N CH3
N CH3
Troger碱 在季铵盐中若氮上连的四个基团不同时,可以拆开 成对映异构体:
CH3 N C6H5 C2H5 CH2CH=CH2 C6H5 CH2=CHCH2 CH3 N C2H5
CH3-NH2 甲胺;“铵”用来表示胺的盐类 及季铵类。
Learning Check:
Name the following:
Solution:
Name the following:
N-Ethyl-N-methylcyclohexylamine
N-methylethanamine
(or Ethyl methyl amine)
三、胺的物理性质(自学)
甲胺、二甲胺、三甲胺和乙胺室温下为气体,其它 低级胺为液体;高级胺为固体; 低级胺有氨味,三甲胺有鱼腥味,腐胺(丙二胺) 尸胺(丁二胺)有恶臭味; 芳香胺为高沸点的液体或低熔点的固体; 胺与水能形成分子间的氢键; 一级胺和二级胺本身分子间也能形成氢键。
(CH3)3N bp: 2.87º C C2H5NHCH3 36-37º C CH3CH2CH2NH2 47.8º C
B.
F F C F
NH2 CH3
NH2
NH2 F CH2
Solution:
Without looking at a table, Rank the structures in each set in order of decreasing basicity (#1 = strongest)
A.
Tricyclohexylamine
1,3-Butanediamine N-methylpyrrolidine Diisopropylamine
(二)胺的结构
脂肪胺
N R R
2
芳香胺
N
R
1
R1 R2
Ar
形 状:棱锥形 氮原子:sp3杂化
形 状:棱锥形 氮原子:sp3~sp2杂化(更接近sp2)
(二)胺的结构
NH2 O2N H NH2 C O NH2 Br
3
2
1
NH2
B.
F
NH2 CH3
NH2 F CH2
F C F
3
1
2
(二)酰化反应(Acylation)
胺类: 伯胺、仲胺,叔胺分子中氮原子上无氢, 不能进行酰化反应。 酰化剂: 酰氯、酸酐和磺酰氯。取代反应 O
