10 甲烷_烷烃
烷烃
相互关系 E F C A D B
白磷与红磷 正丁烷与异丁烷
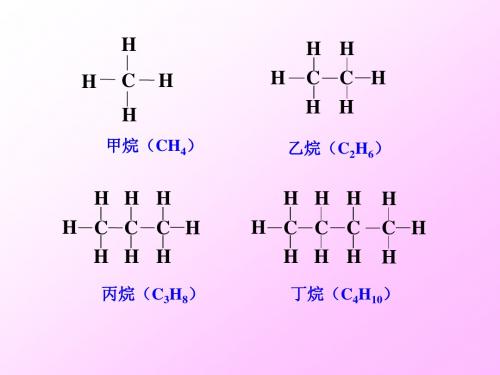
H H H C C H H H
H H H H C C C H H H H
丙烷( 丙烷(C3H8) 结构简式: 结构简式:CH3CH2CH3
乙烷( 乙烷(C2H6) 结构简式: 结构简式:CH3CH3 CH3—CH3
H H H H C C C 丁烷(C4H10) 结构简式: 结构简式:CH3CH2CH2CH3 或CH3(CH2)2CH3 CnH2n+2(n≥1) ) CnH2n(n≥3) )
(三)同系物
结构相似,在分子组成上相差一个或若干个 结构相似,在分子组成上相差一个或若干个CH2 原子团的物质 相差一个或若干个 互称同系物。 互称同系物。 同:通式同,组成元素同,同类物质 通式同,组成元素同, 原子团,(分子式不同) ,(分子式不同 异:组成上相差n个CH2原子团,(分子式不同) 组成上相差 个 式量相差: 式量相差:14n 电子数相差: 电子数相差:8n
同系物一定不是同分异构体; 同系物一定不是同分异构体;同分异构体一定不是同系物
练习:选择正确答案的序号, 练习:选择正确答案的序号, 填入下表空格中 A.同位素 B.同分异构体 . . C.同系物 D.同素异形体 . . E.同一物质 F.同类物质 . . 物质名称 氯仿与三氯甲烷 一氯甲烷与四氯化碳 乙烷与新戊烷
气态, (1)状态:常温常压下的烷烃, C1~C4,气态, )状态:常温常压下的烷烃, C5~C16,液态, 液态, C17及以上,固态。 及以上,固态。 (2)密度: 液态时密度均小于1g/cm3(均比水轻)。 )密度: 液态时密度均小于 均比水轻)。 (3)溶解性:均难溶于水,易溶于有机溶剂。 )溶解性:均难溶于水,易溶于有机溶剂。
甲烷_烷烃

甲烷烷烃2.难点聚焦1.有机物:含碳.化合物叫做有机化合物...,简称有机物。
(除CO、CO2、碳酸盐、碳化物、硫氰化物、氰化物等外)它们虽然含碳,但性质和组成与无机物很相近,所以把它们看作为无机物。
也就是说,有机物一定含碳元素,但含碳元素的物质不一定是有机物。
而且有机物都是化合物,没有单质。
那么究竟哪些物质是有机物,哪些物质是无机物,有什么判断依据呢?我们可以通过有机物与无机物的主要区别加以判断。
3.有机物的组成C、H、O、N、S、P、卤素等元素。
构成有机物的元素只有少数几种,但有机物的种类确达三千多种?几种元素能构几千万种有机物质?(学生自学后概括)有机物种类之所以繁多主要有以下几个原因:①碳原子最外电子层上有4个电子,可形成4个共价键;②有机化合物中,碳原子不仅可以与其他原子成键,而且碳碳原子之间也可以成键;③碳与碳原子之间结合方式多种多样,可形成单键、双键或叁键,可以形成链状化合物,也可形成环状化合物;(结构图5—1)④相同组成的分子,结构可能多种多样。
(举几个同分异构体)在有机物中,有一类只含C、H两种元素的有机物。
4.烃:仅含碳和氢两种元素的有机物称为碳氢化合物,又叫烃 在烃中最简单的是甲烷,所以我们就先从甲烷开始学起。
甲烷一、甲烷的物理性质(学生回答)无色、无味,难溶于水的,比空气轻的,能燃烧的气体,天然气、坑气、沼气等的主要成分均为甲烷。
收集甲烷时可以用什么方法?(1.向下排空气法,2.排水法) 二、甲烷的分子结构已知甲烷的气体密度在标准状况下为0.717 g/L ,其中含碳的质量分数为75%,含氢质量分数为25%,求甲烷的分子式。
(平行班提示:M=ρV m )甲烷的分子式:CH 4 电子式: 结构式:CH 4:正四面体 NH 3:三角锥形三、甲烷的化学性质 1.甲烷的氧化反应CH 4+2O 2−−→−点燃CO 2+2H 2Oa.方程式的中间用的是“ ”(箭头)而不是“====”(等号), 主要是因为有机物参加的反应往往比较复杂,常有副反应发生。
(完整版)高中有机化学方程式总结
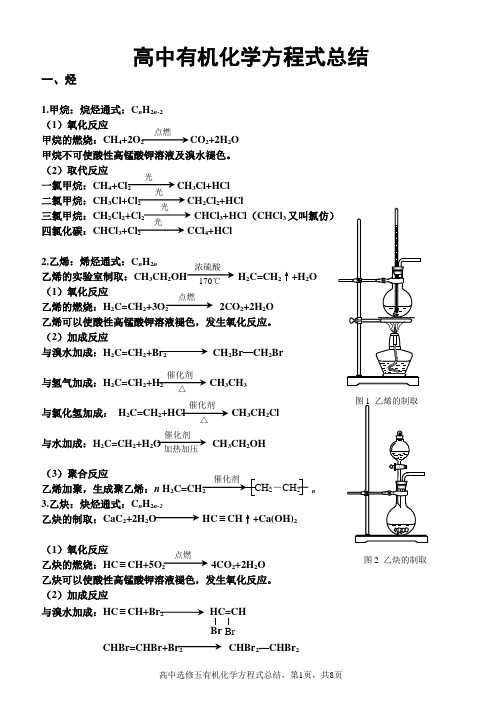
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
《烷烃》精品课件

1、烷烃
【温故知新】 甲烷:
2.烷烃的性质: (1)物理性质:
①均为难溶于水的无色物质; ②其熔点、沸点和密度一般随着分子中碳原子数的增加(相对分子质量增大) 而升高,密度均小于水;
碳原子数相同的烷烃,随支链增加,熔沸点降低。 ③随着分子中碳原子数的增加,常温下的状态由气态变为液态,再到固态。
【练习】
某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,
得到0.16molCO2气体和3.6g液态水。据此判断下列分析中不正确
的是( D )
【解析】标况下,2.24L两种气态烃组成的混合物,其物质的 量为0.1mol,完全燃烧得到0.16molCO2和3.6g水,水的物质的 量为0.2mol,则混合气体平均分子式为C1.6H4 所以,肯定含有C原子数小于1.6的烃,即一定含有甲烷,因甲 烷中含有4个氢原子,则另一种烃也含有4个氢原子.
的是( D )
A.将气体通入酸性KMnO4溶液中,溶液颜色无变化,该气体一定是甲烷 B.在导管口点燃该气体,火焰呈淡蓝色,用干燥的冷烧杯罩在火焰上方,
杯壁有水滴产生,该气体一定是甲烷 C.点燃该气体,火焰呈淡蓝色,用沾有澄清石灰水的冷烧杯罩在火焰上
方,烧杯壁上有白色物质产生,该气体一定是甲烷 D.若上述B、C的现象均能出现,则可判断该气体一定是甲烷
加热、光照或使用催化剂的条件下进行。 有机物除了有以上通性,依据其组成和结构的不同,还具有很多特性。
【课堂小结】
物理性质
烷烃的性质
化学性质
稳定性 可燃性 高温分解 取代反应
【知识海洋】 高温分解: 在隔绝空气并加热至1000℃以上的高温条件下,甲烷分解
可以用于制造颜料、油墨、油漆等
甲烷烷烃

甲烷与酸性高锰酸钾溶液、 甲烷与酸性高锰酸钾溶液、 溴水等不反应。 溴水等不反应。
氧化反应—燃烧 ★氧化反应 燃烧
现象:火焰呈蓝色,放出大量 现象:火焰呈蓝色, 的热。 的热。并有水滴和能使澄清石 灰水变浑浊的气体产生。 灰水变浑浊的气体产生。
点燃
CH4+2O2
CO2+2H2O
注意:点燃前必须验纯,否则会发生爆炸! 注意:点燃前必须验纯,否则会发生爆炸!
六、烃基 ——烃分子失去一个或几个 原子后 烃分子失去一个或几个H原子后 烃分子失去一个或几个 剩余的部分 用R-表示 表示 甲基 CH3- 或 -CH3 练习: 练习:写出乙基的结构简式 或 -CH2CH3 CH3CH2或 -C2H5 或 C2H5-CH3CH2
常见的烃基: 常见的烃基: 甲基: 甲基: -CH3 次甲基: 次甲基: CH - -
∣
亚甲基: 亚甲基: -CH2 -
乙基: 乙基: -CH2CH3 丙基: 丙基: CH2CH2CH3 - H3C 异丙基 CH H3C --C3H7
烃基的特点: 烃基的特点:
呈电中性的原子团,含有未成键的单电子。 呈电中性的原子团,含有未成键的单电子。 原子团 未成键的单电子
同系物: 同系物:
结构相似,在分子组成上相差一个或若干个CH 结构相似,在分子组成上相差一个或若干个 2 相差一个或若干个 原子团的物质互称为同系物。 原子团的物质互称为同系物。
烷烃通式: 烷烃通式: CnH2n+2 烷烃的结构相似是指: 烷烃的结构相似是指:
相同 ①通式_____ 通式_____ 同 一类物质: ____一类物质 ②是____一类物质:碳、碳单键形成链状 同 ③组成元素_____; 组成元素_____; _____ 化学式量相差14n; ④化学式量相差 ; 结构相似但不完全相同; ⑤结构相似但不完全相同; 化学性质相似。 ⑥化学性质相似。
烷烃 知识点
方法二:求出0.1mol该气态烃中含C、H的物质的量,进而求出1mol该气态烃中C、H的物质的量,从而求出分子式。
②同一个碳原子上连相同的烃基时,烃基等效,只需观察其中一个即可。例如:
—中的3个氢原子等效,只算其中一个即可;
中的三个甲基等效,只算其中一个即可;
中两个乙基等效,只算其中一个即可。
③处于镜面对称位置(相当于镜面成像时,物与像的关系)的氢原子等效。例如:
一氯取代物有4种,一氯取代物只有1种。
(2)二元取代物同分异构体数目的判断
(1)同系物的结构相似,主要指化学键类型相似,分子中各原子的结合方式相似。对烷烃而言,就是指碳原子间通过共价单键相连,其余价键全部结合氢原子。同系物结构相似,并不是相同。例如:和,前者有支链,而后者无支链,结构不相同,
但两者的碳原子均以单键结合成链状,结构相似,故互称为同系物。
(2)同系物的组成元素必相同。
例如:,属于环烷烃,通式为CnH2n,化学性质与烷烃相似。
2、烷烃的物理性质
烷烃的物理性质一般随着分子中碳原子数的递增而呈现规律性的变化。
(1)溶解性:烷烃均不溶于水而易溶于有机溶剂,液态烷烃本身也可以作为有机溶剂。
(2)状态:常温常压下,碳原子数小于等于4的烷烃一般呈气态,碳原子在5~16之间的烷烃常温下为液态,碳原子数大于16的烷烃常温下为固态(但新戊烷在常温下为气体)。
(3)同系物必符合同一通式。但符合同一通式且分子组成上相差一个或多个CH2原子团的物质不一定是同系物,例如: (乙烯)和(环丙烷)。
(4)同系物一定具有不同的分子式。
六、同分异构现象和同分异构体
1、定义:化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。具有同分异构现象的化合物互称为同分异构体。同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一。
甲烷烷烃课件

甲烷烷烃课件
4(06广东24)(8分)
环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂。下面
是部分环烷烃及烷烃衍生物的结构简式、键线式和某此有机化 合物的反应式(其中Pt、Ni是催化剂)。
结构简式
CH2
H2C
CH2
H2C
CH2
CH2
CH2 CH2 CH2 CH2
Br—CH2—CH2—CH(CH3)—CH2—Br
。
⑶环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反 应,如环丁烷与HBr在一定条件下反应,其化学方程式为 (不需注明反应条件)。
+HBr →CH3CH2CH2CH2Br
⑷写出鉴别环丙烷和丙烯的一甲种烷方烷烃法课件。试剂 KMnO4(H+);现象与结 论 。 能使KMnO4(H+)溶液褪色的为丙烯,不能使KMnO4(H+)溶液褪色的为环丙烷。
(3)判断有机反应类型是高考试题必考类型之一,可以有选择 题,有机推断题等题型来考查这个知识点。
甲烷烷烃课件
高考回顾:
1、(06上海1)石油是一种重要能源,人类正面临着石油短缺、
油价上涨的困惑。以下解决能源问题的方法不当的是( A )
A.用木材作燃料
B。用液氢替代汽油
C.开发风能
D.开发地热
2、(06上海5)下列有机物命名正确的是( B )
键线式
(环己烷)
Br Br
甲烷烷烃课件
① ② ③
回答下列问题:④
+ H2 + H2
Ni 353K
Ni 373K
+ H2
Pt 573K
+ KMnO4 H+
COOH +
烷烃

一、烷烃的命名:1、习惯命名法:(1)、通常把烷烃泛称“某烷”,某是指烷烃中碳原子的数目。
由一到十用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,自十一起用汉字数字表示。
例如: CH4叫甲烷,CH3CH3叫乙烷,CH3CH2CH3叫丙烷;C15H32叫十五烷。
(2)、为了区别同分异构体,用“正”、“异”和“新”来表示。
CH3—CH2—CH2—CH3正丁烷CH3—CH—CH3异丁烷∣CH3CH3—CH2—CH2—CH2—CH3正戊烷CH3—CH—CH2—CH3异戊烷∣CH3CH3∣CH3—C—CH3新戊烷∣CH3习惯命名法简单方便,但只能使用于结构比较简单的烷烃,对于结构比较复杂的烷烃必须用系统命名法。
2、系统命名法:在系统命名法中,对于支链烷烃,把它看作直链烷烃的烷基取代基衍生物。
烃分子失去一个氢原子所剩余的部分叫做烃基;烷烃分子失去一个氢原子所剩余的部分叫做烷基。
通式:Cn H2n+1(n≥1),通常用“R—”表示。
常见的烷基:CH3—甲基 CH3—CH2—乙基CH3—CH2—CH2—正丙基 CH3—CH—异丙基∣CH3对于支链烷烃的命名法可按照下列步骤进行:(1)、定主链,称“某烷”。
选定分子里最长碳链为主链,并按主链上碳原子的数目称为“某烷”。
(碳原子数在1~10的用甲、乙、丙、丁、戊、己、庚、辛、壬、癸命名。
)例一: CH3 — CH — CH2— CH2— CH2— CH3∣CH3在上式中线内的碳链为最长的,作为母体,含六个碳原子故叫己烷。
甲基则当作取代基。
(2)、写编号,定支链所在的位置。
①在选定主链以后,就要进行主链的位次编号,也就是确定取代基的位次,主链从一端向另一端编号,号数用1,2,3┉ 等表示。
②对简单的烷烃从距离支链最近的一端开始编号,位次和取代基名词之间要用“—”连接起来。
在有几种编号的可能时,应当选定使取代基的位次为最小。
例二: 1 2 3 4 5 6CH3—CH2— CH — CH2— CH2— CH3∣CH3(3)、写名称,相同基合并写,不同取代基从小到大写。
甲烷__烷烃

2.(2007·大庆一模)从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产 生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过 A.加成反应 B.取代反应 C.聚合反应 (B ) D.催化裂化反应
解析
本题主要考查石油的分馏产品之一石蜡的成分及其所发生的化学反应
பைடு நூலகம்
的知识内容。石蜡与石油成分相同,主要为烷烃、环烷烃和芳香烃,因此与 Cl2发生过的反应主要为取代反应,应选B。
(3)气体密度变化。
1.利用燃烧的产物确定分子式时,应注意看清是完全燃烧,还是不完全燃烧。 氢原子由水求算,碳原子完全燃烧可用CO2求算,不完全燃烧应用CO2和CO求算。 2.如用体积、压强变化计算,要注意反应温度和H2O的状态。100℃以上H2O 为气态。100℃以下水的体积不考虑。
1.某有机物2.8 g完全燃烧后生成了8.8 g CO2和3.6 g H2O,已知该有机物在标 准 状况下的密度为1.25 g·L-1。通过计算确定该有机物的分子式。 解析
.. : C H: .. H
H
H
H
H
C
H
H
2、碳原子相互之间能以共价键结合形成长的碳链
C
C C C
C
C C C C C
C
C
…
3、同分异构现象。 C
C
C C C
C C C C
C
二、烃分子的结构特点
1、C原子的成键的特点
2、烃分子的空间结构的想像
掌握简单小分子(如CH4、C2H4、C2H2、C6H6、H2O、 NH3等)空间结构。
试管中的液面____,试管壁上有_______出现,水槽中还观察到_________。 解析 将Cl2与CH4混合光照二者发生逐级取代反应生成气体一氯甲烷和氯化
甲烷与烷烃
同分异构体的书写方法: 同分异构体的书写方法:
1.先写出最长的碳链 1.先写出最长的碳链 2.写少一个 原子的直链,把剩下的C 写少一个C 2.写少一个C原子的直链,把剩下的C作为支链加 在主链上,依次变动位置。 在主链上,依次变动位置。 3.写少两个 写少两个C 3.写少两个C原子的直链 ①剩下的2个C作为一个支链加在主链上 剩下的2 ②剩下的2个C作为两个支链加在主链上 剩下的2 4.分别加上氢原子 得同分异构体结构式, 分别加上氢原子, 4.分别加上氢原子,得同分异构体结构式,用系 统命名法命名。 统命名法命名。
燃料: 燃料 建材: 建材 食物: 食物
汽油、煤油、 汽油、煤油、柴油 木材、黏结剂、涂料、油漆 木材、黏结剂、涂料、 糖类、油脂、 糖类、油脂、蛋白质
日用品: 塑料、橡胶、纤维、 日用品 塑料、橡胶、纤维、清洁剂
有机物的主要特点 有机物的主要特点
大多数有机物难溶于水 易溶于有机溶剂。 难溶于水, a. 大多数有机物难溶于水,易溶于有机溶剂。 b. 绝大多数有机物受热容易分解,且易燃烧。 绝大多数有机物受热容易分解, 易燃烧。 容易分解 非电解质, 多数有机物为非电解质 不易导电。 c. 多数有机物为非电解质,不易导电。 多数熔沸点低 熔沸点低。 d. 多数熔沸点低。 有机物的反应复杂 一般比较慢, 反应复杂, e. 有机物的反应复杂,一般比较慢,常常伴 有副反应发生。 有副反应发生。 有机物的以上性质特点与其结构密切相关。 密切相关。
CH4 + Cl2 CH3Cl + Cl2
光
CH3Cl + HCl CH2Cl2 + HCl
一氯甲烷(无色气体) 一氯甲烷(无色气体) 光 二氯甲烷(难溶于水的无色液体) 二氯甲烷(难溶于水的无色液体)
烷烃

附表:烷烃的碳原子数与其对应的同分异构体数
碳原 子数 同分 异体 数
1
1
2
1
3
1
4
2
5
3
6
5
7
8
9 10
9 18 35 75
练习1:
1 互为同位素,___ 2 是同素异形体, 下列五组物质中___
___ 5 是同分异构体,___ 4 是同系物,___ 3 是同一物质。
1、 3、
12 6
C
14 6
CH3CH2CH2CH3 CH3(CH2)3CH3
癸烷
十七烷
CH3(CH2)8CH3
CH3(CH2)15CH3
【练习】下列物质是否为同系物?
A、CH3CH2OH 和 CH3COOH B、CH2=CH2和
CH2 CH2
CH2
C、 CH3CH2CH3和 CH3CH3 D、CH3CH2CH3 和 C(CH3)4
(2)含有18个氢原子的烷烃
(3)相对分子质量为128的烷烃
【讨论与交流】 分析表中数据,讨论烷烃物理性质存在哪些规律?
名称 甲烷 结构简式 CH4 常温时 熔点/℃ 沸点/℃ 相对密度 的状态 气 -182.5 -161.5 水溶性 不溶
乙烷
丙烷 丁烷 戊烷 癸烷 十六烷 十七烷
CH3CH3
CH3CH2CH3 CH3(CH2)2CH3 CH3(CH2)3CH3 CH3(CH2)8CH3 CH3(CH2)14CH3 CH3(CH2)15CH3
CH2 CH3
试比较同系物、同分异构体、同素异形体、同位素 四个名词的含义。 同系物 分子组成相差 一个或几个 CH2原子团 结构相似 有机化合物 同分异构 体 分子式 相同 同素异 形体 同种 元素 同位素 质子数相 同,中子 数不同 ——
烷烃英文命名

注意:主链连有复杂烷基,则把位号和取代基名称看成 一个整体,仍然按词头的第一个字母确定命名次序。
13
IUPAC体系中支链烷基的命名
• 八个支链烷基保留普通名
(CH3)2CH-
isopropyl 异丙基
CH3CH2CH(CH3)- sec-butyl 仲丁基
CH3 CH3CHCHCH3
CH3
2,3dimethylbutane
2,3-二甲基丁烷
6
支链烷烃的IUPAC命名
• 给主链碳原子编号时,应使取代基的位次
和最小。一般是从离取代基近的一端开始
给主链编号。
CH3
CHHCH3
trimethylhexane 2,3,5-三甲基己烷
Nomenclature
Number Prefix(数字前缀):
总碳数≤10时
甲: meth-
壬: nona-
乙: eth-
癸: deca-
丙: prop-
丁: buta-
戊: penta-
己: hexa-
庚: hepta-
辛: octa-
1
直链烷烃的IUPAC命名
• C1到C4直链烷烃保留普通名:
20
饱和一元醇的命名
• IUPAC 命名法:
– 选主链:选含羟基的最长碳链为主链。 – 编碳号:从最靠近羟基的一端开始,依次个主
链碳原子编号。 – 定名称:母体名称为相应烷烃词尾ane去掉,
换上anol,并在母体名前面加上羟基的位号。
CH3CHCH3 2-propanol
OH
isopropanol
(isopropyl alcohol)
烷烃

烷烃常见烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的一类有机化合物。
烷烃分子中,氢原子的数目达到最大值,它的通式为CnH2n+2。
分子中每个碳原子都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体(tetrahedron)。
甲烷是标准的正四面体形态,其键角为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长烷烃还可能发生光学异构现象。
当一个碳原子连接的四个原子团各不相同时,这个碳就叫做手性碳,这种物质就具有光学活性。
烷烃失去一个氢原子剩下的部分叫烷基,一般用R-表示。
因此烷烃也可以用通式RH来表示。
烷烃最早是使用习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使用。
于是有人提出衍生命名法,将所有的烷烃看作是甲烷的衍生物,例如异丁烷叫做2-一甲基丙烷。
现在的命名法使用IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。
甲烷和烷烃的性质

甲烷和烷烃的性质甲烷和烷烃的性质甲烷和烷烃(alkanes)是有机化合物中最简单的一类化合物。
它们的化学结构非常简单,由单一的碳-碳 (C-C)和碳-氢 (C-H)键组成,而且它们在自然界中普遍存在。
甲烷是一种无色、无味、无毒的气体,在大自然中广泛存在,是天然气和沼气的主要成分。
烷烃是由多个碳原子和氢原子构成的分子,其中最简单的是乙烷(C2H6),它不溶于水、具有强烈的气味和易燃性。
物理性质甲烷是一种无色、无味、无毒的气体,密度为0.7174g/L,沸点为-161.5℃,燃点为680℃。
它是一种易挥发的气体,具有强烈的温室效应,可以在大气层中吸收太阳光,并导致全球气候变暖。
烷烃的物理性质随其碳原子数的增加而逐渐改变,它们通常是无色、透明液体或气体,密度较小,熔点和沸点逐渐增加。
化学性质甲烷是一种非常稳定的化合物,难以被氧化或加氢。
它只能通过光化学反应或高温下的裂解反应发生化学反应。
与氧气反应时,甲烷能够发生爆炸性反应,生成二氧化碳和水。
$CH_4 + 2O_2 \to CO_2 + 2H_2O$烷烃可以被氢气和卤素(氯、溴、碘)加成,生成相应的烷基卤素化合物。
烷基卤素(如四氯化碳、三氯甲烷)是一种很好的有机试剂,可以用于有机合成和环境治理。
烷烃还可以通过加氢、脱氢、烷基化、裂解、环化等反应发生化学反应,形成其他有机化合物。
反应示例:加氢:$C_2H_4 + H_2 \to C_2H_6$脱氢:$C_2H_6 \to C_2H_4 + H_2$烷基化:$C_2H_4 + CH_3Cl \to CH_3CH_2Cl$裂解:$C_8H_18 \to C_4H_8 + C_4H_{10}$环化:$C_6H_{12} \to C_5H_{10} + H_2$应用领域甲烷是一种非常重要的天然气和工业气体,广泛应用于燃料、能源、冶金、化工、制药等领域。
烷烃也是化工工业中的基础化合物,用作溶剂、合成高级化学品和塑料等原料。
烷烃的分类

烷烃的分类烷烃是一类仅含有碳和氢元素的有机化合物,分子中只有碳碳键和碳氢键。
根据碳原子数的不同,烷烃可以分为以下几个分类。
一、甲烷(CH4)甲烷是最简单的烷烃,也是天然气的主要成分之一。
它的分子中只有一个碳原子和四个氢原子,呈现出四面体的结构。
甲烷是无色、无臭的气体,在常温下不易液化。
二、乙烷(C2H6)乙烷是由两个碳原子和六个氢原子组成的烷烃。
乙烷也是天然气中的一种重要成分,常用于燃气供暖和燃料。
乙烷是无色、无臭的气体,比甲烷密度稍大。
三、丙烷(C3H8)丙烷是由三个碳原子和八个氢原子组成的烷烃。
它是一种常用的液化石油气,也广泛应用于燃料和化工工业。
丙烷是无色、无臭的气体,在正常压力下可液化。
四、丁烷(C4H10)丁烷是由四个碳原子和十个氢原子组成的烷烃。
它是一种无色、无臭的气体,也可液化。
丁烷常用作燃料和溶剂。
五、异丁烷(C4H10)异丁烷和丁烷的分子式相同,但它们的结构不同。
异丁烷的碳原子上有一个支链,因而它的物理性质与丁烷有所不同。
异丁烷是一种无色、无臭的气体,也可液化。
它常用作燃料和溶剂。
六、戊烷(C5H12)戊烷是由五个碳原子和十二个氢原子组成的烷烃。
与前面提到的烷烃不同,戊烷已经超过了人类的嗅觉阈值,具有一种特殊的气味。
戊烷主要用作燃料和溶剂。
七、己烷(C6H14)己烷是由六个碳原子和十四个氢原子组成的烷烃。
它是一种无色、无臭的液体,可作为燃料和溶剂使用。
以上是烷烃的主要分类,每种烷烃的分子结构和物理性质都有所差异。
烷烃是石油和天然气中的重要组成部分,广泛应用于能源和化工工业。
通过对烷烃的分类和了解,我们可以更好地理解和应用这些有机化合物。
烷烃的定义

烷烃的定义烷烃是有机化合物的一种,由碳和氢元素组成。
它是最简单的烃类化合物,也被称为脂烃。
烷烃分子中只含有碳碳单键和碳氢单键。
烷烃由于其结构的简单性和化学性质的稳定性,在许多领域都有广泛的应用。
烷烃的分子由一系列连续的碳原子构成,并用碳氢单键将它们连接在一起。
根据碳原子的数量,烷烃可以分为不同的类别,包括甲烷、乙烷、丙烷、丁烷等。
甲烷是最简单的烷烃,只含有一个碳原子和四个氢原子。
乙烷由两个碳原子和六个氢原子组成,以此类推。
烷烃的化学式可以用CnH2n+2表示,其中n代表碳原子的数量。
这个化学式显示了烷烃分子的碳氢比为2:1。
由于烷烃分子中只含有碳碳单键和碳氢单键,它们被认为是饱和化合物,与之相对的是不饱和化合物,如烯烃和炔烃,它们含有碳碳双键和三键。
烷烃的化学性质相对稳定,不容易发生化学反应。
这是因为烷烃分子中的碳碳和碳氢单键都是相对强度很高的化学键,需要较高的能量才能打断。
因此,烷烃在常温下不会自发地与其他物质发生反应。
然而,一些较活泼的物质,如氧气和氯气,在适当的条件下可以与烷烃反应。
烷烃的物理性质与碳原子的数量和分子结构有关。
随着碳原子数量的增加,烷烃的分子量和沸点通常也会增加。
这是因为分子量的增加会导致分子之间的分子力增强,从而需要更高的能量来克服这种力。
同时,烷烃的密度和粘度也随着分子量的增加而增加。
烷烃在常温下通常是无色无味的气体或液体,某些烷烃也可以是无色无味的固体。
它们通常具有较低的溶解度,但能够与非极性溶剂(如非极性有机溶剂)良好溶解。
烷烃的燃烧热值通常较高,可以作为燃料使用。
甲烷是自然气体的主要成分,被广泛应用于煤气和热能的生产。
烷烃在生物体内也起着重要的作用。
例如,脂肪是一种由烷烃构成的化合物,在动植物体内存储能量。
烷烃也是生物分子的组成部分,如脂肪酸和胆固醇。
总结起来,烷烃是一类由碳和氢元素组成的有机化合物。
它们的分子结构简单,只含有碳碳单键和碳氢单键。
烷烃分子的化学性质相对稳定,不容易发生化学反应。
烃的化学方程式

烃的化学方程式一、甲烷及烷烃1、甲烷燃烧:CH 4+2O 2CO 2+2H 2O 2、乙烷燃烧:2C 2H 6+7O 2 4CO 2+6H 2O 3、丙烷燃烧:C 3H 8+5O 22CO 2+4H 2O4、丁烷燃烧:2C 4H 10+13O 28CO 2+10H 2O5、甲烷及氯气见光:CH 4+Cl 2 CH 3Cl +HCl CH 4+2Cl 2CH 2Cl 2+2HCl CH 4+3Cl 2 CHCl 3+3HCl CH 4+4Cl 2CCl 4+4HCl6、乙烷及氯气见光: CH 3CH 3+Cl 2CH 3CH 2Cl +HCl7、丙烷及氯气见光: CH 3CH 2CH 3+Cl 2 CH 3CH 2CH 2Cl +HCl CH 3CH 2CH 3+Cl 23CHCH 3+HCl8、甲烷隔绝空气加强热:CH 4C +2H 29、十六烷的裂化:C 16H 34C 8H 18+C 8H 16 10、辛烷的裂化:C 8H 18C 4H 10+C 4H 8 11、丁烷的裂化:C 4H 10C 2H 6+C 2H 4 C 4H 10C 3H 6+CH 412、加热醋酸钠及碱石灰的混合物制备甲烷:CH 3COONa +NaOH Na 2CO 3+CH 4↑二、乙烯及烯烃加热CaO 加热催化剂 加热 催化剂 加热 催化剂 加热 催化剂高温 光照光照光照 光照 光照 光照点燃点燃 点燃点燃1、乙烯燃烧:C 2H 4+3O 2 2CO 2+2H 2O2、丙烯燃烧:2C 3H 6+9O 26CO 2+6H 2O3、乙烯使酸性高锰酸钾溶液褪色: 5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+12MnSO 4+6K 2SO 4+28H 2O4、丙烯使酸性高锰酸钾溶液褪色: 5CH 3CH=CH 2+10KMnO 4+15H 2SO 45CH 3COOH +5CO 2↑+5K 2SO 4+10MnSO 4+20H 2O5、乙烯的催化氧化:2CH 2=CH 2+O 22CH 3CHO6、丙烯的催化氧化:2CH 3CH=CH 2+O 22CH 3CH 2CHO 2CH 3CH=CH 2+O 22CH 3COCH 37、乙烯使溴的四氯化碳溶液褪色:CH 2=CH 2+Br 2BrCH 2CH 2Br8、丙烯使溴的四氯化碳溶液褪色:CH 3CH 2=CH 2+Br 2CH 3CHCH 2BrBr 9、乙烯及氢气的催化加成:CH 2=CH 2+H 2CH 3CH 3 10、丙烯及氢气的催化加成:CH 3CH=CH 2+H 2CH 3CH 2CH 3 11、乙烯及氯化氢的加成:CH 2=CH 2+HCl CH 3CH 2Cl 12、丙烯及氯化氢的加成:CH 3CH=CH 2+HClCH 3CHCH 3ClCH 3CH=CH 2+HClCH 3CH 2CH 2Cl 13、乙烯及水的加成:CH 2=CH 2+H 2OCH 3CH 2OH 14、丙烯及水的加成:CH 3CH=CH 2+H 2OCH 3CH 2CH 2OHCH 3CH=CH 2+H 2OCH 3CHOHCH 3加热、加压催化剂 加热、加压催化剂 加热、加压催化剂 加热催化剂点燃 点燃 催化剂nCH 2=CH 2CH 2—CH 215、乙烯的加聚: C16、丙烯的加聚:17、乙烯及丙烯的加聚:18、实验室制备乙烯:CH 3CH 2OH CH 2=CH 2↑+H 2O三、1,3—丁二烯及二烯烃1、1,3—丁二烯的燃烧:2C 4H 6+11O 28CO 2+6H 2O2、1,3—丁二烯的燃烧的催化氧化:CH 2=CH —CH=CH 2+O 2CH 3COCOCH 3CH 2=CH —CH=CH 2+O 2OHCCH 2CH 2CHO3、1,3—丁二烯使酸性高锰酸钾溶液褪色: CH 2=CH -CH=CH 2+4KMnO 4+6H 2SO 42CO 2↑+2K 2SO 4+4MnSO 4+HOOC —COOH +8H 2O4、1,3—丁二烯及溴水的加成:CH 2=CH —CH=CH 2+Br 2BrCH 2CHBrCH=CH 2CH 2=CH —CH=CH 2+Br 2BrCH 2CH=CHCH 2BrCH 2=CH —CH=CH 2+2Br 2BrCH 2CHBrCHBrCH 2Br5、1,3—丁二烯的加聚:6、2—甲基—1,3—丁二烯的加聚:170℃浓硫酸 加热催化剂加热催化剂点燃 nCH 2=CH 2+nCH 3CH=CH 2CH 2—CH 2—CH —CH 2催化剂nCH 3CH —CH 2催化剂nCH 3nCH 3CH=CH 2催化剂nCH 2=CH —CH=CH 2 CH 2—CH = CH —CH 2n催化剂nCH 2=C —CH=CH 2 CH 2—C = CH —CH 2nCH 3CH 37、2—氯—1,3—丁二烯的加聚:8、1,3—丁二烯及丙烯腈的加聚:9、1,3—丁二烯及苯乙烯的加聚:10、1,3—丁二烯的制备:CH 3CHBrCHBrCH 3+2NaOH CH 2=CH —CH=CH 2↑+2NaBr +2H 2O四、乙炔及炔烃1、乙炔的燃烧:2C 2H 2+5O 2 4CO 2+2H 2O2、丙炔的燃烧: C 3H 4+4O 23CO 2+2H 2O3、乙炔使酸性高锰酸钾溶液褪色: C 2H 2+2KMnO 4+3H 2SO 42CO 2+K 2SO 4+2MnSO 4+4H 2O5CH 3C CH +8KMnO 4+12H 2SO 45CH 3COOH +5CO 2+8MnSO 4+4K 2SO 4+12H 2O4、乙炔及氢气的加成:HC CH +H 2CH 2=CH 2HC CH +2H 2CH 3CH 35、乙炔及溴水的加成: HC CH +Br 2BrCH=CHBr HC CH +2Br 2BrCH —CHBrBr Br 6、丙炔及氢气的加成: CH 3C CH +2H 2CH 3CH 2CH 3 CH 3C CH +2Br 2CH 3CBr 2CHBr 2点燃 点燃 加热CH 3CH 2OH 催化剂nCH 2=C —CH=CH 2CH 2—C = CH —CH 2nClClnCH 2=CH —CH=CH 2 +nCH 2=CHCN催化剂CH 2—CH=CH —CH 2—CH —CH 2nCNnCH 2=CH —CH=CH 2 +nCH=CH 2 催化剂CH 2—CH=CH —CH 2—CH —CH 2nC 6H 5C 6H 57、乙炔及氯化氢的加成:HC CH +HClCH 2=CHCl8、氯乙烯的加聚:nCH 2=CHCl CH —CH 2Cl 9、丙炔及氯化氢的加成:CH 3C CH +HClCH 3CH=CHClCH 3C CH +HClCH 3CHCl=CH 210、乙炔及水的加成:HC CH +H 2OCH 3CHO 11、丙炔及水的加成:CH 3C CH +H 2OCH 3CH 2CHOCH 3C CH +H 2OCH 3COCH 312、乙炔的加聚:nHC CH CH = CH13、丙炔的加聚:nCH 3C CH C ===CHCH 314、电石及水反应制备乙炔:CaC 2+2H 2O Ca(OH)2+C 2H 2↑五、苯和苯的同系物 1、苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 2、甲苯的燃烧:C 7H 8+9O 27CO 2+4H 2O3、甲苯使酸性高锰酸钾溶液褪色: 5 —CH 3+6KMnO 4+9H 2SO 4 5 —COOH +6MnSO 4+3K 2SO 4+14H 2O4、苯在铁的作用下及液溴反应: +Br —Br +HBr5、甲苯在铁的作用下及液溴反应:H 3C — +Br 2H 3C — —Br +HBrH 3C — +Br 2H 3C — +HBr点燃 点燃 催化剂n 催化剂n催化剂nH 3C 6—CH 3+Cl2—CH 2Cl +HCl7、苯及浓硫酸、浓硝酸的混合溶液水浴加热:+HNO —NO 2+H 2O8、甲苯和浓硫酸、浓硝酸的混合溶液水浴加热:O 2H 3C — +3HNO3 H 3C — —NO2+3H 2OO 2N 9、苯及浓硫酸共热:+H 2—SO 3H +H 2O10、苯和氢气的加成: +11、甲苯和氢气的加成: ——CH 3六、石油、煤炭和天然气的综合利用1、石油的裂化如十六烷的裂化:C 16H 34C 8H 18+C 8H 16C 8H 18C 4H 10+C 4H 82、石油气的裂解:C 4H 10C 2H 6+C 2H 4 C 4H 10C 3H 6+CH 43、煤炭的气化:C(s)+H 2O(g)CO(g)+H 2 (g) CO +3H 2CH 4+H 2O加热催化剂 加热 催化剂浓硫酸 加热4、煤炭的液化:2C +2H 2O +2H 22CH 3OHCO +2H 2CH 3OH5、天然气转变成合成气:CH 4+H 2OCO +3H 2高温、高压催化剂催化剂 高温、高压催化剂。
烷烃的一氯代物数目表

烷烃的一氯代物数目表
烷烃是一类碳氢化合物,它的分子由碳和氢原子组成,并且没有含有任何官能团。
一氯代物指的是将烷烃中的一个氢原子替换为氯原子的化合物。
以下是一些常见烷烃的一氯代物的数目表:
1. 甲烷 (CH4) 的一氯代物是氯甲烷 (CH3Cl),只有一个一氯代物。
2. 乙烷 (C2H6) 的一氯代物是氯乙烷 (C2H5Cl),同样只有一个一氯代物。
3. 丙烷 (C3H8) 的一氯代物有两个:1-氯丙烷 (CH3CH2CH2Cl) 和 2-氯丙烷(CH3CHClCH3)。
4. 丁烷 (C4H10) 的一氯代物也有两个:1-氯丁烷 (CH3(CH2)2CH2Cl) 和 2-氯丁烷 (CH3CHClCH2CH3)。
5. 戊烷 (C5H12) 的一氯代物有三个:1-氯戊烷 (CH3(CH2)3CH2Cl),2-氯戊烷(CH3CH2CH(Cl)CH2CH3) 和 3-氯戊烷 (CH3(CH2)2CH(Cl)CH3)。
通过这个数目表,我们可以看到不同烷烃的一氯代物数量是不同的。
从甲烷到戊烷的一氯代物数目逐渐增加,这是因为随着碳原子数的增加,烷烃分子中氢原子的数量也增加,因此有更多的氢原子可以被氯原子替换。
需要注意的是,该数目表只列举了一氯代物,而烷烃还可以有其他卤代物,如二氯代物、三氯代物等。
这些化合物的数目会更多。
总而言之,烷烃的一氯代物数目表可以帮助我们了解不同烷烃分子中的氯代物的数量。
这对于有机化学的学习和实际应用中的相关研究具有重要意义。
第二节 烷烃10

烷 烃
碳原子间都以碳碳单键结合形成链状,碳原子剩余的价 碳原子间都以碳碳单键结合形成链 碳碳单键结合形成 全部跟氢原子结合 都达到饱和,这样的烃叫做饱和烃或 结合, 键全部跟氢原子结合,都达到饱和,这样的烃叫做饱和烃或 饱和链烃,又叫烷 饱和链烃,又叫烷烃。
*环烷烃 环烷烃
环丙烷
环己烷
[练习]下列物质为烃的有( BCD
一、烷烃的结构与性质
5、烷烃的物理性质 由于烷烃的结构相似,其性质上也具有相似性 均难溶于水,密度比水小。
随碳原子个数的增加,状态由气态—液态 随碳原子个数的增加,状态由气态 液态 固态 液态—固态 熔、沸点逐渐升高 密度逐渐增大
通常情况下,碳原子数 个的烷烃呈气态, 通常情况下,碳原子数1~4个的烷烃呈气态, 个的烷烃呈气态 碳原子数5~10个的烷烃呈液态,碳原子数 个 个的烷烃呈液态, 碳原子数 个的烷烃呈液态 碳原子数11个 以上的烷烃呈固态
–
[总结 总结] 总结
1)命名步骤: )命名步骤: (1)找主链,称某烷(长,多)。 找主链, 找主链 称某烷( (2)编号码,定位置(近,小,简)。 编号码, 编号码 定位置( (3)写名称:由小到大,位次在前,相同合并,主 写名称: 写名称 由小到大,位次在前,相同合并, 链压阵. 链压阵 2)名称组成: 2)名称组成: 取代基位置+-+取代基数目 取代基名称 主链名称 取代基数目+取代基名称 取代基位置 取代基数目 取代基名称+主链名称 3)数字意义: )数字意义: 一个阿拉伯数字表示一个取代基位置 汉字数字表示相同取代基的个数 阿拉伯数字之间用“ 隔开; (阿拉伯数字之间用“,”隔开;阿拉伯数字与文字 之间用“-”隔开,中文字和中文之间直接写) 之间用“ 隔开, 隔开
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲烷烷烃1.复习重点1.甲烷的结构、化学性质;2.烷烃的定义、命名、同系物、同分异构体及典型的取代反应。
2.难点聚焦1.有机物:含碳.化合物叫做有机化合物...,简称有机物。
(除CO、CO2、碳酸盐、碳化物、硫氰化物、氰化物等外)它们虽然含碳,但性质和组成与无机物很相近,所以把它们看作为无机物。
也就是说,有机物一定含碳元素,但含碳元素的物质不一定是有机物。
而且有机物都是化合物,没有单质。
那么究竟哪些物质是有机物,哪些物质是无机物,有什么判断依据呢?我们可以通过有机物与无机物的主要区别加以判断。
3.有机物的组成C、H、O、N、S、P、卤素等元素。
构成有机物的元素只有少数几种,但有机物的种类确达三千多种?几种元素能构几千万种有机物质?(学生自学后概括)有机物种类之所以繁多主要有以下几个原因:①碳原子最外电子层上有4个电子,可形成4个共价键;②有机化合物中,碳原子不仅可以与其他原子成键,而且碳碳原子之间也可以成键;③碳与碳原子之间结合方式多种多样,可形成单键、双键或叁键,可以形成链状化合物,也可形成环状化合物;(结构图5—1)④相同组成的分子,结构可能多种多样。
(举几个同分异构体)在有机物中,有一类只含C、H两种元素的有机物。
4.烃:仅含碳和氢两种元素的有机物称为碳氢化合物,又叫烃在烃中最简单的是甲烷,所以我们就先从甲烷开始学起。
甲烷一、甲烷的物理性质(学生回答)无色、无味,难溶于水的,比空气轻的,能燃烧的气体,天然气、坑气、沼气等的主要成分均为甲烷。
收集甲烷时可以用什么方法?(1.向下排空气法,2.排水法)二、甲烷的分子结构已知甲烷的气体密度在标准状况下为0.717 g/L,其中含碳的质量分数为75%,含氢质量分数为25%,求甲烷的分子式。
(平行班提示:M=ρV m)a.计算甲烷的摩尔质量因为摩尔质量=气体摩尔体积×密度=22.4L/mol×O.7179/L=16 g/mol所以甲烷的分子量为16。
b.按分子量和质量分数计算一个甲烷分子中C、H原子的个数C原子数:16×75%÷12=1H原子数:16×25%÷1=4所以甲烷的分子式为CH4。
甲烷的分子式:CH4电子式:结构式:用短线表示一对共用电子对的图式叫结构式。
上述结构式都不能表明甲烷分子的真实构型[模型展示]甲烷分子的球棍模型和比例模型。
得出结论:以碳原子为中心,四个氢原子为顶点的正四面体结构。
甲烷是非极性分子,所以甲烷极难溶于水,这体现了相似相溶原理。
CH 4:正四面体 NH 3:三角锥形三、甲烷的化学性质1.甲烷的氧化反应CH 4+2O 2−−→−点燃CO 2+2H 2Oa.方程式的中间用的是“ ”(箭头)而不是“====”(等号),主要是因为有机物参加的反应往往比较复杂,常有副反应发生。
b.火焰呈淡蓝色:CH 4、H 2、CO 、H 2S我们知道酸性KMnO 4具有很强的氧化性,若遇到一般的还原性物质时常常会发生氧化还原反应,且自身被还原而褪色 ,那么甲烷能否被酸性高锰酸钾溶液氧化呢?我们通过下面的实验来验证。
[演示实验5—1]观察、记录、思考实验现象:经过一段时间后,酸性KMnO 4溶液的颜色无任何变化,即不褪色。
结论:甲烷气体不能被酸性KMnO 4溶液氧化。
在通常条件下,甲烷不仅与高锰酸钾等强氧化剂不反应,而且与强酸、强碱也不反应,所以可以说甲烷的化学性质是比较稳定的。
但稳定是相对的,在一定条件下也可以与一些物质如Cl 2发生某些反应。
(承上启下,并对学生进行辩证唯物主义的教育)2.甲烷的取代反应[演示实验5—2]现象:①量筒内Cl 2的黄绿色逐渐变浅,最后消失。
②量筒内壁出现了油状液滴。
③量筒内水面上升。
④量筒内产生白雾[投影显示]甲烷与氯气的反应过程[说明]在反应中CH 4分子里的1个H 原子被Cl 2分子里的1个Cl 原子所代替..,但是反应并没有停止,生成的一氯甲烷仍继续跟氯气作用,依次生成二氯甲烷、三氯甲烷和四氯甲烷,反应如下:a.注意CH 4和Cl 2的反应不能用日光或其他强光直射,否则会因为发生如下剧烈的反应:CH 4+2Cl 2−−→−强光C+4HCl 而爆炸。
b.在常温下,一氯甲烷为气体,其他三种都是液体,三氯甲烷(氯仿)和四氯甲烷(四氯化碳)是工业重要的溶剂,四氯化碳还是实验室里常用的溶剂、灭火剂,氯仿与四氯化碳常温常压下的密度均大于1 g·cm -3,即比水重。
c.分析甲烷的四种氯代物的分子极性。
但它们均不溶于水。
(实验班)取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应3.甲烷的受热分解CH 4−−→−高温C+2H 2这么高的温度才分解,说明甲烷的热稳定性很强。
小结:本节课我们开始了对有机物的系统学习,介绍了有机物、烃的概念,解释了有机物种类繁多的主要原因;认识到甲烷的正四面体立体结构和它的几个重要化学性质:氧化反应、取代反应、受热分解反应,学习中重点应对甲烷和Cl 2的取代反应加以理解,当然也要树立结构和性质紧密相关的观点。
教学说明本章是学习有机物的开始,俗话说:万事开头难。
因此在教学中注重了以周围熟悉的有机物引入有机物的概念,从有机物的重要用途来激发学生学习有机物的兴趣。
为了让学生对甲烷的分子结构有一个正确的认识,采用了模型展示的方法;通过实验演示甲烷的取代反应和不能被酸性高锰酸钾溶液氧化的事实以及投影分析取代反应的过程,不仅提高了广大学生的分析思考问题、动手的能力,同时还帮助学生树立科学的学习和分析方法。
二、烷烃的结构和性质1.烷烃的概念a.分子里碳原子都以单键结合成链状;b.碳原子剩余的价键全部跟氢原子结合.2. 烷烃的结构式和结构简式甲烷乙烷丙烷丁烷结构式:结构简式:CH4CH3CH3CH3CH2CH3CH3CH2CH2CH3 /CH3(CH2)2CH3这种式子,书写起来是比较方便的,我们称之为有机物的结构简式。
当然,在书写有机物分子的结构简式时,若遇到像丁烷分子中有两个(或多个)相同的成分时,还可以写成CH3(CH2)2CH3。
由于结构简式书写方便,且仍能表示出分子结构的简况,所以更多情况下常使用结构简式。
既然甲烷的结构和其他的烷烃分子很相似,那么它们在性质上是否也很相似呢?3.烷烃的物理性质学生自学P116思考、分析表中数据,讨论,并得出一些规律。
(a)随着分子里含碳原子数的增加,熔点、沸点逐渐升高,相对密度逐渐增大;(b)分子里碳原子数等于或小于4的烷烃。
在常温常压下都是气体,其他烷烃在常温常压下都是液体或固体;(c)烷烃的相对密度小于水的密度。
(评价学生的回答,然后补充说明)(1)表中所列烷烃均为无支链的烷烃,常温常压下是气体的烷烃除了上述碳原子数小于或等于4的几种分子之外,还有一种碳原子数为5的分子,但分子中含有支链的戊烷,(2)烷烃分子均为非极性分子,故一般不溶于水,而易溶于有机溶剂,液态烷烃本身就是良好的有机溶剂。
[设疑]烷烃分子的熔沸点为什么会随着碳原子数的增大即相对分子质量的提高而升高呢?由于随着相对分子质量的增大,分子之间的范德华力逐渐增大,从而导致烷烃分子的熔沸点逐渐升高。
甲烷与其他烷烃结构的相似不仅表现在物理性质上的规律性变化,而且化学性质上也具有极大的相似性。
4.烷烃的化学性质(1)通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合;(2)在空气中都能点燃;(3)它们都能与氯气发生取代反应。
(评价并补充说明)(1)烷烃与氯气也可以是溴在光照条件下发生的取代反应,由于碳原子数的增多而使生成的取代产物的种类将更多;例如:甲烷的氯代物有:一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷共四种氯代物。
同学们算乙烷的氯代物有几种?答案:9种。
(实验班可以讲规律)(2)在空气或氧气中点燃烷烃,完全燃烧的产物为CO2和H2O,相同状况下随着烷烃分子里碳原子数的增加往往会燃烧越来越不充分,使燃烧火焰明亮,甚至伴有黑烟;(3)烷烃分子也可以分解,但产物不一定为炭黑和氢气,这在以后的石油裂化—裂解的学习中就将学到。
5.烷烃的通式:C n H2n+2CH4C2H6C3H8C4H10C5H12……若烷烃分子的碳原子数为n,那么氢原子的数目就可表示为2n+2,这样烷烃的分子式就可以表示为C n H2n+2。
大家再比较一下相邻碳原子数的烷烃在分子组成上有何特点,当然也可以用通式来推算。
(可以通过观察表5—1中的结构简式,也可以用通式推算,用C n H2n+2减去C n-1H2(n-1)+2,都可以得到相同的结论):在分子组成上相差一个或若干个CH2原子团。
6.同系物概念分子结构相似....,在分子组成上相差一个或若干个CH2原子团的物质,互称为同系物。
[练习]下列各组内的物质不属于同系物的是(C )(强调):在判断同系物的时候要严格把握同系物概念涵义的两个方面:一是分子结构相似,二是分子组成上相差一个或若干个CH 2原子团,二者要联系在一起应用,缺一不可。
当然,还应注意,同系物的关系不光是只有烷烃分子之间存在,在其他的有机物内也存在着同系物关系。
小结:本节课我们学习和讨论了几个重要的概念:烷烃、结构简式以及同系物,通过研究分析,讨论比较从而得出了烷烃分子的结构特点,以及烷烃的物理和化学性质的变化规律,当然在学习时应重点掌握烷烃性质的变化规律。
3.例题精讲一、烷烃1、烷烃的概念:碳原子跟碳原子都以单键结合成链状,碳原子剩余的价键全部跟氢原 子相结合。
这样的结合使得每个碳原子的化合价都已充分利用,都已达到“饱和”,这种结合的链烃叫做饱和链烃,或称烷烃。
2、烷烃的通式:C n H 2n+2 (n ≥1)3、烷烃物理性质:(1)状态:一般情况下,1—4个碳原子烷烃为气态,5—16个碳原子为液态,16个 碳原子以上为固态。
(2)溶解性:烷烃不溶于水,易溶于有机溶剂。
(3)熔沸点:随着碳原子数的递增,熔沸点逐渐升高。
(4)密度:随着碳原子数的递增,密度逐渐增加。
4、烷烃的化学性质(1)一般比较稳定,在通常情况下跟酸、碱和高锰酸钾等都不起反应。
(2)取代反应:在光照条件下能跟卤素发生取代反应。
(3)氧化反应:在点燃条件下,烷烃能燃烧, C n H 2n+2+O H n nCO O n 222)1(213++−−→−+点燃 (4)分解反应:在高温下,烷烃能分解成小分子。
二、同系物1、同系物的概念:结构相似,在分子组成上相差一个或若干个CH 2原子团的物质相互称为同系物。
2、掌握概念的三个关键:(1)通式相同;(2)结构相似;(3)组成上相差n 个(n ≥1) CH 2原子团。
例1、 下列化合物互为同系物的是:A O 2和O 3B 、C 2H 6和C 4H 10H Br CH 3C 、Br —C —Br 和Br —C —HD 、CH 3CH 2CH 3和CH 3—CH —CH 3H分析:(A )是同素异形体,(C )为同一种物质,分子组成上不相差CH 2原子团,而(B )(D )符合题意。
