无机试题答案钟
中级无机化学习题答案已打印

第一章、酸碱理论1.下列化合物中,哪些是路易斯酸,哪些是路易斯碱?BH4-,PH3,BeCl2,CO2,CO,Hg(NO3)2,SnCl2解答:路易斯酸BeCl2,CO2,CO,Hg(NO3)2,SnCl2路易斯碱PH3,CO,SnCl22.写出下列物种的共轭酸和共轭碱:NH2,NH2,H2O,HI,HSO4-解答:共轭酸共轭碱NH3:NH4+ NH2-NH2-:NH3NH2-H2O:H3O+OH-HI:I-HSO4-:H2SO4SO42-3.下列各对中哪一个酸性较强?并说明理由。
(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+(c) Si(OH)4 和Ge(OH)4 (d) HClO3和HClO4(e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4解答:(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+路易斯酸性:前者,中心离子电荷高,吸引电子能力大质子酸性:前者,中心离子电荷高,对O的极化能力大,H+易离解;(b)[Al(H2O)6]3+和[Ga(H2O)6]3+路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(c) Si(OH)4 和Ge(OH)4路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(d) HClO3和HClO4 (e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4均为后者,非羟基氧原子多,酸性越强。
4.应用Pauling规则,(1) 判断H3PO4(pKa=2.12)、H3PO3(pKa=1.80)和H3PO2(pKa=2.0)的结构;(2) 粗略估计H3PO4、H2PO4-和HPO42-的pKa值。
解答:(1)根据pKa值判断,应有相同非羟基氧原子。
(2)H3PO4:一个非羟基氧原子,pKa值约为2;H2PO4-pKa值增加5,约为7;HPO42-pKa约为12。
西南大学网络学院中级无机化学答案已整理(可直接打印)

1. 解释CF3COOH的酸性比CH3COOH的酸性强.2.PCl3、AsBr3、SbCl3可顺利置换出Ni(CO)4中的CO,但NCl3、PCl5却不易,为什么?参考答案:1. 是因为F是电负性最高的元素,F原子的极强的吸电子能力以及羰基的诱导作用,使CF3COOH分子中羰基O原子的正电性增强,从而对H原子的吸引减弱而使其易于解离。
当H原子解离后,生成的阴离子CF3COO?中形成离域∏34,大大增加了该阴离子的稳定性。
因此CF3COOH具有很强的酸性。
2.PCl3、AsBr3、SbCl3都有可用于σ配位的孤对电子,也有空的d轨道可接受来自Ni的反馈的d电子,因而可顺利置换Ni(CO)4中的CO。
NCl3虽然有孤对电子,但因N的电负性大,该孤对电子难以给出生成σ配键。
NCl3上虽也有反键空轨道,但能量较高,难以接受来自Ni的反馈d电子,PCl5其P原子没有孤对电子,所以难与Ni成键。
[多选题]实验室配制SnCl2溶液时,必须在少量盐酸中配制(而后稀释至所需浓度),才能得到澄清溶液,这是由于()C:同离子效应D:阻止SnCl2水解[单选题]Fe3+与F-、Cl-、Br-、I-形成配合物,其稳定性最大的是()。
A:Fe3+与F-形成配合物[单选题]H2PO4-的共轭酸为()。
B:H3PO4[单选题]HCO3-的共轭碱为()。
A:CO32-[单选题]LiF、LiCl、LiBr、LiI在水中溶解度最大的为()。
D:Lii[单选题]在水中TlBr的溶解度比TlBr3的溶解度()。
B:小[单选题]以HF为溶剂,醋酸为()。
B:碱[单选题]HF、HCl、HBr、HI的酸性最强的为()。
D:HI[单选题]硼酸H3BO3是一种()。
B:一元弱酸第二批次[单选题]下列氢氧化物溶解度最小的是()。
D:Ce(OH)4[单选题]已知配合物Cr(NH3)4Cl3的水溶液具有与NaCl溶液类似的摩尔电导率,且0℃时,每摩尔该化合物可以形成一摩尔的AgCl沉淀,则该配合物的化学式为() A:[ CrCl2(NH3)4]Cl[单选题] 估算配合物中自旋对磁矩的贡献最大的是()。
无机材料物理性能试题及答案终审稿)

无机材料物理性能试题及答案文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-无机材料物理性能试题及答案无机材料物理性能试题及答案一、填空题(每题2分,共36分)1、电子电导时,载流子的主要散射机构有中性杂质的散射、位错散射、电离杂质的散射、晶格振动的散射。
2、无机材料的热容与材料结构的关系不大,CaO和SiO2的混合物与CaSiO3的热容-温度曲线基本一致。
3、离子晶体中的电导主要为离子电导。
可以分为两类:固有离子电导(本征电导)和杂质电导。
在高温下本征电导特别显着,在低温下杂质电导最为显着。
4、固体材料质点间结合力越强,热膨胀系数越小。
5、电流吸收现象主要发生在离子电导为主的陶瓷材料中。
电子电导为主的陶瓷材料,因电子迁移率很高,所以不存在空间电荷和吸收电流现象。
6、导电材料中载流子是离子、电子和空位。
7. 电子电导具有霍尔效应,离子电导具有电解效应,从而可以通过这两种效应检查材料中载流子的类型。
8. 非晶体的导热率(不考虑光子导热的贡献)在所有温度下都比晶体的小。
在高温下,二者的导热率比较接近。
9. 固体材料的热膨胀的本质为:点阵结构中的质点间平均距离随着温度升高而增大。
10. 电导率的一般表达式为∑=∑=iiiiiqnμσσ。
其各参数ni、qi和i的含义分别是载流子的浓度、载流子的电荷量、载流子的迁移率。
11. 晶体结构愈复杂,晶格振动的非线性程度愈大。
格波受到的散射大,因此声子的平均自由程小,热导率低。
12、波矢和频率之间的关系为色散关系。
13、对于热射线高度透明的材料,它们的光子传导效应较大,但是在有微小气孔存在时,由于气孔与固体间折射率有很大的差异,使这些微气孔形成了散射中心,导致透明度强烈降低。
14、大多数烧结陶瓷材料的光子传导率要比单晶和玻璃小1~3数量级,其原因是前者有微量的气孔存在,从而显着地降低射线的传播,导致光子自由程显着减小。
无机化学练习题及答案解析

无机化学练习题一、选择题1.Na2S2O7中S的氧化数是()(A) +2 (B) +4 (C) +6 (D) +82.相同浓度的下列几种酸中,酸性最弱的是()(A) HCl (B) HBr (C) HI (D) H2Se3.CaF2 的K sp = 3.95×10-11 ,在氟离子浓度为3.0 mol·dm-3 的溶液中Ca2+离子可能的最高浓度是( ) (A)4.39×10-11 mol·dm-3 (B) 1.09×10-12 mol·dm-3(C) 1.09×10-13 mol·dm-3 (D) 4.39×10-12 mol·dm-34.由下列反应设计的电池,不需要惰性电极的是( )(A) H2(g) + Cl2 (g) = 2HCl(aq) (B) Ce4++ Fe2+= Ce3++ Fe3+(C) Zn + Ni2+= Zn2++ Ni (D) Cu + Br2 = Cu2++ 2Br-5.向原电池Zn│Zn2+(1 mol.dm-3 )‖Cu2+(1 mol.dm-3 )│Cu的负极中通入H2S气体,生成白色沉淀,则电池的电动势将( ) (A) 增大(B) 减小(C) 不变(D) 无法判断6.由铬在酸性溶液中的元素电势图,可确定能自发进行的反应是( )Cr3+ - 0.41VCr2+- 0.91VCr(A) 3Cr2+→ 2Cr3++ Cr (B) Cr + Cr2+→ 2Cr3+(C) 2Cr → Cr2++ Cr3+(D) 2Cr3++ Cr → 3Cr2+7.已知:Fe3++ e-= Fe2+θE= 0.77 VCu2++ 2e-= Cu θE= 0.34 VAg++ e-= Ag θE= 0.80 VAl3++ 3e-= Al θE= -1.66 V则最强的氧化剂是( ) (A) Al3+(B) Fe3+(C) Cu2+(D) Ag+8.下列新制备出的氢氧化物沉淀在空气中放置,颜色不发生变化的是( )(A) Fe(OH)2(B) Mn(OH)2(C) Co(OH)2(D) Ni(OH)29.Fe3+具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P 所要满足的条件是( ) (A) △和P越大越好(B) △> P (C) △< P (D) △= P10.不具有空间异构体的是( )(A) [PtCl2(NH3)4]2+(B) [PtCl3(NH3)3]+(C) [PtCl(NO2)(NH3)4]2+(D) [PtCl(NH3)5]3+11.下列反应中配离子作为氧化剂的反应是( )(A) [Ag(NH3)2]Cl + KI = AgI↓+ KCl + 2NH3(B) 2[Ag(NH3)2]OH + CH3CHO = CH3COOH + 2Ag↓+ 4NH3 + H2O(C) [Cu(NH3)4]2+ + S2-= CuS↓+ 4NH3(D) 3[Fe(CN)6]4-+ 4Fe3+ = Fe4[Fe(CN)6]312. [Ni(CN)4]2-是平面四方形构型,中心离子的杂化轨道类型和d电子数分别是( )(A) sp2,d7(B) sp3,d8 (C) d2sp3,d6(D) dsp2,d813.下列原子中半径最大的是( )(A) Ba (B) Ca (C) As (D) At14.IA族的金属(除锂外)与过量水反应的产物,最好的表示是( )(A) MOH和H2(B) M+(aq),OH-(aq)和H2(C) MOH和H2O (D) M2O和H215.下列各组化合物热稳定性关系正确的是( )(A) Na2CO3 > Na2SO4(B) K2CO3 > Ag2CO3(C) NaHCO3 > Na2CO3(D) (NH4)2CO3 > ZnCO316.常温下和N2能直接起反应的金属是( )(A) Na (B) K (C) Be (D) Li17.ICl2-离子的几何形状为直线型,其中心原子I 的杂化态为( )(A) sp (B) sp2(C) sp3(D) sp3d18.向含I-的溶液中通入Cl2,其产物可能是( )(A) I2和Cl-(B) IO3-和Cl-(C) ICl2-(D) 以上产物均可能19.干燥H2S气体,通常选用的干燥剂是( )(A) 浓H2SO4(B) NaOH (C) P2O5(D) NaNO320.下列化合物中同时具有离子键和共价键的是( )(A) ClF (B) NaCl (C) NaCN (D) H2SO421.ⅣA族元素从Ge到Pb,下列性质随原子序数的增大而增加的是( )(A) +2氧化态的稳定性(B) 二氧化物的酸性(C) 单质的熔点(D) 氢化物的稳定性22.能共存于酸性溶液中的一组离子是( )(A) K+,I-,SO42-,MnO4-(B) Na+,Zn2+,SO42-,NO3-(C) Ag+,AsO43-,S2-,SO32-(D) K+,S2-,SO42-,Cr2O72-23. 当0.075 mol·dm-3的FeCl2溶液通H2S气体至饱和(浓度为0.10 mol·dm-3),若控制FeS 不沉淀析出,溶液的pH值应是()(K sp(FeS) = 1.1 ⨯ 10-19,H2S:K a1 = 9.1 ⨯ 10-8,K a2 = 1.1 ⨯ 10-12)(A) pH≤0.10 (B) pH≥0.10 (C) pH≤8.7 ⨯ 10-2(D) pH≤1.06二、填空题1.在含有AgCl固体的饱和溶液中加入盐酸,则AgCl的溶解度;如加入氨水,则其溶解度;若加入KNO3,则其溶解度。
(完整版)无机化学试题与答案,推荐文档

A. 增大 B.减小 C.不变
D.不能确定
9. 酸性溶液中,锰的元素电势图如下:
试判断发生歧化反应的物质是(
)。
A. MnO4- 和 MnO42-
B. Mn3+ 和 Mn2+ C. Mn3+ 和 MnO42-
D. MnO2 和
Mn3+
10. 以下分析报告是四种酸性未知溶液的定性分析结果,合理的是( )
8.硫化物 ZnS、CuS、 MnS、SnS、HgS 中易溶于稀盐酸的是
, 不溶
于稀盐酸但溶于浓盐酸的是
,不溶于浓盐酸但可溶于硝酸的是
,只溶于王水的是
.
9.难溶电解质 Mg(OH)2,分别在(1)纯水中;(2) MgC12 溶液中;(3)NH4C1 溶液 中溶解,溶解度大小顺序为_________ > _________ > _______.
判断反应 Pb2+ + Sn →Pb + Sn2+ 能否在下列条件下自发进行?
无机化学试题
一、选择题(20 分,每题 2 分)
1.已知:298K 时,反应
C(石墨)+ O2(g)→ CO2(g) ⊿rHmΘ=-393.5kJ ·mol-1
CO(g)+ 1/2O2(g)→ CO2(g) ⊿rHmΘ=-283.0kJ ·mol-1
则反应 C(石墨)+ 1/2O2(g)→ CO(g)的⊿rHmΘ 等于( )。
顺序是 HC1〈 HBr〈 HI 。
3.铜与浓 HNO3 反应生成 NO2,铜与稀 HNO3 反应生成 NO,所以稀 HNO3 的氧化性比浓 HNO3 强。 4.金刚石与石墨是同素异形体,由金刚石转变为石墨的△rH > 0。 5.硼酸是三元酸。 6.KMnO4 在酸中、碱中、受热、见光都不稳定。
无机化学题库及答案
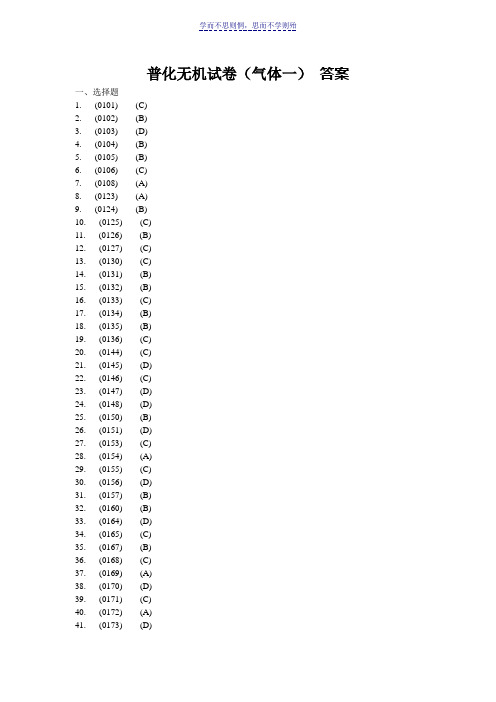
学而不思则惘,思而不学则殆普化无机试卷(气体一)答案一、选择题1. (0101) (C)2. (0102) (B)3. (0103) (D)4. (0104) (B)5. (0105) (B)6. (0106) (C)7. (0108) (A)8. (0123) (A)9. (0124) (B)10. (0125) (C)11. (0126) (B)12. (0127) (C)13. (0130) (C)14. (0131) (B)15. (0132) (B)16. (0133) (C)17. (0134) (B)18. (0135) (B)19. (0136) (C)20. (0144) (C)21. (0145) (D)22. (0146) (C)23. (0147) (D)24. (0148) (D)25. (0150) (B)26. (0151) (D)27. (0153) (C)28. (0154) (A)29. (0155) (C)30. (0156) (D)31. (0157) (B)32. (0160) (B)33. (0164) (D)34. (0165) (C)35. (0167) (B)36. (0168) (C)37. (0169) (A)38. (0170) (D)39. (0171) (C)40. (0172) (A)学而不思则惘,思而不学则殆41. (0173) (D)42. (0174) (B)43. (0175) (C)44. (0176) (B)45. (0177) (C)46. (0178) (D)47. (0179) (C)48. (0180) (C)49. (0181) (A)50. (0182) (B)51. (0183) (B)52. (0184) (A)53. (0185) (B)54. (0186) (B)55. (0187) (C)56. (0188) (C)57. (0189) (D)58. (0190) (A)59. (0191) (A)60. (0192) (B)61. (0193) (D)62. (0194) (A)63. (0195) (A)64. (0196) (C)65. (0197) (A)66. (0198) (B)67. (0199) (B)二、填空题 ( 共7题 13分 )68. (0107) 低压高温69. (0128) 分子间的作用力 , 分子的体积70. (0137) 3NH p : 3.9 MPa 2N p : 1.5 MPa 2H p : 4.6 MPa71. (0149) 0.5872. (0161) 46773. (0162) (1) H 2> He > Ne > CO 2; (2) 分子平均能量都相等 。
西南大学网考中级无机化学答案参考

8:[单选题]下列元素第一电离能最大的是()。
A:BB:CC:ND:O参考答案:C9:[单选题]下列离子中,离子半径最小的是()。
A:Cl-B:Ca2+C:Sc3+D:Ti4+参考答案:D 10:[单选题]性质最相似的两个元素是()。
A:Zr 和HfB:Ru 和RhC:Mn 和MgD:Cu 和Cr 参考答案:A11:[多选题]下列性质相似的元素是()。
A:Al和BeB:B和AlC:B和SiD:Al和Ca参考答案:AC12:[单选题]估计Ru3(CO)12中共有()个M―M键A:1B:2C:3D:4参考答案:C1:[判断题]判断方程式B2H6 + 2N(CH3)3=2BH3N(CH3)3是否正确。
参考答案:正确2:[判断题]判断方程式SOCl2 +Cs2SO3=2CsCl+2SO2是否正确。
参考答案:正确3:[判断题]判断方程式SbF5 + KF= KSbF6 是否正确。
参考答案:正确4:[判断题]判断方程式Cr(CO)6 + C6H6=Cr(C6H6)(CO)3 + 3CO是否正确。
参考答案:正确5:[判断题] 判断方程式Mn2(CO)10 + Br2=2Mn(CO)5Br是否正确。
参考答案:正确6:[判断题]. 判断方程式Fe(CO)5 + 3KOH=K[Fe(CO)4H] + K2CO3 + H2O 是否正确。
参考答案:正确7:[判断题]判断方程式CrCl3 + 3Na + 6CO=3NaCl + Cr(CO)6是否正确。
参考答案:正确8:[判断题]判断方程式2CoCO3 + 8CO + 2H2=Co2(CO)8 + 2CO2 + 2H2O是否正确。
参考答案:正确9:[判断题]判断方程式Fe + 5CO=Fe(CO)5是否正确。
参考答案:正确10:[判断题]判断方程式BF3NMe3 + BCl3 = Cl3BNMe3 + BF3是否正确。
参考答案:正确11:[判断题].判断方程式F4SiNMe3 + BF3 = F3BNMe3 + SiF4 是否正确。
12 级无机复习题 答案版

专业 班级: 座位号 班序号: 姓名A 、50 ml ;B 、40 ml ;C 、25 ml ;D 、15 ml 。
13、静脉滴注0.9g/L 的NaCI 溶液,红细胞结果会( D )。
A 、正常;B 、基本正常;C 、皱缩;D 、溶血。
14、人体血液平均每100 ml 中含+K 19mg 的渗透浓度约为(以mmol/L 表示)( B )。
A 、0.0049;B 、4.9;C 、49;D 、490。
15、将12.5g 葡萄糖溶于水,配成250 ml 溶液,该溶液的质量浓度为( C )。
A 、25 g/L ;B 、5.0 g/L ;C 、50 g/L ;D 、0.025 g/L 。
16、下列4种质量浓度相同的溶液中,渗透压最大的是( D )。
A 、蔗糖溶液;B 、葡萄糠溶液;C 、KCI 溶液;D 、NaCI 溶液。
17、会使红细胞发生皱缩的是( C )。
A 、12.5g/L 的3NaHCO 溶液;B 、1.00 g/L 的NaCI 溶液;C 、112 g/L 的353O H NaC ;D 、50g/L 的葡萄糖溶液。
18、已知2CaCI 溶液与蔗糖溶液的渗透浓度均为300mmol/L ,则两者物质的量浓度为( A )。
A 、c (蔗糖)=3c (2CaCI );B 、c (2CaCI )=3 c (蔗糖);C 、c (蔗糖)= c (2CaCI );D 、c (蔗糖)=2 c (2CaCI )。
19、下列化合物是弱电解质的是( C )。
A 、NaCI ;B 、2CaCI ;C 、3CaCO ;D 、3HNO 。
20、下列化合物是强电解质的是( D )。
A 、O H NH 23∙;B 、COOH CH 3;C 、O H 2;D 、42SO H 。
21、下列电离方程式中错误的是( C )。
A 、-++→CI H HCI ;B 、-++→OH Na NaOH ;C 、+++→23322CO H CO H ;D 、-++⇔OH NH OH NH 44。
07中级无机答案(B)

化学系200 7级化学教育专业2009年秋学期《中级无机化学》(B)答案一、填空题(每空1分,共20分)1.阿伦尼乌斯的水-离子,布朗斯特-劳莱的质子,路易斯酸碱2.拉平,区分3.第二周期性,第四周期元素的不规则性,惰性电子对效应4.异构现象,几何异构,旋光异构,键合异构,配位异构5.低6.前线轨道7.铝8.镧系元素,锕系元素9.惰性电子对10.镧系收缩二、简答题(每题5分,共50分。
11.Cu[SiF6] 六氟合硅(Ⅳ)酸铜K2[Co(SO4)2] 二硫酸根合钴(Ⅱ)酸钾(NH4)3[SbCl6] 六氯合锑(Ⅲ)酸铵[CrCl2(H2O)4]Cl 一氯化二氯·四水合铬(Ⅲ)[Ni(Co)4] 四羰基合镍(0)12.Sc 3d14s2Ti 3d24s2V 3d34s2Cr 3d54s1 Mn3d54s2 Fe 3d64s2Co 3d74s2Ni 3d84s2Cu 3d104s1Zn 3d104s213. 硬软酸碱原理:硬酸趋向于跟硬碱形成稳定的配合物,而软酸趋向于跟软碱形成稳定的配合物。
应用价值:(1)应用硬软酸碱原理可以很方便地对化合物的稳定性作出预言。
(2)硬软酸碱原理可以解释地球化学中的Goldschmidt分类规则,亲岩元素多以硅酸盐、磷酸盐、硫酸盐、碳酸盐、氧化物、氟化物形式存在,而亲硫元素多以硫化物形式存在。
(3)硬软酸碱原理还可以用来预言反应进行的方向。
14.在Ellingham图上,C氧化线是一条向下倾斜的直线,在较高温度下几乎能与所有元素的氧化线相交,当温度高于交点温度时,C的氧化线位于相交元素氧化线的下方,故可作为许多金属氧化物的还原剂,有“万能还原剂”之称。
在Ellingham图上,氢氧化线位置比较高,而且是一条向上倾斜的直线,能与它相交的氧化线很少,加上氢气在实际使用中的安全性问题和形成金属氢化物等原因,大大限制了氢气在还原金属氧化物方面的应用。
15. Zn,Cd,Hg的活泼性不一定大于 Cu,Ag,Au。
中级无机化学习题(含答案)

(B) 对 B(CH3)3 的碱性较强:(1) Me3N,Et3N;(2) (2-CH3)C5H4N,(4-CH3)C5H4N;(Bu
丁基;C5H4N 吡啶) 答:(A) (1) BBr3;(2) BCl3;(3) B(n-Bu)3;(B) (1) Me3N;(2) (4-CH3)C5H4N 6. 解释酸性变化规律 HOI < HOBr < HOCl。
9. 比较下列每组两个化合物与乙醇形成氢键的能力:
2
(1) (H3Si)2O 和(H3CH2C)2O;(2) (H3Si)3N 和(H3C)3N 答:对同一种 H 给体(如乙醇)而言,Lewis 碱性越强形成的氢键也越强。因为 O 和 N 上
的电子可扩充到 Si 的空 d 轨道上,因此与 Si 结合的 O 和 N 较与 C 结合的 O 和 N 的
Lewis 碱性低,因而可以预期(1)中的乙醚和(2)中的三甲胺形成的氢键更强些。
10.比较 HCF3 与 HCH2NO2 的酸性强弱,叙述理由。 答:HCF3 酸性较弱。按照诱导效应似应是前者的酸性强,因为 3 个电负性很大的 F 使 C
原子上带很高的正电荷。然而 HCF3 失去质子形成的 CF3-基团 C 上的负电荷离域化程 度并不高,而在 HCH2NO2 失去质子形成的 CH2NO2-基团 C 上的负电荷可以向 NO2 基 团的*轨道离域而稳定。所以后者的酸性较强。
子是
,与 BF3 相结合的原子是
。
答:P,N
4. 按照质子亲和势增加的顺序将下列各碱 HS,F,I,NH2-排序为。 答: I- < F- < HS- < NH25 . 在下述各组化合物中按题目要求进行选择。
(A) 最强的 Lewis 酸:(1) BF3,BCl3,BBr3;(2) BeCl2,BCl3;(3) B(n-Bu)3,B(t-Bu)3;
(完整版)无机化学试题及答案解析

第12 章S 区元素(第一套)一、单选题1. 重晶石的化学式是(A) BaCO3 , (B) BaSO4 , (C) Na2SO4 , (D) Na2CO32. 下列碳酸盐,溶解度最小的是(A) NaHCO3 , (B) Na2CO3 , (C) Li2CO3 , (D) K2CO33. NaN03受热分解的产物是(A) Na2O,NO2,O2;(B)NaNO2,O2;(C)NaN02,N02,02;(D)Na20,N0,02。
4. 下列哪对元素的化学性质最相似(A) Be 和Mg (B) Mg 和Al (C) Li 和Be (D) Be 和Al5. 下列元素中第一电离能最小的是(A) Li (B) Be (C) Na (D) Mg6. 下列最稳定的氮化物是(A) Li3N (B) Na3N (C) K3N (D) Ba3N27. 下列水合离子生成时放出热量最少的是(A) Li+ (B) Na+ (C) K+ (D) Mg2+8. 下列最稳定的过氧化物是(A) Li202 (B) Na202 (C) K202 (D) Rb2029. 下列化合物中键的离子性最小的是(A) LiCl (B) NaCl (C) KCl (D) BaCl210. 下列碳酸盐中热稳定性最差的是(A) BaC03 (B) CaC03 (C) K2C03 (D) Na2C0311. 下列化合物中具有磁性的是(A) Na202 (B) Sr0 (C) K02 (D) Ba0212. 关于s 区元素的性质下列叙述中不正确的是(A) 由于s 区元素的电负性小,所以都形成典型的离子型化合物(B) 在s 区元素中,Be、Mg 因表面形成致密的氧化物保护膜而对水较稳定(C) s 区元素的单质都有很强的还原性(D) 除Be、Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做焰火材料13. 关于Mg , Ca , Sr , Ba及其化合物的性质下列叙述中不正确的是(A) 单质都可以在氮气中燃烧生成氮化物M3N2(B) 单质都易与水水蒸气反应得到氢气(C) M(HCO3)2在水中的溶解度大MC03的溶解度(D) 这些元素几乎总是生成+2 价离子二、是非题(判断下列各项叙述是否正确对的在括号中填“/ 错的填“X”)1. 因为氢可以形成H+所以可以把它划分为碱金属2. 铍和其同组元素相比离子半径小极化作用强所以形成键具有较多共价性3. 在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
高等无机化学考试题及参考答案(硕士)【精选】

第一部分(试题,50分)(一)运用群论的方法,写出NH 3分子(C 3V 点群)红外和Raman 振动的对称性(20分)。
解:1)C 3V 操作下不动原子数和总的可约表示特征标表C 3VE2C 3Vσ3不动原子数χ4 1 231n3Γ1223)1231021121(61)()(11=⨯⨯+⨯⨯+⨯⨯=∑=ΓΓR R h n i RA χχ1))1(231021121(61)()(12=-⨯⨯+⨯⨯+⨯⨯=∑=ΓΓR R h n i RA χχ 4)023)1(022121(61)()(1=⨯⨯+-⨯⨯+⨯⨯=∑=ΓΓR R h n i RE χχ平动与x,y,z,有关故NH 3分子的平动对称性为A 1+E ,转动与E A A N 43213++=ΓRx,Ry,Rz,有关故转动对称性为A 2+E ,最后得分子振动对称性为2A 1+2E ,它们既是红外和Raman 振动的对称性(二)3d 2组态的谱项有那些?按照谱项能量由低到高排序,并指出基谱项(10分)。
解:由可知,S 可能取值为1,0,L 可能取值为4,3,2,1,0,l L m m ∑=s S m m ∑=同时还要根据鲍林不相容原理可知,3d 2中两个电子所有量子数不能全同,从而可得3d 2组态有五个谱项,分别为,能量从低到高为,基谱项为。
G F D P S 13131,,,,S G P D F 11313,,,,F 3(三)用d 电子组态离子在八面体场中的定性能级图解释[Mn(H 20)6]2+离子基本无色的原因(10分)。
解,在d 5组态的Mn 2+能级图上看出不存在和基谱项具有相同多重度的激发谱项,同g A 16时因为多重度不同的的谱项之间的跃迁是自旋禁阻的,但是由于自旋—轨道偶合还是改变谱项的能量,使谱项发生混合,在光谱图上仍会有出现吸收峰,但是这种自旋禁阻的跃迁具有低的跃迁概率,吸收强度很小,故Mn(H 20)6]2+几乎为无色。
(四)根据过渡金属离子水交换速率和d 电子组态之间的关系图,分别说明4V 2+,Cr 3+,Ni 2+离子的水交换反应速率比较慢以及Cr 2+,Cu 2+离子的反应速率非常快的原因(10分)。
大学真题无机化学答案解析

大学真题无机化学答案解析大学无机化学真题答案解析无机化学是化学的重要领域之一,它研究的是无机化合物的性质、结构和反应等方面。
在大学的无机化学课程中,学生们经常会遇到各种难题。
为了帮助同学们更好地理解无机化学知识,我选取了一些典型的大学无机化学真题,并进行了答案解析。
题目一:下面哪一种物质是高温超导材料?A. C60B. NaClC. CuD. H2O答案解析:高温超导材料是指在相对较高的温度下,材料表现出超导现象的物质。
根据现有研究,选择A选项,C60(富勒烯)是高温超导材料。
富勒烯是一种由60个碳原子组成的球形分子,结构独特,具有良好的导电性能,因此成为高温超导材料的候选物质。
题目二:以下哪一个金属是属于过渡金属?A. CuB. AuC. AlD. Fe答案解析:过渡金属是指位于周期表中d区的金属元素,它们具有多种氧化态和复杂的电子结构。
根据现有知识,选择D选项,Fe (铁)是过渡金属。
铁的原子序数是26,位于d区,具有典型的过渡金属性质,如多种氧化态和催化剂活性等。
题目三:下面哪一种离子是有色的?A. Na+B. Cl-C. Cu2+D. Zn2+答案解析:离子的有色性来源于其电子结构中的能级跃迁引起的吸收或发射光谱。
根据现有知识,选择C选项,Cu2+离子是有色的。
铜离子在空乏态时,电子位于d轨道,当吸收可见光能量后,电子会跃迁到高能位,从而使物质呈现颜色。
题目四:下面哪一种元素形成阴离子?A. 碱金属元素B. 碱土金属元素C. 非金属元素D. 过渡金属元素答案解析:阴离子是指带负电的离子。
根据现有知识,选择C选项,非金属元素形成阴离子。
非金属元素由于具有较高的电负性,能够接受电子,形成带负电荷的离子,例如氯离子(Cl-)和氧离子(O2-)等。
题目五:下面哪一种化合物是属于酸?A. NaClB. HClC. CaCl2D. NaOH答案解析:酸是指能够释放出H+离子的化合物。
根据现有知识,选择B选项,HCl是酸。
无机化学试题(含答案)

无机化学试题第一章气体填空题:1、某广场上空有一气球,假定气压在一日内基本不变,早晨气温15℃时,气球体积为25.0L;中午气温为30℃,则其体积为 26.3 L;若下午的气温为25℃,气球体积为 25.9 L。
2、某真空集气瓶的质量为134.567g。
将一温度为31℃,压力为98.0 kPa的气体充入其中,然后再称其质量为137.456g,则该气体的质量m= 2.889g。
如果集气瓶中装满31℃的水,其总质量为1067.9g(该温度下水的密度为0.997g·mL-1),集气瓶的容积为0.936 L;该气体的密度ρ= 3.09 g.·L-1,摩尔质量M=79.6g·moI-1。
3、恒定温度下,将1.0L 204kPa的氮气与2.0L 303kPa的氧气充入容积为3.0L的真空容器中,则p(N2)= 68 kPa; p(O2)= 202 kPa; 容器内的总压力p=270 kPa。
4、在温度T时,在容积为c L的真空容器中充入氮气和氩气。
容器内压力为a kPa,若p(N2)=b kPa, 则p(Ar)= a-b kPa; N2和Ar的分体积分别为 bc/aL和 (a-b)c/a L; n(N2)= bc/RT mol,n(Ar)= (a-b)c/RT mol。
5、在相同温度、压力、体积下,两种气体的摩尔质量分别为M1和M2(M1>M2)。
试比较:n1 = n2, m1> m2; Ēk,1= Ēk,2; v1< v2; ρ1>ρ2。
若体积增大,温度、压力保持不变,则ρ1, ρ2都不变。
选择题:1、一定温度下,某容器中含有相同质量的H2,O2,N2与He的混合气体,其中分压最小的组分是………………………………………………………………( B )(A)N2 (B)O2(C)H2(D)He2、某温度下,一容器中含有2.0mol O2,3.0mol N2及1.0mol Ar。
《中级无机化学》试题及答案
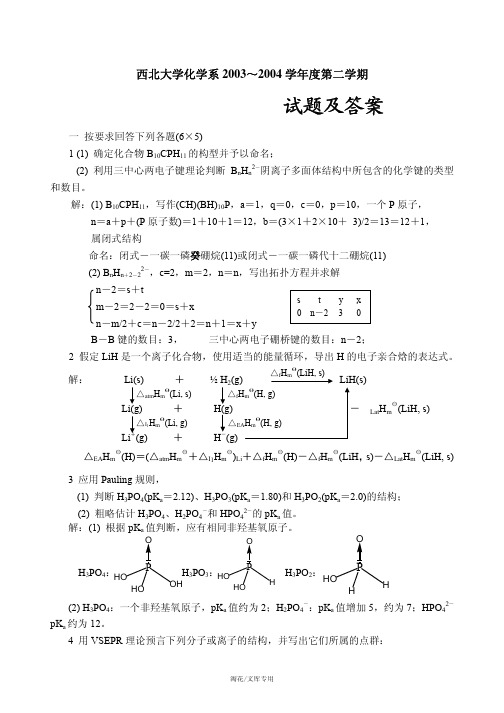
西北大学化学系2003~2004学年度第二学期《中级无机化学》试题及答案一 按要求回答下列各题(6×5)1 (1) 确定化合物B 10CPH 11的构型并予以命名;(2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。
解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子,n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1,属闭式结构命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11)(2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解n -2=s +tm -2=2-2=0=s +xn -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2;2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。
解: △Lat H m θ(LiH, s)△EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s)3 应用Pauling 规则,(1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构;(2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。
解:(1) 根据pK a 值判断,应有相同非羟基氧原子。
H 3PO 4: H 3PO 3: H 3PO 2:(2) H 3PO 4:一个非羟基氧原子,pK a 值约为2;H 2PO 4-:pK a 值增加5,约为7;HPO 42-pK a 约为12。
0049《中级无机化学》模拟测试答案西南大学网络教育20年春季作业参考答案

0049 20201主观题1、在BrF3中,SbF5与KF的反应方程式。
参考答案:SbF5+KF = KSbF62、参考答案:3、参考答案:Fe(C5H5)2 + CH2O + HNCH3‍(C5H5)Fe(C5H4 CH2NCH3)2 + H2O4、Fe3++Eu2+=参考答案:Fe3++Eu2+=Fe2++Eu3+5、Mn2(CO)10+I2=参考答案:Mn2(CO)10+I2=2Mn(CO)5I6、C5H6+NaOH=参考答案:C5H6+NaOH=C5H5Na+H2O7、参考答案:TiO2 + 2C + 2 Cl2TiCl4 + 2 CO8、超酸是哈密特酸度函数Ho()-11.93的酸。
参考答案:< (或“小于”)9、配合物四氢合铝(III)酸锂的化学式为()。
参考答案:Li(AlH4)10、K4[Fe(CN)6]为低自旋配合物,根据晶体场理论,中心离子的电子排布为()。
参考答案:t2g6 e g011、造成第三过渡元素原子半径和第二过渡元素原子半径相接近的原因是()。
参考答案:镧系收缩12、金属酶是能执行催化功能的()蛋白。
参考答案:金属13、根据鲍林规则,估计HOCl的p K a 值为()。
参考答案:≥ 714、[Fe(H2O)6]Cl3为高自旋配合物,根据晶体场理论,中心离子的电子排布为()。
参考答案:t2g3 e g215、二、三过渡系,称为()过渡元素。
参考答案:重单项选择题16、下列物种中,属于N2H5+的共轭碱是()。
.NH3.N2H4.N2H62+.N2H5OH17、按酸碱质子理论,下列分子或离子中为碱的是()。
.SbF5.NaAc.AlCl3.Ac -18、在[Co(NH3)4Cl2]中,Co的氧化数为()。
.0.+1.+2.+319、已知配合物[Pt(NH3)2(NO2) Cl]的空间构型为平面正方形,它的几何异构体数目为()。
. 1. 2. 3. 520、下列不是π-酸配体的是()。
中级无机化学答案整理版
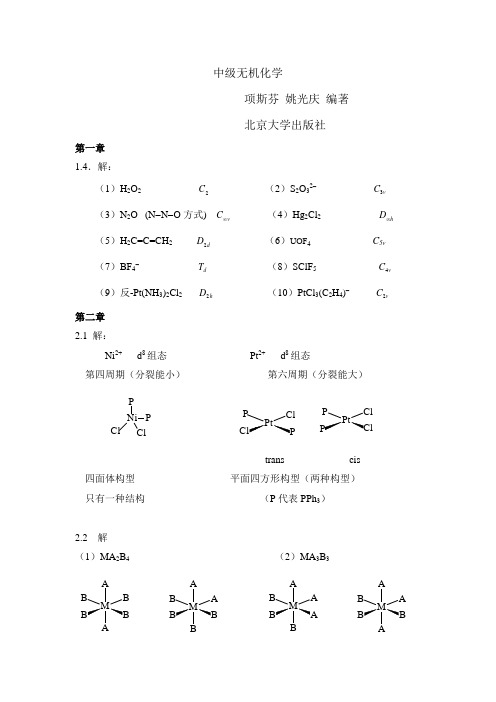
中级无机化学项斯芬 姚光庆 编著 北京大学出版社第一章 1.4.解:(1)H 2O 22C(2)S 2O 32- 3v C (3)N 2O (N -N -O 方式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4-d T (8)SClF 54v C(9)反-Pt(NH 3)2Cl 2 2h D(10)PtCl 3(C 2H 4)- 2v C第二章 2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期(分裂能小)第六周期(分裂能大)P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)2.2 解 (1)MA 2B 4(2)MA 3B 3M A BB M AA BM AAB M A A Btrans cis fac(面式) mer(经式) D4h C2v C3v C2vμ=0 μ≠0 μ≠0 μ≠0μfac>μmer2.3 Co(en)2Cl2+D2h C2光活异构体C2Co(en)2(NH3)Cl2+33Htrans cisCo(en)(NH3)2Cl2+3333NHNH33trans(1)trans(2) cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
(2)等物质量的异构体中分别加入过量AgNO3,产生少量沉淀(1molAgCl↓)的为前者(摩尔比为2:1),产生大量沉淀(2molAgCl↓)的为后者。
或用电导方法测量,前者和后者的电导比为2:3(3)[Co(H2O)4Cl2]+顺式C2v、反式D4h,对称性不同,偶极矩不同,可以用物理方法鉴别,例如红外或Raman光谱不同。
