日本-NissuiPharmaceutical(45500)2016-2019年二季度财务报表数据-原点参数
日本进口药品

国药准字 J20100121
阿加曲班注 射液
Argatroban Injection
诺保思泰
注射剂 20ml:10mg 10支/盒
260 H20100591
硫酸异帕米 星注射液
Isepamicin Sulfate Injection
依克沙
Exacin
注射剂
2ml:200mg 10支/盒
261 H20100592
1瓶/盒,4 瓶/盒
72 H20130206
甲钴胺注射 液
Mecobalami n Injection
弥可保
73 H20130207
甲钴胺注射 液
Mecobalami n Injection
弥可保
Methycobal 注射剂 Methycobal 注射剂
1ml:0.5mg 10安瓿/盒
50安瓿/ 1ml:0.5mg 盒,1000安
瓿/箱
79 H20130124
Compound
复方甘草酸 苷注射液
Glycyrrhiz in
美能
Injection
Stronger
NeoMinophagen
注射剂
C
----
10支/盒
89 H20120507
Sodium
玻璃酸钠注 Hyaluronat
射液
e
Injection
127
国药准字 J20120009
144 H20110567
阿加曲班注 射液
Argatroban Injection
诺保思泰
NOVASTAN
注射剂
2ml:10mg 10支/盒
145 H20110568
阿加曲班注 射液
仿制药参比制剂目录(第五批)
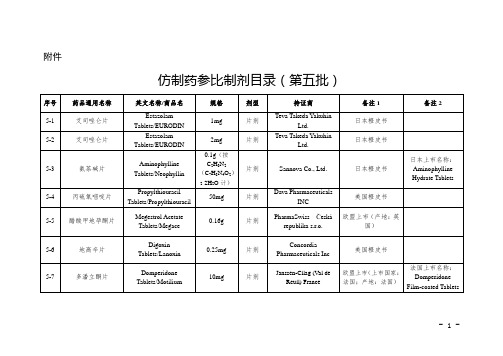
0.2g
片剂
EXELGYN
欧盟上市(上市国家:法国;产地:法国)
5-28
诺氟沙星片
Norfloxacin Tablets/BACCIDAL
0.1g
片剂
KYORIN Pharmaceutical Co.,Ltd.
日本橙皮书
5-29
Teva Takeda Yakuhin Ltd.
日本橙皮书
5-3
氨茶碱片
Aminophylline Tablets/Neophyllin
0.1g(按C2H8N2(C7H8N4O2)2·2H2O计)
片剂
Sannova Co., Ltd.
日本橙皮书
日本上市名称:Aminophylline Hydrate Tablets
日本橙皮书
5-13
红霉素肠溶胶囊
Erythromycin Enteric Capsules/ERYC
0.25g(25万单位)
胶囊剂
Mayne Pharma International Pty Ltd
美国橙皮书
美国上市名称:Erythromycin delayed-release capsules
5-14
日本橙皮书
5-48
丙硫氧嘧啶片
Propylthiouracil Tablets/PROPYL-THYRACIL
0.1g
片剂
Paladin Labs Inc
上市国家:加拿大
5-49
磷酸氯喹片
Chloroquine Phosphate Tablets/Resochin
0.25g(按氯喹C18H26ClN3计155mg)
MerckSanté S.A.S
日本药典 (JP)和日本的辅料标准

3. 推动国际协调的进程 (1)
通过药典讨论小组(PDG)与欧洲药典和美国药典合作 → 带来了日本药典第15版中的各种协调最终文本 20个一般章节中有19个 35个辅料专论中有24个
3. 推动国际协调的进程 (2)
在每个协调一般测试方法和辅料中均包括了协调 现状陈述 未说明的区别和当地要求均采用了通用符号(黑色 菱形 ◆ ) 一般信息中的信息补遗 -日本药典中实施的国际协调
2004年4月1日依法建立的一个新的半政府性 机构(公司性质的管理机构)。 进行几乎所有药品和医疗器械方面的科学和 技术评估和检查 在确定日本药典中起着实质的办公 室
日本药品和医疗器械局 6 楼-11楼 Shin-kasumigaseki大 厦 Chiyoda-ku, 东京
http://www.mhlw.go.jp/topics/bukyoku/iyaku/
yakkyoku/index.html
英文版的日本药典
http://www.mhlw.go.jp/topics/bukyoku/iyaku/ yakkyoku/english.html
5.最新分析方法的引入和参考标准中统 一系统的确立。
日本药典(JP)和日本的辅料标准
Kiyomi UENO
日本药品和医疗器械局(PMDA), 日本药
典
辅料标准
日本药典 (JP) 日本厚生劳动省 部门公告 日本的药物辅料(JPE)(医薬品添加物規格) 公告 医薬食品局長通知 散装准药品成分的日本标准 (医薬部外品原料規格) 公告 医薬食品局長通知 食品添加剂的日本规范和标准(食品添加物規格) 日本厚生劳动省 部门公告 厚生労働大臣告示
日本药典委员会/药政管理和食品卫生委员会(日 本厚生劳动省) 15个专家委员会,1个附设委员会和3个工作小组 (药品和医疗器械局) 成员: -大约150个专家,来自国家研究机构、大学及其它 部门 -东京、大阪药品生产商联合会以及其它所示各方 的代表 频率:每个委员会负责两个月
日本美思满科普

美思满说明书美思滿胎盤素是通過高科技生物手段提取的,保存了原始物質95%以上的活性。
並且注射後,可以迅速地進入人體循環系統,其中的有益物質滲入到各個器官後,立即參與到人體工作中,全面改善體質和外在容顏,效果持久看得到!日本美思滿胎盤素富含各種氨基酸,活性肽,各種生長因子和修護因子,通過人體循環全面調理身體各項機能,美容養顏,增強抵抗力,調節內分泌,延緩五臟六腑的早衰及老化。
【品質】呈淡黃色的液體,PH值介於6.8-7.0之間,含有壓縮於生理鹽水的滲氧素,以便迅速被人體吸收。
胎盤絨毛含量為100mg。
【成分】富含各種氨基酸、黏多糖體、活性肽、維他命、蛋白質、礦物質、脂質脂肪酸、核酸、糖類、酶類及各種生長因子和修護因子等。
【主要功能】美白養顏作用,促進末梢血液循环,賦活細胞和組織,促進皮膚呼吸,去除自由基作用,增進細胞分裂,保濕作用,自律神經正常化作用,免疫賦活作用。
【療程效用】將按使用者的年齡及體質的不同而有所差異,一般上可維持數年之久。
【安全保證】1956年日本厚生省批核承認番號(東藥)第11386號。
日本衛生部授予醫藥品販賣業許可證。
世界生產人胎素最久之生產商。
日本醫療保險項目之一(更年期障礙及乳汁分泌不全)。
日本醫藥安全管理局頒發優良生產流程(GMP)證書。
新加坡(HSA)化驗測試(不含荷爾蒙及有毒物質)。
香港生產力促進局HKPC的安全化驗測試(不含重金屬)。
產品使用將近60年,從未發生副作用。
【使用方法】美思滿胎盤素可肌肉注射、皮下注射,也可靜脈滴注,還可以進行穴位注射,通過人體經絡及穴位遊走來增強功效。
Weixinhao: NBNK88【適用人群及適用範圍】1、人的身體處於亞健康狀態者;工作壓力大,長期伏案工作者;2、更年期綜合症(荷爾蒙失調症);3、乳汁分泌不全者;4、希望肌膚變年輕以及抗衰老的人士均可使用;5、年齡超過二十五歲,男女均可。
對於美容,越年輕注射,效果越好(讓時間停留,定格青春)。
国家药监局关于发布仿制药参比制剂目录(第三十八批)的通告-国家药品监督管理局通告2021年第18号

国家药监局关于发布仿制药参比制剂目录(第三十八批)的通告正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家药品监督管理局通告2021年第18号国家药监局关于发布仿制药参比制剂目录(第三十八批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第三十八批)。
特此通告。
附件:仿制药参比制剂目录(第三十八批)国家药监局2021年2月20日附件仿制药参比制剂目录(第三十八批)序号药品通用名称英文名称/商品名规格持证商备注1备注238-1噻托溴铵奥达特罗吸入喷雾剂Tiotropium Bromide and Olodaterol Hydrochloride Inhalation Spray/Spiolto(思合华)每瓶60喷,每喷含噻托铵2.5μg(相当于噻托溴铵一水合物3.124μg)和奥达特罗2.5μg(相当于盐酸奥达特罗2.736μg)Boehringer Ingelheim International GmbH国内上市的原研药品原研进口38-2噻托溴铵喷雾剂Tiotropium Bromide Spray每瓶60喷,每喷含噻托铵2.5μg,药液浓度含噻托铵0.2262mg/mlBoehringer Ingelheim International GmbH国内上市的原研药品原研进口38-3硝酸咪康唑阴道软胶囊Miconazole Nitrate Vaginal Soft Capsules/Gyno-Daktarin(达克宁)0.4gJanssen-Cilag N.V.国内上市的原研药品原研进口38-4硝酸咪康唑阴道软胶囊Miconazole Nitrate Vaginal Soft Capsules/Gyno-Daktarin(达克宁)1.2gJanssen-Cilag N.V.国内上市的原研药品原研进口38-5丁丙诺啡纳洛酮舌下片Buprenorphine Hydrochloride and Naloxone Hydrochloride Sublingual Tablets 丁丙诺啡2mg/纳洛酮0.5mg(均以碱基计)Indivior UK Limited国内上市的原研药品原研进口38-6丁丙诺啡纳洛酮舌下片Buprenorphine Hydrochloride and Naloxone Hydrochloride Sublingual Tablets 丁丙诺啡8mg/纳洛酮2mg(均以碱基计)Indivior UK Limited国内上市的原研药品原研进口38-7羧甲基纤维素钠滴眼液Carboxymethylcellulose Sodium Eye Drops0.4ml:2mgAllergan Pharmaceuticals Ireland国内上市的原研药品原研进口38-8复方倍他米松注射液Compound Betamethasone Injection/得宝松1ml:二丙酸倍他米松(以倍他米松计)5mg与倍他米松磷酸钠(以倍他米松计)2mg MSD Merck Sharp & Dohme AG国内上市的原研药品原研进口38-9注射用全氟丁烷微球Perflubutane Microspheres for Injection/Sonazoid(示卓安)每瓶中含微球的体积为16μlGE Healthcare AS国内上市的原研药品原研进口38-10索磷维伏片Sofosbuvir,Velpatasvir and Voxilaprevir tablets/Vosevi(沃士韦)每片含 400mg 索磷布韦、100mg 维帕他韦和 100mg 伏西瑞韦Gilead Sciences Ireland UC国内上市的原研药品原研进口38-11复合维生素片Vitamin Complex Tablets/ Elevit Pronatal(爱乐维)复方制剂Bayer S.A.国内上市的原研药品原研进口38-12盐酸奥洛他定鼻喷雾剂Olopatadine Hydrochloride Nasal Spray/Patanase0.665mg/sprayNovartis Pharmaceuticals Corp未进口原研药品美国橙皮书38-13盐酸环丙沙星滴眼液Ciprofloxacin Ophthalmic Solution/Ciloxan0.30%Novartis Pharmaceuticals Corp未进口原研药品美国橙皮书38-14硫酸麻黄碱注射液Ephedrine Sulfate Injection/Akovaz50mg/mlExela Pharma Sciences LLC未进口原研药品美国橙皮书38-15艾考糊精腹膜透析液Icodextrin Peritoneal Dialysis Solution/Extraneal 含7.5%艾考糊精(2L/袋、2.5L/袋)Baxter Healthcare Corporation未进口原研药品美国橙皮书38-16艾考糊精腹膜透析液Icodextrin Peritoneal Dialysis Solution/Extraneal 含7.5%艾考糊精(1.5L/袋、2L/袋、2.5L/袋)Baxter A/S未进口原研药品欧盟上市38-17氨基酸(15)腹膜透析液Amino Acids (15) Peritoneal Dialysis Solution 2.0LBaxter Healthcare Ltd.未进口原研药品欧盟上市38-18氨基酸(15)腹膜透析液Amino Acids (15) Peritoneal Dialysis Solution 2.5LBaxter Healthcare Ltd.未进口原研药品欧盟上市38-19麦芽酚铁胶囊Ferric Maltol Capsules /Feraccru每片含铁30mgNorgine B.V.未进口原研药品欧盟上市38-20氯甲西泮注射液Lormetazepam Injection/ Sedalam10ml:2mgDr. Franz K?hler Chemie GmbH未进口原研药品欧盟上市38-21硝酸异康唑阴道片Isoconazole Nitrate Vaginal Tablets300mgバイエル薬品株式会社未进口原研药品日本上市38-22盐酸头孢卡品酯片Cefcapene Pivoxil Hydrochloride Tablet/Flomox 100mg塩野義製薬株式会社未进口原研药品日本上市38-23氧氟沙星滴耳液Ofloxacin Ear Drops0.30%アルフレッサファーマ株式会社/第一三共株式会社未进口原研药品日本上市38-24氟骨化三醇片Falecalcitriol Tablets/Fulstan0.15μg大日本住友製薬株式会社未进口原研药品日本上市38-25氟骨化三醇片Falecalcitriol Tablets/Fulstan0.3μg大日本住友製薬株式会社未进口原研药品日本上市38-26注射用盐酸吡柔比星Pirarubicin Hydrochloride for Injection/Pinorubin 10mg日本マイクロバイオファーマ株式会社未进口原研药品日本上市38-27注射用盐酸吡柔比星Pirarubicin Hydrochloride for Injection/Pinorubin 20mg日本マイクロバイオファーマ株式会社未进口原研药品日本上市38-28注射用盐酸吡柔比星Pirarubicin Hydrochloride for Injection/Pinorubin 30mg日本マイクロバイオファーマ株式会社未进口原研药品日本上市38-29注射用盐酸多柔比星Doxorubicin Hydrochloride for Injection /Adriacin 10mgアスペンジャパン株式会社未进口原研药品日本上市38-30美沙拉秦缓释颗粒Mesalazine Sustained-release Granules /Pentasa 1g,按美沙拉秦(C7H7NO3)计Ferring S.A.S未进口原研药品法国上市38-31美沙拉秦缓释颗粒Mesalazine Sustained-release Granules /Pentasa 2g,按美沙拉秦(C7H7NO3)计Ferring S.A.S未进口原研药品法国上市38-32富马酸伏诺拉生片Vonoprazan Fumarate Tablets /Vocinti(沃克)10mgTakeda Pharmaceutical Company Limited国内上市的原研药品原研进口38-33富马酸伏诺拉生片Vonoprazan Fumarate Tablets /Vocinti(沃克)20mgTakeda Pharmaceutical Company Limited国内上市的原研药品原研进口38-34碳酸镧颗粒Lanthanum Carbonate Oral Powder/ Fosrenol 1000mgShire Development LLC/Takeda Pharmmaceuticals USA INC 未进口原研药品美国橙皮书38-35尼莫地平口服溶液Nimodipine Oral Solution / Nymalize6mg/mlArbor Pharmaceuticals, LLC未进口原研药品美国橙皮书38-36氟尿嘧啶注射液Fluorouracil Injection/ Fluorouracil500mg/10mlAccord Healthcare, Inc国际公认的同种药品美国橙皮书38-37小儿复方氨基酸注射液(19AA-Ⅰ)10% Amino Acid Injection /Trophamine 10%10%(500ml)B Braun Medical Inc未进口原研药品美国橙皮书38-38氯化钾缓释片Potassium Chloride Extended Release Tablets/K-Tab20mEq(相当于1.5g氯化钾)Abbvie Inc未进口原研药品美国橙皮书38-39盐酸吡格列酮片Pioglitazone Hydrochloride Tablets/Actos45mgTakeda Pharmaceuticals USA Inc未进口原研药品美国橙皮书38-40盐酸丁螺环酮片Buspirone Hydrochloride Tablet15mgTeva Pharmaceuticals USA Inc.国际公认的同种药品美国橙皮书38-41盐酸罗匹尼罗缓释片Ropinirole Hydrochloride Sustained-release Tablets 8mgGLAXO SMITHKLINE/SmithKline Beecham Limited未进口原研药品欧盟上市38-42亚叶酸钙注射液Calcium Folinate Injection5ml:50mgHospira UK Ltd未进口原研药品欧盟上市38-43苯磺酸氨氯地平片Amlodipine Besylate Tablets10mg(以C20H25CLN2O5计)Pfizer未进口原研药品欧盟上市38-44甲氨蝶呤注射液Methotrexate Injection2ml:50mgPfizer Pharma Pfe GmbH未进口原研药品欧盟上市38-45多西他赛注射液Docetaxel Injection/Taxotere20mg/1mlSanofi Mature IP未进口原研药品欧盟上市38-46盐酸罗哌卡因注射液Ropivacaine Hydrochloride Injection/Naropin/Naropeine/Naropina20mg/10mlAspen Pharma Trading Limited未进口原研药品欧盟上市38-47盐酸坦索罗辛口崩缓释片Tamsulosin Hydrochloride Oral Dispersible Sustained Release Tablets0.2mgAstellas Pharma Inc/アステラス製薬株式会社未进口原研药品日本上市38-48钆特醇注射液Gadoteridol Injection/ ProHance10ml:2.793gブラッコスイス株式会社未进口原研药品日本上市38-49钆特醇注射液Gadoteridol Injection/ ProHance15ml:4.1895gブラッコスイス株式会社未进口原研药品日本上市38-50注射用头孢他啶Ceftazidime For Injection/Modacin1.0gグラクソ?スミスクライン株式会社未进口原研药品日本上市38-51注射用氨曲南Aztreonam For Injection1.0g日本エーザイ株式会社未进口原研药品日本上市5-19卡托普利片Captopril Tablets/Captopril12.5mgDaiichi Sankyo Espha Co., Ltd./アルフレッサファーマ株式会社日本橙皮书增加持证商アルフレッサファーマ株式会社5-20卡托普利片Captopril Tablets/Captopril25mgDaiichi Sankyo Espha Co., Ltd./アルフレッサファーマ株式会社日本橙皮书增加持证商アルフレッサファーマ株式会社21-102注射用环磷酰胺Cyclophosphamide for Injection/Endoxan(安道生)1gBaxter Oncology GmbH/Baxter Healthcare Ltd国内上市的原研药品增加持证商Baxter Healthcare Ltd23-48阿普司特片Apremilast Tablet /Otezla10mgCelgene Corp/Amgen Inc未进口原研药品增加持证商Amgen Inc23-49阿普司特片Apremilast Tablet /Otezla20mgCelgene Corp/Amgen Inc未进口原研药品增加持证商Amgen Inc27-412阿普司特片Apremilast Tablet /Otezla30mgCelgene Corp/Amgen Inc未进口原研药品增加持证商Amgen Inc27-372苯磺酸氨氯地平片Amlodipine Besylate Tablets5mg(以C20H25CLN2O5计)Pfizer Luxembourg Sarl/Pfizer Limited/Pfizer未进口原研药品增加持证商Pfizer Luxembourg Sarl/Pfizer;不限定商品名8-175盐酸齐拉西酮胶囊Ziprasidone Hydrochloride Capsules/Zeldox20mg(按齐拉西酮计)Pfizer Australia Pty Limited / Pfizer Pharma PFE GmbH原研进口持证商变更,增加变更后持证商Pfizer Pharma PFE GmbH8-225盐酸齐拉西酮胶囊Ziprasidone Hydrochloride Capsules/Zeldox40mg(按齐拉西酮计)Pfizer Australia Pty Limited / Pfizer Pharma PFE GmbH原研进口持证商变更,增加变更后持证商Pfizer Pharma PFE GmbH21-111沙美特罗替卡松吸入粉雾剂Salmeterol Xinafoate and Fluticasone Propionate Powder for Inhalation/Seretide(舒利迭)50ug/100ug/泡Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入粉雾剂”21-112沙美特罗替卡松吸入粉雾剂Salmeterol Xinafoate and Fluticasone Propionate Powder for Inhalation/Seretide(舒利迭)50ug/250ug/泡Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入粉雾剂”21-113沙美特罗替卡松吸入粉雾剂Salmeterol Xinafoate and Fluticasone Propionate Powder for Inhalation/Seretide(舒利迭)50ug/500ug/泡Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入粉雾剂”21-116沙美特罗替卡松吸入气雾剂Salmeterol Xinafoate and Fluticasone Propionate Aerosol/Seretide(舒利迭)25ug/125ug/揿Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入气雾剂”22-122氟维司群注射液Fulvestrant Injection/Faslodex(芙仕得5ml:0.25gAstraZeneca UK Limited/AstraZeneca AB国内上市的原研药品持证商发生变更,增加变更后持证商AstraZeneca AB23-217中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection625mlB. Braun melsungen ag国际公认的同种药品英文名称修订为“Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection”23-218中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection1250mlB. Braun melsungen ag国际公认的同种药品英文名称修订为“Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection”27-326琥珀酸索利那新片Solifenacin Succinate Tablets/Vesicare5mgAstellas Pharma US Inc未进口原研药品更新持证商为Astellas Pharma US Inc27-327琥珀酸索利那新片Solifenacin Succinate Tablets/Vesicare10mgAstellas Pharma US Inc未进口原研药品更新持证商为Astellas Pharma US Inc备注1.未在国内上市品种,需参照原总局2015年第230号公告等的相关要求开展研究,通用名、剂型等经药典委核准后为准。
JP日本药典(药局方)标准品汇总信息-2016-update

日本药典(药局方)标准品汇总信息
序号
名称(中文)
Name(English)
CAS NO.
1
阿奇霉素标准品及杂质对照品
Azithromycin
117772-70-0
2
氨曲南标准品及杂质对照品
Aztreonam
78110-38-0
92636-39-0
61
盐酸头孢甲肟标准品及杂质对照品
CefmenoximeHydrochloride
75738-58-8
62
头孢沙定标准品及杂质对照品
Cefroxadine
51762-05-1
63
头孢呋辛酯标准品及杂质对照品
CefuroximeAxetil
64544-07-6
64
盐酸佐柔比星盐酸柔红霉素
33103-22-9,33137-73-4
14
盐酸土霉素标准品及杂质对照品
OxytetracyclineHydrochloride
2058-46-0
15
硫酸卡那霉素标准品及杂质对照品
KanamycinMonosulfate
25389-94-0
16
卡鲁莫南钠标准品及杂质对照品
CarumonamSodium
10
亚胺培南标准品及杂质对照品
Imipenem
64221-86-9
11
盐酸表柔比星盐酸表阿霉素标准品及杂质对照品
EpirubicinHydrochloride
56390-09-1
12
红霉素标准品及杂质对照品
Erythromycin
114-07-8
日本上市公司-NissuiPharmaceutical(45500)2016-2020年财务报表数据-原点参数

目录
序号 1 2 3 4 5 6 7 8 9 10 11 12
公司基本信息 资产负债表-BS(本币) 资产负债表-BS(人民币) 资产负债表-BS(美元) 利润表-IS(本币) 利润表-IS(人民币) 利润表-IS(美元) 现金流量表-CF(本币) 现金流量表-CF(人民币) 现金流量表-CF(美元) 报表货币换算汇率表
报表期间: 2016-2020
内容
说明
— 原始财报,可登陆原点参数"全球上市企业数据库"查看。
13
— 文件格式为EXCEL,按表分开存放,详见附表。 — 所有科目为中文
— 所有货币换算为报告期当期汇率
— 本币为公司财报原始的货币
公司名称 公司英文名称 公司简称 股票代码 交易所 成立时间 上市时间 注册地址 员工数
公司基本信息表
日水製薬株式会社 Nissui Pharmaceutical Co., Ltd. NissuiPharmaceutical 45500 东京证券交易所 1935-04-06 1990-12-12 台東区上野三丁目24番6号 316
公司简介
资产负债表、利
Contents-日本药典目录英文版

CONTENTSPreface (i)The Japanese Pharmacopoeia,Sixteenth Edition (1)General Notices (1)General Rules for Crude Drugs (5)General Rules for Preparations (7)General Tests,Processes and Apparatus (25)1.Chemical Methods1.01Alcohol Number Determination (25)1.02Ammonium Limit Test (27)1.03Chloride Limit Test (28)1.04Flame Coloration Test (28)1.05Mineral Oil Test (28)1.06Oxygen Flask Combustion Method (28)1.07Heavy Metals Limit Test (29)1.08Nitrogen Determination(Semimicro-Kjeldahl Method) (30)1.09Qualitative Tests (31)1.10Iron Limit Test (37)1.11Arsenic Limit Test (37)1.12Methanol Test (39)1.13Fats and Fatty Oils Test (39)1.14Sulfate Limit Test (41)1.15Readily Carbonizable Substances Test (41)2.Physical MethodsChromatography2.01Liquid Chromatography (42)2.02Gas Chromatography (45)2.03Thin-layer Chromatography (47)2.04Amino Acid Analysis of Proteins (47)Spectroscopic Methods2.21Nuclear Magnetic ResonanceSpectroscopy (48)2.22Fluorometry (50)2.23Atomic AbsorptionSpectrophotometry (51)2.24Ultraviolet-visible Spectrophotometry (52)2.25Infrared Spectrophotometry (53)Other Physical Methods2.41Loss on Drying Test (55)2.42Congealing Point Determination (55)2.43Loss on Ignition Test (56)2.44Residue on Ignition Test (56)2.45Refractive Index Determination (56)2.46Residual Solvents Test (57)2.47Osmolarity Determination (57)2.48Water Determination(Karl FischerMethod) (58)2.49Optical Rotation Determination (61)2.50Endpoint Detection Methods inTitrimetry (62)2.51Conductivity Measurement (63)2.52Thermal Analysis (65)2.53Viscosity Determination (67)2.54pH Determination (69)2.55Vitamin A Assay (71)2.56Determination of Specific Gravity andDensity (72)2.57Boiling Point and Distilling RangeTest (74)2.58X-Ray Powder Diffraction Method (75)2.59Test for Total Organic Carbon (79)2.60Melting Point Determination (80)3.Powder Property Determinations3.01Determination of Bulk and TappedDensities (82)3.02Specific Surface Area by GasAdsorption (84)3.03Powder Particle DensityDetermination (86)3.04Particle Size Determination (87)4.Biological Tests/Biochemical Tests/Microbial Tests4.01Bacterial Endotoxins Test (92)4.02Microbial Assay for Antibiotics (96)4.03Digestion Test (100)4.04Pyrogen Test (103)4.05Microbial Limit Test (103)4.06Sterility Test (114)5.Tests for Crude Drugs5.01Crude Drugs Test (117)5.02Microbial Limit Test for Crude Drugs (120)6.Tests for Preparations6.01Test for Metal Particles in OphthalmicOintments (126)6.02Uniformity of Dosage Units (127)6.03Particle Size Distribution Test forPreparations (129)6.04Test for Acid-neutralizing Capacity ofGastrointestinal Medicines (129)6.05Test for Extractable Volume ofParenteral Preparations (130)6.06Foreign Insoluble Matter Test forInjections (131)6.07Insoluble Particulate Matter Test forInjections (131)6.08Insoluble Particulate Matter Test forOphthalmic Solutions (134)6.09Disintegration Test (135)6.10Dissolution Test (137)JP XVI Contents6.11Foreign Insoluble Matter Test forOphthalmic Solutions (141)7.Tests for Containers and Packing Materials7.01Test for Glass Containers for Injections..1417.02Test Methods for Plastic Containers (142)7.03Test for Rubber Closure for AqueousInfusions (148)8.Other Methods8.01Sterilization and Aseptic Manipulation (149)9.Reference Standards;Standard Solutions;Reagents,Test Solutions;MeasuringInstruments,Appliances,etc.Reference Standards9.01Reference Standards (150)Standard Solutions9.21Standard Solutions for VolumetricAnalysis (153)9.22Standard Solutions (164)9.23Matching Fluids for Color (166)Reagents,Test Solutions,etc.9.41Reagents,Test Solutions (167)9.42Solid Supports/Column Packings forChromatography (306)9.43Filter Papers,Filters for filtration,Test Papers,Crucibles,etc (308)9.44Standard Particles,etc (308)Measuring Instruments and Appliances,Thermometers,etc.9.61Optical Filters for Wavelength andTransmission Rate Calibration (309)9.62Measuring Instruments,Appliances (309)9.63Thermometers (310)Official Monographs (313)Crude Drugs (1593)Infrared Reference Spectra.....................1775–1961 Ultraviolet-visible Reference Spectra.........1965–2131General InformationG1Physics and ChemistryGuideline for Residual Solvents and Models for the Residual Solvents Test (2135)Inductively Coupled Plasma Atomic Emission Spectrometry (2136)Near Infrared Spectrometry (2141)pH Test for Gastrointestinal Medicine (2144)System Suitability (2145)Test for Trace Amounts of Aluminum inTrans Parenteral Nutrition(TPN)Solutions (2146)Validation of Analytical Procedures (2148)G2Solid-state PropertiesLaser Diffraction Measurement ofParticle Size (2151)Powder Fineness (2154)Powder Flow (2155)Solid and Particle Densities (2158)G3Biotechnological/Biological Products Amino Acid Analysis (2159)Basic Requirements for Viral Safety ofBiotechnological/Biological Productslisted in Japanese Pharmacopoeia (2166)Capillary Electrophoresis (2179)Isoelectric Focusing (2184)Mass Spectrometry of Peptides andProteins (2186)Mycoplasma Testing for Cell Substrates used for the Production of Biotechnological/Biological Products (2188)Peptide Mapping (2191)Qualification of Animals as Origin ofAnimal-derived Medicinal Productsprovided in the General Notices ofJapanese Pharmacopoeia and OtherStandards (2194)SDS-Polyacrylamide Gel Electrophoresis (2196)Total Protein Assay (2201)G4MicroorganismsDecision of Limit for BacterialEndotoxins (2205)Disinfection and Sterilization Methods (2205)Media Fill Test(Process Simulation) (2206)Microbial Attributes of Non-sterilePharmaceutical Products (2209)Microbiological Evaluation of Processing Areas for Sterile PharmaceuticalProducts (2211)Preservatives-Effectiveness Tests (2215)Rapid Counting of Microbes usingFluorescent Staining (2217)Rapid Identification of MicroorganismsBased on Molecular Biological Method (2220)Sterility Assurance for Terminally Sterilized Pharmaceutical Products (2221)Terminal Sterilization and SterilizationIndicators (2225)G5Crude DrugsAristolochic Acid (2227)Purity Tests on Crude Drugs Using Genetic Information (2228)On the Scientific Names of Crude DrugsListed in the JP (2231)G6Drug FormulationTablet Friability Test (2244)G7Containers and PackagePlastic Containers for PharmaceuticalJP XVI ContentsProducts (2244)G8WaterQuality Control of Water for PharmaceuticalUse (2246)Water to be used in the Tests of Drugs (2253)G9OthersInternational Harmonization Implementedin the Japanese Pharmacopoeia SixteenthEdition (2253)AppendixAtomic Weight Table(2010) (2287)Standard Atomic Weights2010 (2288)Index (2291)Index in Latin name (2307)Index in Japanese (2309)PREFACEThe15th Edition of the Japanese Pharmacopoeia (JP)was promulgated by Ministerial Notification No. 285of the Ministry of Health,Labour and Welfare (MHLW)on March31,2006.In July2006,the Committee on JP established the basic principles for the preparation of the JP16th Edi-tion,setting out the roles and characteristics of the JP, the definite measures for the revision,and the date of the revision.At the Committee,the five basic principles of JP, which we refer to as the``five pillars'',were estab-lished as follows:1)Including all drugs which are im-portant from the viewpoint of health care and medical treatment;2)Making qualitative improvement by in-troducing the latest science and technology;3)Pro-moting internationalization;4)Making prompt partial revision as necessary and facilitating smooth adminis-trative operation;and5)Ensuring transparency regarding the revision,and disseminating the JP to the public.It was agreed that the Committee on JP should make efforts,on the basis of these principles,to en-sure that the JP is used more effectively in the fields of health care and medical treatment by taking appropri-ate measurements,including getting the understanding and cooperation of other parties concerned.It was agreed that the JP should provide an official standard,being required to assure the quality of medi-cines in Japan in response to the progress of science and technology and medical demands at the time.It should define the standards for specifications,as well as the methods of testing to assure overall quality of all drugs in principle,and it should have a role in clarifying the criteria for quality assurance of drugs that are recognized to be essential for public health and medical treatment.The JP has been prepared with the aid of the knowledge and experience of many professionals in the pharmaceutical field.Therefore,the JP should have the characteristics of an official standard,which might be widely used by all parties concerned.It should provide information and understanding about the quality of drugs to the public,and it should be conducive to smooth and effective regulatory control of the quality of drugs,as well as promoting and maintaining international consistency and harmoniza-tion of technical requirements.It was also agreed that JP articles should cover drugs,which are important from the viewpoint of health care and medical treatment,clinical results and frequency of use,as soon as possible after they reach the market.The target date for the publication of JP16th Edi-tion(the Japanese edition)was set as April2011.JP Expert Committees are organized with the fol-lowing panels:Panel on the Principles of Revisions; Sub-committee on the Principles of Revisions;Panel on Medicinal Chemicals;Panel on Antibiotics;Panel on Biologicals;Panel on Crude Drugs;Panel on Phar-maceutical Excipients;Panel on Physico-Chemical Methods;Panel on Preparations;Panel on Physical Methods;Panel on Biological Tests;Panel on Nomen-clature;Panel on International Harmonization;Panel on Pharmaceutical Water;and Panel on Reference Standards.Furthermore,working groups are estab-lished under the Panel on Physico-Chemical Methods, Panel on Preparations and Panel on Biological Tests to expedite discussion on revision drafts.In the Committee on JP,Takao Hayakawa took the role of chairman from July2003to December2010, and Mitsuru Hashida from January2011to March 2011.In addition to the regular revision every five years in line with the basic principles for the preparation of the JP it was agreed that partial revision should be done as necessary to take account of recent progress of science and in the interests of international harmonization.In accordance with the above principles,the panels initiated deliberations on selection of articles,and on revisions for General Notices,General Rules for Crude Drugs,General Rules for Preparations,General Tests, Monographs and so on.Draft revisions covering subjects in General Notices, General Rules for Crude Drugs,General Rules for Preparations,General Tests and Monographs,for which discussions were finished between September 2005and March2007,were prepared for a supplement to the JP15.They were examined by the Committee on JP in April2007,followed by the Pharmaceutical Affairs and Food Sanitation Council(PAFSC)in June 2007,and then submitted to the Minister of Health, Labour and Welfare.The supplement was named ``Supplement I to the JP15th Edition'',promulgated on September28,2007by Ministerial Notification No. 316of MHLW,and became effective on October1,i。
日本一致性评价常用溶出介质的配制

disodium hydrogenphosphate-citric acid buffer solution, pH 4.0
pH5.5
薄めたMcIlvaineの緩衝液
dilute McIlvaine buffer solution
0.05mol/Lリン酸一水素ナトリウムと0.025mol/Lクエン酸を用いてpHを調整
disodium hydrogenphosphate-citric acid buffer solution, pH 2.5
pH3.0
薄めたMcIlvaineの緩衝液
dilute McIlvaine buffer solution
溶出液一覧表(TableDissolution medium)
溶出液
dissolution
medium
説明
explanation
詳細
details
pH1.2
基本的な試験液
standard dissolution medium
日本薬局方崩壊試験の第1液
1st fluid for dissolution test
pH8.0*
リン酸水素二ナトリウム・クエン酸
緩衝液
disodium hydrogenphosphate-citric acid buffer solution
0.05mol/Lリン酸水素二ナトリウム試液1000mlに、クエン酸一水和物5.25g
を水に溶かして1000mLとした液を加え、pH8.0に調整
を加えてpHを6.8に調整
pH6.8*3
リン酸水素二ナトリウム・クエン酸
日本药典:现状和将来(中文)

主任 药物药典及标准部 标准和指导方针开发办公室 药品和医疗器械代理(PMDA)
// 2013 ChP Scientific Symposium (November 13, 2013) //
Pharmaceuticals and Medical Devices Agency (PMDA)
⇒ 促进草案的完整性 ⇒ 便于日本药典委员会审议
⇒ 保持和日本药典的一致性
// 2013 ChP Scientific Symposium (November 13, 2013) //
15
Pharmaceuticals and Medical Devices Agency (PMDA)
建立日本药典的安全进程
公众咨询
Pharmaceuticals and Medical Devices Agency (PMDA)
16
日本药典MHLW/PMDA 委员会
MHLW 日本药典委员会, PAFSC
人员
- 来自于国内研究所,大学或其它机构的11位专家。
频率
- 两年一次
PMDA 日本专家委员会
人员
- 来自于国内研究所,大学或其它机构的160位专家。
- 药品制造商协会的代表(东京、大阪)和其他感兴趣的各方
频率
- 每一个专家委员会 每两月一次会面。 原始质量控制实验室: 无
17
Pharmaceuticals and Medical Devices Agency (PMDA)
日本药典专家委员会组织
Update; October 1, 2013
Com. on 化学 (1) and (2) Com. on 抗生素 Com. on 生物 Com. on 原料药(B) - Com. on 原料药 (A) Com. on 辅料 - WG (Alchoholimetric Tables)
药用辅料翻译汇编

课程论文课程题目:制剂技术与工程学院:药学院专业:制药工程与技术姓名:刘晶晶学号:030131092聚丙烯酸树脂1 通用名英国药典:甲基丙烯酸铵共聚物(A型)甲基丙烯酸铵共聚物(B型)基本丁基甲基丙烯酸酯共聚物甲基丙烯酸 - 丙烯酸乙酯共聚物(1:1)分散30%甲基丙烯酸 - 甲基丙烯酸甲酯共聚物(1:1)甲基丙烯酸 - 甲基丙烯酸甲酯共聚物(1:2)聚丙烯酸酯分散体(30%)欧洲药典:甲基丙烯酸铵共聚物(A型)甲基丙烯酸铵共聚物(B型)基本丁基甲基丙烯酸酯共聚物甲基丙烯酸 - 丙烯酸乙酯共聚物(1:1)分散30%甲基丙烯酸 - 甲基丙烯酸甲酯共聚物(1:1)甲基丙烯酸 - 甲基丙烯酸甲酯共聚物(1:2)聚丙烯酸酯分散体30%美国药典:氨基甲基丙烯酸酯共聚物甲基丙烯酸铵共聚物甲基丙烯酸铵共聚物分散体丙烯酸乙酯和甲基丙烯酸甲酯共聚物分散甲基丙烯酸共聚物甲基丙烯酸共聚物分散体注意:在美国药典20中收载了3个聚丙烯酸树脂品目;见第9项。
在这些品目中介绍几种型号的剧丙烯酸树脂。
在欧洲药典2002中收载了4个聚丙烯酸树脂的专门品目。
2 别名Acryl-EZE; acidi methacrylici et ethylis acrylatis polymerisatum;acidi methacrylici et methylis methacrylatis polymerisatum; ammo-nio methacrylatis copolymerum; copolymerum methacrylatis buty-lati basicum; Eastacryl ; Eudragit ; Kollicoat MAE ; polyacrylatisdispersio 30 per centum; polymeric methacrylates. See also Table I.3 化学名和CAS注册号表Ⅰ聚丙烯酸树脂的化学名和CAS登记号化学名商品名公司名CAS登记号丙烯酸丁酯/甲基丙烯酸二甲胺基乙酯/甲基丙烯酸甲酯聚合物(1:2:1)丙烯酸乙酯/甲基丙烯酸甲酯聚合物(2:1)甲基丙烯酸/甲基丙烯酸甲酯聚合物(1:1)甲基丙烯酸/丙烯酸乙酯聚合物(1:1)甲基丙烯酸/甲基丙烯酸甲酯聚合物(1:2)Eudragit E 100Eudragit E 12.5Eudragit E POEudragit NE 30DEudragit NE 40Eudragit NM 30D Eudragit L 100Eudragit L 12.5Eudragit L 12.5 PAcr yl-EZEAcr yl-EZE 93AAcr yl-EZE MP30 D-55EvonikindustriesEvonikindustriesEvonikindustriesEvonikindustriesEvonikindustriesEvonikindustriesEvonikindustries[24938-16-7][9010-88-2][25212-88-8][25086-15-1[26936-24-3][33434-24-1]丙烯酸乙酯/甲基丙烯酸甲酯/甲基丙烯酸氯化三甲胺基乙酯聚合物(1:2:0.2)丙烯酸乙酯/甲基丙烯酸甲酯/甲基丙烯酸氯化三甲胺基乙酯聚合物(1:2:0.1)Eudragit L100-55 Eastacr yl30DKollicoatMAE30 DPKollicoatMAE100 PEudragit S 100Eudragit S 12.5Eudragit S 12.5 PEudragit RL 100EEudragit RL POEudragit RL 30 DEudragit RL1Eudragit RL100 EEudragit RL POEudragit RL 30 DEudragit RL12.52.5EvonikindustriesEvonikindustriesColorconColorconEvonikindustriesEvonikindustriesEastmanChemicalKollicoatMAE30 DPBASF FineChemicalsKollicoatMAE100 PBASF FineChemicaEvonikindustriesEvonikindustriesEvonikindustriesEvonikindustriesEvonikindustriesEvonikindustries4 分子式与分子量欧洲药典2002中载:甲基丙烯酸-丙烯酸乙酯共聚物(1:1)是甲基丙烯酸和丙烯酸乙酯的共聚物。
日本药典-羧甲基纤维素

Carmellose / O‹cial Monographs
JP XV
about 3 m in length, packed with silica gel for gas chromatography (300 to 500 mm in particle diameter). Column temperature: A constant temperature of about 509 C. Carrier gas: Hydrogen or helium. Flow rate: Adjust the ‰ow rate so that the retention time of nitrogen is about 2 minutes. Selection of column: Collect 0.5 mL of nitrogen in a gas mixer, add Carbon Dioxide to make 100 mL, mix well, and proceed with 1.0 mL of the mixture under the above operating conditions. Use a column giving well-resolved peaks of nitrogen and Carbon Dioxide in this order. Detection sensitivity: Adjust the detection sensitivity so that the peak height of nitrogen obtained from 1.0 mL of the standard gas mixture composes about 50z of the full scale. Assay For the withdrawing of Carbon Dioxide, proceed as directed in the Purity. Place 125 mL of a solution of potassium hydroxide (1 in 2) in a gas pipet of suitable capacity. Measure exactly about 100 mL of Carbon Dioxide in a 100-mL gas buret ˆlled with water. Force the entire volume of gas into the gas pipet, and shake for 5 minutes. Draw some of the unabsorbed gas into the gas buret, measure the volume, force the residual back upon the surface of the liquid in the gas pipet, and repeat this procedure until a constant volume of the residual reading is obtained. Determine the volume V (mL) of the residual gas, and correct its volume V to 209 C and under a pressure of 101.3 kPa. Volume (mL) of CO2 = calculated volume (mL) of the sample - calculated volume V (mL) Containers and storage Containers—Pressure resistant metal cylinders. Storage—Not exceeding 409 C.
日本糖尿病新药ザファテック——琥珀酸曲格列汀(TrelagliptinSuccinate)[JAN]
![日本糖尿病新药ザファテック——琥珀酸曲格列汀(TrelagliptinSuccinate)[JAN]](https://img.taocdn.com/s3/m/71821f1f79563c1ec5da714a.png)
持续性选择的DPP-4抑制剂—2型糖尿病治疗剂—中文名:琥珀酸曲格列汀(TrelagliptinSuccinate)[JAN]储存方法:室温保存使用期限:请在外包装盒上标明的使用期限内使用。
(在使用期限内一旦开封请尽快使用。
)【禁忌】(以下患者禁用)(1)严重酮症、糖尿病昏迷或昏迷前期、1 型糖尿病患者[由于输液、胰岛素快速校正高血糖是必要的,故不适合使用本品。
](2)严重感染、手术前后、严重创伤患者[由于需要注射胰岛素控制血糖,故不适合使用本品。
](3)严重肾功能障碍患者或需透析的晚期肾衰竭患者[由于本品主要经肾脏排泄,排泄延迟可能导致本品的血药浓度上升。
](参见【药代动力学】项)(4)对本品的成份有过敏史的患者【组成·性状】【功能主治】 2 型糖尿病【用法·用量】通常成人每周一次口服曲格列汀 100mg。
(2)以下几点患者指导。
1)本品为每周服用 1 次药物,应在每周的同一天服用。
2)本品忘记服用时,在注意到这点时按规定剂量服用,之后按预先每周定好时间服用。
【使用上的注意】1. 慎重给药(以下患者慎用)下列患者或状态:(1)中度肾功能损害患者(见<用法用量相关使用上的注意>、参见【药代动力学】项)(2)正在使用磺脲类药物或胰岛素制剂的患者[与其他 DPP-4 抑制剂并用时有严重低血糖的报道](见「重要注意事项」、「相互作用」、「严重不良反应」)(3)脑垂体功能不全或肾上腺功能不全[有引发低血糖的风险](4)营养不良、饥饿、饮食不规律、进食量不足或虚弱状态[有引发低血糖的风险](5)激烈肌肉运动[有引发低血糖的风险](6)饮酒过量者[有引发低血糖的风险]2. 重要的注意事项(1)应注意,由于本品与其他糖尿病药物并用时有引发低血糖的风险,因此在与这些药物并用时需对患者详细说明低血糖症状及其处理方法。
尤其是与磺脲类药物或胰岛素制剂并用时,有低血糖风险增加的可能。
为了降低磺脲类药物或胰岛素制剂的低血糖风险,在合并使用这些药物时考虑减少磺脲类药物或胰岛素制剂的用量。
复方甘草酸苷片-日本

【用法用量】
成人通常1次2-3片,小儿1次1片,1日3次,饭后口服。可依年龄、症状适当增减。
【不良反应】
本制剂在治疗慢性肝病时,在双盲法试验107例中,7例(占6.5%)出现副作用。主要症状有血钾值降低2例(占1.9%),血压上升2例(占1.9%),腹痛2例(占1.9%)等。重要副作用假性醛固酮症(Pseudoaldosteronism)(发生频率不明):可以出现低血钾症、血压上升、钠及体液潴留、浮肿、尿量减少、体重增加等假性醛固酮增多症状,因此在用药过程中,要充分注意观察(血清钾值等),发现异常情况,应停止给药。另外,可出现乏力感、肌力低下、肌肉痛、四肢痉挛、麻痹等横纹肌溶解的症状,在发现CK (CPK)升高,血、尿中肌红蛋白升高时应停药并给与适当的处置。其它副作用还可能出现以下症状(见表)。
【贮藏】
室温保存(1-30℃)。
【包装】
铝塑泡罩包装。21片/板×1板/盒,10片/板×10板/盒。
【有效期】
60个月。
【执行标准】
进口药品注册标准JX20070059
【批准文号】
进口药品大包装注册证号:BH20080182分包装药品批准文号:国药准字J20080080
【生产企业】
日本米诺发源制药株式会社
【成份】
本品为复方制剂,其组份(每片)为:甘草酸苷(Glycyrrhizin) 25mg甘草酸单铵盐(Monoammonium Glycyrrhizinate) 35mg甘氨酸(Aminoacetic Acid) 25mg蛋氨酸(Methionine) 25mg
【性状】
白色糖衣片。
【适应症】
慢性肝病,改善肝功能异常。湿疹、皮肤炎、斑秃。
药代动力学人体内药代动力学血中浓度健康成人口服本品4片含甘草酸苷100mg时虽然血中甘草酸苷浓度未获得准确的误差范围但有资料表明甘草酸苷水解产物甘草次酸在给药后血中浓度出现两次高峰第一次在用药后14小时出现第二次在1024小时出现
尼索地平 日本药局方标准

【尼索地平】
日文名:ニソルジピン 英文名:Nisoldipine
结构式:
解离常数:未测定
在各溶出介质中的溶解度(37℃):
在各溶出介质中的稳定性: 水:未测定。
在各pH 值溶出介质中:在含0.05%吐温-80的pH1.2溶出介质中、6小时降解10%。
光:对400nm 附近的短波长光、不稳定。
《四条标准溶出曲线》
溶出度试验条件:桨板法/50转、溶出介质中添加0.05%吐温-80。
< 5mg 规格 片剂 >
溶出度试验条件:桨板法/50转、溶出介质中添加0.1%吐温-80。
< 10mg规格片剂>
《质量标准》
避光操作取本品,照溶出度测定法(桨板法),5mg规格以0.05%吐温-80溶液900ml 为溶剂,10mg规格以0.1%吐温-80溶液900ml为溶剂,转速为每分钟50转,依法操作,经45分钟时,取溶液适量滤过,弃去至少10ml初滤液,精密量取续滤液适量,加溶出介质稀释制成每1ml中含5.6μg的溶液,作为供试品溶液。
另精密称取预经105℃干燥2小时的尼索地平对照品0.028g,置200ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密量取4ml,置100ml量瓶中,加甲醇稀释至刻度,摇匀,作为对照品溶液。
精密量取上述两种溶液各20μl,注入液相色谱仪,记录色谱图;按外标法以峰面积计算每片的溶出量,限度均为标示量的75%,应符合规定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂,以水-甲醇-四氢呋喃(9:9:2)为流动相,检测波长为237nm,设定柱温为40℃,调整流速使尼索地平峰保留时间约为7分钟,理论板数按尼索地平峰计算应不低于4000,拖尾因子应不大于1.5。
日本田边三菱制药简介

日本三菱化学株式会社目录1. 企业简介: (2)1.1 发展历程: (2)1.2 企业简介: (2)1.3主要事业领域: (2)1.3.1医药品事业: (2)1.3.2其它事业: (3)1.4 中国进口的产品: (3)1.4.1 三菱制药株式会社产品批文: (3)1.4.2 田边制药 (4)2. 位于中国的分支企业: (5)2.1 三菱制药(广州)有限公司 (5)2.1.1 简介 (5)2.1.2 公司历程 (5)2.1.3 产品批准文号 (5)2.2 天津田边制药有限公司 (6)2.2.1 简介 (6)2.2.2 产品批准文号 (7)2.3 三菱制药研发(北京)有限公司 (7)3. 创新官:松田清Kiyoshi Matsuda (8)4. 三菱的危机: (8)日本三菱化学株式会社1. 企业简介:1.1 发展历程:1950 成立日本化成工业株式会社(后来更名为三菱化成株式会社)2001 三菱制药株式会社成立2005 三菱化学株式会社与三菱制药株式会社共同成立三菱化学控股株式会社2007 田边制药株式会社与三菱制药公司合并成立日本田边三菱制药公司1.2 企业简介:日本田边三菱制药公司是日本第六大制药公司,于2007年10月1日由田边制药株式会社与三菱制药公司合并成立。
合并前的两家制药公司在国际制药行业均有一定影响力,业务遍布全球130多个国家,强强联合主要旨在适应全球高龄化社会的到来和生命科学革新的需要,增强各自在研发和生产上的实力。
是世界500强企业三菱化学控股集团下的控股子公司。
注册资金500亿日元。
1.3主要事业领域:1.3.1医药品事业:主要为医疗用药品的生产和销售1.3.1.1 主要的处方药:a. 心血管系统药物:Anplag(抗血栓类药)、T anatril(高血压治疗药)、Herbesser(心绞痛・高血压治疗药)、Sermion(脑循环・代谢改善药)、Maintate(高血压・心绞痛・心律失常治疗药)、Liple(慢性动脉闭塞症・循环障碍治疗药)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
内容
说明
— 原始财报,可登陆原点参数"全球上市企业数据库"查看。
13
— 文件格式为EXCEL,按表分开存放,详见附表。 — 所有科目为中文
— 所有货币换算为报告期当期汇率
— 本币为公司财报原始的货币
公司名称 公司英文名称 公司简称 股票代码 交易所 成立时间 上市时间 注册地址 员工数
日本-NissuiPharmaceutical(45500)2016-2019年二季度财务报表数据-原点参数
目录
序号 1 2 3 4 5 6 7 8 9 10 11 12
公司基本信息 资产负债表-BS(本币) 资产负债表-BS(人民币) 资产负债表-BS(美元) 利润表-IS(本币) 利润表-IS(人民币) 利润表-IS(美元) 现金流量表-CF(本币) 现金流量表-CF(人民币) 现金流量表-CF(美元) 报表货币换算汇率表
公司基本信息表
日水製薬株式会社 Nissui Pharmaceutical Co., Ltd. NissuiPharmaceutical 45500 东京证券交易所 1935-04-06 1990-12-12 台東区上野三丁目24番6号 316
公司简介
资产负债表、利润
