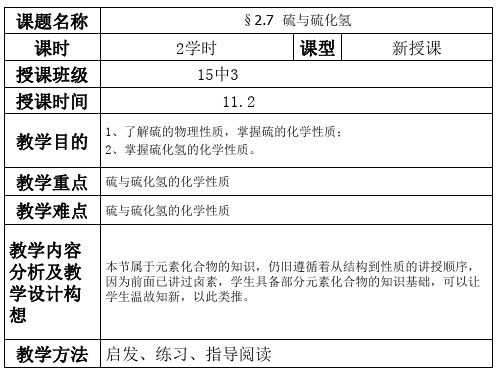
硫与硫化氢PPT讲稿
硫及其化合物的性质

滴加BaCl2溶液 加盐酸 有无白色沉淀 被检液 取清液
【注意】 ①加入盐酸酸化以排除CO32-、SO32-、Ag+等的干扰。 ②不用硝酸酸化,防止SO32-被氧化成SO42-而造成干扰。
H+ O2 O2 Na2S H2S S NaOH H2 H2S
FeSO4
2)在试管中注入 某无色溶液,加热试管, 溶液变为红色,冷却后
恢复无色,则此溶液
可能是 __
__溶液;加热时
溶液由无色变为红色的原因是: 溶有SO 2 气体的品红; SO2气体逸出,品
红溶液恢复红色。
硫及其化合物
第三课时:三氧化硫、硫酸
常见化合态的硫
硫铁矿 黄铜矿 FeS2 CuFeS2
石膏
芒硝
CaSO4· 2O 2H
Na2SO4· 2O 10H
二、硫单质
1. 物理性质 硫磺是一种黄色晶体,质脆,易研成粉末, 硫不溶于水,微溶于酒精,易溶于CS2
二氧化硫的化学性质
与碱反应
与碱性氧化物反应
与盐反应
二氧化硫的化学性质
2.具有还原性
二氧化硫的化学性质
气大,易溶于水,1体积水溶解40体积SO2,易液化( 常压下沸点-10℃)
Biblioteka
二氧化硫的化学性质
1. 具有酸性氧化物的通性,可以使指示剂变色 与水反应生成二元中强酸H2SO3
科学视野 可逆反应:在相同条件下,既能向正反应方向进 行,同时又能向逆反应方向进行的反应 特点: (1)向两个相反的反应进行的两个化学反应,在 相同的条件下同时进行、共存。两个反应构成了 一个对立的统一体 (2)在反应体系中,与化学反应有关的各种物质 共存,如H2SO3溶液中有SO2、H2O和H2SO3分子
硫硫化氢优秀课件

Cu2S为黑色固体,不溶于水,不溶于稀酸。 Ag2S是黑色固体,不溶于水,不溶于稀酸。
硫和变价金属反应时,一般生成低价金属硫化物。但Hg例外, Hg与S在常温下即可反应生成HgS
(2)与非金属反应
H2+ S
H2S
S + O2 点燃 SO2
一、硫化氢
1、 硫化氢的物理性质
2、 硫化氢的化学性质
(1)不稳定性 (2)弱酸性 (3)强还原性
二、硫的氧化物
1、二氧化硫实验室制法 (1)原理:
①Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2 ↑ ②Cu +2H2SO4(浓) =△ CuSO4 + H2O + SO2 ↑
SO2 + Ca(OH)2 = CaSO3 + H2O
CaSO3 + SO2 + H2O = Ca(HSO3)2 ★使澄清石灰水先变浑浊后变澄清的气体除
二氧化碳外,还可能是二___氧__化__硫__。
3)与碱性氧化物反应 SO2 +CaO==CaSO3 2CaSO3+O2==2CaSO4往煤中加生源自灰可以减少煤燃烧产生的二氧化硫的排放
小知识
硫化氢在某一空 间聚积到4%以上时可
发生爆炸。当空气中 硫化氢浓度达0.012~ 0.03mg/m3时,人即 可嗅到;浓度达30~ 75mg/m3时,嗅10 分钟即可引起中毒。
2004年6月辽宁盘锦硫化氢泄漏中毒
如何抢救硫化氢中毒
目前对于硫化氢中毒尚无特效疗法。轻者主要是
对症治疗,如眼部有刺激反应者,应先用自来水或生
硫及其化合物第一课时-单质硫、硫化氢、臭氧、过氧化氢 课件

“臭豆腐”作为一种传统美食,因为其带来嗅觉与味觉的冲突反差,使很多人爱上了它,欲罢不能。
为什么臭豆腐“闻着臭”呢?这因为是豆腐在发酵腌制过程中,蛋 白质在蛋白酶的作用下分解,所含的硫氨基酸也充分水解,产生一 种叫硫化氢(H2S)的化合物,这种化合物具有刺鼻的臭味。
二、氢化物
二、氢化物
1.物理性质
(二)硫化氢(H2S) 3.实验室制法
知识拓展:自我阅读2
氧气的同素异形体臭氧-O3
臭氧单质的性质
知识拓展:自我阅读3
1.物理性质 纯H2O2是淡蓝色的黏稠液体,可任意 比例与水混溶,水溶液俗称双氧水, 为无色透明液体,溶液显酸性。
探究
❖从价态角度考虑,过氧化氢有哪些性质?
这里说明 图片内容
过氧化氢试剂瓶上的标签
这里说明 图片内容
(一)过氧化氢(H2O2) 2.化学性质
2Fe2+ + H2O2 +
== 2
H2S + H2O2 ==
+ 2H2O
5 H2O2
(一)过氧化氢(H2O2) 2.化学性质
2H2O2 =催=化=剂
(一)过氧漂白
本 节 知 识 主 线
+4
SO2
0S
-2
单质 氧化物
H2SO4 H2SO3
H2S
酸
SO42SO32-
S2-
盐
一、硫的存在和性质及用途
1.存在 (1)游离态:存在于火山喷口附近或地壳的岩层里。
①硫化物形式: 硫铁矿:_F_e_S_2_;黄铜矿:_C_u_F_eS2 。 (2)化合态 存在形式 ②硫酸盐形式(填化学式): 芒硝:N_a_2_S_O_4_·__1_0_H_2O_; 石膏:_C_a_S_O_4_·__2_H_2_O_。
硫、硫化氢、二氧化硫、硫酸盐

氯
原 理 实 质
水
二氧化硫
SO2与有色物质直 接结合生成不稳 定无色物质
非氧化还原反应 暂时性 漂白某些有色物 质,不能使紫色石蕊
氯气中HClO将有色 物质氧化成无色物质 氧化还原反应 永久性
效 果
可漂白大多数有 范 围 色物质,能使紫色石 蕊试液褪色
试液褪色
不同漂白剂漂白原理比较
漂白剂 活性炭 漂白原理 物理吸附 强氧化作用,氧化分解加热不复色 结合生成不稳定的无色物质,加热复 色
高山流水, 苍翠欲滴, 美丽的自 然景色令 人心旷神 怡。
随着工农业的发展,自然环境遭到破坏。 1985年,几场酸雨过后,我国四川奉节县9万 亩华山松全部枯死,重庆南山2.7万亩马尾松 死亡过半。
二、二氧化硫 (SO2)
(一、)二氧化硫(SO2)的结构 构型:折线型 (角型) 极性共价键组成的极性分子
(二、)二氧化硫的性质
1、二氧化硫的物理性质
1、色、态、味:无色,有刺激性气味的有毒气体 2、熔、沸点——易液化 3、密度——比空气重(64∶29) 4、溶解性:易溶于水(1体积水溶解40体积SO2)
2、二氧化硫的化学性质
(1)酸性氧化物 (2)氧化性
(3)还原性
(4)其他特性?
思考:可以分别选用什么药品来探索或验 证二氧化硫的化学性质?
C、SO2+2Mg=S+2MgO
总
漂白性
特 氧化性 性
结
+4价
SO
与H2O反应 与碱反应
2
还原性
重视环境保护,防止酸雨危害环境!
二、硫的氧化物
六、三氧化硫 1、物理性质 SO3是无色易挥发的晶体,熔点 16.8Co,沸点44.8Co,常温下,SO3是液态而 不是气态;标况下,是固态而不是气态。 2、化学性质SO3是硫酸的酸酐(硫酐),具有酸 性纸化物的通性。如 SO3+H2O=== H2SO4 SO3+CaO===CaSO4 SO3+2NaOH=== Na2SO4+H2O
硫与硫化氢

5.1从黑火药到酸雨(1)知识要点一、硫1.自然界中硫的存在:含量低(硫元素在地壳中含量0.05%),分布广游离态——火山口附近化合态——芒硝、石膏、硫铁矿、黄铜矿等含硫化合物,生物体内蛋白质中2.硫的物理性质淡黄色固体,不溶于水,微溶于酒精,易溶于CS2。
可利用硫易溶于CS2的特点分离或除去硫,如可用CS2洗涤沾有硫粉的试管。
3.化学性质硫是比较活泼的非金属元素。
硫的原子结构示意图:,S原子最外层有6个电子,能得到2个电子成为-2价的硫,最高正价为+6价,此外硫的常见化合价还有+4价等。
硫单质中硫为0价,在化学反应中,其化合价既能降低又能升高,因此硫既能作氧化剂又能作还原剂。
(1)与金属反应S作氧化剂,与钠、铝、铁、铜、汞等金属单质都能反应,S被还原为S。
具有可变价态的金属(如铁、铜)只能被硫氧化到较低价态。
①2Na + S→Na2S,常温下研磨即可剧烈反应。
②Fe + S Δ→ FeS,加热条件下反应。
停止加热后,混合物仍保持红热状态(说明反应放热),生成黑褐色固体硫化亚铁。
③2Cu + S Δ→ Cu2S,Cu在S蒸气中燃烧,生成黑色固体硫化亚铜。
④Hg + S → HgS,实验室可利用此反应处理洒落的汞滴。
(2)与非金属反应①与氢气,硫作氧化剂H2 + S Δ→H2S②与氧气,硫作还原剂S + O2点燃→SO2硫在空气中燃烧产生微弱的淡蓝色火焰,在纯氧中燃烧产生明亮的蓝紫色火焰。
在点燃条件下,即使O2过量反应产物也是SO2,S和O2单质间化合产物不能写成SO3。
(3)黑火药反应该反应中,S和KNO3为氧化剂,C为还原剂。
二、硫化氢无色,有臭鸡蛋气味有毒气体,比空气重(标准状况下密度ρ=3422.4=1.52g/L),能溶于水,水溶液为氢硫酸。
1.化学性质硫化氢气体具还原性,具体表现为能在O2中燃烧,能被Cl2、SO2等氧化,能使酸性高锰酸钾褪色等。
0-2(1)可燃性→2SO2 + 2H2O氧气充足时,硫化氢气体完全燃烧:2H2S + 3O2点燃→2S↓ + 2H2O氧气不足时,硫化氢气体不完全燃烧:2H2S + O2点燃(2)与SO2反应2H2S + SO2→ 3S↓ + 2H2OH2S与SO2在集气瓶内混合后,可在瓶壁观察到有水珠和淡黄色粉末出现。
无机化学 硫和硫化氢(1) PPT课件

稀 HCl(aq)
AgCl CdS
K+,Cd2+
通 H2S
K+
在酸中和碱中硫化氢或氢硫酸均
具有较强的还原性,
H2S + I2 —— S + 2 HI H2S + 4 Br2 + 4 H2O —— H2SO4 + 8 HBr
2 Fe3+ + H2S —— 2 Fe2+ + S + 2 H+ S2- + O2 + 2 H2O —— 2 S + 4 OH-
由于 H2S 有较强的还原性,制 备时不能用氧化性酸。
PbS,CdS,SnS,SnS2
③ 盐酸中不溶解,但可以 溶于硝酸的
CuS,Ag2S
④ 溶于王水,即浓硝酸和 浓盐酸的混合物,HgS 。
具有酸性的硫化物可溶于碱性 硫化物中。
Sb2S3,Sb2S5,As2S3,As2S5, SnS2,HgS 等酸性或两性硫化物 可与 Na2S 或(NH4)2S 反应
计算并结合定性分析实验,关于 硫化物在酸中的溶解性有如下结论
① 在 0.3 mol•dm-3 的盐酸中 可以溶解的硫化物
FeS, Fe2S3,CoS,NiS, Cr2S3,MnS, ZnS 或者说在 0.3 mol•dm-3 的盐酸 中通 H2S 时这些硫化物不能生成。
② 不溶于 0.3 mol•dm-3 稀 盐酸,但可以溶于浓盐酸的
H2Sx 多硫化氢 Na2Sx 多硫化钠
Na2S 无色,随着 S 的数目增 加,Na2Sx 变黄、变红。
多硫化物不稳定,遇酸易分解。 S22- + 2 H+ —— S + H2S 如过硫化钠见酸生成单质 S,使溶 液变浑浊,并放出 H2S 性的 GeS,SnS, As2S3 和 Sb2S3 等。
硫化氢知识培训ppt课件

定期使用硫化氢检测仪器对工作场 所进行检测,确保及时发现潜在危 险。
应急处理方法和注意事项
迅速撤离
发现硫化氢泄漏时,人员应迅速 撤离到安全区域,并向上风方向
转移。
报告相关部门
立即向安全监管部门报告泄漏情 况,以便及时采取应对措施。
采取紧急处置措施
在确保自身安全的前提下,可以 采取关闭阀门、切断气源等紧急 处置措施,减轻泄漏危害。
的能力。
加强应急处置能力
建立健全应急处置机制,配备 必要的应急救援设备和人员,
加强应急演练和培训。
06
CATALOGUE
法律法规与标准规范解读
国家相关法律法规要求
01
《中华人民共和国安全生产法》
涉及硫化氢等危险化学品的生产、储存、使用等环节的安全管理要求。
02
《危险化学品安全管理条例》
对危险化学品的生产、经营、储存、运输、使用以及废弃处置等环节进
01
在可能接触硫化氢的环境中,工作人员应佩戴正压式空气呼吸
器,确保呼吸安全。
穿戴防护服
02
选择适当的防护服,如防化服、防毒衣等,避免皮肤接触硫化
氢。
使用化学防护眼镜和防毒面具
03
保护眼睛和面部免受硫化氢的伤害。
工作场所安全要求
加强通风
确保工作场所通风良好,降低硫 化氢浓度,减少危害。
设置警示标识
在可能产生硫化氢的区域设置明显 的警示标识,提醒人员注意。
2018年印度尼西亚一化工厂硫化氢泄漏事故
造成4人死亡,多人受伤,事故原因是化工厂安全管理不善,硫化氢泄漏后应急处置不当。
事故原因分析总结
设备设施缺陷
设备老化、腐蚀、破损 等问题可能导致硫化氢
硫、硫化氢、二氧化硫、硫酸盐.

三、酸雨的形成及防治
石灰石-石膏法 Ca(OH)2 + SO2= H2O+CaSO3 2CaSO3+O2 = 2CaSO4
CaCO3△= C△O2↑+CaO SO2+CaO =△ CaSO3 2CaSO3 +O2= 2 CaSO4
氨水法 SO2+2NH3+H2O = (NH4)2SO3 2(NH4)2SO3+O2 = (NH4)2SO4
一、硫单质 硫,俗称硫磺。
硫的物理性质:淡黄色固体,难溶于 水,可溶于酒精,易溶于CS2。
比较活泼的非金属单质,常见化合 价为-2,0,+4,+6,你能说出 其代表物吗?
思考:硫会具有哪些性质?
氧化性: S + H2 === H2S
△
Fe+S = FeS
2 Fe+3Cl2 =点燃2FeCl3
Hello,大家好,我叫二氧化硫。我看不见、 摸不着。但我身体却散发着一种刺鼻的气味。 我的爱好:洗澡。我最爱钻进水里了,和水 溶在一起好舒服。可是令我不解的是,有时 候我看到人们想对他们表示一下友好,他们 却离我而去,有的时候还被送到了医院,真 是莫名其妙。我和地面离得很近,空气也得 在我上面,我才不在乎他压着我呢,反正我 就是喜欢水和大地。好了,我先说到这吧, 我的物理性质你猜到了吗?
浓硫酸与木炭共热的反应及其生成的产物
如下:
2H2SO4(浓)+C
反应装置如下:
2SO2↑+CO2↑+2H2O,
试一试
2H2SO4(浓)+C
2SO2↑+CO2↑+2H2O,
根据所学知识设计一个实验,验证浓硫酸与木 炭反应的产物:
药品:酸性KMnO4溶液、NaOH溶液、溴水、澄 清石灰水、品红、浓硫酸、无水硫酸铜、饱和 碳酸氢钠溶液等
硫与硫化氢
氢硫酸
硫化物
碱金属的硫化物(如Na2S) 由于水解 而使溶液显碱性。所以硫化钠俗称 “硫化碱”。代替NaOH作为碱使 用 某些金属的硫化物,如:Al2S3, Cr2S3 等遇水发生完全水解: Al2S3+6H2O 2Al(OH)3↓+ 3H2S↑ Cr2S3+6H2O 2Cr(OH)3↓+有还原性 但 碱性介质>酸性介质 产物视氧化剂强度而定,一般为S E A (S/H S)=0.144V 2 , 使溶液变浑浊 ① 易被空气中氧氧化
2-)=-0.407V E (S/S 2H2S + B O2 → 2S + 2H2O ② 2H2S + 2FeCl3 →2S +FeCl2+2HCl ③ H2S + H2O2 → S + 2H2O ④ H2S +4Cl2 +4H2O → H2SO4+8HCl
氢硫酸
1.二元弱酸 -7 + a(1) K = 1.1 × 10 H2S H + HS -13 + 2 a(2) K = 1.1 × 10 HS H +S c2(H+)· c (S2-)= c(H2S)· Ka(1) · Ka(2) 饱和溶液中,c(H2S)=0.1mol· L-1 c2(H+)· c (S2-)=1.21×10-21 用调节溶液酸度,改变c (S2-) 进行金属离子的分离
教学方法 启发、练习、指导阅读
2.7 硫与硫化氢
硫的化合物
1 单质 S8
结构: S:sp3杂化 形成环状S8分子
S( 斜方)
94.5oC
190C S( 单斜) 弹性硫
2 硫化氢、硫化物和多硫化物 11-3-5 硫化氢、硫化物和多硫化 硫化氢
硫化氢、硫、H2S、S

硫化氢(H2S)与硫单质(S)硫元素常见的化合价有(由低到高排序):____________________________。
一、硫化氢(H2S)1.H2S的物理性质:无色、有臭鸡蛋气味的气体,有毒,能溶于水(1:2.6),H2S的水溶液显弱酸性(填“酸”或“碱”)。
2. H2S的化学性质:(1)弱酸性:H2S的电离方程式为:H2S H++HS-,HS-H++S2-。
H2S与NaOH溶液反应的化学反应为_____________________________。
(2)不稳定性,受热易分解,反应为:H2S H2+S。
(3)强还原性:H2S与O2反应为:2H2S+O2(少量)2H2O+2S;2H2S+3O2(过量)2H2O+2SO2。
H2S与卤素单质(如Cl2、Br2)反应为:____________________________________________。
H2S与H2O2反应为:____________________________________________。
H2S与Fe3+反应为(写离子反应):____________________________________________。
H2S与酸性KMnO4溶液反应为(写离子反应):____________________________________________。
二、硫(S)1.硫元素的存在形态:(1)游离态:天然硫,火山口附近或地壳岩层里。
(2)化合态:主要有硫化物、硫酸盐,煤、石油和蛋白质里都含有少量的硫元素。
2.硫单质的物理性质:淡黄色固体,俗称硫磺。
硫单质难溶于水,易溶于CS2,理由是________ _________________________________________。
3.硫单质的化学性质:(1)硫的氧化性(弱氧化性):a.与金属反应,将金属氧化为低价态:S与Fe反应为:Fe+S FeS(黑色),实验现象:反应发光,持续红热,生成黑色物质。
硫、硫化氢讲解

(3)强氧化性 ①氧化非金属单质C S P等
②氧化金属单质
Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O (强氧化性酸性)
常温下,Fe、Al遇浓H2SO4会钝化,加热后会继续反应;因 此可用铁制槽车运输浓H2SO4。
2003年12月23日22点,重庆市开县境内发 生天然气井喷事故,200多人中毒死亡,中毒人 数现达万人左右。
小知识
硫化氢在某一空 间聚积到4%以上时可
发生爆炸。当空气中 硫化氢浓度达0.012~ 0.03mg/m3时,人即 可嗅到;浓度达30~ 75mg/m3时,嗅10 分钟即可引起中毒。
2004年6月辽宁盘锦硫化氢泄漏中毒
[思考] 将浓硫酸加入浓盐酸中可快速得到HCl气体,利用浓硫酸 什么性质?浓硫酸具有难挥发性,将其敞口放置浓度和质量是否 不变呢?
2.化学性质
(12H++SO42-
用途
NaHSO4 == Na++ H++SO42-
• 制气体: H2SO4 + Zn = ZnSO4+ H2 ↑
★ 浓硫酸也有强氧化性,能不能氧化SO2? 能不能用浓硫酸干燥SO2 ? (3)二氧化硫的氧化性(与硫化氢反应) (4S)O2二+2氧H化2S=硫3的S+漂2H白2O性
练习1:将SO2通入BaCl2溶液至饱和,未见 沉淀生成,继续通入另一种气体,仍无沉淀,则
通入的气体可能是( A )
A、CO2 B、NH3 C、NO2 D、H2S 练习2:将SO2通入BaCl2溶液至饱和,未见
硫及其化合物
2020高中化学硫、硫化物、硫化氢

S6、S4、S2 ( 长链断裂 )
444.6℃
弹性硫 ( plastic) ( 不稳定 ) S2(g)
S
S
S
SS
弹性硫的形成氢硫酸,其饱和浓度为0.1/dm3
孤电子对
1、H2S的结构
sp3
孤电子对
2、H2S的制备
H2S的溶液必须是新配制的。
三、金属硫化物:常见的可溶硫化物为Na2S、(NH4)2S
3、硫的单质
(1) S8:最稳定的形式,成环状(ring)或皇冠状(crown), 它有两种形式:
S
SS
S
S4
S以 sp3 杂化形成环状 SS88分子
弹性硫
S(斜方) 94.5oC S(单斜) 190 C 弹性硫
S8 ( 溶于CS2 ) 160℃
长时间 放 置
S∞ ( 线性分子 ) 290℃以上
第 3 节 硫、硫化物、硫化氢 一、硫与氧的区别
1、单键的键能:-O-O-(142 kJ/mol), -S-S-(268 kJ/mol) 主要是因为前者原子半径小,孤对电子之间的排斥作用大所致。 2、单质:O2为双原子分子,而硫的单质为多原子分子,其中S8最 稳定。 为什么第二周期多为双原子分子,而第三周期及其后的多为多原 子分子呢? 第二周期的原子半径小,故两个原子之间除了形成键之外,还 可以肩并肩地形成键。而后面的原子半径变大,形成键后,较 难形成键,为了达到8电子稳定结构,就形成多原子分子。
比如ZnS的Ksp = 1.0 10-20 时, [Zn2+] = 10-3 mol/dm3,沉 降不完全,如何让其沉降完全呢?
此时,既不能增加[H+],也不能增加[H2S]。
因此必须降低[H+],方法: a:加氨水,不合适; b:加NaOH,不合适; c:加NaOAc,合适。
高一化学 硫化氢和硫 PPT课件 图文

(3)硫与其它物质的反应
黑火药的成份是硝酸钾、硫黄、木炭,燃烧 时发生如下反应: S + 2KNO3 + 3C 点燃 K2S + N2 + 3CO2
硫能与强碱溶液反应
0
△
-2
+4
3S + 6KOH → 2K2S +K2SO3 + 3H2O
氧化产物与还原产物的物质的量之比为 1 : 2
( Na2SO3 ) (Na2S)
原理:FeS + H2SO4 FeSO4 + H2S 装置:固液不加热装置(与制氢、制二氧化碳相同 )
或启普发生器 净化: 无水 CaCl2 收集方法:向上排空气法 或 排饱和硫氢化钠溶液
检验: 使湿润的醋酸铅、硝酸铅试纸或硫酸铜溶 液变黑
尾气: NaOH 溶液
实验室制备及检验硫化氢性质的操作过程:
2Cu+S
Cu2S(黑色)
现象:铜丝在硫蒸气中燃烧发红,变成黑色物质。
思考:氯气与硫的氧化性哪一个强?
[讨论] 硫能与大多数金属反应, 请写出硫粉 与钠、铝、汞等反应的化学方程式
Hg+S → HgS (黑色)
——可以用硫粉来处理散落的汞滴。
2Al+3S
Al2S3(制取Al2S3的唯一途径)
2Na+S → Na2S (常温即可反应,爆炸)
-2 +4
0
2H2S + SO2 2H2O + 3S
氧化产物和还原产物的质量比是 2:1
反应前
反应后
H2S +X2 2HX + S (X=Cl、Br、I) 单质氧化性: Cl2 > Br2 > I2 > S 离子还原性: Cl- < Br - < I - < S2-
硫和硫化氢课件高一下学期化学人教版(精)3

+3H2O
课堂小结
1. 硫是一种重要的非金属元素,在不同的物质里表现-2、0、+4、 +6等多种化合价; 2. 硫是一种黄色晶体,不溶于水,微溶于酒精,易溶于CS2; 3. 硫的化学性质比较活泼,能与许多金属单质及非金属单质发生 化学反应。
• 还会被 稀/浓硝酸、浓硫酸 氧化【具体产物价态目前不要求】
2. 硫化氢的化学性质
④ 氢硫酸(H2S):挥发性 二元弱酸
• 能使紫色石蕊变红 • 酸的通性:
e.g. 与活泼金属 H2S + Mg = MgS + H2↑ 与碱(如NaOH) Na2S 或 NaHS(酸过量时)
2. 硫化氢的化学性质
【学习任务二】硫化氢及其盐 (S:-2价)
1. 硫化氢的物理性质 ① 无色、有臭鸡蛋气味的有毒气体 ② 密度大于空气 ③ 能溶于水(1:2.6),水溶液称 氢硫酸
(溶解性:CO2 < Cl2 < H2S < SO2 < HCl < NH3)
2. 硫化氢的化学性质
① 不稳定性:300 oC分解 H2S △= H2 + S
PART
01
性质并进行证实,理解物质的微观结构与宏观性
质之间的关系;
PART
02
结合实验探究,认识硫的存在和性质,了解硫的用途。
【学习任务一】硫(S)的性质与用途
自然界的硫单质
印尼东爪哇外南梦, 卡瓦伊真火山喷出的气体 通过火山口内的喷气孔形 成硫黄,当地很多青壮年 男子冒险去火山口采硫黄 矿谋生。这些硫矿被运到 当地工厂加工,在硫化橡 胶、漂白糖等工业步骤中 使用。
硫和硫化氢

方程式: Fe + S → FeS
△
方程式:2 Cu + S △ → Cu2S 注意: 生成物铜为+1价亚铜 不生成硫化铜 CuS ! 如何处理打碎的温度计? 与Hg反应的化学方程式: Hg + S → HgS 估计硫与钠能反应吗 ?如果能,反应现象如何呢?
硫和氯气都能分别与铜、铁反 应,试比较反应有何异同。
-2,0,+4,+6
举例:
根据硫的原子结构及化合价预测硫单质的化学性质
4、化学性质 可与金属、氢气反应 既有氧化性:
又有还原性:
自身氧化还原:
可与氧气反应 与热的碱反应
4、化学性质 (1)氧化性:
①与金属反应 与铁反应现象: 加热到红热,移去酒精灯,继续保持红热,生成黑色固体 注意: 生成 物的铁为+2价 不生成 硫化铁 Fe2S3 与铜反应现象: 铜丝在硫蒸气中燃烧发红,变成黑色物质。
2H2S+O2→2S↓+2H2O
氢硫酸在空气中易变浑浊,所以不能长久保存,随用随配
动植物在腐败时会产生H2S 3、实验室制取H2S。
常用FeS跟稀盐酸或稀硫酸反应。
FeS+2HCl → H2S↑+FeCl2 FeS+H2SO4→H2S↑+FeSO4
思考1:FeCl2或FeSO4中通入硫化氢气体有黑色沉 淀吗?为什么硫酸铜溶液中有黑色沉淀?
2:把70mlH2S和90mlO2气体混合燃烧,反应后恢复原状况,可 得到SO2体积是( ) A. 50ml B. 55ml C. 60ml D. 70ml
3:常温常压下,点燃100 ml H2S和O2的混合气体,充分反应恢 复到原状况,气体的体积变为57ml,这57ml气体的成分可能是
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
几种重要的矿物
黄铁矿(硫铁矿)(FeS2) 工业制硫酸的原料 黄铜矿(CuFeS2) 芒硝(Na2SO4·10H2O)
生石膏(CaSO4·2H2O)
硫及其化合物
火山口处的硫
硫矿露天开采
黄铜矿(CuFeS2) (伴生水晶)
黄铁矿(FeS2)
芒硝 (Na2SO4·10H2O)
-----可除去试管壁的硫粉 氧化产物与还原产物的物质的量之比为_________
5. 硫的用途
硫及其化合物
工业制硫酸、橡胶,三药一柴的重要原料 黑火药、农药、药膏,火柴
小结:
黑火药的成分: 研究硫的科学思维方法:
黑火药爆炸反应原理:
硫:①存在形式 ②物理性质
1、通过现象研究本质 2、根据结构预测性质
硫与硫化氢课件
爆竹声中一岁除, 春风送暖入屠苏。 千门万户曈曈日, 总把新桃换旧符。
鞭炮响转眼间一年已过, 屠苏酒暖心房春风吹拂。 旭日升千门万户多明亮, 人人把新桃符换旧桃符。
烟花爆竹中的学问
早在宋朝,我国已发明制造烟花的技术
烟花是用黑火药和发色剂混合制成的,烟花所用的发 色剂大多是金属化合物。用硝酸锶可发洋红色光;用 硝酸钡可发黄绿色光;用硝酸钠可发黄光;用碱式碳 酸铜可发绿色光;在烟花中加入铝镁合金,燃烧时会 发出耀眼的白光。
(5)氧气能置换出硫单质 (6)硫与氧气反应,氧气作氧化剂,硫作还原剂
(7)二氧化硫中的元素的价态
2、(1)11.2g铁粉与2.2g硫粉均匀混合,在密闭容器中
加热,冷却后加入足量盐酸,在标况下收集到的气体体积
_____________。
(2)将铁粉、硫粉混合均匀隔绝空气加热,充分反应后
生成22g硫化亚铁,则原混合物中铁粉、硫粉的质量分别
(4)若0.1mol某单质与足量硫充分反应,质量增加了1.6克,
则组成这种单质的元素不可能为
()
A.银 B.铁 C.铜 D.钾
二、令人生厌的硫化氢(H2S)
1、硫化氢的性质
物理性质
_无_色、有_臭__鸡__蛋__气味、有毒气体,相同状况下,硫化 氢比空气__重__;在标准状况下的密度约_1_._5_2__g/L.
方程式:2 Cu + S △→ Cu2S 注意: 生成物铜为+1价亚铜
如何处理打碎的温度计?
不生成硫化铜 CuS !
与Hg反应的化学方程式: Hg + S → HgS
估计硫与钠能反应吗 ?如果能,反应现象如何呢?
硫和氯气都能分别与铜、铁反 应,试比较反应有何异同。
△ +1
2Cu + S → Cu2S
常它温的下水,溶1液体叫积_水_氢_溶_硫_解_酸_2_._6,体显积_,弱_H_2_S酸硫性化氢__能__于水,
氢硫酸分子的结构:电子式 结构式 , 化合物
思考:根据硫化氢的组成和化合价,预测硫 化氢气体及氢硫酸的化学性质 硫化氢 --- 还原性、氧化性、不稳定性
氢硫酸 --- 弱酸性、还原性
•H2S的化学性质:
①与氧气 S O2 SO2
空气中:淡蓝色火焰 纯氧中: 明亮的蓝紫色火焰
回忆氢气在氧气、氯气中 燃烧的火焰颜色
②与强氧化剂反应
S+6HNO3(浓) →△ H2SO4+6NO2↑+2H2O S+2H2SO4(浓) →△ 3SO2↑+2H2O
(3)自身氧化还原:3S+6NaOH →△ 2Na2S+Na2SO3+3H2O
△ +2
Fe + S → FeS
硫是氧化剂 化合反应
点燃 +2
Cu + Cl2 → CuCl2
点燃 +3
2Fe + 3Cl2 → 2FeCl3
氯气是氧化剂
化合反应
生成低价的金属硫化物 生成高价的金属氯化物
结论: 氯气的氧化性比硫强
氧气的氧化性呢?
②与氢气反应 H2 + S →△ H2S
(2)还原性: 点燃
4、化学性质
既有氧化性:可与金属、氢气反应
又有还原性: 可与氧气反应
自身氧化还原:
与热的碱反应
4、化学性质 (1)氧化性:
①与金属反应
与铁反应现象:
加热到红热,移去酒精灯,继续保持红热,生成黑色固体
方程式:Fe
+
S
△
→
FeS
注意: 生成 物的铁为+2价
与铜反应现象:
不生成 硫化铁 Fe2S3
铜丝在硫蒸气中燃烧发红,变成黑色物质。
为_____________。
(3)一定量的铁粉与硫粉的混合物隔绝空气加热,充分
反应后冷却,再加入足量稀硫酸,得到标准状态下的气体
11.2L,则原混合物可能的组成:
①n(Fe)=n(S) 总质量________44克
②n(Fe)>n(S) 总质量________44克
③n(Fe)<n(S) 总质量________44克
③原子结构
3、实验验证性质, 性质反映结构
④化学性质 ⑤ 用途
4、比较与演绎并用
1、请用不同的方法验证硫的氧化性比氧气弱(已 知硫化氢溶液久置于空气中,有淡黄色沉淀析出) ,能用化学方程式表示的请写出相关方程式。比一 比试一试,哪组同学设计的方案即好又多
(1)与铁、铜金属反应,变价金属的价态 (2)水与硫化氢的热稳定性比较 (3)生成硫化氢与水的条件比较 (4)生成等物质的量的水与硫化氢放出的热量比较
(1)不稳定性: H2S →△ H2 + S
(H2S既表现氧化性,又表现还原性)
(2)可燃性(还原性) 点燃
不完全燃烧 2H2S+O2 → 2S+2H2O
完全燃烧
点燃
2H2S+3O2 → 2SO2+2H2O
(3) 强还原性
常见的氧化剂有:_O_2_、__S_O__2_、__氯_水__、__B__r_2_水__、__K_M__n_O_4_、__F_e__3+__等__
黑火药
成分:硫磺、硝石、木炭
点燃
化学反应:S + 2KNO3 + 3C → K2S + N2 ↑+ 3CO2 ↑
氧化剂是___________,__________元素被氧化,还原 产物是_________,每生成1molCO2转移 _____ mol电子。
一、除夕爆竹话硫磺
硫及其化合物
1. 硫元素的存在形式 火山口附近 (1)游离态 单质硫 地壳的岩层 (2)化合态 主要有硫化物、硫酸盐;煤、
石膏 (CaSO4·2H2O)
2. 硫单质的物理性质
硫及其化合物
俗名“硫磺”,属于分子晶体 黄色或淡黄色固体,熔沸点较低
不溶于水,微溶于酒精,易溶于CS2 用CS2洗涤粘在试管上的硫粉
硫磺晶体
3、原子结构
S原子结构示意图 电子式
硫元素的常见化合价
举例:
-2,0,+4,+6
根据硫的原子结构及化合价预测硫单质的化学性质
