第五章 相平衡
第五章 相平衡

衡时的p-x相图如右图
g
A
xB
B
三、二组分气-液平衡系统
例题二:在p=101.3 kPa,85℃时,由甲苯(A)及苯(B)组成的 二组分液态混合物即达到沸腾。该液态混合物可视为理想液 态混合物。试计算该理想液态混合物在101.3 kPa及85℃沸腾 时的液相组成及气相组成。已知85℃时纯甲苯和纯苯的饱和 蒸气压分别为46.00 kPa和116.9 kPa。
b、具有最低会溶温度的系统 如H2O-(C2H5)3N系统 TB=291K
c、具有两种会溶温度的系统 如H2O-(C2H5)3N系统 曲线内为两相共存 曲线外是互溶单相区
d、不具有两种会溶温度的系统 如H2O-乙醚系统
T/K
291
H2O x
481
T/K
(C2H5)3N
333
H2O x
烟碱
五、二组分液-固平衡系统
pA*
p pA pB pA* xA pB* xB
pA* (1 xB) pB* xB
pB* pA* xB pA*
A
xB
B
压力与液相组成图(T一定)
设A在气相中的摩尔分数为yA,B为yB,则有
yA
pA p
pA* xA p
yB
pB p
pB* xB p
yA pA* xA yB pB* xB
继续降低压力至D,气液达到平衡
此时,液相组成为C点
p T一定 a
气相组成为E点
C点和E点称为相点 CE称为联结线
继续降低压力至F
pA*
CN
D
F
pB*
EM
此时,液相已经全部蒸发
气相组成为F点 继续降低压力
气相的简单状态变化
第05章 相平衡

第五章相平衡§5.1 引言相平衡是热力学在化学领域中的重要应用之一。
化工中很多分离提纯过程,例如精馏、吸收、结晶、萃取等,都涉及到物质在不同相中的分配,它们主要利用物质的挥发性或溶解度等方面的差异,以达到分离提纯的目的,相平衡亦可为此提供理论依据。
因此研究相平衡有着重要现实意义。
一、相(phase)体系内部物理和化学性质完全均匀的部分称为相。
相与相之间在指定条件下有明显的界面。
(1)气体,不论有多少种气体混合,只有一个气相。
(2)液体,按其互溶程度可以组成一相、两相或三相共存。
(3)固体,一般有一种固体便有一个相。
两种固体粉末无论混合得多么均匀,仍是两个相(固体溶液除外,它是单相)。
体系中相的总数用Φ表示。
二、相变物质从一个相流动到另一个相的过程,称为相变化,简称相变。
相变包括气化(boil)、冷凝(condensation)、熔化(melt)、凝固(freeze)、升华(sublimation)、凝华以及晶型转化等。
三、相图(phase diagram)将多相体系的状态随组成、温度、压力等强度性质的改变而发生的过程用图形表示,称为相图。
根据组成相的物态不同分为气-液相图、液-液相图和液-固相图。
根据用途不同可将相图分为温度-蒸汽压图(T-p图,P314 图5.1)、蒸汽压-组成图(p-x图,P318 图5.3):恒定温度,研究P-x,y之间的关系。
称为压力组成图。
温度-组成图(T -x 图,P321 图5.5):在恒定压力下表示二组分系统气-液平衡时温度与组成关系的相图。
研究T-x ,y 之间的关系。
和温度-蒸汽压-组成图(T -p -x 图,P322 图5.6),T-x-y ,x-y ,p-x-y 相图等。
四、自由度(degrees of freedom )确定平衡体系的状态所必须的压力、温度和浓度等独立强度性质的数目称为自由度,用字母f 表示。
如果已指定某个强度性质,除该性质以外的其它强度性质数称为条件自由度,用*f 表示。
第五章 相平衡

b.同一相内物质间有浓度限制条件R′
5.3 相律
相律
例如:合成氨时系统内有N2,H2,NH3 N2+3H2=2NH3
Kp p p p
2 NH 3 3 N2 H 2
C= S-R C =S-R-R´ 5.3 相律
相律
C = S - R - R'
注意: (1)R---表示独立的化学平衡数。有时系统中可以 存在很多化学平衡,但是独立的并不多。
5.3 相律
相律
自由度(degree of freedom) 系统内独立可变因素的数目称为自由度,用字母f 表示。独立可变因素包括压力、温度和浓度等。
独立可变因素是指在一定范围内这些可变因素变 化时,不会引起相的改变,既不会使原有相消失, 也不会增加新的相。
5.3 相律
相律
相律(phase rule)
Φmin=1
fmin=0
(3)可求系统中最多相数Φ
max
5.3 相律
相律
例题(P336,习题4):已知Na2CO3(s)和 H2O(l)可以生成三种水合物: Na2CO3· H2O(s), Na2CO3· 7H2O(s)和 Na2CO3· 10H2O(s),试求: (1) 在大气压力下,与Na2CO3水溶液和冰 平衡共存的水合盐的最大值; (2) 在298K时,与水蒸气平衡共存的水合 盐的最大值。
单组分系统的两相平衡
解:
p2 vap H m 1 1 (1) ln p1 R T1 T2 p2 34170J m ol1 1 1 ln 1 1 10.02kPa 8.314J m ol K 293K 303K p2 15.91kPa
5.1 引言
化工热力学 第五章 相平衡

A)汽相为理想气体混合物,液相为理想溶液。 B)汽相和液相都是理想溶液。 C)汽相是理想气体混合物,而液相是非理想溶液。 D)两相都是非理想溶液。 5.2.1、相平衡的处理方法 状态方程法:用状态方程来解决相平衡中的逸度系数
ˆ iv yi P li xi P ˆ
活度系数法:液相的逸度用活度系数来计算
s s i i
5.3.2.2) 泡点温度和组成的计算(BUBLT)
已知:平衡压力P,液相组成xi,求 平衡温度T,汽相组成 yi 假设T,确定Pis 计算yi 否
y
i
1
是
园整
5.3.2.3 露点压力和组成计算(DEWP)
已知 平衡温度T,汽相组成yi , 求平衡压力 P,液相组成xi 假设 P 计算Pis及xi
第5章
相 平 衡
在化工生产中,原料由于含有各种杂质,需要提纯进入反 应器;反应又常常是不完全的并伴有副产物,因而产物也是不 纯的,也需要进一步处理,才能得到产品。所有这些都离不开 分离操作,典型的分离操作有精馏(VLE)、吸收(GLE)、 萃取(LLE)、结晶(SLE)等,他们的投资常达整个工厂投 资的一半以上,对有些行业如石油和煤焦油加工等,甚至达到 80%--90%,这些分离都需要相平衡数据。 5.1 相平衡基础 5.1.1、相平衡的判据 何谓相平衡:
例:乙醇(1)----苯(2)溶液,含乙醇80%(mol%),求该溶液在 750mmHg时,的沸点及饱和蒸汽组成。已知乙醇---苯系统有一恒沸 混合物,此混合物含44.8%乙醇,在760mmHg时的沸点为68.24oC (忽略温度对活度系数的影响。 乙醇
苯
lg P1S 8.04494
1554 .3 222 .65 t
物理化学 第五章 相平衡

一、基本概念和公式 (一)几个基本概念 1. 相和相数 (1)相 (phase) 系统内部物理和化学性质完全均匀的部分称为相。 特点 相与相之间在指定条件下有明显的界面, 在界面上宏观性质的改变是飞跃式的。 (2)相数 (number of phase) 系统中相的总数称为相数,用 表示。 气体:
(三)二组分系统的相图及应用
(3) 同时具有最高、最低会溶温度 (4) 不具有会溶温度
(三)二组分系统的相图及应用
4. 不互溶双液系 (1) 特点 如果A,B 两种液体彼此互溶程度极小,以致可忽略 不计。则A与B共存时,各组分的蒸气压与单独存在时一 样,液面上的总蒸气压等于两纯组分饱和蒸气压之和。 * * 即: p pA pB 当两种液体共存时,不管其相对数量如何,其 总蒸气压恒大于任一组分的蒸气压,而沸点则恒低 于任一组分的沸点。 (2) 水蒸气蒸馏
CaF2 ( A)
0 .6
0 .8
1 .0 CaCl2 ( B)
(三)二组分系统的相图及应用
(3) 相合熔点 A和B形成的化合物有确定的熔点,完全熔化时不 分解,在熔点时液相和固相的组成相同,所以稳定化 合物的熔点称为相合熔点。 (4) 不相合熔点 因为C没有自己的熔点,将C加热,到O点温 度时分解成 CaF2 (s) 和组成为B的熔液,所以将O点 的温度称为转熔温度(peritectic temperature)也 叫异成分熔点或不相合熔点。
(四)三组分系统的相图及其应用
(d) 如果代表两个三个组分 系统的D点和E点,混合成新 系统的物系点O必定落在DE 连线上。哪个物系含量多, O点就靠近哪个物系点。 O点的位置可用 杠杆规则求算。
mD OD mE OE
第5章- 相平衡

1 (2) CO O 2 CO 2 2 1 (3) H 2 O 2 H 2O 2
这三个反应中只有两个是独立的,所以 R=2
独立组分数:C= S – R – R′
浓度限制条件:R′ 例如,在真空容器中发生如下反应:
2NH3 (g) N2 (g) 3H2 (g)
第五章
相平衡
相数的确定
系统中相的总数称为相数,用 表示。
气体,不论有多少种气体混合,只有一个气相; 液体,按其互溶程度可以组成一相、两相或三相共存;
固体,一般有一种固体便有一个相。两种固体粉末无论混 合得多么均匀,仍是两个相(固溶体除外,它是单相);
自由度
确定平衡系统的状态(既不产生新相也不消失
* nA (g) pA * nB (g) pB
2、 工业应用:水蒸气蒸馏
简单的低共熔二元相图
1.0Bi
a
A
0.4Cd 1.0Cd 0.2Cd 0.7Cd b c d e H A'
F
p
A
H 596
熔化物(单相)
546
C
F
T /K
C
B
413
D D' E
G
M
熔化物+Cd(s)
G E 413 Bi(s)+熔化物 D BBi
0.2
0.4
0.6
0.8
wCd
1 Cd
Cd-Bi二元相图的绘制
Cd-Bi二元相图的绘制
w(Cd) 0.2
的步冷曲线
b
T /K
f* 2
C
D
f * 1
1. 加热到b点,Bi-Cd全部熔化 Φ 1 f * 2 1 Φ 2 温度可以下降,组成也可变 2. 冷至C点,固体Bi开始析出 Φ 2 f * 2 1 Φ 1 温度可以下降 3.D点固体Bi、Cd同时析出
第五章相平衡

第五章相平衡(Phase equilibrium)相平衡、热平衡和化学平衡是热力学在化学领域中的重要应用,也是化学热力学的主要研究对象。
相平衡研究对生产和科学研究具有重大的实际意义。
例如在化学研究和化学生产过程的分离操作中,经常会遇到各种相变化过程,如蒸发、冷凝、升华、溶解、结晶和萃取等,这些过程及到不同相之间的物质传递。
相平衡研究是选择分离方法、设计分离装置以及实现最佳操作的理论基础。
除了分离以外,相平衡及其基本理论还广泛应用于冶金、材料科学、地质矿物学、晶体生长等学科中,对这些部门的科研和生产有着重要的指导意义。
相平衡研究多相体系相变化规律,是热力学基本原理在化学领域中的重要应用。
“相律”是根据热力学原理推导出来的,以统一观点处理各种类型多相平衡的理论方法十分严谨明确。
它表明一个多相平衡体系的组分数、相数以及自由度之间的关系,可以帮助我们确定体系的平衡性质以及达平衡的必要条件。
然而,相律也有其局限性,它只能对多相平衡作定性描述。
可指明特定条件下平衡体系至多的相数以及为保持这些相数所必具的独立变量数。
但究竟是哪些相共存?哪些性质可作为独立变量以及它们之间的定量关系如何等问题,相律均无能为力。
这方面知识仍有待从实验中确定。
本章着重讨论各种相平衡体系所遵守的一个普遍规律----相律,以及各种基本类型的相图,具体分析体系的相平衡情况与温度、压力和组成等因素的关系,并举例说明其实际应用§5.1相律一、基本术语1、相:体系中物理性质和化学性质完全均匀的一部分称为相物质从一个相转移到另一个相的过程称为相变化过程,而相平衡状态就是相变化过程的极限,此时宏观上投有任何物质在相间传递。
此处“完全均匀”,是指体系中的物质在分子水平上的均匀混合的状态,此时即便是由多种物质构成的体系,但其物理性质和化学性质都达到了完全均匀的程度,用一般的仪器已分不出其界面了,形成一个均相体系。
多相体系中,相与相之间存在明显的界面,称为相界面。
第五章----- 相平衡

P
0
RT (Vi )dP P
p
L V i ˆV Py x P S S dp i i i i i i ps i RT
S
i 1 , 2K N
Bi ln Pi Ai (Antoine方程) ln S 1 i T Ci RT
PiS
0
nG E RT 对于活度系数法, ln i ni T , P ,n j ni i 模型是关键
逆向 蒸发 3 D
(1)等温逆向冷凝或 逆向蒸发现象 在 CmJMTM区域内, 恒温下,随压力升高,
p
液
Mp
g=min L
Cm
K l=max l=min
2
M l=min 出现液体
g=min g=max J
G
MT 逆向 蒸发 逆向 冷凝
B
BC泡点线
出现液体
液相减少的现象。
(2)等压逆向冷凝或 逆向蒸发现象
dni 0
i i
i i i L L i
5
一、相平衡判据
利用逸度定义式:
ˆ dGi d i RTd ln f i
ˆ f ˆ f ˆ L L f ˆ f i i i i
6
一、相平衡判据
相平衡的判据,较常用的有三个
4)非理想系:汽相非理想溶液,液相理想溶液(LR)
i 1
V S S ˆ pyii pi i xi
如压力较高的烃类物系。 第三类和第四类都是碳氢化合物的混合物所组成的物系, 所不同的是第四类的压力比第三类的高。 29
活度系数法公式的简化
5)完全非理想系:汽液两相均为非理想溶液
物理化学第5章相平衡

(2) 保持压力不变,得 T-x 图 常用
这三个变量通常是T,p 和组成 x。所以要表示二组分系统状态图,需用三个坐标的立体图表示。
一. 合金体系 1、相图绘制—— 热分析法 §5.7 具有简单低共熔混合物的固液二组分系统 Cd-Bi二元相图
①对拉乌尔定律有较大正偏差:
在T-x图上就有最低点,这最低点称为最低恒沸点
最低恒沸混合物是混合物而不是化合物,它的组成在定压下有定值。
在标准压力下, 的最低恒沸点温度为351.28 K,含乙醇 95.57 。
改变压力,最低恒沸点的温度也改变,它的组成也随之改变。
属于此类的系统有:
5.8 有化合物生成的固液二组分系统
5.4 完全互溶的双液系统
5.2 单组分系统的克-克方程
5.9 三组分系统
5.7 具有简单低共熔混合物的固液二组分系统
5.1 相律
5.3 水的相图
第五章 相平衡
相平衡是热力学在化学领域中的重要应用之一 研究多相系统的平衡在化学、化工的科研和生产中有重要的意义,例如:溶解、蒸馏、重结晶、萃取、提纯及金相分析等方面都要用到相平衡的知识 相律(phase rule);相图(phase diagram)
2、分析相图
区:图上有4个相区 ( 1) AEH线之上, 熔液(l)单相区 (2) ABE之内, Bi(s)+ l 两相区 (3) HEM之内, Cd(s)+ l 两相区 (4)BEM线以下, Bi(s)+Cd(s)两相区
线:有三条多相平衡曲线
(1)ACE线,Bi(s)+熔液 共存时的熔液组成线。
组成为F的气体冷到E
有组成为x1的液体出现
第五章 相平衡

二元凝聚系统相图表示法:T-x图
一、二元凝聚系统相图的基本类型
1.具有一个低共熔点的简单二元系统相图
特点:两组分在液态时完全互溶,形成单相溶液; 固态时完全不互溶,二组分各自从液相中分别结 晶,组分间无化学作用,不生成新化合物。
⑴
相
图
分
析
G
H
相区:
aEb : 高温熔体的单相区 (液相区)
bEH : L B 两相平衡共存区
熔体(1600℃) 熔体 (1670℃)
α-石英
870℃
1470℃
α-鳞石英
α-方石英
1723℃ 熔融石英
573℃
163℃
180~270℃
急
冷
β-石英
β-鳞石英
β-方石英
石英玻璃
117℃ γ-鳞石英 同 级 转 变(慢)
同
类 转
(快)
变
SiO2相图
1、在573℃以下的低温,SiO2的稳定晶型为-石英,加热至573℃转变为高温型 的-石英,这种转变较快;冷却时在同一温度下以同样的速度发生逆转变。如 果加热速度过快,则-石英过热而在1600℃时熔融。如果加热速度很慢,则在 870℃转变为-鳞石英。
以 忽略压强的影响,相律中的“2”应为“1”。
3. 必须正确判断独立组分数、独立化学反应式、相数以及限 制条件数,才能正确应用相律。
4. 自由度只取“0”以上的正值。如果出现负值,则说明体系可 能处于非平衡态。
第二节 单元系统相图
单元系统中, c = 1
f=c–p+2=3–p
pmin=1 pmax=3
2. 介稳态 即热力学非平衡态,经常出现于硅酸盐系统中。
如: α-石英 870α℃-鳞石英 1470℃α-方石英
物理化学-第五章 相平衡
* p* p p A B
1. 压力-组成图—p-x(y)
(3) 气相线的制作 气相线:液相蒸气总压与蒸气组成关系线。
* pB pB xB yB p p
* * p p* ( p p A B A ) xB
* pB xB yB * * p A +( pB p* A ) xB
讨论组分数(C)与物 种数(S)的关系: 例1:液态水 S=1=C 例2:任意量的PCl5(g)、PCl3(g)和 Cl2(g)构成的平衡系统。 1指的是系统存在一个化学平衡方程式 S=3 C=3-1
PCl5(g)= PCl3(g)+ Cl2(g)
0 vB B
5.1 相律
3.独立组分数(number of independent component) 在平衡系统所处的条件下,能够确保各相组 成所需的最少独立物种数称为独立组分数,用 字母C表示。
在平衡系统所处的条件下,能够确保各相组 成所需的最少独立物种数称为独立组分数,用 字母C表示。
讨论组分数(C)与物 种数(S)的关系: 例1:液态水 S=1 = C
5.1
相律
3.独立组分数(number of independent component) 在平衡系统所处的条件下,能够确保各相组 成所需的最少独立物种数称为独立组分数,用 字母C表示。
5.1
自由度(f)= 系统总变量 -关联方程式数
热力学 平衡系统 S种物种
ф个相
假设S种物种都可 溶于ф个相中
2通常指T, P两个变量
1)系统总变量
1
2
3 … … S系统总变量= NhomakorabeaS-1)ф +2
物理化学 第5章 相平衡

2、三条两相平衡线, φ=2 , f =1 ,压力与温度只能 改变一个,指定了压力,则温度随之而定。 OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点 T 647 K , p 2.2107 Pa ,这时气-液界面消失。 高于临界温度,不能用加压的方法 使气体液化。 OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。 OC 是液-固两相平衡线,当C点延长至压力大于 2 108 Pa 时,相图变得复杂,有不同结构的冰生成。
OD 是AO的延长线,是过冷水和水蒸气的介稳平衡 线。因为在相同温度下,过冷水的蒸气压大于冰的蒸 气压,所以OD线在OB线之上。过冷水处于不稳定状 态,一旦有凝聚中心出现,就立即全部变成冰。 3、一个三相点 (triple point), O点 是气-液-固三 相共存点, φ=3,f=0 三相 点的温度和压力皆由系统自 定。
dp S m dT Vm
由于 因此:
H m S m T dp H m dT T Vm
克拉佩龙方程
适用于纯物质的任意两相平衡
(1)对气-液两相平衡
dp H m dT T Vm
RT Vm Vg Vl Vg p
d ln p vap H m 2 dT RT
T T TF
(2)压力平衡条件:达到平衡时各相的压力相等
p p pF
(3) 相平衡条件: 任一物质B在各相中的化学 势相等,相变达到平衡
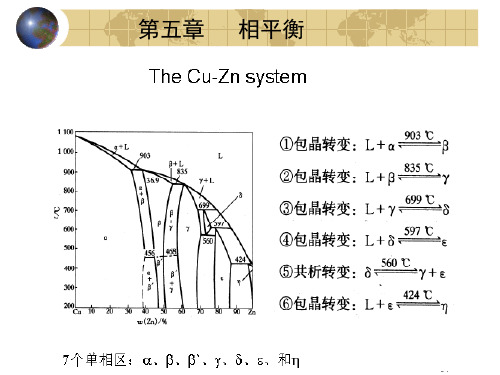
第五章 相平衡(10个)

第五章 相平衡一、本章基本要求1.掌握相、组分数和自由度的意义。
2.了解相律的推导过程及其在相图中的应用。
3.了解克劳修斯-克拉珀龙方程式的推导,掌握其在单组分两相平衡系统中的应用。
4.掌握各种相图中点、线及面的意义。
5.根据相图能够画出步冷曲线,或由一系列步冷曲线绘制相图。
6.掌握杠杆规则在相图中的应用。
7.结合二组分气液平衡相图,了解蒸馏与精馏的原理。
8.对三组分系统,了解水盐系统的应用,相图在萃取过程中的应用及分配定律的应用。
二、 基本公式和内容提要(一)基本公式相律的普遍形式:f K n =-Φ+ 克拉珀龙方程:mm d ln d V T H T p ∆∆= 克劳修斯-克拉珀龙方程的各种形式:微分式: 2m vap d ln d RT H T p ∆= vap m H ∆与温度无关或温度变化范围较小vap m H ∆可视为常数, 定积分:vap m 211211ln ()H p p R T T ∆=- 不定积分式:vap mln H p C RT ∆=-+ 特鲁顿规则:K)J/(mol 88b mvap ⋅≈∆T H杠杆规则:以系统点为支点,与之对应的两个相点为作用点,有如下关系:1122()()n x x n x x -=-其中n 1 、n 2 分别表示平衡两相的摩尔数,x 、x 1、x 2分别表示系统的组成及其对应的平衡两相的组成。
(二)内容提要1.单组分系统 单组分系统相律的一般表达式为:f =1-Φ+2=3-Φ图5-1 水的相图可见单组分系统最多只能有三相平衡共存,并且最多有两个独立变量,一般可选择温度和压力。
水的相图为单组分系统中的最简单相图之一。
图5-1中三条曲线将平面划分成固、液及气相三个区。
单相区内f =2。
AB 、AD 和AE 分别表示气液、气固和固液两相平衡线。
两相共存时f =1。
虚线AC表示应该结冰而未结冰的过冷水与水蒸气平衡共存。
A 点为三相点,这时f =0,水以气、液、固三相共存。
5.相平衡

解:
p2 ∆ vap H m 1 1 ln = ( − ) p1 R T1 T2
ቤተ መጻሕፍቲ ባይዱ
R′ = 1 R′ = 0
4
例如,CaCO3(s)的分解
CaCO 3 (s) ƒ CaO(s) + CO 2 (g)
C = S − R − R′
R′— 除一相中各物质的摩尔分数之和为1这个关系 外的不同物种的组成间的独立关系数。 (ii) 当把电解质在溶液中的离子亦视为物种时,由电 中性条件带来的同一相的组成关系。 例如,在HCN的水溶液中,有五个物种H2O、OH-、 H+、CN-和HCN
状态1:µ α = µ β
β = G Gm α m
当φ = 2时 两相平衡
{p}
f =1
状态2:
α β β + d = + d G Gm Gm Gm α m
αƒβ 2
(T+dT,p+dp) 1 αƒβ {T}
17
dG = dG
α m
β m
1.克拉佩龙方程式
dG = dG
α m β m
dG = − SdT + Vdp
15
最多有一种固体水合物与水溶液、冰共存。
5.2 单组分系统
C =1 f = C −φ + 2
f = 3 −φ
当φ = 1时 单相 f = 2 双变量系统 f = 1 单变量系统 f = 0 无变量系统
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
体系的组分数可用下式表示:
组分数=物种数-独立的化学平衡数-独立的浓度限制条件
定义: K S R R
注:浓度限制条件要在同一相中方能应用,不同相间不 存在浓度限制条件。
CaCO3(s)=CaO(s)+CO2(g) R’=0
210020年7月
多相体系平衡的一般条件
在一个封闭的多相体系中,相与相之间可以有热 的交换、功的传递和物质的交流。对具有φ个相体系 的热力学平衡,实际上包含了如下四个平衡条件:
物理化学
第四章 相平衡
温州医学院药学院
化 学 教研室
版权所有:温州医学院药学院化学教研室
2020年7月18 Copyright © 2004 Chemistry Department of School of Pharmacy, WZMC All rights
1
reserved.
物理化学—第四章
22020年7月
Gibbs 提出,所以又称为Gibbs相律。如果指定 温度或指定压பைடு நூலகம்,上式应改为:
f K 1
216020年7月
第二节 单组分体系的相图 相点
表示某个相状态(如相态、组成、温度等 )的点称为相点。
217020年7月
物系点
相图中表示体系总状态的点称为物系点。 在T-x图上,物系点可以沿着与温度坐标平行的 垂线上、下移动;在水盐体系图上,随着含水 量的变化,物系点可沿着与组成坐标平行的直 线左右移动。
当体系中有化学平衡存在,例如:HI(g),H2 (g) , I2 (g),三种物质构成的体系中,存在下列化学平衡:
2HI(g)=H2 (g)+I2 (g) ,体系中S=3但K=2
因为三个物质中某一物质可以由其它两个物质经化 学反应产生,因此K=2。同理,如果体系中有R个化学 平衡并且是独立的,则组分数就比物种数少R个,即 K=S-R
水的相图
C A
法使气体液化。
水f
冰
P
OB 是气-固两相平衡线,即冰的
O D
升华曲线,理论上可延长至0 K
218020年7月
单相区,物系点与相点重合;两相区中,只 有物系点,它对应的两个相的组成由对应的相 点表示。
219020年7月
单组分体系的相数与自由度
K 1
f 3
当 = 1 单相
f 2 双变量体系
当 = 2 两相平衡
f 1 单变量体系
当 = 3 三相共存
f 0 无变量体系
单组分体系的自由度最多为2,双变量体
213020年7月
(4)化学平衡条件:化学变化达到平衡
BB 0
B
214020年7月
相律 (phase rule)
相律是相平衡体系中揭示相数 ,独立组分
数K和自由度 f 之间关系的规律,可用公式表示 为:
f K 2
215020年7月
f K 2
式 中 2 通 常 指 T,p 两 个 变 量 。 相 律 最 早 由
(1)热平衡条件:设体系有 , , … 个相,达到平衡 时,各相具有相同温度
T T ….. T .
211020年7月
(2) 压力平衡条件:达到平衡时各相的压力相等
p p … pFφ
212020年7月
(3)相平衡条件: 任一物质B在各相中的化学势 相等,相变达到平衡
B
B
…
B
28020年7月
在某些情况下还有一些特殊的浓度限制条件
例如,上述体系中如果反应前只有HI(g),达到 化学平衡时,按照化学反应计量式,所产生的H2 (g) 与I2 (g)的单位物质量之比为1:1,这就是浓度 限制条件。所以这个体系的组分数为1,即为单组 分体系。
NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g) R’=2
三条两相平衡线 在两相平衡线上, 2,f 1
冰 P
O D
q 水蒸气 B
273.16
T /K
压力与温度只能改变一个,指定了压力,则温 度由体系自定。
222020年7月
OA 是气-液两相平衡线,即水的蒸气压曲线。它不能
任意延长,终止于临界点A,这时气-液界面消失。
临界点: T 647 K , p 2.2107 Pa 高于临界温度,不能用加压的方 p/Pa
系的相图可用平面图表示。
220020年7月
水的 相图 是根 据实 验绘 制的
水的相图
p / Pa
C 水的相图
水f
冰
P
610.62
O
D
q
B
水蒸气
273.16
A T /K
221020年7月
水的相图
图上有:
p / Pa
三个单相区 气、液、固
水的相图
C A
水f
在单相区内,K 1, f 2 温度和压力独立地有限度地 变化不会引起相的改变。
第四章 相平衡
1、引言 2、相律 3、单组分体系 4、完全互溶双液体系 5、简单低共熔相图 6、三组分体系的相图
23020年7月
引言
相平衡是热力学在化学领域中的重要应用之一 。研究多相体系的平衡在化学、化工的科研和生产 中有重要的意义,例如:溶解、蒸馏、重结晶、萃 取、提纯及金相分析等方面都要用到相平衡的知识 。 相图(phase diagram) 表达多相体系的状态如 何随温度、压力、组成等强度性质变化而变化的图 形,称为相图。
25020年7月
相(phase):体系内部物理和化学性质完全均匀的 部分称为相。相与相之间在指定条件下有明显的界 面,在界面上宏观性质的改变是飞跃式的。体系中
相的总数称为相数,用 表示。
气体,不论有多少种气体混合,只有一个气相。 液体,按其互溶程度可以组成一相、两相或三相共存。
固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
24020年7月
自由度(degrees of free确do定m平)衡体系的状态所必须的独立强度变量的 数目称为自由度,用字母 f 表示。这些强度变量通 常是压力、温度和浓度等。
如果已指定某个强度变量,除该变量以外的其 它强度变量数称为条件自由度,用 f * 表示。
例如:指定了压力, f * f 1 指定了压力和温度, f ** f 2
26020年7月
第一节 相律
表示平衡体系中所含的化学物质数称为“物种 数”,用符号S表示
足以表示体系中所有各相组成所需的最少物 种数,称独立组分数或简称组分数(number of component),用符号K表示
27020年7月
物种数和组分数为两个不同的概念
不存在化学反应时,物种数和组分数相同
