金属及其化合物-归纳与整理_PPT
金属及其化合物ppt

(4)与氧化性酸的反应 与氧化性酸的反应
∆ Cu+2H2SO4 (浓)= CuSO4+SO2↑+2H2O ∆ 2Fe + 6H2SO4(浓) = Fe2(SO4)3 + 3SO2↑+6H2O
∆ Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O ∆ 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O 常温下, 浓硝酸可用铁槽车或铝槽车运输, 常温下,浓硫酸、浓硝酸可用铁槽车或铝槽车运输, 这是因为常温下,浓硫酸可使铁或铝的表 面生成一层致密的氧化膜,阻止了内部金 属与浓硫酸进一步反应,这种现象叫做 ——钝化。 钝化。 钝化
(3)与非氧化性酸的反应 与非氧化性酸的反应
Mg + 2HCl = MgCl2 + H2↑ 2Al + 6HCl = 2AlCl3 + H2↑ Fe + H2SO4 = FeSO4 + H2↑ K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 金属活动顺序中, 以后的金属不与盐酸、 以后的金属不与盐酸 金属活动顺序中,H以后的金属不与盐酸、稀硫酸反应 但是和稀硝酸反应,原因是:硝酸具有强氧化性 但是和稀硝酸反应,原因是:硝酸具有强氧化性
思考与讨论
• 金属的冶炼有哪些方法 这些方法与金属活 金属的冶炼有哪些方法?这些方法与金属活 泼性有关吗? 泼性有关吗
3.金属的冶炼 金属的冶炼
• 活泼金属:K、Ca、 Na、Mg、Al用电解法。 活泼金属: 、 、 用电解法。 、 、 用电解法 用还原剂法。 • 较活泼金属:Zn、Fe、Sn 、Pb、Cu用还原剂法。 较活泼金属: 、 、 、 用还原剂法 • 不活泼金属:Hg、Ag、Pt、Au用加热法 不活泼金属: 、 、 、 用加热法
金属元素及其化合物精品PPT课件

NH4+ + H2O
NH3·H2O + H+
Mg + 2H+ NH4+ + Mg
Mg2+
+ H2 ↑
NH3 ↑ + Mg2+ + H2 ↑
4.金属的重要化合物 ①氧化物 举例常见的碱性氧化物、两性氧化物、酸性氧化物、过氧化物。 过氧化物是金属阳离子与过氧根离子结合成的化合物。 ②氢氧化物 金属对应的氢氧化物通常是碱,极少数为两性。 极活泼金属的氢氧化物能溶于水,性质稳定,很难分解,如氢氧化钠、
氢气。 ⑶Al、Fe遇浓硝酸、浓硫酸,在常温下发生钝化。 ⑷Cu→Ag和氧化性酸发生氧化还原反应,但不生成氢气。 ⑸Pt→Au只能和强氧化性混酸(王水)发生氧化还原反应。
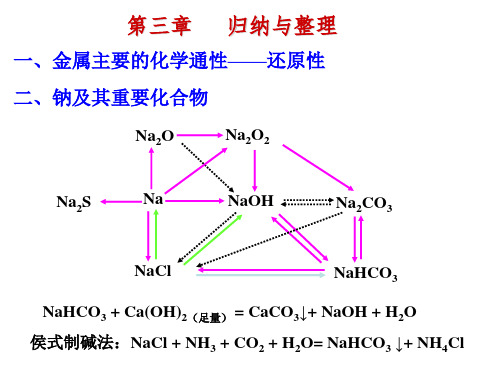
第二节 钠及其化合物
1.钠单质 ①物理性质 银白色金属光泽;质软;熔沸点低;密度为0.97g/cm3,比煤油大,比
水小;导电导热性能良好。
在金属活动性顺序中位于氢前的金属与非氧化性酸(如盐酸、稀硫酸) 作用,发生置换反应,生成盐和氢气;与氧化性酸(如硝酸、浓硫酸)
反应不放出氢气。大多数金属在加热条件下能与浓硫酸发生反应,如:
Δ
Cu + 2H2SO4(浓)
CuSO4 + SO2 ↑ + 2H2O
除个别金属如Au、Pt外的几乎所有金属在常温下都能与硝酸反应,例如:
NaOH溶液浓度增大,并放出氢气;溶液中NaOH的质量分数不变,有氢 气放出;溶液的总质量减少,有氢气放出;钠浮于液面,到处游动, 发出嘶嘶的响声。
⑶与酸反应 钠与酸反应,实质上是与酸电离出的H+反应,所以比与水反应更剧烈。
点最高的是钨(3413℃),最低的是汞(-39℃ ) ②化学通性 ⑴与非金属单质反应 a.大多数金属都能与大多数非金属在常温或加热的条件下直接化合形
人教版高中化学必修1:第三章金属及其化合物_归纳与整理_课件7(1)

Δ铁三角:
FeCl2
Fe(OH)2
强氧化剂(如Cl2、O2、HNO3)
Fe2+
Fe3+
还原剂(如Fe粉)
还原剂(如Al) 弱氧化剂
强氧化剂
(如S、I2)
Fe3+遇SCN一显红色, 可利用这一反应来检验Fe3+ 的存在。
Fe
铁的氢氧化物
名称
氢氧化亚铁
氢氧化铁
化学式
Fe(OH)2
物理性质 难溶于水的白色絮状沉淀
CO2 ↑ +H2O
反应速率:Na2CO3 < NaHCO3
热稳定性
Na2CO3受热不分解, 很稳定。
Δ
2NaHCO3 = Na2CO3
+ H2O +CO2 ↑(易分解)
可用热稳定性来鉴别Na2CO3与NaHCO3 。
四、铝及其化合物的相互关系: AlCl3
Al
Al2O3
Al(OH)3
KAl(SO4)2•12H2O
NaAlO2
Al2O3 、Al(OH)3既可与强酸反应生成盐和水,又可 与强碱反应生成盐和水。是典型的两性氧化物、两性氢氧 化物。
明矾(KAl(SO4)2•12H2O)可作为净水剂。
五、铁及其重要化合物、Fe2+与Fe3+的关系,
Fe3+的检验方法。
Fe2O3
Fe3O4
Fe
FeCl3
Fe(OH)3
NaCl
Na
NaOH
Na2CO3
NaHCO3
Na2O2
Na2CO3•10H2O
2Na2O2 + 2H2O = 4NaOH + O2 ↑ 2Na2O2 + 2CO2= 2Na2CO3 + O2 焰色反应:Na→黄色,K→紫色(透过蓝色钴玻璃)
人教新课标版高一必修一第三章 金属及其化合物归纳与总结课件

4Na + O2 = 2Na2O
加热
2Na + O2 === Na2O2 淡黄色、供氧剂、强氧化性、漂白性 2Na2O2 + 2H2O = 4NaOH + O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2
(2)铝与氧气的反应: 2Al + 3O2 === 2Al2O3 金属表面氧化膜的形成和作用 其它金属与氧气的反应情况 金属与其它非金属单质的反应 金属元素在形成化合物时所显的价态
金属材料的基本元素是金属。因此, 金属材料具有高强度、优良的塑性和韧性, 耐热、耐寒,可铸造、锻造、冲压和焊接, 还有良好的导电性、导热性和铁磁性,因 此是一切工业和现代科学技术中最重要的 材料。
本节小结 一、金属的性质
二、金属的化合物
三、正确选择金属材料
(2)Al(OH)3既能溶于酸又能溶于强碱溶液
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O
(3)不稳定性 ∆ 2Al(OH)3 == Al2O3+3H2O 在金属活动顺序表中,只有K、Ca、Na的氢氧 化物可溶于水(其对应的氧化物可与水化合),
热稳定性好,其它金属的氢氧化物均难溶于水
(其对应的氧化物不能与水化合) ,且受热易 分解生成金属氧化物和水。
4、三价铁的氧化性 (1)Fe3+检验 反应的离子方程式: Fe3++SCN-=[Fe(SCN)]2+(血红色 )
人教版高中化学必修一 《第三章 金属及其化合物》物知识点总结课件(共22张PPT)

2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
_过__氧化物
11
▪ Al2O3 —— 两性 酸:Al2O3+__6HCl =____2_A__lC__l3_+_3_H__2O___; 碱:Al2O3+__2NaOH =___2_N__a_A_l_O_2_+_H__2O___;
金属氧化物
碱性氧化物
金属
两性氧化物
氧
氧化物 其它氧化物:过氧化物
化
物 非金属 酸性氧化物
氧化物 其它氧化物
2020/7/11
10
颜色状态 氧元素价态 生成条件
Na2O 白色固体
-2价 常温
Na2O2 淡黄色固体
-1价 加热
与水反应 与CO2反应
特性
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3
2020/7/11
8
(5)与盐溶液的反应 Na与CuSO4溶液反应的化学方程式:
2Na + CuSO4 + 2H2O = Na2SO4 + Cu(OH) 2 ↓+ H2 ↑
注意:活泼金属与盐溶液反应时,首先与水反 应,然后与盐反应。
Fe + CuSO4 = FeSO4 + Cu
2020/7/11
9
有金属光泽、易传热、易导电,有延展性、可塑性, 常温下除汞(液态)以外都是固体 。
金属原子的最外层电子排布特点:
金属原子最外层电子数较少,易失去最外层电子。
有还原性
2.金属的化学性质
金属与非金属、水、酸、盐等反应
金属及其化合物归纳总结

第三章金属及其化合物归纳与整理及练习《金属及其化合物》主要内容:第一节:金属化学性质:一、金属与氧气反应(钠、镁、铝、铁)二、金属与水反应(钠与水、铁与水)三、金属与酸反应(铁、铝、镁与盐酸)四、铝与氢氧化钠反应五、金属与盐反应(铁与氯化铁、铜与氯化铁、硝酸银)第二节:几种重要的金属化合物:一、氧化物(Na2O、Na2O2、MgO、Al2O3、Fe2O3、CuO)二、氢氧化物(NaOH、 Al(OH)3、Mg(OH)2、Fe(OH)3、Fe(OH)2、Cu(OH)2)三、盐(Na2CO3与NaHCO3、铝盐及偏铝酸盐、铁盐及亚铁盐)四、焰色反应(操作步骤、钠钾的焰色反应)第三节:用途广泛的金属材料:一、常见合金的重要应用(铜合金、铁合金、铝合金)二、正确选用金属材料。
[归纳整理]一、钠及重要化合物之间的转化关系1、钠 (1)与氧气反应: (2)钠与水的反应:2、氧化物与过氧化钠:Na2O+H2O— Na2O+CO2— Na2O+HCl— Na2O2+H2O— Na2O2+CO2—3、碳酸钠与碳酸氢钠(1)在水中的溶解性:(2)受热分解:(3)与盐酸反应:(4)相互转化:[例题]例1、用1L1.0mol/LNaOH溶液吸收0.8molCO2,所以溶液中的CO32-,HCO3-的物质的量浓度之比为_____。
例2、200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应,反应后固体的质量增加了3.6g。
则原混合气体的平均式量为A.5.8 B.11.6 C.23.2 D.46.4 [练习]1、金属钠露置在空气中,在其表面不可能生成的物质是A.Na2O B.NaOH C.Na2CO3D.NaCl2、下列叙述中正确的是A.Na2O与Na2O2都能与水反应生成碱,它们都是碱性氧化物B.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2C.Na2O有氧化性,Na2O2只有还原性D.Na2O能继续被氧化成Na2O2,Na2O2比Na2O稳定3、用于呼吸用具上和潜水艇中作为氧气的来源的物质是A.Na2O2B.NaHCO3C.H2O2D.KMnO44、除去小苏打溶液中少量苏打的方法是A.加热B.加NaOH C.通CO2气体D.加盐酸5、关于Na2CO3和NaHCO3性质的有关叙述正确的是A.在水中溶解性:Na2CO3<NaHCO3B.热稳定性:Na2CO3>NaHCO3C.与酸反应的速度:Na2CO3<NaHCO3D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO36、现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当应物只有CaCO3固体,6摩尔/升,盐酸和蒸馏水).请填写下列空白:(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式______________。
第三章 金属及其化合物 归纳与整理 课件(新人教版必修1)
Al
H+
OH-
Al3+ H+ Al2O3 OH- AlO2
H+
OH-
Al(度的硫酸、氢氧化钠溶液分别 放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比 是5:6,则甲、乙两烧杯中的反应情况可能分别是( B ) A甲、乙中都是铝过量
B.甲中铝过量、乙中碱过量
△ O Ca(OH)2 、2NH4Cl Ca(OH)2 CaCl2 2NH3 2H2O
(4)“侯氏制碱法”与“索尔维法”相比较,其优点是 _______N_a_C__l被__充__分__利__用__,___N_H__4C__l可__作__氮__肥__和__其__它__工__________ _______业___原__料__,__不__产__生__用__途__较__小__的__C_a_C_l_2_等__废__渣__,__降。
C.甲中酸过量、乙中铝过量
D.甲中酸过量、乙中碱过量
从定性和定量的角度理解铝与酸、碱反应的实质
2Al + 6H+ = 2Al3+ + 3H2↑ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
①等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积比VVNHaOClHHH22=1∶1。
②足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比VVNHaOClHHH22=1∶3。
③一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,产生氢气的体积比13<VVNHaOClHHH22<11, 则必定是 a.铝与盐酸反应时,铝过量而盐酸不足;b.铝与氢氧化钠反应时,铝不足而氢氧化 钠过量。解题时应充分利用上述过量关系。
金属及其化合物精品课件

安徽省贵池中学 赵 伟
第三章 金属及其化合物
地壳中元素含量示意图
氧 在地壳中含量最多的元素是:
在地壳中含量最多的金属元素是: 铝
第一节 金属的化学性质
金属的物理性质:
1.固态(除Hg外) 3.易导电 5.延展性 2.有金属光泽 4.易导热 6.熔点较高
金属的化学性质:
1.金属与盐反应 2.金属与酸反应 3.金属与非金属反应
一.金属与非金属的反应
钠的物大于煤油的密度;
1.钠与氧气的反应:
新切开的钠的表面在空气中的变化:
2.铝与氧气的反应:
[讨论] 为什么熔化的液态 铝不滴落? [探究] 铝能燃烧吗?如果能, 该怎么做呢?
金属氧化物的利弊:
活泼金属在空气中易与氧 气反应,生有一层氧化物薄膜。 有的氧化膜疏松,不能保护内 层金属,如铁等。有的氧化膜 致密,可以保护内层金属不被 继续氧化,如铝、镁等。
3. 镁与氧气的反应:
2Mg + O2 === 2MgO
点燃
4. 铁与氧气的反应:
3Fe + 2O2 === Fe3O4
(纯氧)
点燃
小结: 金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序表里,金属的位置 越靠前,它的活动性就越强。 在金属活动性顺序表里,从左到右, 金属与氧气反应,条件不同,产物也不 同,规律如下:
活泼金属容易与氧气反应,常温时生成 正常价态氧化物,加热时生成复杂氧化物。 如K、Na
较活泼金属在加热或点燃条件下与氧气 可以发生反应。如Mg、Al、Fe 不活泼金属难与氧气反应。如Ag、Au
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在自然界中金属多以化合态存在, 只有极少 数金属(如:金、铂)以游离态存在。
一.金属的化学性质:
金属 金属原子 失电子趋势 与氧气的作用
与水的作用
与酸的作用
Na
Al
Fe Cu
大
小
易被氧化 常温时能被氧化
加热时 能被氧化
常温时 强碱溶液 加热时与 不反应 置换出H2 里反应 水蒸气反应
二.金属氧化物的化学性质
1.金属氧化物与水的反应
规律:
金属氧化物+水→碱 条件:碱必须可(微)溶
K2O + H2O = 2KOH Na2O + H2O = 2NaOH BaO + H2O = Ba(OH)2 CaO + H2O = Ca(OH)2
1) 过氧化钠与水反应: 实验现象: ①酚酞溶液变红 ②有气泡产生
Fe3++Fe=3 Fe2+ 2Fe3++2I-=2Fe2++I2
六.焰色反应
钠
(呈黄色)
钾(透过蓝色钴 玻璃呈紫色)
钙
锶
钡
铜
銣
=3Fe(OH)3
+3NaCl
4Fe(OH)2 +O2+2H2O= 4Fe(OH)3
2.Fe(OH)2和Fe(OH)3与酸反应 Fe(OH)2+2HCl=FeCl2+2H2O
Fe(OH)3+3HCl=FeCl3+3H2O 3.氢氧化铁的不稳定性 2Fe(OH)3=Fe2O3+3H2O
这是难溶碱的共性——受热分解。
2Na + O2 =(==淡N黄a色2O固2 体)
现象: 切口处银白色的金属光泽,在空气 中很快变暗
钠的保存:保存在煤油或石蜡油中
思考:1、为什么钠要保存在煤油里?
钠易与空气中的氧气、水反应,钠不与煤油反应, 且密度比煤油大,保存在煤油里可以隔绝空气和水。
2、能否用手直接拿钠? 不能。因为手上有汗,汗里含有水份,钠会与 水反应。
4Al + 3 O2 ==== 常温或加热 2Al2O3
2.与水反应
浮
剧烈反应,浮在水面
熔
熔成小球
游
产生的气体推动四处游动
响
发出“嘶嘶”响声
红 滴有酚酞的溶液变红来自2Na + 2H2O == 2NaOH + H2
3Fe+4H2O(g)== Fe3O4+4H2
2Al+2NaOH+2H2O==2NaAlO2+3H2
③试管口的带火星木条复燃
2Na2O2+2H2O == 4NaOH + O2↑ 2)过氧化钠与二氧化碳反应:
2Na2O2+2CO2 == 2Na2CO3 + O2↑
2.金属氧化物与盐酸的反应
氧化物
Na2O MgO Fe2O3 CuO
固体颜色 白色
水溶性 溶
与盐酸反应的化学方程 式(注明溶液颜色)
Na2O+2HCl=2NaCl+H2O
通入CO2
2NaHCO3=Na2CO3+H2O+CO2
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+H2O+CO2= 2NaHCO3
五. 铁离子
1、Fe3+的检验
FeCl3溶液 FeCl2溶液
滴入KSCN溶液
溶液显血红色
溶液颜色无变化
Fe3++3SCN- = Fe(SCN)3
(血红色)
能置换出稀酸中的氢
不反应
与盐溶液的作 先与水
用
反应
前面的金属能将 后面的金属置换出来
Ⅰ.钠的物理性质和化学性质
物理性质:为银白色的固体,质软(硬
度小),密度比水还小,熔点较低。
化学性质:钠单质的化学性质活泼,
与氧气、水反应表现很强的还原性。
1.与氧气反应
4Na + O2 == 2Na2O (白色固体) △
4.氢氧化铝制备
用铝盐溶液和氨水 Al2(SO4)3+6NH3·H2O=2Al(OH)3 +3(NH4)2SO4 5.氢氧化铝的性质
具有两性: Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+NaOH=NaAlO2+2H2O 既能与酸起反应,又能与强碱溶液起反 应的氢氧化物叫两性氢氧化物。 6.氢氧化铝的不稳定性
白色 不溶
红棕色俗 称铁红
不溶
MgO+2HCl=MgCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O
黑色
不溶
CuO+2HCl=CuCl2+H2O
碱性氧化物:
凡能跟酸起反应,生成盐和水的氧化物 叫做碱性氧化物. 酸性氧化物:
凡能跟碱起反应,生成盐和水的氧化物 叫做酸性氧化物 。
Al2O3+6HCl=2AlCl3+3H2O
3、如果钠着火了,该如何灭火? 因为钠会与水反应,所以不能用水或湿布灭火; 因此只能用沙土来灭火。
4 、能否把钠保存在四氯化碳(CCl4)中? 不能。因为钠的密度比四氯化碳小,会浮于四氯化
碳液面之上,四氯化碳无法隔绝空气与水蒸气。
现象: 可观察到钠先熔化后燃烧,发出黄色
火焰,生成淡黄色的固体 △
2Na + O2 === Na2O2
2Al(OH)3=Al2O3+3H2O
四.碳酸钠(苏打、纯碱)和碳酸氢钠 (小苏打)的性质
1、Na2CO3和NaHCO3在水中的溶解性
溶解性: Na2CO3>NaHCO3 2、Na2CO3和NaHCO3的热稳定性 Na2CO3 :受热不分解 NaHCO3 :受热分解
2NaHCO3==Na2CO3+H2O+CO2
3、Na2CO3和NaHCO3与其它物质的反应
Na2CO3+2HCl=2NaCl+H2O+CO2
NaHCO3+HCl=NaCl+H2O+CO2
Na2CO3+Ca(OH)2=CaCO3 +2NaOH 4、Na2CO3和NaHCO3的相互转化
1 固体,加热 2 溶液,加NaOH
NaHCO3
Na2CO3
2、Fe3+的氧化性
加入
现象
铁粉, KSCN溶
液
不显血红 色
加入氯水, 溶液显血
振荡
红色
反应的化学方程式
2FeCl3+Fe= 3FeCl2
2FeCl2+Cl2= 2FeCl3
3.Fe3+与Fe2+转化
+氧化剂(Cl2)
Fe2+ +还原剂(Fe)
还原剂
Fe3+
氧化剂
2Fe2++Cl2=2Fe3++Cl2 2Fe3++Cu=2Fe2++Cu2+
Al2O3+2NaOH=2NaAlO2+H2O
既能和酸反应生成盐和水,又能和碱反 应生成盐和水的氧化物叫两性氧化物。
三.金属氢氧化物的化学性质
1.铁的氢氧化物的制备
FeCl3溶液
FeSO4溶液
加 生成红褐色 先生成白色絮状沉淀,而后迅
NaOH
速变为灰绿色,最后变为红褐
溶液 沉淀
色沉淀
化学方 程式
FeCl3+3NaOH FeSO4+2NaOH=Fe(OH)2 +Na2SO4
