低密度脂蛋白胆固醇(LDL—C)测定试剂盒(直接法—表面活性剂清除法)产品技术要求derui
日立 7180 7170 706 低密度脂蛋白胆固醇(LDL-C)检测试剂盒 说明书

说明书版本号:V1.0货号HOEM0601-01HOEM0601-02HOEM0601-03产品名称低密度脂蛋白胆固醇(LDL-C)检测试剂盒(直接法)预期用途本试剂盒用于体外测定人血清中低密度脂蛋白胆固醇(LDL-C)的含量。
低密度脂蛋白胆固醇用于冠心病和动脉粥样硬化的诊断。
动脉粥样硬化(AS)斑块中沉淀的脂质主要是低密度脂蛋白(LDL),在各类脂质中,LDL被认为是主要的致病因素,而高密度脂蛋白(HDL)可能起保护作用,血清总胆固醇(TC)大致反映LDL胆固醇(LDL-CHO)水平,但也受HDL-C水平的影响,因此在AS脂类危险因素判别中,TC偏高时,测定LDL-C有重要临床意义。
检验原理反应分两步进行:第一步:R1中聚阴离子与LDL形成复合物,在表面活性剂1作用下,不与胆固醇酶试剂反应。
而其它脂蛋白(CM,VLDL-C,HDL-C)则被酶试剂水解产生过氧化氢,在缺乏偶联剂时被消耗而不显色。
第二步:R2中表面活性剂2使LDL释放胆固醇,在胆固醇酶试剂与偶联剂作用下参与Trinder反应而显色,吸光度与样本中低密度脂蛋白胆固醇浓度成正比。
主要组成成分组成浓度试剂1(R1):Tris缓冲液100mmol/L(pH7.5)聚阴离子化合物0.5mmo1/LN-乙基-N-(2-羟基-3-磺丙基)间甲苯胺(TOOS)1mmol/L4-氨基安替比林0.5mmo1/L胆固醇酯酶800U/L胆固醇氧化酶500U/L表面活性剂适量试剂2(R2):Tris缓冲液100mmol/L(pH7.0)过氧化物酶30KU/L表面活性剂适量储存条件及有效期未开封试剂避光保存于2~8℃,有效期12个月;试剂开封后避光保存于2~8℃,在无污染情况下有效期1个月;试剂不可冰冻。
样本要求1.新鲜无溶血的血清2.样本中血红蛋白≤600mg/dL、甘油三酯≤1000mg/dL、胆红素≤20mg/dL时未观察到明显干扰。
3.稳定性:2~8℃保存可稳定7天。
低密度脂蛋白胆固醇

低密度脂蛋白胆固醇( LDL- C ) 测定1 .原理:1 . 1 方法学:化学选择抑制法(直接法)。
1 .2 方法原理:本方法以液体双试剂形式反应,Rl 中含聚阴离子,样本加入后,聚阴离子选择性地庶蔽LD L 血清中HDL、VLDL及CM在表面活性剂作用下与酶试剂产生不完整的Trinder反应,反应中产生的H2O2在缺乏偶联剂时被消耗而不显色。
当加入R2时,含对LDL有特异作用的表面活性剂能水解LDL,释放出其胆固醇,参与完整的Trinder反应,测定578nm处的吸光度与LDL-C成正比。
BK-300系统生化仪器会自动的将适量的试剂及样本加入反应管( cuvette )中。
机器会自动侦测578nm 吸光度的改变,吸光度的改变直接与低密度脂蛋白胆固醇的浓度成正比。
2 .样本:2 . 1 病人准备:病人应处于安静、呼吸稳定的状态,穿刺时应尽量减少病人的疼痛感。
坐位与卧位、睡眠后与清醒时、运动后与进餐后都会产生不同的结果。
2 . 2 样本种类:生物学的体液样本应该以同样的方式来收集,以便用来测试任何实验室中的试验。
新鲜的、刚被抽出的血清或血浆样本是最佳的选择。
2 .3 样本采集:除非是卧床的病人,一般在静脉采血时取坐位。
体位影响水分在血管内外的分布,因此影响测定水平。
故在采血前至少应静坐5min 。
一般从肘静脉取血,使用止血带的时间不超过lmin ,穿刺成功后立即松开止血带。
采血前24 小时禁食高脂,最好12 小时禁食。
(详见本科制定的静脉采血SOp 文件)2 . 4 样本接收:接收标本时应检查标本是否符合要求(要求封密、无溶血、无杂物)、所用试管是否正确、试管标签是否填写完整、并询问采血时间,对不合格标本应退回重采,并填写记录。
2 . 5 样本保存:2 . 5 . 1 采血管应该一直保持垂直、塞住的姿势。
血清或血浆应该立即被分离,防止溶血,避免接触到血球部分。
从采血到上机的最长时间限制是2 小时。
小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒(过氧化物酶法)产品技术要求百奥泰康

小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒(过氧化物酶法)产品技术要求百奥泰康预览说明:预览图片所展示的格式为文档的源格式展示,下载源文件没有水印,内容可编辑和复制小而密低密度脂蛋白胆固醇(sd LDL-C)测定试剂盒(过氧化物酶法) 适用范围:该产品用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:Tris 缓冲液 100mmol/L胆固醇酯酶(CHE) 1600U/L胆固醇氧化酶(CHO) 600U/L磷脂酶 2700U/L过氧化氢酶 1200U/L2-羟基-3-间甲苯胺丙磺酸钠 2mmol/L试剂2:Tris 缓冲液 100mmol/L过氧化物酶(POD) 5000U/L4-氨基安替比林4mmol/L1.2.2校准品的组成校准品为冻干品,校准品组成是在磷酸盐缓冲液中加入含一定浓度的小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
1个水平校准品目标浓度为1.1 mmol/L(42.5 mg/dL),浓度有批特异性,具体定值详见瓶签。
1.2.3质控品的组成两水平冻干质控品,在20g/L牛血清中加入小而密低密度脂蛋白胆固醇纯品,稳定剂<5%。
靶值范围分别为:0.259 ~ 1.036 mmol/L (10.0~40.0 mg/dL)、1.036 ~2.072 mmol/L(40.0~80.0 mg/dL)。
2.1 外观试剂1 为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂2 为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度试剂空白吸光度应≤0.1。
2.4 分析灵敏度浓度为2.59 mmol/L(100.0 mg/dL)时,吸光度变化应≥0.05。
上虞市创烨生物 低密度脂蛋白胆固醇(LDL-C)测定试剂盒 说明书
网址:邮箱:****************低密度脂蛋白胆固醇(LDL-C)测定试剂盒使用说明书【简介】用于全自动生化分析仪测定人体血清低密度脂蛋白胆固醇含量。
动脉粥样硬化(AS)斑块中沉淀的脂质主要是低密度脂蛋白(LDL-C),在各类脂质中,LDL-C被认为是主要的致病因素,而高密度脂蛋白(HDL-C)可能起保护作用,血清总胆固醇(TC)大致反应LDL胆固醇(LDL-C)水平,但也受HDL-C水平的影响,因此在AS脂类危险因素判别中,TC偏高时,测定LDL-C 有重要临床意义。
【测定方法】直接清除法【测定原理】第一步,试剂Ⅰ中的多聚体和非离子表面活性剂与LDL结合,选择性地抑制LDL与胆固醇酶试剂反应,而胆固醇氧化酶(C0)和胆固醇酯酶(CE)与非 LDL脂蛋白(HDL,VLDL,CM)中的胆固醇反应,由于缺乏一个色源,Trinder反应不显色。
第二步,LDL-C与胆固醇酶试剂反应而显色。
【试剂盒组成】规格组份浓度试剂液体双试剂试剂Ⅰ:试剂Ⅱ=3:14-氨基安替比林、TOOS、工具酶等适量LDL-C校准品冻干1ml LDL-C等见标签【样本要求】标本应空腹抽取,尽快分离血清,在冷藏(2-8℃)条件可稳定1周。
标本如不能及时测定,应于-20℃保存,避免反复冻融。
【测定步骤】1.本试剂为液体双试剂,可直接使用。
2.测定参数:波长:546nm;光径:10mm;温度:37℃。
3.测定方法:加入物空白管标准管测定管试剂Ⅰ300 300 300 蒸馏水(uL) 3 - - 标准液(uL) - 3 -样本(uL) - - 3混匀,置37℃孵育5分钟,读取各管吸光度A1试剂Ⅱ(uL)100 100 100 匀,置37℃保温5分钟,读取各管吸光度A2,计算ΔA=A2-A14.上机参数:温度 37℃血清+R1反应时间 300秒样本量 3uL 主波长 546nm试剂Ⅰ 300uL 副波长 660nm试剂Ⅱ 100uL血清+R1+R2反应时间 300秒5.计算:LDL-C含量(mmol/L) = [(ΔA标本-ΔA空白)/ (ΔA标准-ΔA空白)] ×校准品值网址:邮箱:****************【性能指标】1、空白吸光度≤0.05;2、线性范围0-12.9mmol/L;3、批内/分析内精密度CV≤5%;批间相对极差≤7%;4、准确性相对偏差不超过±10%。
低密度脂蛋白胆固醇测定试剂盒技术审评规范

低密度脂蛋白胆固醇测定试剂(盒)技术审评规范(2014版)一、前言本审评规范旨在指导注册申请人对低密度脂蛋白胆固醇测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对低密度脂蛋白胆固醇测定试剂(盒)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本审评规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本审评规范。
本审评规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本审评规范相关内容也将适时进行调整。
二、适用范围低密度脂蛋白胆固醇测定试剂(盒)用于体外定量测定人血清和/或血浆中的低密度脂蛋白胆固醇的含量。
从方法学考虑,本文主要指采用分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行低密度脂蛋白胆固醇定量检验所使用的临床化学体外诊断试剂。
本规范不适用于干式低密度脂蛋白胆固醇测定试剂(盒)。
依据《体外诊断试剂注册管理办法(试行)》(以下简称《办法》)低密度脂蛋白胆固醇测定试剂盒管理类别为Ⅱ类,分类代号为6840。
三、基本要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《体外诊断试剂注册申报资料基本要求》(国食药监械〔2007〕609号)的相关要求。
下面着重介绍与低密度脂蛋白胆固醇测定试剂(盒)预期用途有关的临床背景情况。
低密度脂蛋白(LDL)是富含胆固醇(CHO)的脂蛋白,是动脉粥样硬化的危险性因素之一,LDL经过化学修饰后,其中的apoB-100变性,通过清道夫受体(scavenger receptor)被吞噬细胞摄取,形成泡沫细胞并停留在血管壁内,导致大量CHO沉积,促使动脉壁形成动脉粥样硬化斑块(atheromatous plaque),故LDL为致埃及粥样硬化的因子。
3种低密度脂蛋白胆固醇均相测定方法的评价

3种低密度脂蛋白胆固醇均相测定方法的评价胡进访;吴雁;魏慧敏【期刊名称】《天津医科大学学报》【年(卷),期】2004(10)2【摘要】目的:对表面活性剂清除法(SUR法)、可溶性反应法(SOL法)和过氧化氢酶清除法(CAT法)3种低密度脂蛋白胆固醇(LDL-C)均相测定方法进行评价.方法:3种均相法与聚乙烯硫酸盐(PVS)沉淀法、Friedewald公式计算法进行比较,分析各自的精密度、准确性、特异性和干扰因素.结果:3种均相法均具有较好的精密度(批内、批间、总变异系数均<3.2%),3种均相法线性范围均可达10.22 mmol/L,最低检测浓度为0.02~0.03mmol/L,回收率为98.4%~101.9%.3种均相法与PVS法、Friedewald公式计算法相关良好(相关系数为0.924 6~0.9974).高密度脂蛋白(<4.12 mmol/L)、血红蛋白(<2 g/L)、甘油三酯(<11.4 mmol/L)、胆红素(<200 mg/L)对3种均相法的检测无影响,而CAT法受高TG、高血红蛋白、高胆红素影响均较小.结论:3种LDL-C均相测定法简便、快速、准确,适于临床实验室自动化分析.【总页数】4页(P282-284,287)【作者】胡进访;吴雁;魏慧敏【作者单位】天津市经济技术开发区医院检验科,天津,300457;天津市经济技术开发区医院检验科,天津,300457;天津市经济技术开发区医院检验科,天津,300457【正文语种】中文【中图分类】R446.1【相关文献】1.畜禽肉中高、低密度脂蛋白胆固醇含量的测定方法 [J],2.低密度脂蛋白胆固醇的直接测定方法及其评价 [J], 杨德寨3.血清低密度脂蛋白胆固醇Friedwald计算法与均相法测定结果比较 [J], 吕杨;董矜4.四种高密度脂蛋白胆固醇均相测定方法的评价 [J], 温学红;胡进访;王学谦5.低密度脂蛋白胆固醇均相测定方法研究进展 [J], 郭占军;赵华因版权原因,仅展示原文概要,查看原文内容请购买。
低密度脂蛋白胆固醇检测作业指导书

低密度脂蛋白胆固醇检测作业指导书1 检验目的规范低密度脂蛋白胆固醇(LDL-C)检测试验,确保检测结果准确性和重复性。
2 测定方法直接酶法。
3 检测原理样本与试剂1中的聚阴离子和表面活性剂的作用下,除LDL外的其它脂蛋白与胆固醇酯酶、胆固醇氧化酶等起反应被消除。
当加入试剂2后,其中的另一表面活性剂迅速发生作用并释入LDL,并在酶作用下单一催化LDL-CHOL,与4-氨基安替比林(4-AAP)和酚发生显色反应,显色深浅与血清中LDL-CHOL含量成正比。
4 样本血清、肝素或EDTA抗凝血浆,处理方法见生化标本采集程序。
5 仪器和试剂5.1 仪器:美国贝克曼-库尔特DXC800、AU5811全自动生化仪、迈瑞BS800M生化分析仪。
5.2 试剂:由武汉元景商贸公司提供原装贝克曼-库尔特试剂及迈瑞公司提供的生化试剂(详见试剂说明书),超过失效期的试剂不能使用。
5.3 校准物:Rodan混合校准品,符合WHO标准,贮存、准备严格遵照其说明书。
5.4 质控物:Rodan正常值及病理值质控品,符合WHO 标准,贮存、准备严格遵照说明书。
6 校准6.1 仪器校准:每年由该仪器维修工程师参照厂方的技术规范对仪器进行一次校准。
6.2 项目校准:试剂盒在仪器上放置稳定期后;试剂批号更换后;由质控结果随时决定。
7 操作步骤上机操作,操作程序、质量控制程序见相应生化仪操作程序。
8 参考范围2.1~3.3mmol/L。
9 警告/危急值未规定。
10 性能指标10.1 线形上限:10mmol/L。
10.2 精密度:≤5%。
10.3 准确度:不准确度≤10%。
10.4 试剂贮存:密闭避光贮存2~8℃可稳定12个月。
11 干扰因素及变异的潜在来源11.1 溶血会产生干扰。
11.2 TG 6mmol/L,Hb 9.2g/L及胆红素116µmol/L均不影响实验结果。
12 临床意义LDL-C是判断高脂血症、预防动脉粥样硬化的重要指标;其水平更能说明胆固醇的代谢状况,LDL-C水平与冠心病发病率呈正相关。
LDL-C文档,低密度脂蛋白胆固醇测定试剂盒(LDL-C)检测标准操作规程

1、方法依据:深圳迈瑞生物医疗电子股份有限公司低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法)检测方法 2、适用范围:适用于人血清或血浆低密度脂蛋白胆固醇(LDL-C)的测定。
3、试剂仪器:3.1 试剂:深圳迈瑞生物医疗电子股份有限公司原装试剂盒。
3.2 试剂储存:2℃~8℃保存有效期为一年。
试剂开瓶后应避光保存,在2℃~8℃可稳定28天。
试剂不可冰冻。
3.3 仪器:迈瑞BS-2000M 全自动生化分析仪. 4、操作程序4.1方法原理本试剂盒为均相方法,省去离心步骤直接检测LDL-C 。
在反应第一步,LDL 被选择性保护,而非LDL 脂蛋白被酶处理。
第二步中,LDL 被释放,由胆固醇酶法显色反应选择性地测定出LDL-C 。
(1) HDL,VLDL,和乳糜微粒胆甾烯酮+ H 2O 22H 2O 2 2H 2O + O 2 (2) LDL 胆甾烯酮 + H 2O 2H 2O 2 + TOOS + 4-氨基安替比林 醌亚胺染料4.2样本要求新鲜血清或血浆,采集后及时测定,应避免溶血和污染。
血清在2℃~8℃可保存5天。
CHE+CHOPOD过氧化氢酶 CHE+CHO4.3上机操作4.3.1试剂装载、校准、样品和质控血清分析操作详见“《迈瑞BS-2000M全自动生化分析仪标准操作、维护、保养规程》”。
4.3.2 校准:4.3.2.1 标准液的准备:校准品使用迈瑞医疗国际股份有限公司配套冻干品,按说明书要求稀释后分装,-20℃冷冻保存,用前提前15分钟从冰箱中取出,复溶到室温后上机检测。
4.3.2.2 校准程序:首次使用校准。
当有以下情况时需重新校准:1)换试剂批号或出现质控漂移时;2)当仪器做完保养后;3)仪器进行零件更换时。
每次试验前用准备好的校准品进行校准,校准通过后进行检测。
4.3.2.3 质控:在标本开始之前做质控,质控通过后方能进行标本的检测。
4.3.3 测试基本参数4.4参考范围0~4.11 mmol/L (注:各实验室应有自己的参考范围。
小而密低密度脂蛋白胆固醇

Any hardcopy, printed or photocopied, is considered an uncontrolled copy, unless it is the original, signed-off version 记录改版或修订需更改的内容:1检验目的规范小而密低密度脂蛋白胆固醇(sdLDL-C)的检测试验,确保检测结果的准确性和重复性。
2检验项目方法和原理2.1方法:直接清除法2.2原理:小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒采用的测定方法为直接清除法:试剂I中的聚阴离子和抗人高密度脂蛋白抗体选择性地抑制sdLDL以外的脂蛋白,适量的非离子表面活性剂在胆固醇氧化酶(CO)和胆固醇脂酶(CE)、过氧化氢酶存在下消除非sdLDL脂蛋白中的胆固醇。
剩余的sdLDL-C与胆固醇酶试剂反应而显色。
3标本要求3.1原始样本类型:血清。
3.2标本容器:真空采血管中的红盖管。
添加剂为促凝剂。
3.3标本保存和运送:室温保存,及时送检。
15-25℃可稳定1天,2-8℃可稳定3天,(-15)-(-25)℃可保存2月。
3.4标本采血量:静脉血2 ml。
3.5标本处理:2500~3000r/min离心6-10min,分离血清待上机。
3.6注意事项:试剂变浑浊或空白吸光度值>0.200时,将不能使用,应弃去。
4患者准备要求患者采样前需禁食8-12小时,最好3天内不要暴食5试剂和仪器5.1试剂5.1.1来源:浙江东瓯诊断产品有限公司5.1.2规格:R1:3×50 ml, R2:1×50 ml5.1.3试剂盒组成:R1 N-乙基-N-(3-磺丙基)-3-甲基苯胺≥0.1 g/L;胆固醇氧化酶≥0.2 KU/L; 胆固醇酯酶≥1 KU/L;过氧化氢酶≥500 KU/L;抗人高密度脂蛋白抗体≥10 mg/L;聚阴离子≥0.2 g/L;表面活性剂适量R2 过氧化氢酶≥5 KU/L; 4-氨基安替比林≥0.1 g/L;表面活性剂适量; 稳定剂适量5.1.4储存和稳定性:2-8℃冷藏,避光保存至有效期,保持竖直向上存放。
低密度脂蛋白胆固醇_LDL-C_的检测

-3-
咨询邮箱:bestbio@ 电话:021-33921235
400-8363-211
本产品仅供科学研究使用!请勿用于临床、诊断、食品、化妆品检测等用途!
成人 血清≤3.98mmol/L,建议各实验室应建立自己的参考范围。
质中,LDL-C 被认为是主要的致病因素,而高密度脂蛋白胆固醇(HDL-C)可能起保护作用, 血清总胆固醇(TC)大致反应 LDL-C 水平,但也受 HDL-C 水平的影响,因此在 AS 脂类危 险因素判别中,TC 偏高时,测定 LDL-C 有重要临床意义。
贝博 TM CellProbeTM 低密度脂蛋白胆固醇(LDL-C)检测试剂盒的检测原理是:第一步, 样品中的非 LDL 脂蛋白与试剂 A 反应形成复合物,游离胆固醇等被清除;第二步,试剂 B 加到反应混合物中后,LDL-C 被裂解,LDL 中的胆固醇与酶试剂反应生成醌亚胺化合物,通 过检测相应波长处的吸光度可得 LDL-C 的含量。
乘以稀释倍数。 当样品中抗坏血素浓度≤1704 umol/L,胆红素浓度≤684 umol/L,血红蛋白浓度≤5.00g/L,甘
油三酯浓度≤22.6 mmol/L 时没有观察到对本方法的干扰。当以上物质高于上述浓度时,可能会 影响结果的准确性,在此情况下本方法不适用。
一、 标本收集和处理 1、 模型构建,采血。 2、 采血后应及时分离血清,避免溶血。样品中 LDL-C 在冷藏(2~8℃)条件可稳 定 1 周。标本如不能及时测定,应于-20℃保存,避免反复冻融。
-2-
咨询邮箱:bestbio@ 电话:021-33921235
400-8363-211
本产品仅供科学研究使用!请勿用于临床、诊断、食品、化妆品检测等用途!
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求haomai

低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:本试剂用于体外定量测定人血清液中低密度脂蛋白胆固醇(LDL-C)的含量。
1.1包装规格1.2主要组成成分本试剂由试剂1(R1)和试剂2(R2)组成试剂1(R1):PIPES缓冲液50mmol/LBSA 0.75g/LH-DAOS 2.5mmol/L4-氨基安替比林 2.5mmol/L胆固醇氧化酶2KU/L胆固醇酯酶 1.8KU/L抗坏血酸氧化酶2KU/L试剂2(R2):PIPES缓冲液50mmol/LBSA 1g/L过氧化物酶2KU/L2.1 外观试剂盒外观应整洁,文字符号标识清晰;R1为无色至淡黄色液体,R2为无色至淡黄色液体。
液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 空白吸光度以生理盐水为样品,在37℃、546nm波长、1cm光径条件下,吸光度≤0.05。
2.4 分析灵敏度浓度为1.0 mmol/L的样本,吸光度差值△A>0.03。
2.5 准确性相对偏差应不大于10%。
2.6 重复性用不同浓度的两个样本进行检测,各重复检测10次,其批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在(1,25)mmol/L范围内,线性相关系数r应不低于0.990;2.7.2 在(1,2.5]mmol/L范围内绝对偏差不超过±0.25mmol/L;(2.5,25)mmol/L 范围内相对偏差不超过±10%。
2.8 批间差用三个批号的试剂盒测定同一份样本,试剂盒批间相对极差应不超过10%。
2.9 稳定性试剂盒在2~8℃避光保存,可稳定22个月。
取到效期后的样品检测试剂空白吸光度、分析灵敏度、准确度、重复性、线性范围应分别符合2.3、2.4、2.5、2.6、2.7的要求。
临床化学脂类质控血清产品技术要求yuepu
临床化学脂类质控血清
适用范围:与本公司生产的试剂盒配套使用,用于载脂蛋白A1、载脂蛋白B、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、脂蛋白a、甘油三酯共7个检测项目的室内质量控制。
1.1 包装规格
1×3mL ;3×3mL;5×3mL;10×3mL;1×1mL ;3×1mL;5×1mL;10×
1mL。
1.2主要组成成分
冻干粉,单水平,人血清基质、防腐剂(0.1%)、冻干保护剂(2%)和稳定剂(0.1mol/L),具体质控项目及目标浓度范围如下表所示:
质控品质控范围批特异,详见靶值单。
2.1 性状
浅黄色至黄色冻干粉,复溶后为浅黄色至黄色透明液体。
2.2 可接受区间
质控品各项目测值应在质控范围内。
2.3 瓶间均匀性
使用配套试剂盒测定,瓶间变异系数(CV)应不超过10%。
2.4 稳定性
2.4.1 效期稳定性
原包装试剂盒在2℃~8℃密封避光保存条件下有效期为36个月。
在稳定期内赋值结果的变化趋势不显著。
2.4.2 复溶稳定性
质控品复溶后在2℃~8℃密闭避光保存,稳定期为7天;-20℃冰冻保存稳定期为28天。
在稳定期内赋值结果的变化趋势不显著。
低密度脂蛋白试剂盒说明书_概述

低密度脂蛋白试剂盒说明书概述1. 引言1.1 概述本篇文章旨在对低密度脂蛋白试剂盒进行综合介绍和分析。
在当前的医学领域中,低密度脂蛋白(LDL)作为血液中最主要的胆固醇载体之一,其水平与心血管疾病的风险存在紧密关联。
因此,准确测量LDL水平对于预防、诊断和治疗心血管疾病具有重要意义。
低密度脂蛋白试剂盒被广泛应用于临床实验室和科研机构,用于定量测定血液中的LDL水平。
本说明书旨在为使用者提供全面详细的关于该试剂盒的信息,包括原理介绍、使用方法以及实验注意事项等方面内容。
通过阅读本说明书,使用者将能够充分了解并正确操作该试剂盒来进行LDL分析实验。
1.2 文章结构本文章按照以下结构来展开论述:首先,在第二部分中我们将深入介绍低密度脂蛋白试剂盒的原理,并详细描述其中涉及的化学反应和测定原理。
然后,在第三部分,我们将讨论使用该试剂盒所得到的实验结果,包括数据收集与处理,数据解读与分析以及结果可靠性评估等方面。
接下来,在第四部分中,我们将对试剂盒的优缺点进行讨论,并展望其在未来的应用前景。
最后,在第五部分中,我们将总结本文的主要发现和观点,并提出对未来研究的建议和意义总结。
1.3 目的本篇文章的目的是全面介绍低密度脂蛋白试剂盒,并提供相关实验操作指南和数据结果解读。
通过深入了解该试剂盒的原理和使用方法,读者将能够充分掌握该实验技术并正确应用于实际科研或临床工作中。
同时,通过对该试剂盒的优缺点讨论和应用前景展望,也可以为今后相关领域研究提供参考,并指导下一步研究方向的选择。
最终目标是促进低密度脂蛋白相关疾病治疗和预防工作的开展,并推动相关科学领域的发展。
2. 低密度脂蛋白试剂盒说明书:2.1 原理介绍低密度脂蛋白(Low Density Lipoprotein,LDL)试剂盒是一种用于测定血液中LDL水平的实验工具。
该试剂盒基于特定酶法或免疫分析原理,并使用相关试剂和设备来测量样本中的LDL含量。
2.2 使用方法在使用低密度脂蛋白试剂盒进行实验前,请确保按照以下步骤正确操作:1. 准备实验材料:包括试剂盒、标准品、样本和所需仪器设备。
低密度脂蛋白胆固醇(LDL-C)测定试剂盒(酶直接法)使用说明书
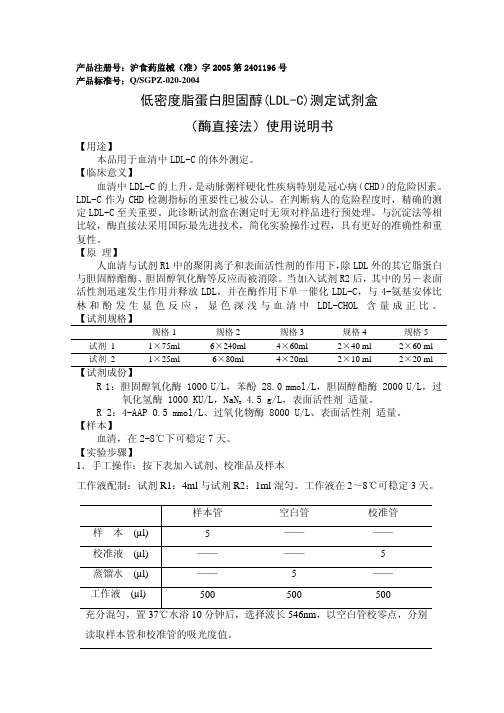
产品注册号:沪食药监械(准)字2005第2401196号产品标准号:Q/SGPZ-020-2004低密度脂蛋白胆固醇(LDL-C)测定试剂盒(酶直接法)使用说明书【用途】本品用于血清中LDL-C的体外测定。
【临床意义】血清中LDL-C的上升,是动脉粥样硬化性疾病特别是冠心病(CHD)的危险因素。
LDL-C作为CHD检测指标的重要性已被公认。
在判断病人的危险程度时,精确的测定LDL-C至关重要。
此诊断试剂盒在测定时无须对样品进行预处理。
与沉淀法等相比较,酶直接法采用国际最先进技术,简化实验操作过程,具有更好的准确性和重复性。
【原 理】人血清与试剂R1中的聚阴离子和表面活性剂的作用下,除LDL外的其它脂蛋白与胆固醇酯酶、胆固醇氧化酶等反应而被消除。
当加入试剂R2后,其中的另-表面活性剂迅速发生作用并释放LDL,并在酶作用下单一催化LDL-C,与4-氨基安体比林和酚发生显色反应,显色深浅与血清中LDL-CHOL含量成正比。
【试剂规格】规格1 规格2 规格3 规格4 规格5 试剂 1 1×75ml 6×240ml 4×60ml 2×40 ml 2×60 ml试剂 2 1×25ml 6×80ml 4×20ml 2×10 ml 2×20 ml【试剂成份】R 1:胆固醇氧化酶 1000 U/L,苯酚 28.0 mmol/L,胆固醇酯酶 2000 U/L,过4.5 g/L,表面活性剂 适量。
氧化氢酶 1000 KU/L,NaN3R 2:4-AAP 0.5 mmol/L、过氧化物酶 8000 U/L、表面活性剂 适量。
【样本】血清,在2-8℃下可稳定7天。
【实验步骤】1.手工操作:按下表加入试剂、校准品及样本工作液配制:试剂R1:4ml与试剂R2:1ml混匀。
工作液在2~8℃可稳定3天。
样本管空白管校准管样本(µl) 5 ————校准液(µl) ———— 5蒸馏水(µl) —— 5 ——工作液(µl) 500 500 500 充分混匀,置37℃水浴10分钟后,选择波长546nm,以空白管校零点,分别读取样本管和校准管的吸光度值。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)标准化操作规程LDLC-SOP

低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)标准化操作规程1 目的规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过的临床检验人员。
3 适用范围本试剂用于体外定量检测血清中低密度脂蛋白胆固醇的浓度。
4 检验方法本试剂采用直接测试法测定低密度脂蛋白胆固醇的浓度。
5 检验原理样本中的低密度脂蛋白胆固醇在试剂中表面活性剂的作用下被胆固醇脂酶选择性地催化水解为胆固醇和游离脂肪酸,生成的胆固醇经胆固醇氧化酶氧化生成胆甾-4-烯-3-酮和过氧化氢,过氧化氢在过氧化物酶的催化下与苯胺类色原物质和4-氨基安替比林作用产生水和醌亚胺色素,醌亚胺色素的生成量与样本中低密度脂蛋白胆固醇的含量成正比,通过测定特定波长处反应最终生成的色素量,可以计算出样本中低密度脂蛋白胆固醇的浓度。
低密度脂蛋白胆固醇脂+ H2O −−−−→−酶酯胆固胆固醇+游离脂肪酸胆固醇 + O2−−−−−−→−胆固醇氧化酶胆甾-4-烯-3-酮+ H2O2H 2O2+ 4-氨基安替比林 + 苯胺类色原物质−−−−−→−过氧化物酶醌亚胺色素 + 水6 标本要求6.1 样本为血清,不得使用溶血、脂血或被污染的样本。
6.2 样本在2℃~8℃可稳定7天,-20℃可稳定1个月。
避免样本反复冻融。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司低密度脂蛋白胆固醇试剂盒(直接测试法)7.27.3试剂的稳定性与贮存:7.3.1试剂在2℃~8℃条件下,干燥、避光、密封贮存,有效期为12个月。
7.3.2试剂开封后在2℃~8℃条件下可稳定30天。
7.3.3 请勿于0℃以下保存试剂。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1 试剂空白吸光度:A<0.05。
8.2.2 分析灵敏度:测试1.00mmol/L的样本时,吸光度变化△A>0.03。
8.2.3 线性范围:试剂线性在[0.20,11.60] 区间内;线性回归系数r≥0.9950;[0.20,2.00] mmol/L范围内,线性绝对偏差应不超过±0.30mmol/L;(2.00,11.60] mmol/L范围内,线性相对偏差不超过±10%。
艾威德 AS-420 AS-660 AS-1200 低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接

低密度脂蛋白胆固醇(LDL-C )测定试剂盒(直接法-表面活性剂清除法)说明书【产品名称】低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-表面活性剂清除法)【包装规格】a)试剂1:2×45mL 试剂2:2×15mL b)试剂1:4×60mL 试剂2:4×20mL c)试剂1:2×60mL试剂2:2×20mL【预期用途】用于体外定量测定人血清中低密度脂蛋白胆固醇的含量。
血清中LDL-C 含量与心脑血管病的发病率及病变程度呈正相关,测定低密度脂蛋白胆固醇常用于心脑血管病病症的辅助诊断[1]。
【检验原理】血清中低密度脂蛋白胆固醇被聚阴离子包裹后,剩余的极低密度、高密度脂蛋白胆固醇与4-氨基安替比林、胆固醇酯酶、胆固醇氧化酶、过氧化物酶反应,生成无色的水。
待加入表面活性剂后,被包裹的低密度脂蛋白胆固醇重新被打开。
被打开的低密度脂蛋白胆固醇与4-氨基安替比林、胆固醇酯酶、胆固醇氧化酶、过氧化物酶)、3-乙基-N-(3-磺丙基)-3-甲基丙胺反应生成有色的敖合物。
该敖合物颜色的深浅与血清中的低密度脂蛋白胆固醇的含量成正相关。
【主要组成成分】试剂1主要组分CHE (胆固醇酯酶)≥0.8KU/L POD (过氧化物酶)≥30KU/L CHO (胆固醇氧化酶)≥0.5KU/L 4-AA (4-氨基安替比林)0.5mmol/L 聚阴离子0.5mmol/L试剂2主要组分ESPAS (3-乙基-N-(3-磺丙基)-3-甲基丙胺)3mmol/L表面活性剂2%注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为18个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI 7020型/7060型/7180型/7600型/LABOSPECT 008AS 型;贝克曼AU400/AU480/AU640/AU680/AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR /TBA-2000FR ;罗氏cobas 8000c 702/cobas 8000c 701/cobas 8000c 502;西门子SIEMENS ADVIA 1800/ADVIA 2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C ;科华KHB 卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/BS-800/BS-2000M ;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray 420;英诺华D280;特康TC6010L ;锦瑞GS400;普康6066。
小而密低密度脂蛋白胆固醇(sd LDL—C)测定试剂盒(过氧化物酶法)产品技术要求mairui

2性能指标2.1外观R1试剂应为澄清透明的液体,无沉淀、悬浮物和絮状物;R2试剂应为澄清透明的液体,无沉淀、悬浮物和絮状物;校准品复溶前应为浅黄色冻干粉末,复溶后应为浅黄色液体。
试剂盒各组分应齐全、完整,液体无渗漏;包装标签文字符号应完整、清晰。
2.2净含量液体试剂的净含量应不少于标示值,标示值见表1。
2.3试剂空白吸光度试剂以水为空白在37℃±1℃,605nm波长条件下,吸光度应小于0.05 A。
2.4分析灵敏度当样本浓度为0.52 mmol/L 时,吸光度变化应不小于0.01 A。
2.5线性范围试剂盒在(0.104 ~ 2.59)mmol/L范围内:a)线性相关系数r应不小于0.9900;b)当样本浓度不大于0.777 mmol/L 时,线性绝对偏差应不大于±0.078 mmol/L;当样本浓度大于0.777 mmol/L 时,线性相对偏差应不大于±10.0%。
2.6测量精密度2.6.1重复性变异系数:CV应不大于10.0%。
2.6.2批间差相对偏差:R应不大于10.0%。
2.7准确度1测定企业参考品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性血红蛋白浓度在500 mg/dL内、内源性酯浓度在600 mg/dL内、胆红素浓度在40mg/dL 内、抗坏血酸在50mg/dL内,对试剂检测结果的偏差影响在±10.0%范围内。
2.9校准品均一性试剂盒校准品的瓶内均一性:CV应不大于10.0%。
2.10生物安全性校准品的HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
2。
低密度脂蛋白胆固醇(LDL—C)测定试剂盒(直接法—表面活性剂清除法)产品技术要求深圳上泰生物

低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-表面活性剂清除法)2.性能指标2.1外观外观应符合以下要求:a)试剂盒各组分应齐全、完整,液体无渗漏;包装标签文字符号清晰;b)R1:无色至微黄色澄清液体,无沉淀及絮状悬浮物;c)R2:无色至微黄色澄清液体,无沉淀及絮状悬浮物;d)校准品、质控品:白色或淡黄色冻干粉,复溶后为无色至淡黄色透明溶液,无浑浊、无未溶解物。
2.2装量液体试剂装量要求不少于标示量。
2.3水分含量校准品质控品的水分含量应不超过 5 %。
2.4试剂空白吸光度用空白样本加入试剂测试时,试剂空白吸光度<0.05。
2.5分析灵敏度测定1.00 mmol/L人血清样本时,试剂与样本反应产生的吸光度值应>0.03。
2.6线性范围2.6.1试剂盒在[0.30,10.00] mmol/L 区间内,线性相关系数(r)应不小于0.990。
2.6.2在[0.30,3.00] mmol/L 区间内,线性绝对偏差应不超过±0.30 mmol/L;在(3.00,10.00] mmol/L 区间内,线性相对偏差应不超过±10 %。
2.7精密度2.7.1重复性重复测试(2.50±0.50)mmol/L 和(5.00±1.00)mmol/L 的样本,所得结果的变异系数(CV)应不大于3 %。
2.7.2批间差测试(2.50±0.50)mmol/L 的样本,所得结果的批间相对极差(R)应不大于10 %。
2.8准确度相对偏差应不超过±10 %2.9分析特异性当抗坏血酸≤50 mg/dL,胆红素≤20 mg/dL、血红蛋白≤500 mg/dL、脂肪乳剂≤1 %时,对试剂检测结果的偏差影响在±10 %以内。
2.10量值溯源应明确分析物的量值溯源。
2.11校准品赋值结果及其不确定的的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
两种清除法测定低密度脂蛋白胆固醇的临床评价

两种清除法测定低密度脂蛋白胆固醇的临床评价黎德群【期刊名称】《川北医学院学报》【年(卷),期】2004(019)001【摘要】目的对表面活性剂清除法(SUR法)和过氧化氢酶清除法(CAT法)两种低密度脂蛋白胆固醇(LDL-C)均相测定法进行临床评价.方法将上述两种方法与聚乙烯硫酸沉淀法(PVS法)进行比较,分析各自方法的精密度、准确性、特异性和干扰因素.结果两种清除法与PVS法(X)具有良好的相关性,SUR法(Y1):Y1=0.9311X+0.1022,r=0.9801;CAT法(Y2):Y2=0.9401X+0.0991,r=0.9832.高、中、低三种LDL-C浓度混合血清所测定结果表明两种方法均具有良好的精密度,总CV值SUR法3.45-3.89%,CAT法3.51-3.99%,均达到临床满意的程度.两法线性范围均较宽(线性均至8.22mmol/I.),最低检测浓度均为0.12mmol/L,平均回收率SUR法为98.0%,CAT法为97.6%.TG <14.2mmol/L,Hb<5g/L,HDL-C<3.88mmol/L,胆红素<450μmol/L对两法基本无影响.结论两种LDL-C清除法测定结果的准确度和精密度均符合临床要求,适宜自动分析,值得在临床推广应用.【总页数】3页(P98-100)【作者】黎德群【作者单位】内江市第四人民医院检验科,四川,内江,641000【正文语种】中文【中图分类】R446.1【相关文献】1.低密度脂蛋白胆固醇保护性试剂匀相测定法的临床评价 [J], 杨瑞锋;逄红;鄢盛恺2.罗丹明B-Fe2+-H2O2光度法测定两种中药对羟基自由基的清除作用 [J], 王征帆3.两种常用方法测定血浆纤维蛋白原的临床评价 [J], 李黎4.两种清除法测定高密度脂蛋白胆固醇的临床评价 [J], 苟兴平5.两种方法测定超敏C反应蛋白结果的比较及临床评价 [J], 赵蓉芬;彭碧因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
低密度脂蛋白胆固醇(LDL-C)测定试剂盒
2、性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白吸光度
试剂以纯水为空白时,波长546 nm,光径1.0 cm,温度37℃,吸光度<0.05。
2.3分析灵敏度
试剂盒测试1.00 mmol/L被测物时,吸光度变化值>0.03。
2.4线性范围
2.4.1试剂盒在0.30~11.60 mmol/L区间(范围)内,其回归系数r≥0.995。
2.4.2相对偏差或绝对偏差应符合表3 要求。
表3 相对偏差或绝对偏差
2.5精密度
2.5.1试剂盒重复性CV 值应≤3%。
2.5.2试剂盒批间相对极差(R)应≤10%。
2.6准确度
相对偏差(Bias%)应在参考物质靶值±10%以内。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。
