高二上学期理科班期中卷-必修3
高二第一学期历史(理科)期中考试卷及参考答案

高二第一学期历史(理科)期中考试卷(考试时间:90分钟,卷面总分:100分,考试范围:必修三)一、选择题(60分,每题1分,答案涂在答题卡上)1.“知足常乐”源于古代“无为而治”思想,提出这一思想的学派是( )。
A.儒家 B.法家 C.道家 D.墨家2.春秋战国时期是中国历史上思想文化空前繁荣的时代,思想领域出现了“百家争鸣”的活跃局面。
其中强调用“刑罚”加强统治的学派是( )。
A.儒家 B.道家 C.法家 D.墨家3.下列观点与墨家思想相符合的是( )。
A.爱人如己,崇尚和平 B.己所不欲,勿施于人C.清心寡欲,顺应自然 D.善用权力,建立权威4.儒学在中国古代被确立为正统思想,这开始于( )。
A.周朝 B.秦朝 C.汉朝 D.宋朝5.黄宗羲、顾炎武、王夫之思想的共同之处是( )。
A.提倡“重农抑商” B.主张学习西方 C.反对经世致用 D.批判君主专制6.毕升的发明在科技史上是一个划时代的技术创新,大大促进了文化的传播。
毕升的发明是( )。
A.造纸术 B.雕版印刷术C.活字印刷术 D.指南针7.弗兰西斯·培根说:“这三种东西改变了整个世界的面貌和状态,第一种是在文字方面,第二种是在战争上,第三种是在航海上。
”这里的“第三种”指( )。
A.指南针 B.造纸术 C.印刷术 D.火药8.《金史》有“声如雷震……人与牛皮皆碎迸无迹,甲铁皆透”的战争场景描绘,对此解释不正确的是( )。
A.战争场面惨烈 B.火药已应用于军事战争C.火药的使用改变了战争结局 D.火药威力巨大9.文字是人类用来记录语言的符号系统,是文明社会产生的标志。
目前所知我国最早的成熟文字是( )。
A.甲骨文 B.金文 C.小篆 D.隶书10.“笔画简约,勾连不断,线条流畅纵情,具有极高的审美价值”,它所描述的字体是( )。
A.篆书 B.隶书 C.楷书 D.草书11.在创作上强调个性表现,集文学、书法、绘画、篆刻艺术为一体,集中体现出画家多方面的文化素养的是( )。
人教A版高中数学必修三试卷高二年级第一学期期中考试(重点、平行)数学试题.doc

高中数学学习材料马鸣风萧萧*整理制作高二年级第一学期期中考试(重点、平行)数学试题(考试时间100分钟,满分150分)一、选择题:(本大题共12小题,每小题5分,满分60分;每小题给出的四个选项中只有一项是符合题目要求的.)1.数列1,-3,5,-7,9,……的一个通项公式为( ) A.12-=n a n B.)12()1(--=n a n n C.1(1)(21)n n a n +=-- D.)12()1(+-=n a n n 2. △ABC 中,sin 2A =sin 2B +sin 2C ,则△ABC 为ABC 等边三角形D 等腰三角形.3.数列{}n a 的前n 项和223,{}n n S n n a =-则的通项公式为( )A .43n -B .45n -C .23n -D .21n - 4.在数列{}n a 中,122,211=-=+n n a a a ,则101a 的值为 A .49B .50C .51D .525.下列不等关系的推导中,正确的个数为( ) ①a >b ,c >d ⇒ac >bd ,②a >b ⇒,③a >b ⇒a n >b n ,④⇒x <1.A . 0个B . 1个C . 2个D . 3个6.在△ABC 中,如果a=4,b=5,A=30°,则此三角形有( ) A . 一解 B . 两解 C . 无解 D . 无穷多解7.若a ,b ,c 成等比数列,则函数y=ax 2+bx+c 的图象与x 轴的交点个数为( ) A . 0 B . 1 C . 2 D . 0或18.在△ABC 中,下列关系中一定成立的是( ) A . a <bsinA B . a =bsinA C . a >bsinA D .a ≥bsinA9.等差数列{a n },{b n }的前n 项和分别为S n ,T n ,若=,则=( )A .B .C .D .10.点p (x ,y )是直线x+3y ﹣2=0上的动点,则代数式3x +27y 有( ) A . 最大值8 B . 最小值8 C . 最小值6 D . 最大值 611.在钝角△ABC 中,a=1,b=2,则最大边c 的取值范围是( ) A .(1,3) B . (1,) C . (,3) D . 不确定 12.一个蜂巢里有1只蜜蜂.第1天,它飞出去找回了5个伙伴;第2天,6只蜜蜂飞出去,各自找回了5个伙伴…如果这个找伙伴的过程继续下去,第6天所有的蜜蜂都归巢后,蜂巢中一共有( )只蜜蜂. A . 55986 B . 46656 C . 216 D . 36 二、填空题(本大题共6小题,每小题5分,共30分)13.若﹣1,a ,b ,c ,﹣9成等差数列,则b= ,ac= .14.在△ABC 中,若sin A ∶sin B ∶sin C =2∶3∶4,则最大角的余弦值= . 15.不等式x 2﹣ax ﹣b <0的解集是(2,3),则不等式bx 2﹣ax ﹣1>0的解集是 . 16.各项为正数的等比数列{}n a 的公比1q ≠,且2311,,2a a a 成等差数列,则3445a aa a ++的值是 。
2021-2022年高二(上)期中化学试卷(理科) 含解析

2021年高二(上)期中化学试卷(理科)含解析一、选择题:(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意.)1.(2分)判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定自发进行的是()A.△H>0,△S>0B.△H<0,△S>0C.△H>0,△S<0D.△H<0,△S<0考点:反应热和焓变.专题:化学反应中的能量变化.分析:当△G=△H﹣T•△S<0时,反应能自发进行.解答:解:化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H﹣T•△S<0时,反应能自发进行,当△H<0,△S>0时,△G=△H﹣T•△S<0,一定能自发进行,而△H>0,△S<0时不能自发进行,△H>0,△S>0或△H<0,△S<0能否自发进行,取决于反应的温度,所以△H<0,△S>0一定能自发进行,故选B.点评:本题考查反应热与焓变,题目难度不大,注意自由能判据的应用.2.(2分)在一固定容积的密闭容器中进行反应2SO2(g)+O2(g)⇌2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是()A.S O2为0.4mol/L,O2为0.2mol/L B.S O2为0.25mol/L C.S O2、SO3均为0.15mol/L D.S O3为0.40mol/L考点:化学反应的可逆性.专题:化学平衡专题.分析:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.解答:解:A、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,实际变化应小于该值,故A错误;B、SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,实际变化为0.05mol/L,小于0.2mol/L,故B正确;C、反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故C错误;D、SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故D错误.故选B.点评:本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.3.(2分)在一定条件下发生反应:2A(g)+2B(g)⇌xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V D=0.2mol/(L•min),下列说法正确的是()A.A和B的转化率均是20% B.x=4C.平衡时A的物质的量为2.8mol D.平衡时气体压强比原来减小考点:化学平衡的计算.专题:计算题;化学平衡专题.分析:根据反应速率之比等于化学计量数之比来确定化学计量数x,V D=0.2mol/(L•min),V C==0.4mol/(L•min),则x=4;2A(g)+2B(g)⇌4C(g)+2D(g),开始 4 2 0 0转化0.8 0.8 1.6 0.8平衡3.2 1.2 1.6 0.8结合转化率的概念及物质的量之比等于压强之比来计算.解答:解:V D=0.2mol/(L•min),V C==0.4mol/(L•min),由反应速率之比等于化学计量数之比,则x=4,2A(g)+2B(g)⇌4C(g)+2D(g),开始 4 2 0 0转化0.8 0.8 1.6 0.8平衡3.2 1.2 1.6 0.8A.A的转化率为×100%=20%,B的转化率为×100%=40%,故A错误;B.由上述分析可知,x=4,故B正确;C.平衡时A的物质的量为3.2mol,故C错误;D.平衡时气体的物质的量之和为3.2mol+1.2mol+1.6mol+0.8mol>4mol+2mol,则反应后压强增大,故D错误;故选B.点评:本题考查化学平衡的计算,熟悉化学平衡的三段法计算及转化率的计算即可解答,注意反应速率与化学计量数的关系、化学计量数与压强的关系来解答,题目难度中等.4.(2分)下列图示关系不正确的是()A.B.C.D.考点:燃烧热;氧化还原反应;常见的能量转化形式;中和热.专题:化学反应中的能量变化.分析:A、依据反应热、中和热、燃烧热概念分析判断;B、依据能源、一次能源、二次能源的概念分析判断;C、依据氧化还原反应、吸热反应、放热反应概念分析判断;D、根据沼气和新能源、可再生能源、太阳能的关系分析判断;解答:解:A、反应热是:化学反应过程中放出或吸收的热量;中和热:在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O时所放出的热量;燃烧热:在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量,中和热和燃烧热都属于反应热,故A正确;B、能源为:自然界贮存的已经查明和推定的能够提供热、光、动力和电能等各种形式的能量来源,包括一次能源和二次能源,二者不重合,故B错误;C、氧化还原反应是反应前后有元素化合价变化的反应,可以是吸热反应,也可以是放热反应,吸热反应放热反应不一定是氧化还原反应,图示正确,故C正确;D、沼气本身提供的是清洁能源,是一种新能源,沼气是利用太阳能的作用,有机物通过微生物发酵产生的气体,其主要成分是甲烷,不仅解决了沼气工程中的环境问题、消耗了大量废弃物、保护了环境、减少了温室气体的排放,而且变废为宝,产生了大量的热能和电能,符合能源再循环利用的环保理念,故D正确;故选B.点评:本题考查了反应热、燃烧热、中和热、能源分类、氧化还原反应与吸热放热反应的关系,新能源的利用开发和与能源的关系.5.(2分)在一定温度下,反应A2(g)+B2(g)⇌2AB(g)达到平衡的标志是(N A代表阿伏加德罗常数)()A.单位时间生成N A的A2同时生成N A的ABB.容器内的总压不随时间变化C.单位时间生成2N A的AB同时生成N A的B2D.单位时间生成N A的A2同时生成N A的B2考点:化学平衡状态的判断.专题:化学平衡专题.分析:通过化学方程式可知,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器的压强都不变,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答该题.解答:解:A、单位时间生成N A的A2同时生成2N A的AB时反应达到平衡状态,所以单位时间生成N A的A2同时生成N A的AB时反应不达到平衡状态,故A错误;B、通过化学方程式可知,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器的压强都不变,故B错误;C、单位时间内生成2N A的AB同时生成N A的B2,说明正逆反应速率相等,达到平衡状态,故C正确;D、无论是否达到平衡状态,都存在单位时间内生成N A的A2同时生成N A的B2,不能说明正逆反应速率相等,故D错误.故选C.点评:题考查化学平衡状态的判断,题目难度不大,本题易错点为B,注意反应前后气体化学计量数不变的化学反应不能用气体压强作为判断化学平衡的依据.6.(2分)下列说法中有明显错误的是()A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大B.活化分子之间发生的碰撞不一定为有效碰撞C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率考点:化学反应速率的影响因素.专题:化学反应速率专题.分析:A.压强增大,体积减小,则单位体积内活化分子数目增加;B.活化分子发生碰撞不一定发生化学反应,发生化学反应的碰撞为有效碰撞;C.升高温度,降低反应所需的活化能,活化分子的百分数增大;D.使用催化剂,分子本身的能量不变,但改变反应的途径,降低反应所需的活化能,活化分子的百分数大大增加.解解:A.对有气体参加的化学反应,压强增大,体积减小,则单位体积内活化分子数答:目增加,所以反应速率加快,故A正确;B.活化分子发生碰撞不一定发生化学反应,发生化学反应的碰撞为有效碰撞,即活化分子之间发生的碰撞不一定为有效碰撞,故B正确;C.升高温度,降低反应所需的活化能,活化分子的百分数增大,所以反应速率加快,故C正确;D.使用催化剂,分子本身的能量不变,但改变反应的途径,降低反应所需的活化能,活化分子的百分数大大增加,显然分子的能量不会增加,故D错误;故选D.点评:本题考查影响化学反应速率的因素,明确温度、压强、催化剂对反应速率的影响及与活化能的关系是解答本题的关键,题目难度不大.7.(2分)(xx•重庆)下列热化学方程式书写正确的是(△H的绝对值均正确)()A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=﹣1367.0kJ/mol(燃烧热)B.N aOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)C.S(s)+O2(g)═2SO2(g);△H=﹣269kJ/mol(反应热)D.2NO2═O2+NO;△H=+116.2kJ/mol(反应热)考点:热化学方程式.专题:压轴题.分析:根据热化学方程式的书写及其注意事项可知,需注明物质的聚集状态、△H的正负号、数值、单位,燃烧热抓住1mol可燃物燃烧生成稳定氧化物、中和热抓住生成1mol水,且利用燃烧与中和反应放热来解答.解答:解:A、燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,故A错;B、中和反应是放热反应,△H应小于0,故B错;C、热化学方程式的书写注明了物质的聚集状态、△H的正负号、数值、单位,故C 正确;D、热化学反应方程式要注明物质在反应时的状态,故D错;故选:C.点评:本题考查燃烧热以及热化学方程式的书写正误判断,重在搞清书写热化学方程式的注意事项.8.(2分)将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:X(g)+2Y(g)⇌2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是()A.100℃B.200℃C.300℃D.不能确定考点:化学平衡的计算.专题:计算题;化学平衡专题.分析:本题目通过求出X或Y的转化率,然后查图象就可以确定其相应温度,令开始加入的X和Y的物质的量分别为1mol、2mol,设达到平衡时,X转化的物质的量为x,根据三段式用x表示出平衡时各组分的物质的量,根据反应物的总物质的量和生成物的总物质的量相等,列方程球x的值,计算x的转化率,结合图象判断.解答:解:令开始加入的X和Y的物质的量分别为1mol、2mol,设达到平衡时,X转化的物质的量为x,则:X(g)+2Y(g)⇌2Z(g)起始/mol 1 2 0转化/mol x 2x 2x平衡/mol 1﹣x 2﹣2x 2x所以有1﹣x+2﹣2x=2x,解得x=0.6mol.故X和Y的转化率均为×100%=60%,对应温度为300℃.故选C.点评:本题考查化学平衡的有关计算,难度不大,清楚求出X或Y的转化率,然后查图象就可以确定其相应温度是解题的关键,注意三段式解题法的运用.9.(2分)某温度下,已知反应mX(g)+nY(g)⇌qZ(g)△H=+Q kJ•mol﹣1(Q>0),下列叙述正确的是()A.反应速率υ正(X)=υ正(Y)B.反应达到最大限度时,加入X,反应的△H增大C.在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量D.降低温度,反应的速率值变大,平衡向逆反应方向移动考点:化学反应速率的影响因素.专题:化学平衡专题;化学反应速率专题.分析:A.反应速率之比等于化学计量数之比;B.改变反应物的用量,反应热不变;C.该反应为可逆反应,反应物不会完全转化为生成物;D.降低温度,反应速率减小;降低温度,化学平衡逆向移动.解答:解:A.反应速率之比等于化学计量数之比,则反应速率υ正(X)=υ正(Y),故A 正确;B.改变反应物的用量,反应热不变,所以加入X,反应的△H不变,故B错误;C.该反应为可逆反应,反应物不会完全转化为生成物,则在一定条件下向容器中放入m molX和n mol Y,充分反应吸收的热量小于QkJ,故C错误;D.降低温度,反应速率减小;该反应为吸热反应,则降低温度,化学平衡逆向移动,故D错误;故选A.点评:本题考查影响化学反应速率的因素,选项B、C为易错点,注意利用该反应的特点来解答,题目难度中等.10.(2分)在一定条件下,可逆反应N2(g)+3H2(g)⇌2NH3(g);△H<0.达到平衡,当单独改变下列条件后,有关叙述错误的是()A.加催化剂v(正)v(逆)都发生变化,而且变化的倍数相等B.加压v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数C.降温,v(正)v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数D.加入氩气,v(正)v(逆)都增大且v(正)增大的倍数大于v(逆)增大的倍数考点:化学平衡的影响因素.专题:化学平衡专题.分析:由反应的热化学方程式N2(g)+3H2(g)⇌2NH3(g);△H<0可知,反应物气体的化学计量数大于生成物气体的化学计量数,增大压强,平衡向正反应方向移动;正反应放热,则升高温度平衡向逆反应方向移动,以此解答该题.解答:解:A.加入催化剂,正逆反应速率都增大,且增大的倍数相同,平衡不移动,故A 正确;B.反应物气体的化学计量数大于生成物气体的化学计量数,增大压强,v(正)、v (逆)都增大,平衡向正反应方向移动,说明v(正)增大的倍数大于v(逆)增大的倍数,故B正确;C.正反应放热,则升高温度平衡向逆反应方向移动,则降低温度,正逆反应速率都减小,平衡向正反应方向移动,v(正)减小的倍数小于v(逆)减小的倍数,故C 正确;D.在体积不变的密闭容器中通入氩气,虽然压强增大,但参加反应的气体的浓度不变,反应速率不变,平衡不移动,故D错误.故选D.点评:本题考查外界条件对平衡移动的影响,以及平衡移动与正逆反应速率的大小关系,题目难度不大,易错点为D,注意压强改变时,只有浓度改变,反应速率和平衡才会改变.二、选择题:(本题包括5小题,每小题4分,共20分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题0分,若正确答案包括两个选项,只选一个且正确给2分,选两个且都正确的给4分,但只要选错一个该小题就为0分)11.(4分)微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O 和Zn,电解质溶液为KOH,电极反应为:Zn+2OH﹣﹣2e=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH ﹣,根据上述反应式,判断下列叙述中正确的是()A.在使用过程中,电池负极区溶液的pH减小B.使用过程中,电子由Ag20极经外电路流向Zn极C.Z n是负极,Ag2O是正极D.Z n电极发生还原反应,Ag2O电极发生氧化反应考原电池和电解池的工作原理.点:专题:电化学专题.分析:银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH﹣﹣2e=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH﹣,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,以此来解答.解答:解:A.负极发生Zn+2OH﹣﹣2e=ZnO+H2O,c(OH﹣)减小,所以电池负极区溶液的pH减小,故A正确;B.Zn为负极,Ag2O为正极,则使用过程中,电子由Zn极经外电路流向Ag20极,故B错误;C.Zn失去电子,Zn为负极,Ag2O得到电子是正极,故C正确;D.Zn电极发生氧化反应,Ag2O电极发生还原反应,故D错误;故选AC.点评:本题考查原电池的工作原理,明确电极反应、正负极的判断、电子的流向即可解答,题目难度不大.12.(4分)可逆反应mA(g)+nB(g)⇌pC(g)+qD(g)的v﹣t图象如图甲,如若其它条件不变,只是在反应前加入合适的催化剂,则其v﹣t图象如图乙,以下说法中正确的是()①a1>a2;②a1<a2;③b1>b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧图中阴影部分面积更大.A.②③⑤⑧B.①④⑥⑧C.②④⑤⑦D.①③⑥⑦考点:化学反应速率的影响因素.专题:化学反应速率专题.分析:若其它条件不变,只是在反应前加入合适的催化剂,正逆反应速率均加快,缩小达到化学平衡的时间,阴影部分的面积为反应物浓度的变化量,平衡状态没有改变,则阴影部分面积相同.解答:解:可逆反应mA(g)+nB(g)⇌pC(g)+qD(g)的v﹣t图象如图,如若其它条件不变,只是在反应前加入合适的催化剂,a1、a2为两种条件下正反应速率,催化剂加快反应速率,则a1<a2;使用催化剂缩小达到化学平衡的时间,则加催化剂时达到平衡的反应速率大,所以b1<b2;使用催化剂缩小达到化学平衡的时间,则t1>t2;阴影部分的面积为反应物浓度的变化量,平衡状态没有改变,则阴影部分面积相同;综上所述②④⑤⑦说法正确,故选C.点评:本题考查影响反应速率的因素及图象,明确图象中纵横坐标及点、线的意义及催化剂对反应速率、化学平衡的影响即可解答,题目难度不大.13.(4分)在一密闭容器中,反应aA(气)bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则()A.平衡向正反应方向移动了B.物质A的转化率减少了C.物质B的质量分数增加了D.a>b考点:化学平衡的影响因素;化学平衡的计算.专题:压轴题;化学平衡专题.分析:采用假设法分析,假设a=b,则保持温度不变,将容器体积增加一倍,平衡不移动,B和C的浓度应均是原来的倍,但当达到新的平衡时,B和C的浓度均是原来的60%,说明减小压强平衡向正反应方向移动,则说明a<b.解答:解:假设a=b,则保持温度不变,将容器体积增加一倍,平衡不移动,B和C的浓度应均是原来的倍,但当达到新的平衡时,B和C的浓度均是原来的60%,说明减小压强平衡向正反应方向移动,则说明a<b.A、由以上分析可知,平衡应向正反应方向移动,故A正确;B、平衡应向正反应方向移动,A的转化率增大,故B错误;C、平衡应向正反应方向移动,物质B的质量分数增加了,故C正确D、增大压强平衡向逆反应方向移动,则说明a<b,故D错误.故选:AC.点评:本题考查化学平衡移动问题,题目难度不大,注意通过改变体积浓度的变化判断平衡移动的方向,此为解答该题的关键.14.(4分)如图是温度和压强对X+Y⇌2Z 反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是()A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态C.X和Y中只有一种是气态,Z为气态D.上述反应的正反应的△H>0考点:化学平衡的影响因素.专题:化学平衡专题.分由图象曲线变化可知,随着温度的升高,Z的体积分数增大,说明升高温度平衡向正析:反应方向移动,说明正反应吸热,增大压强,Z的体积分数减小,说明增大压强平衡向逆反应方向移动,则说明反应前的气体计量数之和小于生成物气体的化学计量数,以此解答该题.解答:解:A.图象曲线变化可知,随着温度的升高,Z的体积分数增大,说明升高温度平衡向正反应方向移动,说明正反应吸热,故A错误;B.如X、Y、Z均为气态,反应前后气体的体积不变,增大压强,平衡应不移动,但由图象可知增大压强平衡向逆反应方向移动,故B错误;C.增大压强,Z的体积分数减小,说明增大压强平衡向逆反应方向移动,则说明反应前的气体计量数之和小于生成物气体的化学计量数,则X和Y中只有一种是气态,Z为气态,故C正确;D.由A可知,正反应吸热,△H<0,故D错误.故选C.点评:本题考查化学平衡移动的图象问题,题目难度中等,解答该题的关键是把握图象中曲线的变化特点,结合外界条件对化学平衡的影响分析.15.(4分)分析如图所示的四个装置,结论正确的是()A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e﹣=6OH﹣+3H2↑C.四个装置中某一电极上均有气泡产生D.(4)中Cu作正极,电极反应式为2H++2e﹣=H2↑考点:常见化学电源的种类及其工作原理.专题:电化学专题.分析:当稀硫酸是电解质溶液时,Mg作负极(活泼性Mg>Al);当NaOH是电解质溶液时,Al作负极(Mg不与NaOH溶液反应);(3)中Cu作负极,反应式为:Cu﹣2e﹣=Cu2+,Fe作正极,因为常温下,Fe被浓硝酸钝化,(4)中Cu作正极,电极反应式为:2H2O+O2+4e﹣=4OH﹣,以此解答该题.解答:解:A.(2)中Mg不与NaOH溶液反应,Mg作负极,(3)中因为常温下,Fe被浓硝酸钝化,Cu作负极,故A错误;B.当NaOH是电解质溶液时,Al作负极(Mg不与NaOH溶液反应),Mg作正极,电极反应式为6H2O+6e﹣=6OH﹣+3H2↑,故B正确;C.(4)中正极反应式为2H2O+O2+4e﹣=4OH﹣,负极反应式为Fe﹣2e﹣=Fe2+,没有气泡产生,故C错误;D.(4)中Cu作正极,发生吸氧腐蚀,正极反应式为:2H2O+O2+4e﹣=4OH﹣,故D 错误.故选B.点评:本题考查原电池的正、负极的判断及电极反应式的书写,电解质溶液不同,导致两极发生改变,考查学生知识的变迁能力和灵活应变能力,题目难度中等.三、解答题(共2小题,满分16分)16.(8分)(xx•广州模拟)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10﹣2)2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L﹣1、0.001mol•L ﹣1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L﹣1)的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):KMnO4酸性溶液的浓度/mol•L﹣1溶液褪色所需时间t/min第1次第2次第3次0.01 14 13 110.001 6 7 7①计算用0.001mol•L﹣1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化,写出计算过程).②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不可行.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应..考点:化学反应速率的影响因素.专题:化学反应速率专题.分析:(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,据此写出离子方程式.(2)所做的实验至少有对比实验、改变浓度的实验、改变温度的实验、加催化剂的实验.(3)①根据v=计算.②因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较;如果想通过直接观察褪色时间长短来判断必须保证高锰酸钾的体积与浓度相同.解答:(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.故答案为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(2)要得出反应物浓度、温度、催化剂对反应速率影响的结论至少要完成:①取不同浓度KMnO4溶液,在相同温度下进行反应;②取同浓度KMnO4溶液,在不同温度下进行反应;③取同浓度KMnO4溶溶,在同温度且有催化剂的条件下进行反应;④取同浓度KMnO4溶液,在同温度且不使用催化剂的条件下进行反应等3个实验来进行对比.故答案为:4.(3)①反应开始时:c(KMnO4)==0.00067 mol•L﹣1反应时间:△t==6.7min KMnO4的平均反应速率:ν(KMnO4)===1×10﹣4 mol•L﹣1•min﹣1故答案为:1×10﹣4 mol•L﹣1•min﹣1.②由题中数据知浓度大的褪色时间反而长,因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较,故不经过计算直接利用表中的褪色时间长短来判断浓度大小与反应速率的关系是不可行的;所以若想通过直接观察褪色时间长短来判断溶液浓度的大小,则必须保证KMnO4酸性溶液的浓度相同,才能判断H2C2O4溶液浓度的大小.故答案为:否(或:不可行);取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.点评:本题考查了影响化学反应速率的因素,难度不大,注意决定反应速率的是物质本身的性质,外界条件只是影响因素.17.(8分)航天技术上使用的氢﹣氧燃料电池具有高能、轻便和不污染环境等优点.氢﹣氧燃料电池有酸式、碱式和非水种,它们放电时的电池总反应方程式均可表示为:2H2+O2=2H20.(1)酸式氢﹣氧燃料电池中的电解质是酸,其负极反应可表示为:2H2﹣4e﹣=4H+,其正极反应表示为O2+4H++4e﹣=2H2O;(2)碱式氢﹣氧燃料电池中的电解质是碱,其正极反应表示为:O2+2H20+4e﹣=40H﹣,其负极反应可表示为2H2+40H﹣4e﹣=4H2O;(3)非水电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2﹣,其负极反应可表示为:2H2+2O2﹣﹣4e﹣=2H20,其正极反应表示为O2+4e﹣=2O2﹣.(4)非水电解质是掺杂K2CO3晶体,在熔融状态下能传导CO32﹣,其正极反应可表示为:O2+2CO2+4e﹣=2C032﹣,其负极反应表示为2H2+2CO32﹣﹣4e﹣=2H2O+2CO2.考点:化学电源新型电池.专题:电化学专题.分析:(1)酸式氢﹣氧燃料电池中,正极发生还原反应生成H2O,可用总反应式减负极反应可到正极反应式;(2)碱式氢﹣氧燃料电池中,负极发生氧化反应,可用总反应式减正极反应得到负极反应式;(3)正极发生还原反应,O2得电子生成O2﹣;(4)负极发生氧化反应,H2得电子,生成物为H2O和CO2.解答:解:(1)酸式氢﹣氧燃料电池中,正极发生还原反应生成H2O,总反应式减负极反应可到正极反应式为O2+4H++4e﹣=2H2O,故答案为:O2+4H++4e﹣=2H2O;(2)碱式氢﹣氧燃料电池中,负极发生氧化反应,总反应式减正极反应得到负极反应式为2H2+40H﹣4e﹣=4H2O,。
高二期中考试试卷数学(必修3,理)
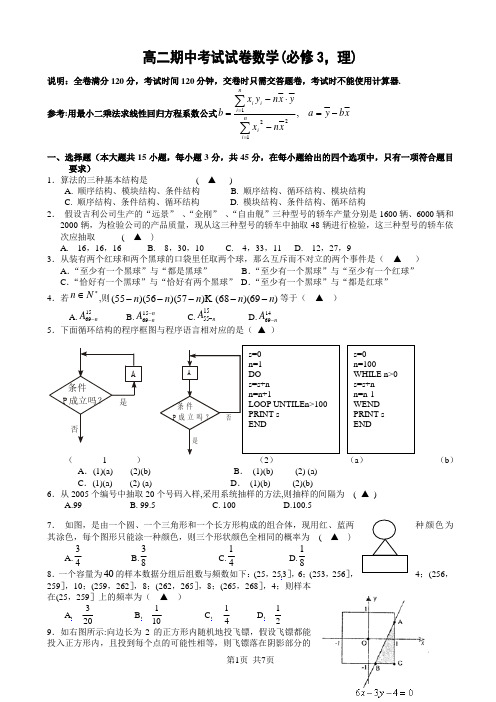
高二期中考试试卷数学(必修3,理)说明:全卷满分120分,考试时间120分钟,交卷时只需交答题卷,考试时不能使用计算器.参考:用最小二乘法求线性回归方程系数公式x b y a xn xy x n yx b ni ini i i -=-⋅-=∑∑==,1221一、选择题(本大题共15小题,每小题3分,共45分,在每小题给出的四个选项中,只有一项符合题目要求)1.算法的三种基本结构是 ( ▲ )A. 顺序结构、模块结构、条件结构B. 顺序结构、循环结构、模块结构C. 顺序结构、条件结构、循环结构D. 模块结构、条件结构、循环结构 2. 假设吉利公司生产的“远景” 、“金刚” 、“自由舰”三种型号的轿车产量分别是1600辆、6000辆和2000辆,为检验公司的产品质量,现从这三种型号的轿车中抽取48辆进行检验,这三种型号的轿车依次应抽取 ( ▲ )A. 16,16,16B. 8,30,10C. 4,33,11D. 12,27,93.从装有两个红球和两个黑球的口袋里任取两个球,那么互斥而不对立的两个事件是( ▲ ) A .“至少有一个黑球”与“都是黑球” B .“至少有一个黑球”与“至少有一个红球” C .“恰好有一个黑球”与“恰好有两个黑球” D .“至少有一个黑球”与“都是红球” 4.若*∈N n ,则)69)(68()57)(56)(55(n n n n n ----- 等于( ▲ )A.1569n A - B.n n A --1569 C.1555n A - D.1469n A -5.下面循环结构的程序框图与程序语言相对应的是( ▲ )(1) (a ) (b ) A .(1)(a) (2)(b) B . (1)(b) (2) (a)C .(1)(a) (2) (a)D . (1)(b) (2)(b)6.从2005个编号中抽取20个号码入样,采用系统抽样的方法,则抽样的间隔为 ( ▲ )A.99B. 99.5C. 100D.100.57. 如图,是由一个圆、一个三角形和一个长方形构成的组合体,现用红、蓝两种颜色为其涂色,每个图形只能涂一种颜色,则三个形状颜色全相同的概率为 ( ▲ )A.34B.38C.14D.18 8.一个容量为40的样本数据分组后组数与频数如下:(25,253],6;(253,256],4;(256,259],10;(259,262],8;(262,265],8;(265,268],4;则样本在(25,259]上的频率为( ▲ )A 203B 101C 41 D219.如右图所示:向边长为2的正方形内随机地投飞镖,假设飞镖都能概率是 ( ▲ )A .14411B .14425C .14437D .1444110.由小到大排列的一组数据:54321,,,,x x x x x ,其中每个数据都小于2-,则样本1,2x -,5432,,,x x x x -的中位数可以表示为 ( ▲ )A.232x x +B.212x x - C.225x + D.243x x -11.书架上原来摆着6本书,现在要再插入3本书,不同的插法种数为 ( ▲ )A.37AB.44A C.789⨯⨯ D.332A12.已知甲、乙两名同学在五次数学测验中的得分如下:甲:85,91,90,89,95;乙:95,80,98,82,95.则甲、乙两名同学数学学习成绩A.甲比乙稳定B.甲、乙稳定程度相同C.乙比甲稳定D. 无法确定13.如右图所示的程序是用来 ( ▲ )A .计算3×10的值B .计算93的值 C .计算103的值 D .计算1×2×3×…×10的值14.为研究变量x 和y 的线性相关性,甲、乙二人分别作了研究,利用线性回归方法得到回归直线方程1l 和2l ,两人计算知x 相同,y 也相同,下列正确的是 ( ▲ )A .1l 与2l 重合B .1l 与2l 相交于点),(y xC .1l 与2l 一定平行D .无法判断1l 和2l 是否相交15.已知直线方程0=+By Ax ,若从0,1,2,3,4,5,这6个数字中每次取出两个不同的数作为A 、B ,则表示不同的直线条数是 ( ▲ )A .30B .22C . 15D . 20 二、填空题(本大题共6小题,每小题4分,共24分)16.完成下列进位制之间的转化:101101(2)=_▲____(10)_____ ▲____(4) 17.为了了解中学生的体能情况,抽取了某校一个年级的部分学生进行一分钟跳绳次数测试,将所得数据整理后,画出频率分布直方图(如图),已知图中从左到右前三个小组的频率分别为 0.1,0.3,0.4,第一小组的频数为 5. 则第四小组的频率_____ ▲_____; 参加这次测试的学生有___ ▲____人。
黄冈市2013年秋季高二期中考试数学理(必修3)试题及答案(word)

2013年秋季必修3模块修习考试(理科)答案一、选择题:1.C2.A3.C4.D5.D6.B7.B8.A9.D 10.D 二、填空题:(11)1 (12) 6 (13) 11 3 (14)54 (15) π1631- 的函数值,=xy=, ,,)()8790888887858461=+++++=甲X , ()8790898887868261=+++++=乙X ()4])8790(87-88)8788()8787()8785()8784([612222222=-++-+-+-+-=)(甲S()320])8790(87-89)8788()8787()8786()8782([612222222=-++-+-+-+-=)(S 因为3204<,所以甲组的成绩比乙组稳定。
…………………………7分 (2)从乙组抽取两名成员的分数,所有基本事件为(用坐标表示):(82,86),(82,88),(82,87),(82,89),(82,90),(86,87),(86,88),(86,89),(86,90),(87,88)(87,89)(87,90),(88,89),(88,90),(89,90)共15种情况。
则抽取的两名成员的分数差值至少是4的事件包含:(82,86),(82,87),(82,88),(82,89),(82,90),(86,90)共6种情况。
由古典概型公式可知,抽取的两名成员的分数差值至少是4分的概率P=52……12分 18.解: (1)分层抽样中,每个个体被抽到的概率均为,样本容量总体中个体总数故甲同学被抽到的概率110P =. …………3分(2)由题意得x=1 000-(60+90+300+160)=390.故估计该中学达到优秀线的人数12011016039029012090m -=+⨯=-. …………6分 (3)频率分布直方图如图所示.…………9分 该学校本次考试的数学平均分6015904530075390105160135901000x ⨯+⨯+⨯+⨯+⨯==.估计该学校本次考试的数学平均分为90分. ………………12分19.解:(1) x 的所有可能取值为-2 ,-1 ,0, 1.(2)数量积为-2的只有25O A O A ∙一种数量积为-1的有15O A O A ∙,1624263435,,,,O A O A O A O A O A O A O A O A O A O A ∙∙∙∙∙六种数量积为0的有13143646,,,O A O A O A O A O A O A O A O A ∙∙∙∙四种 数量积为1的有12234556,,,O A O A O A O A O A O A O A O A ∙∙∙∙四种 故所有可能的情况共有15种. ……8分 所以小波去下棋的概率为1715p = 因为去唱歌的概率为2415p =,所以小波不去唱歌的概率2411111515p p =-=-= ……13分20.解:(Ⅰ)变量x 是在24,,3,2,1 这24个整数中等可能随机产生的一个数,共有24种可能.当x 从2,21,19,17,15,13,11,9,7,5,3,1这12个数中产生时,输出y 的值为1,故211=P ; 当x 从22,20,16,14,10,8,4,2这8个数中产生时,输出y 的值为2,故312=P ; 当x 从24,18,12,6这4个数中产生时,输出y 的值为3,故613=P . 所以输出y 的值为1的概率为21,输出y 的值为2的概率为31,输出y 的值为3的概率为61. ……8分 (Ⅱ)当2100n =时,甲、乙所编程序各自输出y 的值为(1,2,3)ii =的频率如下, 比较频率趋势与概率,可得乙同学所编写程序符合算法要求的可能性较大.……13分 21.解:(Ⅰ)若x ∈Z ,y ∈Z ,则点M 的个数共有21个,列举如下:(2,1),(2,0),(2,1)----;(1,2),(1,1),(1,0),(1,1),(1,2)-------; (0,2),(0,1),(0,0),(0,1),(0,2)--;(1,2),(1,1),(1,0),(1,1),(1,2)--; (2,1),(2,0),(2,1)- . 当点M 的坐标为(1,1),(1,2),(2,1)---时,点M 位于第四象限. 故点M 位于第四象限的概率为17.…………6分(Ⅱ)由已知可知区域W 的面积是5π.因为直线:l y x b=-+与圆22:5O x y +=如图,可求得扇形的圆心角为23π,所以扇形的面积为125233S ππ=⨯=,则满足y x b ≥-+的点M 构成的区域的面积为5220s i n 3312S πππ=-=,所以y x b ≥-+的概率为201125ππ-.……13分。
人教版季延中学2009年秋高二理科期中考试卷(必修3与选修3专题1)

季延中学2009年秋高二理科期中试卷(必修3与选修3专题1)生物科试题本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。
练习用时90分钟。
第I卷(单选题共50分)一、单选题:(每题1分,共50分。
请将答案填写到答题卷中)1.血浆中的水来自A.组织液B.血浆.消化液C.淋巴.组织液D.消化道.组织液.淋巴2.高等动物体内细胞从外界获得营养物质的途径是A.外界食物→循环系统→消化系统→内环境→细胞B.外界食物→消化系统→循环系统→内环境→细胞C.外界食物→内环境→消化系统→循环系统→细胞D.外界食物→循环系统→内环境→消化系统→细胞3.剧烈活动后,血浆PH会因大量乳酸进入血液而A.大于7.35~7.45 B.小于7.35~7.45 C.维持在7.35~7.45 D.稳定在3~4 4.大气中的氧气要与人的血红蛋白结合,需要穿过几层磷脂分子A.3 B.5 C.6 D.105.某人患急性肠炎引起腹泻,医生给予补充生理盐水,其首要目的是A.提供能量B.供给营养C.维持水分代谢的平衡D.维持无机盐代谢的平衡6.人体组织水肿的原因之一可能是A.血浆中蛋白质含量少B.组织液中蛋白质含量少C.血液中尿素含量少D.血液中无机盐含量少7.内环境稳态调节机制的现代观点是A.神经调节B.体液调节C.神经—体液调节D.神经—体液—免疫调节8.止痛药并不损伤神经元的结构,却能在一段时间内阻断神经冲动向感觉中枢的传导,它的作用部分是A.轴突B.细胞体C.突触间隙D.树突9.下列人体生理活动属于神经调节的是A.小肠黏膜上皮细胞以主动运输方式吸收氨基酸B.躯体与运动时骨骼肌的活动C.皮肤伤口处,吞噬细胞对病毒的吞噬反应D.青春期出现第二性征10.人体中绝大部分神经元之间的兴奋传递是通过递质实现的。
下列关于突触和兴奋传递的叙述,错误的是A.突触前后两个神经元的兴奋是同时的B.兴奋通过突触时电信号(电位变化)转化为化学信号(递质释放),再转化为电信号C.构成突触的两个神经元之间是有间隙的D.兴奋在突触处只能单向传递11.取出枪乌贼的粗大神经纤维,进行如下图所示的实验:将电位计的两个微型电极a.b分别置于神经纤维膜外,同时在c处给以一个强刺激,电位计的指针会发生什么现象:A.不会发生偏转B.发生一次偏转C.发生两次方向相同的偏转D.发生两次方向相反的偏转12.聋哑人要理解同伴的“手语”所表达的意思,要依靠的中枢是①躯体运动中枢;②躯体感觉中枢;③视觉中枢;④听觉中枢;⑤语言中枢A.③⑤B.①③C.①③⑤D.①④13.当人处于饥饿状态时A.肾上腺素分泌减少,胰高血糖素增加B.肾上腺素分泌增加,胰高血糖素增加C.肾上腺素分泌减少,胰高血糖素减少D.肾上腺素分泌增加,胰高血糖素增加14.人体下丘脑不能完成的生理功能是A.体温调节B.水平衡的调节C.内分泌的调节D.血液pH值的调节15.水和无机盐的平衡对内环境稳态具有重要意义。
最新高二上期期中考试(必修三)

高二上期期中考试(必修三)总分100分时间90分钟第Ⅰ卷(选择题部分共60分)一、选择题(每小题1.5分,共60分,在每小题的四个选项中,只有一项最符合题目要求)1.孔子主张社会和谐,墨子主张“兼爱”、“非攻”,孟子主张“政在德民”。
这些主张产生共同的社会背景是A.封建制度逐步发展B.百家争鸣趋于合流C.奴隶制度全面崩溃D.社会动荡矛盾尖锐2.先秦诸子百家中,道家讲天道,墨家信鬼神,他们都不讲天命,儒家则讲人道,信天命,不信鬼神;道家无为而无求,墨家有为而有求,儒家有为而无求。
据此可知,与其他思想流派相比,儒家思想A.重视天人关系的研究B.与墨家思想可以互补C.有较强道义和责任感D.蕴含了早期民本思想3.汉武帝时期,官员审判案件时如果没有法律明文规定,可以将《诗》、《书》、《礼》《易》、《乐》《春秋》等经义作为判案依据,史称“春秋决狱”。
这说明A.儒家伦理成为治国的重要依据B.“六经”收录了大量法律文献C.汉代司法审判充满了人文色彩D.汉武帝推崇依法治国的理念4.下图所示是新疆出土的东汉蜀锦“五星出东方(注:金、木、水、火、土星汇聚于东方的天文现象)利中国”护臂。
该护臂工艺精美、文字激扬、意蕴丰富,它A.证实了汉代丝织技术的西传B.展示了汉代蜀锦的工艺流程C.体现了汉代的天人感应观念D.反映了汉代长途贩运的兴盛5.《后汉书·陈定传》中记载:颍川(今属河南)名士陈定的子孙们都很孝敬老人,其中陈纪最出名。
豫州刺史知道了这个孝子的事迹,便向朝廷禀报,获得批准,豫州刺史将陈纪形象作为活教材绘于郡县繁华的街衢之中,于是就有了“图象百城,以厉风俗”的说法。
朝廷这样做的主要目的是A.彰显君主以德治国B.加强社会道德教化C.促进家庭和睦稳定D.维护封建纲常秩序6.汉代在选官制度上体现出对孝的提倡,汉惠帝、吕后开汉代“举孝授官”之先河。
汉代以后,“以孝选官”的现象承袭相沿,继续存在于历代选官的体系中。
据此可知,汉代“举孝授官”A.使士人开始步人政治舞台B.促使了社会实现公平公正C.保证了官僚队伍的廉洁性D.体现了儒学的政治化进程7.玄学是魏晋时期思想文化的标志性成果,玄学家主张的是清谈或玄谈。
期中复习题- 高二上学期物理人教版(2019)必修第三册

一.选择题(第1- 8题只有一项符合题目要求,第9-12题有多项符合题目要求,全部选对的得4分,选对但不全的得2分,有选错的得0分。
)1.在法拉第时代,下列验证“由磁产生电”设想的实验中,能观察到感应电流的是( )A.将绕在磁铁上的线圈与电流表组成一闭合回路,然后观察电流表的变化B.在一通电线圈旁放置一连有电流表的闭合线圈,然后观察电流表的变化C.将一房间内的线圈两端与相邻房间的电流表连接,往线圈中插入条形磁铁后,再到相邻房间去观察电流表的变化D.绕在同一铁环上的两个线圈,分别接电源和电流表,在给线圈通电或断电的瞬间,观察电流表的变化2.关于电场强度和磁感应强度,下列说法正确的是( )A .由真空中点电荷的电场强度公式E =kQ r 2知,当r →0时,其电场强度趋近于无穷大B .电场强度的定义式E =F q适用于任何电场 C .由公式B =F Il知,一小段通电导体在某处不受磁场力,说明此处一定无磁场 D .磁感应强度的方向就是置于该处的通电导线所受的安培力方向3.如图所示,圆形线圈的匝数为10匝、面积为20.4m ,在该圆形线圈平面内有一个面积为20.2m 的正方形区域,该区域内有垂直线圈平面向里的匀强磁场,磁感应强度大小为2.0T ,则穿过该圆形线圈的磁通量为( )A .4WbB .8WbC .0.4WbD .0.8Wb4.如图所示,一质量为m 、电荷量为()0q q >的粒子以速度0v 从MN 连线上的P 点水平向右射入大小为E 、方向竖直向下的匀强电场中。
已知MN 与水平方向成45°角,粒子的重力可以忽略,则粒子到达MN 连线上的某点时( )新人教版 必修 3期中复习题A .所用时间为0mv qEB .速度大小为03vC .与P 点的距离为20qED .速度方向与竖直方向的夹角为30°5.如图所示,静止的电子在加速电压U 1的作用下从O 经P 板的小孔射出,又垂直进入平行金属板间的电场,在偏转电压U 2的作用下偏转一段距离后离开电场.现使U 1加倍,则下列说法正确的是( )A .要想使电子的运动轨迹不发生变化,应该使U 2变为原来的2倍B .要想使电子的运动轨迹不发生变化,应该使U 2变为原来的2倍C .要想使电子离开电场时速度的偏转角变大,应该使U 2变为原来的2倍D .要想使电子离开电场时速度的偏转角变大,应该使U 2变为原来的2倍6.如图(a)所示,两个平行金属板P 、Q 竖直放置,两板间加上如图(b)所示的电压.t =0时,Q 板比P 板电势高5 V ,此时在两板的正中央M 点有一个电子,速度为零,电子在电场力作用下运动,使得电子的位置和速度随时间变化.假设电子始终未与两板相碰.在0<t <8×10-10 s 的时间内,这个电子处于M点的右侧,速度方向向左且大小逐渐减小的时间是 ( )A .0<t <2×10-10 s B .2×10-10 s<t <4×10-10 s C .4×10-10 s<t <6×10-10 sD .6×10-10 s<t <8×10-10s 7.如图所示的电路中,电源电动势为E .内阻为R ,L 1和L 2为相同的灯泡,每个灯泡的电阻和定值电阻阻值均为R .电压表为理想电表,K 为单刀双掷开关,当开关由1位置掷到2位置时,下列说法中正确的是( )A .L 1亮度不变,L 2 将变暗B .L 1将变亮,L 2将变暗C .电源内阻的发热功率将变小D .电压表示数将变小8.如图甲所示电路中,R 为电阻箱,电源的电动势为E ,内阻为r 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高二(理)生物期中试卷试卷满分100分,考试时间80分钟,试卷只提交答题卡。
一、选择题(本大题共60分,每小题2分。
将下列各题中一个正确选项的编号填入括号内) 1、高三学生小明最近到医院体检,体检报告中的肝功能检验结果显示:乙肝抗原呈阴性(-),乙肝抗体呈阳性(+)。
他说自己没有注射过乙肝疫苗,就此结果向你咨询,你应该给他怎样的合理建议(说明:“+”表示有,“-”表示没有)( )A .你体内带有乙肝抗体,说明一定也有乙肝病毒,需要到医院就诊B .你体内没有乙肝病毒,但含有乙肝抗体,一定是妈妈怀孕时传递给你的免疫力C .你体内没有乙肝病毒,但含有乙肝抗体,说明你可能曾感染乙肝病毒后痊愈了D .你体内没有乙肝病毒,但含有乙肝抗体,这是父母遗传给你的免疫力2、在养殖青鱼、草鱼、鲢鱼和鳙鱼四大家鱼时,工作人员给雌、雄亲鱼注射促性腺激素类似物,促进亲鱼的卵和精子成熟,随后进行人工授精和育苗。
该促性腺激素类似物的靶器官是A 、垂体B 、性腺C 、下丘脑D 、甲状腺3、兴奋在神经元之间进行传递时,突触小泡会释放传递信息的物质,该物质是A 、神经递质B 、CO 2C 、Na +D 、O 24、兴奋在两个神经元之间的传递,通过的结构是( )A 、突触B 、细胞体C 、树突D 、轴突 5、在反射弧中,兴奋传导的方向是( )A 、由感受器至神经中枢B 、由神经中枢至感受器C 、由效应器至神经中枢D 、由效应器至感受器6、艾滋病已成为威胁人类健康的一大杀手。
下列有关艾滋病的说法正确的是( ) A 、HIV 主要攻击人体内的T 细胞,使人丧失免疫功能 B 、获得性免疫缺陷病就是指艾滋病C 、艾滋病传染性强,平时不要与艾滋病患者有任何接触D 、HIV 在离开人体后还能存活很长时间,危害极大7、许多止痛药物能止痛的原理是在一段时间内能阻断神经冲动的传导,且不损伤神经细胞,其作用部位是( )A 、细胞体B 、突触间隙C 、突触前膜D 、突触后膜 8、右图是高等动物甲状腺激素分泌调节示意图,以下叙述正确的是( )A 、在寒冷的环境中,激素③的分泌增加,但与大脑皮层无关B 、切除垂体后,①的分泌会增加,③的分泌会立即停止C 、切除甲状腺后,①和②的分泌会增加,但不促进代谢D 、给动物注射③,反馈调节使①和②的分泌会增加9、在反射弧中,传出神经受损伤,其他部位正常,会出现( ) A 、不影响皮肤的感觉和肌肉的运动 B 、皮肤失去感觉、肌肉瘫痪C 、皮肤失去感觉、但肌肉能运动D 、皮肤有感觉、但肌肉瘫痪 10、调节人体生理功能的最高级中枢是( )A 、大脑两半球B 、大脑皮质C 、小脑D 、神经中枢11、下图左侧为燕麦胚芽鞘所做的处理,那么一段时间后,右侧①②③在图示位置时,其生长情况依次是A 、向右弯曲 向右弯曲 向右弯曲B 、向右弯曲 向左弯曲 向左弯曲C 、向左弯曲 直立生长 向右弯曲D 、向右弯曲 直立生长 向左弯曲 12、某人由于营养不良,身体浮肿,其食疗补救措施是A、多吃蔬菜B、多喝牛奶C、多吃馒头D、多喝水13、下列激素中不能调节糖代谢的是()A、生长激素B、胰岛素C、胰高血糖素D、性激素14、用含有甲状腺素制剂的饲料喂蝌蚪,蝌蚪的变化是()A、迅速发育成青蛙B、缓慢发育成青蛙C、变成畸形蝌蚪D、不能进行发育成青蛙15、生产实践中,对禽畜进行阉割的主要目的是为了使其()A、失去第二性征B、不能产生生殖细胞C、营养物质积累,利于肥育D、性情变得温和,易于饲养16、甲状腺功能亢进患者的情绪容易激动,这是因为()A、甲状腺素促进新陈代谢B、甲状腺素促进生长发育C、甲状腺素增生压迫了神经D、甲状腺素能提高神经系统兴奋性17、内分泌腺的分泌物不会存在于()A、血液中B、组织液中C、消化液中D、淋巴中18、人受惊吓后某物质的浓度在血液中比正常要高,这种物质可能是()A、抗原B、激素C、酶D、葡萄糖19、所有被生物体细胞识别为异物的物质就称为()A、抗体B、抗原C、抗毒素D、抗生素20、手术摘除小白兔的垂体后,其甲状腺功能衰退的原因是A.大脑功能异常B.缺乏促性腺激素C.缺乏促甲状腺激素D.垂体一甲状腺之间的神经被切断21、下列属于特异性免疫的是()A、皮肤的屏障作用B、吞噬细胞的吞噬、清除作用C、体液的杀菌作用D、青霉素的过敏反应22、下列器官中,哪个不属于免疫器官()A、淋巴结B、胰脏C、胸腺D、脾脏23、用于预防接种的疫苗一般是()A、天然的,未经人工处理的病菌、病毒等B、人工培育并经过处理的病菌、病毒等C、天然抗体D、人工合成的免疫球蛋白24、植物向光性的形成,是由于单侧光使()A、茎尖芽的顶端分生组织合成生长素的能力发生改变B、生长素在茎的向光侧比背光侧的含量高、C、生长素在茎的背光侧比向光侧的含量高D、茎尖感光部位的感光能力发生改变25、对四组胚芽鞘进行不同处理后,置于黑暗中(如图所示),其中弯向右面生长的一组是()A、(1)和(3)B、(1)和(4)C、(2)和(3)D、(2)和(4)26、扦插繁殖时,如插条带芽就容易成活,其原因是()A、芽能产生生长素B、带芽的插条生长快C、芽能发育成新的枝条D、带芽的插条是活的27、下列各项中最能说明生长素具有促进和抑制作用的是()A、向光性B、应激性C、顶端优势D、向地性28、.下列关于体液免疫和细胞免疫的叙述,正确的是A、体液免疫具有特异性,细胞免疫没有特异性(1)(2)(3)(4)透B、浆细胞和效应T细胞均能产生抗体C、在细胞免疫的反应阶段主要进行B淋巴细胞的增殖和分化D、人体中的特异性免疫是细胞免疫和体液免疫共同完成29、人体内的细胞外液构成了细胞生活的液体环境,在这个环境中可发生许多生化反应,其中有A、蛋白质消化分解成氨其酸B、神经递质和激素的合成C、丙酮酸氧化分解成二氧化碳和水D、乳酸与碳酸氢钠作用生成乳酸钠和碳酸30、下列叙述正确的是A. 只有糖尿病人才会出现糖尿B. 正常人在吃甜食过多引起高血糖时,就会出现糖尿C. 运动员开始奔跑后,血糖浓度不会下降,所以没有肝糖元分解D. 血糖的主要来源是食物中的糖类,而主要去向是氧化分解放能二、简答题(本大题共40分)31、右图为突触模式图,请看图回答。
(12分)(1)、写出各编号的名称,并在图旁的方框内标出神经冲动的传递方向。
②、③、④。
(2)、结构②中所包含的化学物质称为,这些物质可与结构④作用,改变结构①的离子通透性,引起膜电位变化,兴奋传导到下一个细胞;结构②的形成与细胞器有关。
32、下图所示为某人在1小时内的血糖浓度变化曲线,请据图回答:(7分)(1)、实验的第10分钟,此人开始剧烈运动,血糖值由A点渐渐变化到B点,其原因是。
(2)、血糖值由B点变化到C点是由于分解为血糖,调节该过程的激素是。
(3)、使血糖由D点变化到E点的行为可能是。
(4)、调节血糖值由E点变化到F点的激素是,若该激素缺乏,则会导致病。
可见,血糖稳定是多种激素共同作用的结果。
33、用燕麦幼苗A、B、C、D和一侧带小孔的硬纸盒作如下实验:(8分)①将幼苗A放在硬纸盒里培养。
②将幼苗B的顶端用锡箔制成的小帽罩住,再放在硬纸盒里培养。
③将幼苗C的顶端以下部分用锡箔包好遮严,再放在硬纸盒里培养。
④将幼苗D的顶端切掉,再放在硬纸盒里培养。
(1)请根据上述四组实验,分析幼苗A、B、C、D各自生长情况:、、、。
(2)根据实验和的结果,可以说明感受光刺激的部位是,而向光弯曲的部位在。
34、下图所示为某种免疫过程示意图,据图回答下列问题:(13分)血糖水平(mg/100cm3)11090705030100 1 0 20 60时间(min)ABCDEF(1)b细胞为________,溶酶体分解抗原的过程在免疫学上属于______________。
(2)d细胞为________,在机体中该细胞是由________________增殖分化来的。
(3)若用大剂量的X射线杀死c细胞,对机体免疫会造成什么影响?______________。
(4)在该抗原刺激机体产生以上免疫过程时,同时刺激机体产生其他特异性免疫。
请说明免疫类型。
_______________________________。
(5)为验证T细胞是细胞免疫过程中的细胞,某生物兴趣小组以鼷鼠为实验动物进行了相关实验,请为其补全实验设计思路并得出结果。
A.切除鼷鼠的胸腺后,移植异体器官,移植器官保留在小鼠体内。
B.对照组:_____________________________。
C.实验组:____________________________。
高二(理)生物期中考试答题卡班级:座号:姓名:成绩:一、选择题(本大题共60分,每小题2分)二、简答题(本大题共40分)31、(1)②③④(2)32、(1)(2)(3)(4)33(1),,,(2)34、(1) ,。
(2) ________,。
(3)(4) _______________________________。
(5)B.对照组:。
C.实验组:。
高二答案31、(1)②突触小泡③线粒体④受体(2)神经递质高尔基体32、(1)剧烈运动时,血糖大量氧化分解(2)肝糖原胰高血糖素(3)进食或注射葡萄糖(4)胰岛素糖尿33、(1)A向小孔弯曲生长,B向上生长,C向小孔弯曲生长,D不弯曲不生长(2)②③芽的尖端尖端的下面一段34/解析:b细胞能吞噬入侵的抗原,是吞噬细胞。
溶酶体中有多种水解酶,能水解多种抗原,属于非特异性免疫。
d细胞能与靶细胞接触,使靶细胞裂解,因此是效应T细胞。
c 细胞是T细胞,在细胞免疫和体液免疫中有重要作用,T细胞死亡,细胞免疫丧失,体液免疫能力下降。
在该抗原刺激机体产生图中所示细胞免疫过程时,抗原进入靶细胞之前也刺激机体产生了体液免疫。
T细胞在胸腺中分化成熟。
切除胸腺的鼷鼠、不切除胸腺的鼷鼠、切除鼷鼠胸腺后再输入T细胞的鼷鼠三者进行对照,切除胸腺后再输入T细胞的鼷鼠属于实验组。
答案:(1)吞噬细胞非特异性免疫(2)效应T细胞T细胞或记忆细胞(3)c细胞被大量杀死,细胞免疫丧失,体液免疫能力下降(4)同时刺激机体产生体液免疫(5)对照组:做切除手术操作,但不切除胸腺,移植器官被排斥实验组:再输入T细胞,移植器官又被排斥。
