造血干细胞分选主要标志
造血干细胞解读

引起造血干细胞发生异常增生或抑制 原因
病毒感染: 化学因素:如苯基其衍生物 长期放射性元素接触:
造血干细胞临床应用:
1955年Thomas首先开展骨髓造血干细胞移植
根据细胞来源不同分:异基因骨髓移植跟自体造血干细 胞移植
造血干细胞来源不同分:骨髓移植、外周血干细胞移植、 脐带血干细胞移植、胎肝干细胞移植。
造血干细胞解读
定义:由胚胎干细胞发育而来,在造血微 环境及造血因子等诱导下,增殖、分化、 发育成熟为各系血细胞,它是所有血细胞 最原始的起点。具有高度自我更新能力和 多向分化能力,在造血组织中含量极少。
造血干细胞具有以下一般特征: 1.高度的自我更新能力; 2.多向分化能力,也称全能性; 3.造血干细胞具有不均一性,即多态性。
ቤተ መጻሕፍቲ ባይዱ
造血干细胞缺乏形态和表型特征,难以辨 认,但CD34抗原在干细胞为强阳性,一直 持续到晚期祖细胞,到分化为各系原、幼细 胞时,CD34抗原消失。这一特性,是造血 干细胞跟祖细胞分离纯化的主要标志。
目前CD34+造血细胞已经是公认的理想造血 干细胞、祖细胞移植物,可以长期重建髓系 和淋巴系造血干细胞和大量造血组细胞。
造血干细胞表面标志物

造血干细胞表面标志物造血干细胞(Hematopoietic stem cells, HSC)是一类成体干细胞,具有干细胞的特性:自我更新和分化潜能。
造血干细胞是一种骨髓来源的多能干细胞,它是血液系统中的“种子”细胞。
造血干细胞(HSCs)在造血过程中形成血系中的所有细胞,包括各种成熟细胞如白细胞、红细胞、血小板等。
在受到适当刺激时还分化为其他非造血组织(如脂肪细胞、心肌细胞、内皮细胞和胰腺细胞)[1]。
造血干细胞具有调节体内平衡、免疫功能、抗微生物、抗炎症等生物学功能。
它在血液病、遗传性血液病和自身免疫性疾病的治疗方面有重要作用。
1. 造血干细胞类型2. 造血干细胞的来源3. 造血干细胞的生物学特性4. HSC和免疫系统5. 人体造血系统层次6. 造血干细胞的细胞表面标志7. HSC的临床应用1. 造血干细胞类型已经定义了两种类型的造血干细胞:能够终生保持自我更新和多谱系分化潜能的长期再生细胞(LTRC);来源于LTRC的短期再生细胞(STRC),虽然它们保持了多能性,但它们表现出更有限的自我更新潜能。
它们重建髓系和/或淋巴系间隔的时间很短,大约6周。
2. 造血干细胞的来源造血干细胞存在于成年人的骨髓中,特别是在骨盆、股骨和胸骨中。
它们也存在于脐带血和少量的外周血中。
2.1 骨髓造血干细胞(HSCs)是一种骨髓来源的多能干细胞。
从骨髓中获取造血干细胞通过外科手术,从两个髂骨后嵴分次采集。
骨髓中每10万个细胞中约有1个是长期造血干细胞(LT-HSC)。
2.2 外周血大部分造血干细胞来源于骨髓,少量的干细胞和祖细胞在血液中循环。
人类造血干细胞的临床移植,可以从外周血中收集供体细胞。
造血干细胞的采集是在粒细胞集落刺激因子(G-CSF)等造血生长因子的作用下,将骨髓中的HSC动员到外周血后,通过分离的方式采集。
2.3 脐带血(UCB)脐带血是造血干细胞和造血祖细胞的丰富来源,它所含不同类型的造血祖细胞的数量大约是成人血液中观察到的数量的10倍。
人卫检验师精题解析血液

临床血液学检验基础知识1.属于血细胞生理学范畴的是:细胞分化2.属于遗传血液学范畴的是:信息传递3.胚胎时三个造血阶段是:相互交替,此消彼长4.只能短期重建造血的是:早期造血祖细胞5.进行不对称有丝分裂的是:造血干细胞6.在血细胞的增殖中,与多数系统增殖方式不同的是:巨核细胞7.出生后在正常情况侠,产生红细胞的场所是:骨髓8.B淋巴祖细胞的发育部位是:骨髓9.全身骨髓的髓腔内均为红骨髓的阶段是:<4岁10.在胚胎期,骨髓成为造血高度发育的阶段是在人胚发育的:第8个月11.属于多倍体细胞的是:巨核细胞12.可出现两种类型颗粒的细胞是:中幼粒细胞13.核染色质凝聚成条索状或块状,其中有明显间隙,核仁消失,胞质内血红蛋白呈嗜多色性,符合的是:中幼红细胞14.核染色质浓密成块,常呈车轮状或龟背状,无核仁,胞质丰富,有泡沫感,是:浆细胞15.正常骨髓中,粒细胞系统中比例最高的是:中性杆状核粒细胞16.粒细胞系统细胞体积最大的阶段是:早幼粒细胞17.胞质欧诺个开始出现嗜碱性颗粒的阶段是:中幼粒细胞18.正常情况下,既可出现在骨髓中,也可出现在外周血中的粒细胞是:杆状核粒细胞19.嗜酸性粒细胞体积最大的阶段是:中幼粒细胞20.在染色中加入L-酒石酸,观察抑制情况的化学染色:酸性磷酸酶染色21.过氧化物酶染色后显示颗粒粗大、成团块,几乎布满胞质,其阳性级别是:+++22.去吧过碘酸-雪夫反应阳性结果+和++的红色颗粒数量是:10个23.铁染色时,骨髓小粒中的铁属于:细胞外铁24.环形铁粒幼红细胞是指幼红细胞胞质内的蓝色颗粒在:6颗以上,围绕核周1/2以上25.铁粒红细胞指:成熟红细胞26.采用偶氮耦联法原理的化学染色是:碱性磷酸酶染色27.符合碱性磷酸酶火星生理性改变的是:分娩时活性增高28.属于急性淋巴细胞白细胞的化学染色特点是:过氧化物酶染色阳性的原始细胞<3%29.白血病细胞内无Auer小体的急性髓细胞性白血病类型是M030.与M0型急性髓细胞性白血病在形态学上类似的是ALL-L231.胞质中含密集的嗜苯胺蓝颗粒,并有短而粗的Auer小体,数条或数十条呈束状交叉排列,的白血病是:M332.M4型白血病的同质性白血病细胞增生型的特点是,白血病细胞在形态学上:同时具有粒系及单核系特征33.血象中篮细胞增多见于:慢性淋巴细胞白血病34.B细胞型慢性淋巴细胞型白血病主要表达的B细胞特异性抗原有:CD535.浆细胞白血病时,外周血白细胞分类中的浆细胞应>20%36.霍启金病的骨髓组织活检可将R-S细胞阳性率提高到9%-22%37.属于浆细胞病的是:骨髓瘤38.属于骨髓增生型疾病的是:骨髓纤维化39.粒细胞缺乏症的骨髓象主要表现为粒系细胞明显减低和缺乏:成熟阶段的中性粒细胞40.类白血病患者的骨髓象显示为:增生活跃41.维生素K缺乏时,水平或活性减低的项目是:蛋白C42.亚临床型血友病A时的FⅧ:C应为:26%-45%43.纤溶酶原活性增高见于:血栓前状态44.α2纤溶酶抑制物减低见于:DIC45.肩膀原发性纤溶症和继发性纤溶症的指标是:D-二聚体46.能够被蛋白C灭活的凝血因子是:Fva47.能特异性与t-PA以1:1比例结合,使其失活的物质是:PAI-148.血友病患者筛选试验中发生延长的凝血时间是:APTT49.区分遗传性和继发性铁粒幼型贫血的是:发病年龄50.正常情况下,人体内铁主要存在的形式是:铁蛋白51.关于微量元素铁:人体内铁主要经胆汁、尿液排泄52.成人外周血涂片出现有核红细胞最常见于:溶血性贫血53.细胞直方图出现双峰,底部变宽多见于:铁粒幼细胞贫血54.骨髓以中晚幼红增生为主,细胞内、外铁明显减少,最常见于:缺铁性贫血55.通过进行骨髓检查能做出准确判断的是:急性再生障碍性贫血56.铁吸收率的正确范围是:10%-35%57.导致维生素B12缺乏的原因是:全胃切除58.细胞外铁呈阴性,铁粒幼细胞占13%,可能是:缺铁性贫血59.红细胞镰变实验所用试剂是Na2S2O260.氰化高铁血红蛋白吸收峰(nm)是在:54061血清铁浓度减低见于:缺铁性贫血62.测总铁结合力需先测血清铁63.进行糖原染色时幼红细胞呈阳性反应的是:缺铁性贫血原始细胞>30%,过氧化物酶染色阴性或阳性率<3%,无Auer小体,免疫细胞化学MPO阳性,CD13、CD33、CD14、CD15、CD11b中至少有一种阳性。
骨髓瘤化疗后采集干细胞的指标标准

骨髓瘤化疗后采集干细胞的指标标准
骨髓瘤是一种恶性肿瘤,化疗是治疗骨髓瘤的常见方法之一。
在化疗后采集干细胞是为了进行自体干细胞移植,以帮助恢复骨髓功能。
在进行干细胞采集时,通常会根据一些指标和标准来评估患者的适宜程度。
以下是一些常见的指标和标准:
1. 血液学指标,包括血红蛋白水平、白细胞计数、血小板计数等。
这些指标可以反映患者的造血功能和血液状况,对于干细胞采集的适宜性有重要意义。
2. 肿瘤学指标,包括骨髓瘤的病情稳定程度、肿瘤负担等。
化疗后的肿瘤负担对于干细胞采集的适宜性有一定影响,通常需要确保肿瘤得到一定程度的控制。
3. 肝肾功能指标,包括肝功能、肾功能等。
这些功能的正常与否对于干细胞采集的安全性和成功性都有重要影响。
4. 干细胞数量指标,包括外周血干细胞数量、质量等。
这些指标可以直接反映干细胞采集的可行性和预期的收获量。
5. 心肺功能指标,包括心脏功能、肺功能等。
这些指标对于干细胞采集过程中的耐受性和安全性至关重要。
总的来说,干细胞采集的指标标准是多方面的,综合考虑患者的血液学、肿瘤学、肝肾功能、干细胞数量以及心肺功能等多个方面的指标,以确保干细胞采集的安全性和有效性。
医生会根据患者的具体情况进行评估,确定是否适合进行干细胞采集。
造血干细胞

组合的多样性
连接的多样性—N区插入
体细胞高频突变
概念:成熟B细胞在外周接触抗原后,V区 基因发生点突变,突变频率高于随机突变 (10-3) ,称为体细胞高频突变(somatic hypermutation) 后果:使BCR及分泌的抗体的亲和力提高, 称为Ig的亲和力成熟(affinity maturation)。
DN(双阴细胞)CD4-CD8- T细胞 (双阴细胞) 细胞 DP(双阳细胞) CD4+CD8+ T细胞 (双阳细胞) 细胞 SP(单阳细胞) CD4+CD8- T细胞 (单阳细胞) 细胞 或 CD4-CD8+ T细胞 细胞 T细胞库特性 细胞库特性 MHC限制性 限制性 对自身抗原的耐受性
外周淋巴器官
B细胞发育 的两个阶段
4. 抗原受体基因结构及其重排
TCR和BCR(Ig)的胚系基因结构 淋巴细胞发育过程中抗原受体基因重排
Ig的合成和肽链转运
5. 抗原受体多样性产生机制
BCR 组合多样性 连接多样性 N 区插入 体细胞突变 数量 + + +(仅 H 链有) + 10
14
TCR +(有效重排多于 BCR) + ++(各链均有,多于 BCR) 10
B细胞发育过程中的阴性选择 在B细胞发育过程中,可能出现针对自身 抗原的B细胞克隆。机体通过阴性选择过 程清除具有自身反应性的B细胞克隆,实 现中枢的自身耐受。 阴性选择的方式:
中枢克隆清除:B细胞凋亡 中枢克隆无能:B细胞无(或少)mIg 中枢受体修正:改变BCR原有的特异性
B细胞在骨髓的发育 细胞在骨髓的发育
6. BCR基因表达的特点
为什么Ig分子结构是完全对称的?
造血干细胞的提取

造血细胞分离、集落培养及表型分析所谓造血干细胞(hematopoietic stem cells,HSC,)是指具有自我更新和多向分化能力的一类细胞。
它的基本特性是具有自我更新能力,即经过一个细胞周期活动之后,可以产生两个与分裂前性质相同的造血干细胞,同时又具有多向分化能力,即在一定的环境条件下,造血干细胞具有向各系血细胞分化的能力。
图1 造血系统和造血干细胞分化图Fig。
1 hematopoietic system and hematopoietic stem cell differentiation.造血干细胞主要存在于骨髓、动员的外周血、脐血中,与骨髓和动员的外周血相比,脐血来源丰富、受病毒污染的几率小、富含造血干细胞且所含的造血干细胞具有更高的增殖潜能,同时脐血中的淋巴细胞幼稚,具有较低的免疫排斥活性,是优良的造血干细胞来源。
造血干/祖细胞鉴别的传统方法还是应用集落分析方法,它可检测粒-巨嗜细胞集落形成单位(colony - forming unit-granulocyte/ macrophage,CFU-GM)、红系爆式集落形成单位(burst-forming unit-erythroid,BFU-E)、巨核细胞集落形成单位(colony-forming unit-megakaryocyte,CFU-MK)、红系-粒系-巨嗜系-单核系集落形成单位(multipotent colony-forming units,CFU-GEMM 或mixed colony-forming unit,CFU-Mix),等等,它是在半固体培养基上培养14天,然后在显微镜下计数集落。
造血干细胞的表面标志随着个体发育的不同时期不同,CD34+、CD38-、HLA-DR-、Thy-1+、c-kit+、LFA-1-、CD45RA-、CD71-、lin-已经普遍被认为是造血干细胞的标志。
此外,1997年发现一个新的造血干细胞标志是AC133,但具CD34抗原是目前公认的造血干细胞和祖细胞的共同标志。
干细胞标志物

IWHLDA : 人 类 白 细 胞 分 化 抗 原 的 国 际 协 作 组 会 议 ( International workshop on human leukocyte differentiation antigens)
至2010 年已被确定人类CD抗原共363群(CD1-CD363),许多群 中还包括若干个亚群;根据分布的细胞系分为T细胞、B细胞、髓 细胞、NK 细胞、血小板、活化细胞、粘附分子、内皮细胞、细胞 因子受体、红细胞、树突状细胞、干细胞/祖细胞、碳水化合/凝 集素等CD抗原,共13组。 动物的白细胞分化抗原也逐渐地采用CD命名法,与人类CD相同的 ,加上与人类相同的编号。为了与人的CD相区别,在CD前加上动 物种类的的缩写,例如BoCD,表示牛的白细胞分化抗原。绵羊、 山羊、马的分别表示为OvCD、CpCD、EpCD。
作用:
1.参与细胞间的识别、细胞的活化和信号转导、细胞的增殖与分 化、细胞的伸展与移动
2.免疫应答、炎症发生、凝血、肿瘤转移、创伤愈合
细胞膜受体
受体:(receptor)是一种能够识别和选择性结合某种 配体(信号分子)的大分子物质。 配体(ligand):指细胞外的信号分子,包括激素,神经 递质,抗原,药物以及其他有生物活性的化学物质。
IL-4受体,细胞生长、分化 IL-6受体,细胞生长、分化 IL-7受体,细胞生长 -8受体,趋化和活化PMN
CDw130
AM64(IL-6R-gp130SIG)
广泛
IL-6受体gp130,转导信号
注:Thy:胸腺细胞;DC:树突状细胞:FDC:滤泡树突状细胞;B:B细胞; Bsub:B亚群;Pre-B,前B细胞;Bm:成熟B细胞;Ba:活化B细胞;T:T细胞; Tsub:T亚群;Ta:活化T细胞;M:Ma:活化单核细胞;Mac:巨噬细胞;Mas :肥大细胞;PC:浆细胞;G:粒细胞;PMN:多形核细胞;My:髓样细胞; NK:自然杀伤细胞;NKsub:NK亚群;LHC:表皮郎罕氏细胞;RS:ReedSrtenterg细胞;NEC:神经内分泌细胞;RBC:细细胞;Pt:血小板;Eo:嗜酸 性粒细胞;BM:骨髓细胞;Meg:巨核细胞;Fb:成纤维细胞;En:内皮细胞; Leu:白细胞;gp:糖蛋白;p:蛋白质;VLA:很晚出现在抗原;CALLA:共同 型急性淋巴母细胞白血病抗原;LAMP:溶酶体相关膜蛋白;MCP:膜辅蛋白; MAC:膜攻击单位;LFA:淋巴细胞功能相关抗原;CR:补体受体;3FAL:3fucosyl-N-acetyl-lactosamine;PECAM:血小板内皮细胞粘附分子;ECMR:细胞 外基质受体;LCA:淋巴细胞共同抗原;PTPase:磷酸酪氨酸磷酸酯酶;ICAM :细胞间粘附分子;N-CAM:神经细胞粘附分子;TAP:T细胞活化蛋白;Tyr-P :磷酸化酪氨酸;VCAM:血管细胞粘附分子;GPI:糖基磷脂酰肌醇;AIM:活 化诱导分子;LIF:白血病抑制因子;OSM:抑瘤素-M;CNTF:睫状神经营养因 子;CA:胶原蛋白;LM:层粘连蛋白;FN:纤粘连蛋白;FB:血纤维蛋白原; vWF:von Willbrand因子;TM-4:四次跨膜家族。
干细胞标志物

干细胞鉴定
一般生物学特性 细胞标志物 增殖能力 分化能力
干细胞标志物 有哪些?
细胞表面分子 细胞内特异基因的表达 细胞内特殊物质的表达 其他
细胞膜表面分子
又被称为膜抗原或者表面标记分子(surface marker) ,大多数为跨膜(糖)蛋白,结构上分为膜外区、跨膜 区和胞质区,胞质区执行信号转导功能。少数膜分子并 非跨膜蛋白,而是以糖基磷脂酰肌醇(GPI)方式连接 锚固在细胞膜上。
4.钙黏蛋白家族(cadherin family):指在Ca2+参与下使细胞间 相互聚集的细胞粘附分子,又称钙粘着蛋白(C-adherin)。 已知该家族有3个成员,分布在上皮组织的P-钙粘着蛋白、主 要分布在神经组织的N-钙粘着蛋白、分布在胎盘和间皮组织的 P-钙粘着蛋白。 5.未归类的黏附分子
细胞因子受体的分类
• I型细胞因子受体家族(红细胞生成素受体超家族)
•
• •
II型细胞因子受体家族
Ⅲ型肿瘤坏死因子受体超家族 Ⅳ型趋化性细胞因子受体家族(G-蛋白偶联受体)
MHC
在诱导移植排斥反应过程中发挥主要作用的组织抗原被称为主 要组织相容性抗原(major histocompatibility antigen)。
包括LFA-1、 LFA-2、 LFA-3、ICAM-1、 ICAM-2和一些补体受 体等。
2.选择素家族(selectin family)
主要包括白细胞-选择素、血小板-选择素和内皮细胞-选择素3 种,即CD62L、CD62P和CD63E。
3.免疫球蛋白超家族( Ig superfamily)
共15个,主要有主要有CD2、CD4、CD8、CD28、CD31、CD54、 CD58、CD80、CD86。
临床血液学检验-1-1-造血组织和造血调控

CD34 - 、Lin + + 原幼细胞成熟和功能完善
45
图 造血干细胞的自我维持和早期、晚期造血祖细胞群体
(3)造血祖细胞的形态学
39
造血干细胞
CD34 +细胞
CD34 - 细胞
CD34 + 细胞
造血干细胞
早期 造血祖细胞
图 造血干细胞和CD34 +细胞
40
(5)造血干细胞的检测
单个细胞在生物体内有能力长期重建造血是判断该细 胞为造血干细胞的“金标准” 造血干细胞的数量极少,且形态上不能区别,目前还 没有建立体外直接测定造血干细胞的方法 脾集落测试法(脾集落形成试验):1961年Till等首先 采用小鼠脾集落形成试验间接证明了造血干细胞的存 在 免疫表型检测:用流式细胞术检测及分选D34+CD38— 细胞,其性能接近于造血干细胞
图 造血理论的完善及其衍生的医学
32
(一)造血干细胞、造血祖细胞
1.
造血干细胞(hematopoietic stem cell,HSC)
(1)概念 造血干细胞:是具有高度自我更新能力和多向分化能 力,在造血组织中含量极少,形态上难以辩认的类似 小淋巴细胞样的一群异质性的细胞群体
33
(2)造血干细胞的基本特征
造血干细胞随血流大量迁移到肝、脾及淋巴结等部位
3
图 卵黄囊血岛形成
4
血岛细胞 周边部分细胞 原始内皮细胞(血管干细胞) 原始血管壁 中央部分细胞
原始血细胞(造血干细胞)
生成原红细胞样细胞
迁移到肝、脾及淋巴组织
5
2.
肝脏造血
造血时间:始于人胚胎发育第6周初,至第5个月后逐渐 减弱,到出生后停止
造血组织
临检易错题-临床血液学检验

临检易错题-临床血液学检验临床血液学检验第二章造血与血细胞分化发育1、造血干细胞的主要分子标志是CD342、红细胞破坏后,主要被单核-巨噬细胞系统吞噬3、原始细胞胞体大、核浆比大第三章骨髓细胞学检查的临床意义1、核质发育不平衡见于白血病、巨幼细胞贫血和缺铁性贫血2、小红细胞<6μm、大红细胞>10μm、巨红细胞>15μm第四章血细胞化学染色的临床应用1、抗酒石酸酸性磷酸酶染色:戈谢细胞+、尼曼-匹克细胞—;多毛细胞白血病+、慢性淋巴细胞白血病—;T淋巴细胞+、B淋巴细胞—;2、非特异性酯酶染色:急性单核细胞白血病+,可被氟化钠抑制急性粒细胞白血病+,不被氟化钠抑制3、碱性磷酸酶染色:正常:30~130①细菌感染时NAP积分增高,病毒感染不变;②慢性粒细胞白血病,NAP积分明显减低常为0类白血病反应时,NAP积分值明显增高;③急性粒细胞白血病时NAP减低,急性淋巴细胞白血病NAP增高;④再障时NAP增高,PNH时NAP减低。
4、缺铁性贫血时,骨髓细胞外铁明显减低,甚至消失;铁粒幼细胞的百分率减低。
骨髓外铁是观察骨髓小粒中的铁。
5、PAS染色,红血病或红白血病时幼红细胞可呈阳性反应。
6、特异性酯酶染色:萘酚AS-D氯乙酸酯酶,NSE。
粒细胞系统染色阳性,其余都为阴性。
第六章染色体检查1、慢性粒细胞白血病:t(9;22)2、急性早幼粒白血病:t(15;17)第七章贫血及其细胞学检验1、PNH:筛选试验—蔗糖溶血试验确诊实验—酸化血清溶血试验(Ham test),pH6.4~6.52、G6PD:高铁血红蛋白还原试验、变性珠蛋白小体生成试验、荧光斑点试验和G6PD活性检测3、红细胞丙酮酸激酶缺陷症:筛检试验:PK荧光斑点法确认试验:PK活性检测4、HbA2增多见于β珠蛋白合成障碍性贫血5、急性造血功能停滞,亦称再生障碍危象。
表现为血中红细胞及网织红细胞减少或全血细胞减少。
多数骨髓增生活跃,粒红比增高,在骨髓中可见巨大原始红细胞是其突出特点。
流式细胞术分析造血干细胞

造血干细胞HSC1简介造血干细胞(HSC)是罕见的能自我更新的祖细胞,可产生所有血细胞谱系。
此外,HSC能够在移植后的主要受辐照接受者中长期产生所有血细胞类型,并且能够自我更新,因此可以将细胞移植到第二宿主中,从而引起长期的多谱系再造种群。
HSC静态、自我更新和分化之间的平衡在很大程度上取决于HSC跟环境的相互作用。
在发育中的胚胎中,HSC驻留在尚未形成小生态的胎儿肝脏中,可延长细胞寿命。
从E 17.5开始,骨髓被HSC所定居,在整个成年期BM仍然是主要的造血生境。
成年后,最原始的HSC被认为位于BM中最缺氧的微环境中,即低氧干细胞生态位,从而维持了原始表型和细胞周期的静止,从而避免了HSC衰老。
可以基于表面标志物表达,通过流式细胞术分离小鼠HSC。
从BM中分离小鼠HSC的第一步通常是去除表达特异于终末分化血细胞的“谱系”(Lin)抗原的成熟细胞,Lin包括F4/80+/Mac1+单核和巨噬细胞,Gr1+粒细胞,CD11c+DC细胞,CD4+/CD8+/CD3+ T细胞,CD5+ CD19+ B220+ B 细胞,NK1.1+ NK细胞和Ter119+红细胞。
这些抗原在HSC上不存在。
然后,HSC作为谱系阴性(Lin–)细胞进一步富集,表达细胞表面标志物的组合。
常用的标记包括Thy1.1,c-Kit和Sca1。
因此,多能造血祖细胞已被纯化为Lin-Thy1.1lo c-Kit+ Sca-1+细胞,占有核BM细胞的<0.1%。
尽管该种群包含小鼠中的所有多能祖细胞,但它仍然是异质的,除了长期重建的HSC外,还包含瞬时重建的多能祖细胞。
长期自我更新的HSC与短暂重构的多能祖细胞之间在表面标志物表达上存在差异,两种祖细胞群能够区分。
Lin-c-Kit+ Sca-1+Thy1.1loCD150+CD48-群体(SLAM细胞)主要包含长期自我更新的HSC,Lin-c-Kit+Sca-1+Thy1.1loCD150+CD48+群体主要包含瞬时自我更新的多能祖细胞,Lin-c-Kit+Sca-1+Thy1.1loCD150-CD48+群体主要包含非自我更新的多能祖细胞,可据此进行流式分选或移植分析。
免疫细胞:造血干细胞(HSC) PPT课件

脐血T、B细胞相对不成熟,GVHD发生率低; 脐血NK和LAK细胞多,有利于GVL; 脐血含基质细胞,能提供HSC生长的微环境。
2009.02.27报道:
一名26岁产妇临产前突然查出患白血病,第 三军医大学新桥医院的专家待其分娩后,用该产 妇父亲“骨髓和外周血” HSC+ 婴儿出生时采集 的脐带血对白血病进行联合移植治疗,获得成功。
通过造血干细胞“动员”技术,使骨髓 HSC 进入外周血,采集分离约 200ml外周血
即可获得足够数量HSC并用于移植。
脐血移植:
脐带血是胎儿娩出、脐带结扎并离断后 残留在胎盘和脐带中的血液,含有可以重建 人体造血和免疫系统的HSC,可用于移植。
脐血移植的优势:
来源丰富、取材简单; 对供受体HLA相符的要求相对较低; 不易受病毒或残留肿瘤细胞污染; HSC增殖和自我增殖能力强;
适应症:
恶性血液疾病
重症免疫缺陷
遗传性疾病
某些自身免疫病
放/化疗后造血支持
造血干细胞移植包括:
骨髓移植 外周血干细胞移植 脐血移植
骨髓移植:
20 世纪 50 年代开始使用。 HSC 存在于扁骨、
不规则骨和长骨两端的红骨髓,为采集600ml骨髓,
需给供者局部麻醉,经多次骨穿才能完成。
外周血干细胞移植:
造血干细胞与基因治疗
HSC是导入外源基因理想的靶细胞:
HSC具有自我更新能力,可在患者体内长期存 活并表达外源基因产物; HSC具有多向分化潜能,分化成的转基因血细 胞可分布全身发挥效应; 多种疾病与造血细胞异常有关,将缺学家在Science上报道:
从 2 名患有严重免疫缺陷症的患儿骨髓中抽取 HSC ,以逆转录病毒为载体,将正常基因导入 其中,然后回输给病孩。经 10 个月随访,获得 较满意的效果,患儿免疫系统达到正常水平。
造血细胞分离、集落培养及表型分析

造血细胞分离、集落培养及表型分析动性好,同时也避免了细胞因受力而损伤的情况。
流式细胞仪通过激光束照射细胞,检测细胞表面标记物的荧光强度,进而分析细胞表型,包括细胞表面标志、大小、形态等。
2、集落培养集落培养法是一种常用的检测造血干细胞的方法。
将待测细胞在半固体培养基中培养,待细胞分裂形成集落后,根据集落的形态和数量来判断细胞的分化能力。
常用的集落包括粒-巨嗜细胞集落形成单位(CFU-GM)、红系爆式集落形成单位(BFU-E)、巨核细胞集落形成单位(CFU-MK)等。
集落培养法可以检测细胞的增殖能力和分化潜能,是评估细胞功能的重要方法。
二、实验步骤1、细胞样品制备将待测细胞制成单细胞悬液,使得细胞可以均匀地分布在流式细胞仪的流动室中,方便后续的细胞表型分析。
2、流式细胞仪分析将制备好的细胞悬液加入样品管中,加入特异性荧光染料后,通过流式细胞仪进行细胞表型分析。
根据细胞表面标志物的荧光强度,可以判断细胞的类型和状态。
3、集落培养将待测细胞在半固体培养基中培养,待细胞分裂形成集落后,根据集落的形态和数量来判断细胞的分化能力。
常用的集落包括粒-巨嗜细胞集落形成单位(CFU-GM)、红系爆式集落形成单位(BFU-E)、巨核细胞集落形成单位(CFU-MK)等。
三、实验结果分析通过流式细胞仪和集落培养的结果,可以分析细胞的表型和功能。
例如,CD34+、CD38-、HLA-DR-、Thy-1+、c-kit+、LFA-1-、CD45RA-、CD71-、lin-等标志物被广泛认为是造血干细胞的标志。
同时,集落培养的结果也可以评估细胞的增殖能力和分化潜能。
这些结果对于研究造血干细胞的生物学特性和临床应用具有重要意义。
本实验采用流式细胞仪技术对脐血中的造血干细胞进行分离和检测。
流式细胞仪的测量区利用样品流和鞘流的气压差的层流原理,使细胞依次排列成单行,每个细胞以均等的时间依次通过测量区。
被荧光染料染色的细胞受到强烈的激光照射后发出荧光,同时产生散射光。
【完整版】造血及造血干细胞PPT文档

二、造血祖细胞
造血祖细胞(HPC)是指一类由造血干细胞分 (一)中胚叶造血期(卵黄囊造血期)
实验证明:骨髓、外周血以及脐血中CD34+细胞分别占有核细胞的0.
造血祖细胞(HPC)是指一类由造血干细胞分化而来,部分或全部失去身我更新能力的过渡性、增殖性细胞群,具有定
化而来,部分或全部失去身我 向分化和增殖的能力,也称定向干细胞。
血岛中央部分间质细胞——多项潜能的造 血干细胞(HSC),迁移到肝、脾、骨髓、淋巴 组织。
(二)肝脏造血期
此期始于胚胎第6周,至胚胎第7个月,3~6 个月的胎儿,肝脏是主要的造血地点,卵黄囊血岛 的造血干细胞种植到肝脏,造血以RBC为主,4个 月后有粒细胞生成,肝不生成淋巴细胞,出生时肝 脏停止造血。
2、骨髓干细胞分化为:
(1)红系(1)红系祖细胞为红细胞集落形成单位 (CFU-E)→ 有核RBC → RBC
(2)粒、单核系祖细胞为粒、单核细胞集落形成单位 (CFU-GM)
粒细胞集落形成单位(CFU-G)→ 中性粒细胞
CFU——GM
单核细胞集落形成单位(CFU-M)单核细胞
粒-单核细胞集落形成单位
。 主要分布在红骨髓、脾脏及淋巴结
造血干细胞包括三级不同分化水平的干细胞,即原始造血干细胞 (或称多能干细胞)、定向干细胞及其成熟的子代细胞。原始造 血干细胞具有自我更新和分化两种重要潜能,赋予机体在生命过 程中始终保持造血能力。正常情况下,大部分骨髓多能干细胞处 于静止状态,当机体需要时,其中一部分增殖分化,发育为定向 干细胞;另一部分则分裂增殖,以维持多能干细胞数量的相对恒 定。在多能干细胞发育为各种成熟血细胞的过程中,几乎每一阶 段均需多种细胞因子的参与。胸腺、骨髓微环境是造血干细胞发 育分化的必要条件。在体外干细胞或祖细胞培养中,骨髓或胸腺 基质细胞对支持细胞生长和促进分化起关键作用。定向干细胞包 括髓系干细胞和淋系干细胞,前者可分化为红系干细胞、粒细胞 -单核细胞系干细胞、巨核干细胞,并进一步分化成熟为相应血 细胞;后者可分化为前体B细胞(pro-B)和前体T细胞(pro-T),它
干细胞标记物

胸腺抗原-1(Thy-1、CD90)
为GPI (糖磷脂酰肌醇glycophosphatidylinositol,GPI) 连结的膜分子,主要分布在胸腺T细胞、NK细胞和神经元。Thy-1是用来鉴别造血干 细胞的种系特异性标志物.Thy-1在CD34阳性细胞中表达最高,是比CD34更早期的造 血干/祖细胞表面标志,并且当造血干细胞开始表达其分化细胞类型(如CD45RA,CD38, 和CD71)时,他的表达开始下降 .
“通用的”干细胞标记:ABCG2/Bcrp1 (St. Jude Children's Research Hospital )
多能干细胞标记 :干细胞因子 Oct-4 波形蛋白 硷性磷酸酶
鉴定干细胞的常用方法: 细胞形态和结构 细胞功能 细胞表面的特殊标志
细胞内特异基因的表达
胚胎干细胞的常用标志: Oct-4 SSEAs TRA-1-60和TRA-1-81
CD34-----CD45: 研究发现CD34 + 细胞往往同时表达CD45 抗原(LCA ) 并以180 KD 的CD45RO 和200 KD 的CD45RA 两种异构体为主,并通过实验证明,造血干细胞在分化过程中CD45 抗原表达, 早期是以CD45RO 为主,在分化过程中CD45RA 表达上调。
因此在原始hsc分离鉴定上abcg2比cd34更有希望abcg2在sp细胞上的专一表达提示abcg2可能成为是成体多能干细胞阳性筛选的潜在标志物血管内皮生长因子受体2kdrvegfr2是造血干细胞的表面标志多能干细胞限于cd34和kdr部分cd34kdr细胞亚群则主要包括一些系特异定向祖细胞kdr受体血管内皮生长因子受体可作为一种判别hsc和kdr受体血管内皮生长因子受体可作为种判别hsc和造血祖细胞hematopoieticprogenitorcellshpc的标志
造血干细胞分化图
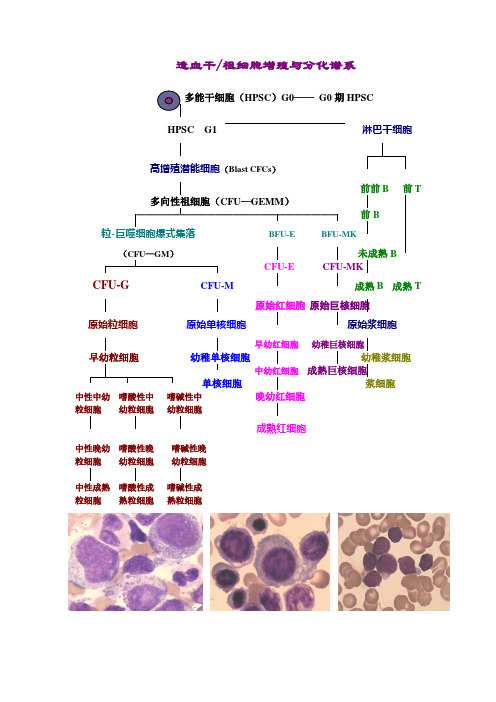
造血干/祖细胞增殖与分化谱系多能干细胞(HPSC)G0——G0期HPSCHPSC G1 淋巴干细胞高增殖潜能细胞(Blast CFCs)前前B前T 多向性祖细胞(CFU—GEMM)———————————————————————前B 粒-巨噬细胞爆式集落BFU-E BFU-MK(CFU—GM)未成熟BCFU-E CFU-MK CFU-G CFU-M 成熟B成熟T原始红细胞原始巨核细胞原始粒细胞原始单核细胞原始浆细胞早幼红细胞幼稚巨核细胞早幼粒细胞幼稚单核细胞幼稚浆细胞中幼红细胞成熟巨核细胞单核细胞浆细胞中性中幼嗜酸性中嗜碱性中晚幼红细胞粒细胞幼粒细胞幼粒细胞成熟红细胞中性晚幼嗜酸性晚嗜碱性晚粒细胞幼粒细胞幼粒细胞中性成熟嗜酸性成嗜碱性成粒细胞熟粒细胞熟粒细胞缺铁性贫血巨幼红细胞性贫血再生障碍性贫血珠蛋白生成障碍性贫血异常血红蛋白病遗传性球形红细胞增多症遗传性椭圆形红细胞增多症遗传性口形红细胞增多症葡萄糖-6-磷酸脱氢酶缺乏症丙酮酸激酶缺乏症阵发性睡眠性血红蛋白尿症自身免疫性溶血性贫血冷凝集素综合征高铁血红蛋白症硫化血红蛋白症真性红细胞增多症白细胞减少症中性粒细胞减少症和粒细胞缺乏症传染性单核细胞增多症急性微分化性白血病(M0)急性粒细胞白血病未分化性(M1)急性粒细胞白血病部分分化性(M2a)M2b(M2b)急性颗粒增多的早幼粒细胞白血病(M3a)M3b 急性粒-单核细胞白血病(M4a M4b M4c M4EO)急性单核细胞白血病(M5a)M5b红白血病(M6)急性巨核细胞白血病(M7)急性淋巴细胞白血病(ALL)T-细胞型:(Ⅰ、Ⅱ、Ⅲ型)B-细胞型:前前B 、前B 、Common 型、B-ALL急性混合细胞白血病(HAL) 浆细胞白血病嗜酸粒细胞白血病 嗜碱粒细胞白血病多毛细胞白血病(HCL) 慢性淋巴细胞白血病 (CLL)慢性粒细胞白血病(CML)肥大细胞白血病大颗粒淋巴细胞白血病幼淋细胞白血病骨髓增生异常综合征(MDS:RA RAS RAEB RAEBT)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
造血干细胞分选主要标志
造血干细胞是血液系统中最基础的细胞类型,其具有极强的自我
更新和分化能力,可以分化为各种具有特定功能的血细胞,如白细胞、红细胞和血小板等。
在临床治疗中,造血干细胞分选可以帮助医生寻
找到适合患者的干细胞,用于造血干细胞移植,以治疗一系列血液和
免疫系统相关疾病。
而造血干细胞分选所依据的主要标志则成为了重
要的参考指标。
造血干细胞分选所基于的主要标志主要包括以下几个方面:
第一、表面标记的克隆化抗体
在造血干细胞表面,存在着多种特异的抗原。
这些抗原可以通过
克隆化抗体进行检测。
其中,CD34是目前应用最为广泛的标志物之一。
CD34能够标记出具备造血干细胞特异性的人类骨髓细胞群,对于造血
干细胞的分选十分重要。
第二、表面标志的共有抗原
除了特异性抗原外,造血干细胞表面还存在着共有的抗原。
这些
共有抗原对于干细胞分选同样具有重要的作用。
此处的共有抗原包括
CD45和CD71,它们能够被所有造血系细胞表达,因此可以从细胞表面
的角度来确定造血干细胞。
第三、功能标志
除表面标记外,功能标志也是造血干细胞分选的重要参考因素。
在这个方面,可以根据细胞的内在功能特性,如依赖多能性(CFU-Mix)的形态、元素的吞噬等方面来对造血干细胞进行分选。
最后,需要强调的是,造血干细胞分选主要标志是多种因素综合
作用的结果。
因此在干细胞分选过程中,应该综合考虑多种检测因素,包括表面标记的克隆化抗体、表面标志的共有抗原、功能标志等因素。
只有全方位地综合考虑这些因素,才能更好地判断一个细胞是否适合
用于造血干细胞移植等临床治疗。
