最新溶质质量分数计算题
初三化学溶质质量分数计算习题

关于溶质质量分数的练习1.6g大理石样品与50g稀盐酸恰好完全反应(杂质不参与反应且不溶于水),生成二氧化碳2.2g。
求:反应后溶液中溶质的质量分数(计算结果保留一位小数)。
2.将6.8 g含杂质的锌粒加入到80 g过量的稀硫酸中(锌与稀硫酸反应的化学方程式:Zn+H2SO4==ZnSO4+H2↑;杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液质量为86.3 g。
试计算:(1)反应生成氢气的质量;(2)锌粒中所含锌的质量分数(精确到0.1%)。
3.鸡蛋壳的主要成分是碳酸钙。
小丽称取15g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了40g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量50.6g。
计算:当碳酸钙恰好完全反应时所得溶液中溶质的质量分数。
(结果保留1位小数)4.28g石灰石样品与210.8g稀盐酸恰好完全反应后(样品中的杂质既难溶于水,又不与稀盐酸反应),生成了8.8g二氧化碳。
(溶解在水中的二氧化碳忽略不计)计算:(1)该石灰石样品中碳酸钙的质量分数。
(2)所得溶液的溶质质量分数。
5. 向某铁粉样品中,加入溶质质量分数为16%的硫酸铜溶液100 g,恰好完全反应,样品中杂质不溶于水也不与硫酸铜反应。
请结合下图提供的数据计算。
(1)框图中的“固体6.8g”是(“纯净物”或“混合物”)(2)求a的数值。
(3)向不饱和滤液中加入100.8 g水,求所得溶液中溶质的质量分数。
6.(3分)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g 于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将烧杯内剩余物质过滤、洗涤、干燥后得滤渣2g。
请计算瓶内过氧化氢溶液中溶质的质量分数。
7.(3分)课外小组同学将100g盐酸分5次加入到35g某石灰石样品中(已知杂质不与盐酸反应),得到如下部分数据和图象。
初三化学 有关溶质质量分数的计算典型五种例题

有关溶质质量分数的计算的五种典型题目第1课时题型一:例题1.每天补充适量的维生素C,有利于提高人体免疫力。
某维生素C泡腾片,每片含1g维生素C,将1片该泡腾片投入适量水中,最终得到250g溶液,计算此溶液中维生素C的质量分数。
练习1.蒸干15克NaCl溶液得到1.2克NaCl,计算原溶液中NaCl的质量分数。
练习2.在一定温度时,NaCl饱和溶液的质量是12g,把它蒸干后,得到3.2gNaCl,计算:(1)该温度时NaCl饱和溶液中溶质的质量分数(2)配制该温度时NaCl饱和溶液1000g,需水和NaCl各多少g?(3)这一温度下NaCl的溶解度?练习3.在80g质量分数为15%NaNO3溶液里加入20g水或20g NaNO3,计算这两种方法制成的两种溶液中溶质的质量分数。
题型二:例题1.某温度时,氯化钾的溶解度为40g,求该温度时,氯化钾饱和溶液中溶质的质量分数。
例题2.10L密度为1.84g/cm3、溶质质量分数为98%的浓硫酸,其中溶液质量为 ,溶质质量为。
练习1.配制500mL质量分数为10%NaOH溶液(密度为1.1g/cm3),需NaOH和H2O 各多少克?练习2.从10L密度为1.84 g/cm3、溶质的质量分数为98%的浓硫酸中取出1L,取出的溶液中溶质的质量分数为,溶质质量为,含纯硫酸的质量为。
练习3.下列四种KCl溶液,溶质的质量分数最大的是()A.15gKCl溶于85g水中B.85g溶液中含有KCl的质量为15gC.20gKCl配成120g溶液D.一定量的KCl加入80g水配成100g溶液第2课时题型三:例题1.把50g质量分数为98%的H2SO4溶液稀释成质量分数为20%的硫酸溶液,需要加水多少克?练习1.需要配制500g质量分数为10%的盐酸,需要质量分数为38%的盐酸(密度为1.19g/cm3)多少毫升?练习2.配制500mL质量分数为20%的H2SO4溶液,需要质量分数为98%H2SO4溶液多少毫升?需要加水多少毫升?查阅资料:密度(g/cm3) 1.07 1.14 1.30 1.5 1.81 1.84% 10 20 40 60 90 98练习3:将100g10%的蔗糖溶液的溶质质量分数为20%,可采用的方法有 ( ) A.加入10g蔗糖 B.蒸发掉50g水C.把溶剂蒸发掉一半D.加入12.5g蔗糖题型四:例题1.50g10%的KNO3溶液与50g30%的KNO3溶液混合后,所得混合溶液的溶质质量分数是多少?练习1.100mL20%的食盐水与200mL20%的食盐水相混合,得到食盐水的溶质质量分数为()A.5% B.10% C.15% D.20%题型五:例题1.含80g碳酸钙的石灰石跟稀盐酸反应来制取二氧化碳,求:(1)制得多少克二氧化碳?(2)若所用盐酸的质量分数为36.5%,密度为1.19g/cm3,需用盐酸多少毫升?例题2.32.5g锌可以与200g某稀硫酸恰好完全反应,计算:(1)这种稀硫酸中溶质的质量分数是多少?(2)反应后所得溶液中溶质的质量分数是多少?(3)若将100g这种稀硫酸稀释成溶质的质量分数为20%的硫酸溶液,需要加水多少克?练习1.139mL密度为1.05g/cm3的盐酸与石灰石25g恰好完全反应,生成8.8g 二氧化碳.计算:(1)盐酸中溶质质量分数;(2)石灰石中碳酸钙的质量分数;(3)生成溶液中溶质的质量分数。
中考化学专题练习-溶质的质量分数及相关计算

精品基础教育教学资料,仅供参考,需要可下载使用!备战中考化学专题练习(全国通用)-溶质的质量分数及相关计算(含答案)一、单选题1.将50g 98%的浓硫酸溶于450g水中,所得溶液中溶质的质量分数为()A. 9.8%B. 10.2%C. 10.8%D. 19.6%2.t℃时,甲物质的饱和溶液的溶质质量分数为15%,乙物质的溶解度为15g,丙物质的10g 饱和溶液蒸干后可得1.5g丙.当这三种物质的饱和溶液的质量相等时,含溶质的质量多少的顺序是()A. 丙>甲=乙B. 甲>乙>丙C. 乙>甲=丙D. 甲=丙>乙3.如图是A、B、C三种物质的溶解度曲线.下列说法错误的是()A. C的溶解度随温度的升高而减小B. t2℃时A、B、C的溶解度大小为A=B>CC. t2℃时,A、C的饱和溶液降温到t1℃时,A、C两溶液中溶质的质量分数相等D. t1℃时,A的饱和溶液中溶质质量分数为20%4.向100g溶液质量分数为10%的氯化钠溶液中加入10g硝酸钾,并完全溶解,该溶液中氯化钠的溶质质量分数会()A. 变大B. 变小C. 不变D. 无法确定5.要使20℃时饱和氢氧化钙溶液的溶质质量分数发生改变,可采取的措施有()①升高温度至30℃;②降低温度至10℃;③加入10g水;④加入1g氢氧化钙;⑤加入1g氧化钙;⑥蒸发掉10g的水,再恢复温度到20℃.A. ①③④B. ②⑤⑥C. ①③⑤D.②④⑤6.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。
下列说法正确的是()③④⑤资料:A的溶解度温度20 30 40 50 60/℃溶解度37.2 41.4 45.8 50.4 55.2/gA. ②中A的质量分数最大B. ③⑤中A的质量分数相等C. ②④⑤的溶液为饱和溶液D. ①③④⑤中没有固体存在7.已知20℃时100g水中最多能溶解36g氯化钠。
20℃时向100g水中加50g氯化钠,充分溶解后,所得溶液中溶质的质量分数为()A. 36%B. 50%C. 33.3%D. 26.5%二、填空题8. 现有1000g溶质质量分数为10%的氯化钠溶液,其中所含溶质的质量是________g;若将此溶液稀释为4%的稀溶液,需加水________g。
初中化学溶质的质量分数计算题

溶质的质量分数计算题、固体物质未完全溶解型1、20c 时,将50gNaCl 放入100g 水中,充分搅拌后所得NaCl 溶液的溶质质量分数是(20C 时NaCl 的溶解度为36g )解析:由溶解度概念知,20C 时100g 水中最多能溶解36gNaCl,而题目却给出了50g,很显然NaCl 未完全溶解,溶液已达到饱和。
故该溶液中NaCl 的质量分数36”“100%=265%10036、结晶水合物溶于水型2、将10g 胆研溶解在90g 水中,则所得溶液中溶质的质量分数为解析:因胆矶溶于水后,其溶质为CUSO 4,而非CUSO 4•5H 2O,10g 胆矶中所含CuSO 4的质量。
故该溶液中溶质的三、所加物质与水反应型3、将31gN%O 溶于69g 水中,所得溶液中溶质的质量分数是多少?解析:由于酸性氧化物(或碱性氧化物)溶于水后,该物质不是溶质,而是与水发生反应后,生成相应的酸(或碱)才是溶质,故解此类题时,应先根据反应的化学方程式计算出生成的溶质量,再求溶液中溶质的质量分数。
质量分数 m(CuSO 4) 422100%=-64g 100%=6.4%10g90g解:设Na2O与水发生反应生成NaOH的质量为x Na2OH2O=2NaOH628031gx62_31g80一x解得:x=40g溶液中溶质的质量分数为40g 100%=40%31g69g四、多种溶质型4、在常温下向100g5%的氯化钠溶液中加入5g 氯化钾粉末,完全溶解后,氯化钠溶液的溶质质量分数是数要分别进行计算,但溶液的质量都按混合溶液的总质量计算,在100g5%的氯化钠溶液中 加5g 氯化钾完全溶解后,溶质氯化钠的质量不变,但溶液的质量增加了5g,因此氯化钠溶液的溶质质量分数为:五、将浓溶液加水稀释型5、把40g30%的NaOH 溶液加水至100g,取出其中的10g,这10g 溶液中溶质的质量分数是六、与化学反应有关型6、向400g 溶质的质量分数为4.9%的稀硫酸中加入足量的锌粒,充分反应后,求所得溶液中溶质的质量分数为多少?解析:稀硫酸与足量的锌粒发生化学反应后,溶液中的溶质不是H 2SO 4,而是ZnSO 4,故计算时要根据反应的H 2SO 2质量求出参加反应的Zn 的质量,和生成的ZnSO 4的质量,以及产生H 2的质量。
中考化学溶质的质量分数训练及答案

经典例题例1.将100mL98%的浓硫酸(密度为1.84g/mL)缓缓倒入100mL水中,搅拌均匀,计算所得溶液中溶质的质量分数。
浓硫酸的质量=100mL×1.84g/mL=184g 浓硫酸中溶质的质量=184g×98%=180.32g稀硫酸的质量是浓硫酸质量加上水的质量184g+100mL×1g/mL=284gω(H2SO4)=(180.32g/284g)×100%=63.5%【答案】稀释后浓硫酸溶液中硫酸的质量分数为63.5%。
例2.常温下将10g下列固体与90g水充分混合,所得溶液的溶质质量分数最小的是()A.胆矾B.氧化钙C.氧化钠D.硝酸钾【分析】计算溶液中溶质的质量分数关键在于判断溶液中溶质是什么,同时求出溶质和溶液的质量各是多少。
物质溶解在水中有下列几种情况需要考虑:①物质在溶解时没有生成新物质且该不含有结晶水,溶质为物质本身,如KNO3,其质量分数等于[10g/(10g+90g)]×100%=10%;②结晶水合物溶于水,溶质应为无水物,结晶水成为溶剂的一部分,如CuSO4·5H2O,这种情况溶质的质量减少了,故溶质质量分数小于10%;③物质溶解时发生化学变化,生成了新物质,溶质为生成物,如Na2O溶于水,溶质质量为NaOH,溶质的质量分数>10%;④溶质质量分数还受溶解度的影响,如常温下将10g氧化钙溶于90g水充分混合,虽然CaO与水混合后溶液中溶质为Ca(OH)2,但其质量分数却比胆矾溶液水所得溶液得溶质质量分数小,这是因为CaO溶于水生成的Ca(OH)2微溶于水,只有极少量的Ca(OH)2溶解于水。
【答案】 B例3.一定量溶质质量分数为8%的食盐水蒸发掉50g水后,溶质质量分数增大一倍,则原溶液中溶质的质量为()A. 8gB. 6.4gC. 3.2gD. 4g【分析】欲使某溶液中溶质质量分数增大一倍,在恒温下蒸发掉的溶剂质量应等于原溶液质量的一半,故本题蒸发50g水以前溶液的质量为100g,故溶质质量为100g×8%=8g。
溶质的质量分数及基本计算练习题(超经典)

第九单元溶液课题3 溶液的浓度1.一定温度下,从100 g 20%的某溶液中取出10 g,剩下的溶液溶质质量分数为A.20% B.18%C.10% D.2%2.对“10%的NaCl溶液”提供的信息理解正确的是A.浓度很小,所以是稀溶液B.表示100 g水可以溶解10 g NaClC.表示该NaCl溶液中含有10 g NaCl,90 g水D.表示该NaCl溶液中NaCl与水的质量比为1∶93.一定温度下,向图I烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是A.所得溶液一定是饱和溶液B.溶质的溶解度变大C.溶质的质量分数可能增加D.溶质的质量一定变大4.下列有关溶液的说法正确的是A.同种溶质的饱和溶液一定比不饱和溶液溶质质量分数大B.溶液中溶质只有一种,溶剂可以多种C.有色溶液可以通过颜色判断浓度大小D.长期放置后不会分层的液体一定是溶液5.现有W克溶质的质量分数为15%的A溶液,欲使其溶质的质量分数增至30%,可采取的方法有A.蒸发掉溶剂的二分之一B.蒸发掉0.5W g溶剂C.加入0.15W g A物质D.加入3 g A物质6.向一定质量溶质质量分数为20%的硝酸钾溶液中同时加入4 g硝酸钾和16 g水,所得的溶液中溶质质量分数为A.20% B.15%C.10% D.无法计算7.下列做法能改变溶液中溶质质量分数的是A.将硝酸钾饱和溶液降温B.将硝酸钾饱和溶液升温C.把氯化钠的饱和溶液恒温蒸发D.向蔗糖的饱和溶液中再加少量蔗糖8.现需要将溶质质量分数为40%的氢氧化钠溶液稀释为40 g溶质质量分数为5%的氢氧化钠溶液。
此时,需要加入水的体积为A.38 mL B.36 mLC.35 mL D.37 mL9.R是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图所示:某化学兴趣小组的同学进行了如下图所示实验:则下列说法不正确的是A.t2 ℃时,硝酸钾饱和溶液的溶质质量分数为37.5%B.R是KNO3C.②③中清液是饱和溶液D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小10.现有某锌铝合金(Zn—Al)样品8.3 g,将其放入200 g稀硫酸中,经测定恰好完全反应,蒸发结晶,称量所得固体质量为27.5 g,则所用稀硫酸的溶质质量分数为A.6.26% B.9.8%C.19.6% D.22.6%11.[2018·金华] 20 ℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。
第15讲溶质质量分数的计算

•答案: (1)24 kg (2)11.7% (3)氯化钠12.3 kg 水37.7 kg
•1.下列对20%的氯化钠溶液的理解无错误的 是( ) •A.该溶液中溶质与溶剂质量比为1∶5 •B.100 g该溶液中含溶质20 g •C.该溶液100 g水中溶有溶质20 g •D.该溶液中溶剂和溶液的质量比为1∶5 •答案: B
•答案: (1)7.5 g (2)AB 量筒 搅拌加速固体 溶解 (3)2.5 g
•方法总结
• 本题容易出错的地方是错误操作。对药品 实际质量的计算,要严格按照公式: 左物右码: 物质的质量=砝码的质量+游码的质量;左码 右物: 物质的质量=砝码的质量-游码的质量 。
• 例4(2012·重庆)盐水选种是我国古代劳动 人民发明的一种巧妙的挑选种子的方法, 农业 生产上常用质量分数为15%~20%的氯化钠溶液 来选种。
•答案: B
•11. (12分)(2012·山西)某实验室欲配制一定溶 质质量分数的KNO3溶液,现实验室只有含少 量NaCl的KNO3固体药品。
•(1)查阅KNO3和NaCl的溶解度曲线如图。从 图中可得到的一条信息是20 ℃时, KNO3的溶 解度为31.6 g(合理即可)。
•A. 23%
B. 46%
•C. 55%
D. 72%
•方法总结
• 乙醇溶液中溶质的质量分数=乙醇质量/( 乙醇质量+水质量)×100%, 因此需要判断溶 质乙醇与溶剂水的质量关系;每个乙醇 (C2H5OH)分子中含6个氢原子, 每个水(H2O) 分子中含2个氢原子;根据“乙醇分子里所含 的氢原子总数与水分子里所含的氢原子总数 相等”可推算溶液中乙醇与水的质量关系, 据 此完成解答。
• 例3(2012·滨州)实验室需要配制15%的氯化 钠溶液50 g。 •(1)计算: 需要氯化钠的质量为________。 •(2)某同学按下图所示步骤依次操作:
初中化学溶质的质量分数练习题(含答案)
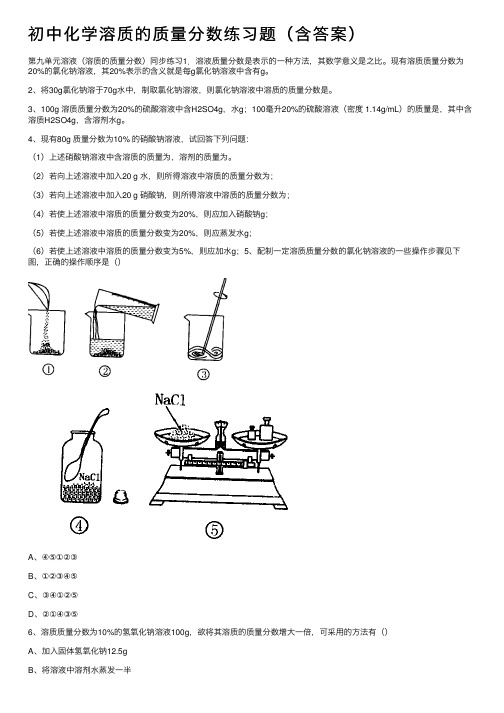
初中化学溶质的质量分数练习题(含答案)第九单元溶液(溶质的质量分数)同步练习1.溶液质量分数是表⽰的⼀种⽅法,其数学意义是之⽐。
现有溶质质量分数为20%的氯化钠溶液,其20%表⽰的含义就是每g氯化钠溶液中含有g。
2、将30g氯化钠溶于70g⽔中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数是。
3、100g 溶质质量分数为20%的硫酸溶液中含H2SO4g,⽔g;100毫升20%的硫酸溶液(密度 1.14g/mL)的质量是,其中含溶质H2SO4g,含溶剂⽔g。
4、现有80g 质量分数为10% 的硝酸钠溶液,试回答下列问题:(1)上述硝酸钠溶液中含溶质的质量为,溶剂的质量为。
(2)若向上述溶液中加⼊20 g ⽔,则所得溶液中溶质的质量分数为;(3)若向上述溶液中加⼊20 g 硝酸钠,则所得溶液中溶质的质量分数为;(4)若使上述溶液中溶质的质量分数变为20%,则应加⼊硝酸钠g;(5)若使上述溶液中溶质的质量分数变为20%,则应蒸发⽔g;(6)若使上述溶液中溶质的质量分数变为5%,则应加⽔g;5、配制⼀定溶质质量分数的氯化钠溶液的⼀些操作步骤见下图,正确的操作顺序是()A、④⑤①②③B、①②③④⑤C、③④①②⑤D、②①④③⑤6、溶质质量分数为10%的氢氧化钠溶液100g,欲将其溶质的质量分数增⼤⼀倍,可采⽤的⽅法有()A、加⼊固体氢氧化钠12.5gB、将溶液中溶剂⽔蒸发⼀半C 、加⼊100g10%的氢氧化钠溶液D 、蒸发掉50g ⽔E 、加⼊50g40%的氢氧化钠溶液7、将m g 硝酸钾的不饱和溶液恒温蒸发⽔分⾄有晶体析出,在此变化过程中溶液⾥溶质质量分数 p % 与时间t 的关系正确的是()8、在45g20%的KCl 溶液中加⼊ 8g KCl 后再加⼊14g ⽔,所得溶液恰好为20℃的饱和溶液,则所得溶液中溶质的质量分数为。
9、下图是某同学配制⼀定质量的0.9%⽣理盐⽔的全过程:(1)请找出上图中的错误:①;②。
溶质的质量分数计算题

溶质的质量分数计算题一、固体物质未完全溶解型1、20℃时,将50g NaCl放入100g水中,充分搅拌后所得NaCl溶液的溶质质量分数是(20℃时NaCl的溶解度为36g)解读:由溶解度概念知,20℃时100g水中最多能溶解36g NaCl,而题目却给出了50g,很显然NaCl未完全溶解,溶液已达到饱和。
故该溶液中NaCl的质量分数36?100%?265%?.100?36二、结晶水合物溶于水型2、将10g胆矾溶解在90g水中,则所得溶液中溶质的质量分数为解读:因胆矾溶于水后,其溶质为CuSO,而非CuSO·5HO,10g胆矾中所含CuSO4442的质量。
故该溶液中溶质的m(CuSO)6.4g44%6.?100%???100%?质量分数m(CuSO?5HO)?m(HO)10g?90g242三、所加物质与水反应型3、将31g NaO溶于69g水中,所得溶液中溶质的质量分数是多少?2解读:由于酸性氧化物(或碱性氧化物)溶于水后,该物质不是溶质,而是与水发生反应后,生成相应的酸(或碱)才是溶质,故解此类题时,应先根据反应的化学方程式计算出生成的溶质量,再求溶液中溶质的质量分数。
解:设NaO与水发生反应生成NaOH的质量为x2NaO?HO?2NaOH 2262 8031g x31g62?80xx?40g 解得:40g?100%?40% 溶液中溶质的质量分数为31g?69g四、多种溶质型4、在常温下向100g 5%的氯化钠溶液中加入5g氯化钾粉末,完全溶解后,氯化钠溶液的溶质质量分数是1 / 13溶质质量?100%?,混合溶液中各种溶质的质量分解读:因溶液中溶质的质量分数溶液质量数要分别进行计算,但溶液的质量都按混合溶液的总质量计算,在100g 5%的氯化钠溶液中加5g氯化钾完全溶解后,溶质氯化钠的质量不变,但溶液的质量增加了5g,因此氯化钠溶液的溶质质量分数为:m(NaCl)100?5%?100%??100%?4.76%m(Nacl)?m(HO)?m(KCl)100?52五、将浓溶液加水稀释型5、把40g 30%的NaOH溶液加水至100g,取出其中的10g,这10g溶液中溶质的质量分数是m(NaOH)?100%?由题意可知,稀释后溶液的溶质质量分数解读:m(NaOH)?m(HO)240?30%12%???100%100六、与化学反应有关型6、向400g溶质的质量分数为4.9%的稀硫酸中加入足量的锌粒,充分反应后,求所得溶液中溶质的质量分数为多少?解读:稀硫酸与足量的锌粒发生化学反应后,溶液中的溶质不是HSO,而是42ZnSO,故计算时要根据反应的HSO质量求出参加反应的Zn的质量,和生成的ZnSO的4224质量,以及产生H的质量。
有关溶质质量分数的计算精选题

有关溶质质量分数的计算精选题一、选择题(本题共计 10 小题,每题 3 分,共计30分,)1. 在Mg食盐溶液中含有食盐mg,则该溶液的质量百分比浓度是()A.mM ×100% B.mM−m×100%C.m M+m ×100%D.MM−m×100%2. 电解水时,常在水中加入少量的硫酸以增强水的导电性.若用8%的硫酸溶液200g,通以直流电进行电解水实验,过一段时间后,溶液中硫酸的质量分数为10%,则已电解的水的质量为()A.10gB.20gC.32gD.40g3. 用60%的酒精溶液a和25%的酒精溶液b配制成45%的酒精溶液,所用a、b溶液的质量比为()A.1:2B.4:3C.2:3D.3:14. 现有100克溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数增加一倍,下列操作中正确的是()A.加入食盐10克B.加入水50克C.蒸发掉溶剂的一半D.加入100克溶质质量分数为30%的食盐溶液5. 传统“陈醋”生产过程中有一步称为“冬捞夏晒”.是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质,假设用醋酸的质最分数为5%的半成醋,生产1000g10%的优级醋,过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为()A.500gB.400gC.2000gD.1000g6. 20∘C时,NaCl的溶解度是36g,在20∘C时将20g食盐放入50g水中得到溶液的溶质质量分数是()A.26.5%B.36%C.28.6%D.40%7. 把40g20%的氯化铵溶液与60g30%的氯化铵溶液混合,混合后的溶液中氯化铵的质量分数应()A.大于30%B.小于20%C.等于25%D.在20%∼30%之间8. 向20%的硝酸钾溶液中再加入1.5克硝酸钾和6.0克水,全部溶解后,所得溶液的溶质质量分数为()A.等于20%B.大于20%C.小于20%D.无法判断 9. ag食盐溶液中含有bg水,则该溶液中溶质的质量分数为()A.ab×100% B.aa+b×100%C.ba×100% D.a−ba×100%10. 一定质量的稀硫酸和氢氧化钠溶液恰好完全反应,所得溶液中溶质质量分数为10%,则溶液中钠离子和水分子的个数比为()A.1﹕71B.2﹕71C.1﹕79D.2﹕79二、填空题(本题共计 10 小题,每题 3 分,共计30分,)11. 配制2000g生理盐水(溶质质量分数为0.9%),需要称取NaCl的质量为________,水的质量为________.12. 氯化钠与人类健康以及生产活动密切相关.医疗上的生理盐水是由氯化钠配制而成的.每100g生理盐水中含有________ g氯化钠.13. 某食品加工厂生产酱油中氯化钠的质量分数为17%,该厂日产酱油15t.试计算该厂每月消耗氯化钠的质量是多少?________.14. 含溶质ag溶剂bg的溶液,溶质的质量分数是________.15. 15.4gNaCl完全溶解在如图甲所示的水中,将完全溶解后所得溶液全部倒入原量筒中,液面位置如图乙,则所得NaCl溶液的密度为________,溶质的质量分数为________.16. 1.8L密度为1.50g⋅mL−1,质量分数为60%的硫酸溶液的质量是________g,其中H2SO4________g,含水________g。
溶质的质量分数计算(含答案)

溶质的质量分数计算一、单选题(共7道,每道14分)1.向50 g质量分数为5%的硫酸钠溶液中加入5g硫酸钠,完全溶解后,所得溶液中硫酸钠的质量分数为( )A.5%B.10%C.13.6%D.15%答案:C解题思路:溶质的质量分数等于溶质质量与溶液质量之比。
根据题意,所得溶液中的溶质包含原溶液中的溶质和新加入的溶质,溶液质量为原溶液的质量和新加入的溶质。
故选C。
试题难度:三颗星知识点:溶质质量分数的计算2.现有100g 20%的某物质的溶液,要使其溶质的质量分数减小为原来的一半,可采取的方法正确的有( )①再加入10 g溶质②再加入100 g溶剂③再加入100 g该溶液④与200 g 5%的该物质溶液混合A.1个B.2个C.3个D.4个答案:B解题思路:溶质的质量分数等于溶质质量与溶液质量之比。
题中要求溶质的质量分数减小为原来的一半,即变成10%,判断所采取的方法是否能达到目的即可。
①再加入10 g溶质,增加溶质,溶液浓度会变大,不会减小,①不符合题意。
②再加入100 g溶剂,②符合题意。
③再加入100 g该溶液,溶液具有均一性,质量分数相等的溶液混合,所得溶液中溶质的质量分数不会改变,③不符合题意。
④与150 g 5%的该物质溶液混合,④符合题意。
综上所述,②④符合题意,故选B。
试题难度:三颗星知识点:溶质质量分数的计算3.现有氯化钠溶液140 g,当蒸发掉20 g水或向原溶液中加入4 g氯化钠(假设过程中溶质均不析出),可得到质量分数相同的氯化钠溶液,则原溶液中含氯化钠的质量是( )A.24 gB.30 gC.16 gD.20 g答案:D解题思路:溶质的质量分数等于溶质质量与溶液质量之比。
根据题意,蒸发掉20 g水或向原溶液中加入4 g氯化钠,可得到质量分数相同的氯化钠溶液,分别表示出两个过程中的溶质质量分数,建立等式即可。
设原溶液中含氯化钠的质量为x,则,解得x=20g,故选D。
试题难度:三颗星知识点:溶质质量分数的计算4.20℃时,KNO3的溶解度为31.6g,向100 g KNO3饱和溶液中再加5 g KNO3晶体后,在温度不变的条件下,所得溶液中溶质的质量分数为( )A.27.6%B.24.0%C.31.6%D.34.9%答案:B解题思路:饱和溶液中,溶质质量分数(ω)与溶解度(S)的关系为。
九年级溶质质量分数计算题

九年级溶质质量分数计算题
一、题目
将10g氯化钠固体完全溶解在90g水中,求所得溶液中溶质的质量分数。
二、解析
1. 明确溶质和溶剂的质量
溶质是氯化钠,其质量公式。
溶剂是水,质量为公式。
根据溶液质量=溶质质量 + 溶剂质量,可得出溶液质量公式。
2. 计算溶质质量分数
溶质质量分数公式。
把公式,公式代入公式,可得公式。
再看一道稍微复杂一点的题目:
一、题目
向100g溶质质量分数为10%的氢氧化钠溶液中,加入12.5g氢氧化钠固体,完全溶解后,求所得溶液中溶质的质量分数。
二、解析
1. 计算原溶液中溶质的质量
已知原溶液质量公式,溶质质量分数公式。
根据溶质质量公式,可得原溶液中氢氧化钠的质量公式。
2. 计算加入固体后溶质的总质量和溶液的总质量
加入公式氢氧化钠固体后,溶质的总质量公式。
溶液的总质量公式。
3. 计算所得溶液中溶质的质量分数
溶质质量分数公式。
溶质质量分数计算(含答案)

溶质质量分数计算一、单选题(共10道,每道10分)1.把15 g固体硝酸钾放入85 g水中,完全溶解后,溶液中硝酸钾的质量分数为( )A.15%B.17.6%C.21.4%D.85%答案:A解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
把15 g固体硝酸钾放入85g水中,完全溶解后,溶质质量为15g,溶剂质量为85g,则溶液质量为15g+85g=100g。
故选A。
试题难度:三颗星知识点:溶质质量分数的计算2.向50 g溶质质量分数为5%的硫酸钠溶液中加入5g硫酸钠,完全溶解后,溶液中硫酸钠的溶质质量分数为( )A.5%B.10%C.13.6%D.15%答案:C解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
50 g溶质质量分数为5%的硫酸钠溶液中,溶质质量为50g×5%=2.5g,溶液质量为50g。
向原溶液中又加入5g硫酸钠,完全溶解后,溶质质量为 2.5g+5g=7.5g,溶液质量为50g+5g=55g。
故选C。
试题难度:三颗星知识点:溶质质量分数的计算3.现有100g20%的某溶液,要使其溶质质量分数增大一倍,可采取的方法是( )A.加入20g溶质B.蒸发掉一半溶剂C.蒸发掉50g水D.加100g50%的该溶液答案:C解题思路:溶质质量分数等于溶质质量与溶液质量之比,可表示为(无论溶液是否饱和均适用)。
其中,溶液质量=溶质质量+溶剂质量。
要使溶质的质量分数增大,方法有加入溶质、蒸发溶剂、加入浓度较大的同种溶液。
使100 g 20%的某溶液溶质质量分数增大一倍,即增大到40%。
100 g 20%的溶液中,溶质质量为100g×20%=20g,溶液质量为100g,溶剂的质量为100g-20g=80g。
①若采用加入溶质的方法,设需要加入溶质的质量为x,则加入溶质后的溶液中溶质的质量为20g+x,溶液的质量为100g+x,溶质的质量分数为40%,,解得x=33.3g,故需要加入溶质的质量为33.3g,A错误。
最新有关溶液的溶质质量分数计算题汇编

有关溶液的溶质质虽分数计算题一、利用溶质质量分数的定义式及变形式的相关计算题1. 在农业上,有时用10%〜20%的食盐溶液来选种。
现配制15%的食盐溶液200kg需要食盐和水各多少千克?2. 将60g20%的食盐溶液和30g5%的食盐溶液相混合,求所得混合溶液的溶质的质量分数。
3. 向100g溶质的质量分数为10%勺KNOB液中加入10g水后,所得溶液的溶质质量分数为;若加入10 g KNO后,溶质的质量分数为4.200C时,将一溶质质量分数为20%勺氯化钠溶液蒸干,得到20g固体,求该溶液质里。
*5.实验室要配制50g溶质质量分数为20%勺硝酸钾溶液。
现有25g溶质的质量分数为40%勺硝酸钾溶液、20g溶质的质量分数为15%勺硝酸钾溶液及足够多的硝酸钾晶体和蒸僻水,二、饱和溶液中溶质质量分数的相关计算1. 已知T °C时,硝酸钠的溶解度为80g,求这温度时硝酸钠饱和溶液的溶质的质量分数2. 某种物质的水溶液,加热蒸发掉10g水,冷却到20C,有晶体析出。
此时溶液中溶质的质量分数为26%,求20 C时该物质的溶解度。
3. 在60C时,50g水中最多能溶解55g硝酸钾把60C时210g水中的硝酸钾饱和溶液蒸发掉50g水,再降到60C,求析出晶体后溶液的溶质的质量分数。
三、溶液的稀释浓缩相关计算:(一)不涉及体积的计算:1. 将200g含水99%J NaO船液的含水量变为98%应蒸发掉多少克水?2. 欲配制50g3%勺氯化钠溶液,需6%勺氯化钠溶液和水各多少克?,(二)涉及体积的计算1. 用98%的浓硫酸(密度为1.84g/cm3)配制成25%的稀硫酸500g,需浓硫酸和水多少毫升?2. 把5mL溶质的质量分数为62%的浓硝酸(密度为l.38g/cm3 )和20mLzK混合,计算稀释后硝酸的溶质的质量分数。
四、有关溶液的标签型题的计算:1.实验室有一瓶未开封的浓盐酸,部分标签如右图所示。
(1)这瓶浓盐酸中溶液的质量为多少克?(2)若用这瓶浓盐酸来配制200g溶质质量分数为10%勺稀盐酸,需量取浓盐酸多少毫升,水多少毫升?8、右图是某公司生产的浓硫酸的标签示意图,根据图示信息试回答下列问题*①该瓶粮硫酸的质量是____ 克,②该Jffi中含硫酸克;③若配制100克19一6%的稀硫酸溶液,需这种浓硫酸多少毫升?水多少毫升?(请写出计算过程):分析纯500mL硅酸含量98%密度L84克厘米:杂质含量符合要求X X化工有限公司初中化学有关溶液的溶质质量分数计算题答案:一、 定义式及变形式1.氯化钠:30Kg 水:170Kg 2. 15% 3. 9.1% 18.2% 4. 100g 5. 10g硝酸钾固体和 40g 水;25g40% 硝酸钾溶液和25g 水;20g15%勺硝酸钾溶液7g 硝酸钾和23g 水 二、 饱和溶液中溶质质量分数的相关计算 1.44.4% 2. 35.1g 3. 52.4%三、 溶液的稀释浓缩相关计算:(一) 不涉及体积的计算: 1.水100g 2. 6%的氯化钠溶液:25g 水:25g (二) 涉及体积的计算 1.浓硫酸:69.3毫升水:372.4毫升2. 15.9% 3. 30.9%四、 有关溶液的标签型题的计算:1. ( 1) 590g (2)浓硫酸45.8毫升水145.9毫升2. 2% 五、 在溶液中进行化学反应的溶质质量分数的相关计算(一) 基本计算型1. 稀硫酸溶质质量分数 98%所得溶液的质量分数:15.1%解:设反应生成的 H2质量为x,消耗的H2SO4质量为y,生成硫酸锌的质量为 z Zn + H2SO4 = ZnSO4 + H2 f 65 98 161 26.5g y Z X 65:2=6.5g:X X=0.2g 65:98=6.5g:y y=9.8g 65:161=6.5g:Z Z=16.1g稀硫酸溶质质量分数:9.8g/100g*100%=9.8% 所得溶液的质量分数:16.1g /(6.5g+100g-0.2g)*100%=15.1%答:稀硫酸溶质质量分数 9.8%所得溶液的质量分数 15.1% o2. 稀盐酸质量73g 生成物溶液中溶质质量分数:14.1%(二) 质量守恒型1. (1)生成二氧化碳的质量:12.5g+50g-58.1g=4.4g (2)石灰石中CaCO3勺质量分数:80%(3)盐酸中溶质的质量分数:14.6%(4)反应后溶液中溶质的质量分数: 20% 设参加反应的碳酸钙质量为 x,消耗的盐酸溶质质量为y,生成CaCl2的质量为z CaCO2HCl=CaCk + H 2O + CO4 100 73 111 44X y z 4.4g 100:44=x:4.4g x=10g 73:44=y:4.4g y=7.3g 111:44 = z:4.4g z=11.1g 石灰石中 CaCO3勺质量分数:10g/12.5g*100%=80% 盐酸中溶质的质量分数: 7.3g/50g*100%=14.6%反应后溶液中溶质的质量分数: 11.1g/(10g+50g-4.4g)*100%=20%答:生成二氧化碳的质量 4.4g ,石灰石中CaCO3勺质量分数80%,盐酸中溶质的质量分数 14.6%,反应后溶液中溶质 的质量分数为20%2. 解:(1)铁和稀硫酸反应的化学方程式为: Fe+HSO —FeSQ+f f(2)完全反应后,容器中的物质的质量差,就是生成氢气的质量,氢气的质量为:33.2g+10.8g-43.9g=0.1g .故填: 0.1g .解:小烧杯中稀硫酸废液的质量为:33.2g-18.2g=15.0g设与铁反应的硫酸的质量为 X,Fe + H 2SQ —FeSQ+ H 2T 98X该废液中硫酸的质量分数为:答:废液中硫酸的质量分数是 (4)如果铁钉的铁锈未除净,则铁锈消耗一部分硫酸,根据氢气求出的硫酸质量就偏小,从而使计算出的硫酸的质 量分数偏小. 故填:偏小;铁锈也能消耗一部分硫酸.(三) 与体积有关的溶液计算题1. 浓盐酸易挥发解:设该盐酸中溶质的质量为 X 。
化学溶质的质量分数习题

化学溶质的质量分数习题1.现有20℃时NH4Cl饱和溶液200g,今欲改变该饱和溶液中溶质的质量分数,可采取的措施是()A.保持温度不变,蒸发掉20g水B.保持温度不变,加入20gNH4Cl固体C.保持温度不变,取出20g溶液D.保持温度不变,加入20g水2.用溶质的质量分数为98%的H2SO4(密度为1.84g/cm3)来配制44mL 20%的H2SO4(密度为1。
14g/cm3),需要98%H2SO4的体积是()A.1。
8mLB.5.6mLC.7。
8mLD.10.2mL3.把70%的硝酸(密度为1。
44g/cm3)与等体积的水混合,所得稀硝酸中溶质的质量分数是( )A.等于35%B.小于35%C.大于35%D.无法确定4.今有60g溶质的质量分数为10%的NaNO3溶液,欲将其溶质的质量分数增大一倍,应采用的方法是( )A.把溶剂蒸发掉一半B.加入6gNaNO3晶体C.把溶剂蒸发掉30gD.加入20%的NaNO3溶液30g5.将80g10%的NaOH溶液与20g15%的NaOH溶液混合,混合溶液中溶质的质量分数为( )A.13%B.12%C.11%D.16%6.下图是a、b两种固体物质的溶解度曲线,下列说法中不正确的是()A.a的溶解度大于b的溶解度B.在25℃时,a、b的饱和溶液中溶质的质量分数相等C.当a中混有少量b时,可用结晶法提纯D.a、b都属于易溶物质7.将质量各为mg的Na2O和NaCl,分别加入到ng水中,完全溶解后得到a和b两种溶液.下列说法中正确的是( )A.该温度下NaCl的溶解度为(100m/n)gB.a、b两种溶液中溶质的质量分数相同C.a比b溶液中溶质的质量分数大D.a、b两种溶液的质量相等8.20℃时,某物质R的不饱和溶液中溶质的质量分数为10%,若向该溶液中再加入5g R或蒸发掉32。
26g水,都可以形成饱和溶液。
那么该物质在20℃时其饱和溶液中溶质的质量分数是()A.10%B.13。
溶质的质量分数计算题

溶质的质量分数计算题一、固体物质未完全溶解型1、20℃时,将50g NaCl 放入100g 水中,充分搅拌后所得NaCl 溶液的溶质质量分数是(20℃时NaCl 的溶解度为36g )解读:由溶解度概念知,20℃时100g 水中最多能溶解36g NaCl ,而题目却给出了50g ,很显然NaCl 未完全溶解,溶液已达到饱和。
故该溶液中NaCl 的质量分数=+⨯=3610036100%265%. 二、结晶水合物溶于水型2、将10g 胆矾溶解在90g 水中,则所得溶液中溶质的质量分数为 解读:因胆矾溶于水后,其溶质为CuSO 4,而非CuSO 4·5H 2O ,10g 胆矾中所含CuSO 4的质量。
故该溶液中溶质的质量分数=⋅+⨯=+⨯=m(CuSO m(CuSO H O m(H O g g g44225100%641090100%64%))).. 三、所加物质与水反应型3、将31g Na 2O 溶于69g 水中,所得溶液中溶质的质量分数是多少?解读:由于酸性氧化物(或碱性氧化物)溶于水后,该物质不是溶质,而是与水发生反应后,生成相应的酸(或碱)才是溶质,故解此类题时,应先根据反应的化学方程式计算出生成的溶质量,再求溶液中溶质的质量分数。
解:设Na 2O 与水发生反应生成NaOH 的质量为xNa O H O NaOH 222+=62 80 31g x628031=g x解得:x g =40 溶液中溶质的质量分数为403169100%40%g g g+⨯= 四、多种溶质型4、在常温下向100g 5%的氯化钠溶液中加入5g 氯化钾粉末,完全溶解后,氯化钠溶液的溶质质量分数是解读:因溶液中溶质的质量分数=⨯溶质质量溶液质量100%,混合溶液中各种溶质的质量分数要分别进行计算,但溶液的质量都按混合溶液的总质量计算,在100g 5%的氯化钠溶液中加5g 氯化钾完全溶解后,溶质氯化钠的质量不变,但溶液的质量增加了5g ,因此氯化钠溶液的溶质质量分数为:m(NaCl m(Nacl m(H O m(KCl )))).++⨯=⨯+⨯=2100%1005%1005100%476% 五、将浓溶液加水稀释型5、把40g 30%的NaOH 溶液加水至100g ,取出其中的10g ,这10g 溶液中溶质的质量分数是解读:由题意可知,稀释后溶液的溶质质量分数=+⨯m(NaOH m(NaOH m(H O )))2100% =⨯⨯=4030%100100%12% 六、与化学反应有关型6、向400g 溶质的质量分数为4.9%的稀硫酸中加入足量的锌粒,充分反应后,求所得溶液中溶质的质量分数为多少?解读:稀硫酸与足量的锌粒发生化学反应后,溶液中的溶质不是H 2SO 4,而是ZnSO 4,故计算时要根据反应的H 2SO 2质量求出参加反应的Zn 的质量,和生成的ZnSO 4的质量,以及产生H 2的质量。
(完整版)溶质的质量分数练习

溶质的质量分数练习篇一:溶质质量分数的计算练习题溶质质量分数的计算1.t℃时,A物质的溶液120g,蒸发掉20g水或加入5gA物质后,溶液均达到饱和,则原溶液溶质的质量分数是() A.% B.20%C.%D.%2、把100克98%的硫酸稀释成10%的硫酸,需加水() A、880克B、800克C、88克 D、100克3、将98%(密度为 g/cm3)的浓硫酸10毫升缓慢倒入100毫升水中稀释后,求稀硫酸溶液中溶质的质量分数的计算式正确的是() A、(10××98%)/(100×1+10×)×100%B、(10×98%)/(100×1+10×98%)×100% C、(10××98%)/(100×1+10××98%)×100% D 10/(100+10)×100%4、某化工厂实验室需要配制5000克20%的盐酸,需38%的盐酸(密度 /cm3)为() A、2211毫升B、1000毫升C、2200毫升D、2632毫升5. 溶质的质量分数为30%的某溶液蒸发掉10g水后,溶液中溶质的质量分数变为40%,则原溶液的质量() A. 30gB. 40g C. 50g D. 70g6.如图是a、b两种固体物质的溶解度曲线,下列说法错误的是()℃时,A、B的饱和溶液中溶质的质量分数相同B.将a的饱和溶液从20℃升温到30℃时,溶液中溶质的质量分数不变C.当A中混有少量B时,可用冷却热饱和溶液方法提纯A;D.在t2℃时,将均含100g水的A、B的饱和溶液分别降温至t1℃,析出晶体量相等7. A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。
B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。
向烧杯中加入一种物质后,甲试管中固体增加,乙试管中的固体减少,则加入的物质可能是() A.硝酸铵 B.氢氧化钠C.氧化钙 D.氯化钠8.图2为A物质的溶解度曲线,回答下列问题:⑴30℃时,A的饱和溶液中,溶质和溶剂的质量比为。
(完整版)溶质的质量分数练习

溶质的质量分数练习篇一:溶质质量分数的计算练习题溶质质量分数的计算1.t℃时,A物质的溶液120g,蒸发掉20g水或加入5gA物质后,溶液均达到饱和,则原溶液溶质的质量分数是() A.% B.20%C.%D.%2、把100克98%的硫酸稀释成10%的硫酸,需加水() A、880克B、800克C、88克 D、100克3、将98%(密度为 g/cm3)的浓硫酸10毫升缓慢倒入100毫升水中稀释后,求稀硫酸溶液中溶质的质量分数的计算式正确的是() A、(10××98%)/(100×1+10×)×100%B、(10×98%)/(100×1+10×98%)×100% C、(10××98%)/(100×1+10××98%)×100% D 10/(100+10)×100%4、某化工厂实验室需要配制5000克20%的盐酸,需38%的盐酸(密度 /cm3)为() A、2211毫升B、1000毫升C、2200毫升D、2632毫升5. 溶质的质量分数为30%的某溶液蒸发掉10g水后,溶液中溶质的质量分数变为40%,则原溶液的质量() A. 30gB. 40g C. 50g D. 70g6.如图是a、b两种固体物质的溶解度曲线,下列说法错误的是()℃时,A、B的饱和溶液中溶质的质量分数相同B.将a的饱和溶液从20℃升温到30℃时,溶液中溶质的质量分数不变C.当A中混有少量B时,可用冷却热饱和溶液方法提纯A;D.在t2℃时,将均含100g水的A、B的饱和溶液分别降温至t1℃,析出晶体量相等7. A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。
B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。
向烧杯中加入一种物质后,甲试管中固体增加,乙试管中的固体减少,则加入的物质可能是() A.硝酸铵 B.氢氧化钠C.氧化钙 D.氯化钠8.图2为A物质的溶解度曲线,回答下列问题:⑴30℃时,A的饱和溶液中,溶质和溶剂的质量比为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
类型一:溶解度相关
1. 150克6%的氯化钠溶液中,有氯化钠,水各多少克?
2.某温度时,蒸干15克氯化钠溶液,得到1.2克氯化钠,求溶质质量分数?
3. 20℃时,氯化钠的溶解度是36克,求20℃,氯化钠饱和溶液的溶质质量分数?
4.某温度下,A的溶质质量分数是50%,求此温度下,A的溶解度?
5.20℃时,将50g NaCl放入100g水中,充分搅拌后所得NaCl溶液的溶质质量分数是(20℃时NaCl的溶解度为36g)
类型二:溶液稀释相关
1.把50g80%的硫酸溶液稀释成20%的硫酸溶液,需要加水多少克?
2.把100g质量分数为98%的硫酸稀释成10%稀硫酸,需加水多少克?
3.某工厂化验室配制5000g11.9%的盐酸,需要40%的盐酸(密度为1.19g/cm3)的体积是多少?
4.把40g 30%的NaOH溶液加水稀释至100g,取出其中的10g,这10g溶液中溶质的质量分数是多少?
5.配制500ml质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水的质量各为多少?
类型三:化学反应相关
1.200g稀硫酸与足量的锌反应后,产生0.4g氢气,计算这种稀硫酸中溶质的质量分数?
2.50g某盐酸恰好与11.2g铁粉完全反应,计算该盐酸中溶质的质量分数?
3.将67.9g碳酸钠溶液与一定量的溶质质量分数为20%的盐酸混合后,恰好完全反应,反应后溶液质量减少了
4.4g。
计算:(1)盐酸溶液的质量(2)反应后所得溶液中溶质的质量分数
4.某酒精溶液中乙醇分子所含氢原子数和水分子所含氢原子数相等,则该酒精中溶质的质量分数为多少?。
