(新课标)2018高考化学一轮复习专题三非金属元素及其化合物第13讲氮及其化合物夯基提能作业
新高考化学一轮复习氮及其化合物课件(117张)

一轮 ·化学
1.学科思想:“加合式”法处理氮氧化物溶于水的计算 无论是单一气体(NO2),还是NO、NO2、O2中的两者或三者的混合气体, 反应的实质是3NO2+H2O===2HNO3+NO,2NO+O2===2NO2,故若有 气体剩余只能是NO或O2,不可能是NO2。 (1)若NO和O2通入水中,总关系式为4NO+3O2+2H2O===4HNO3。 (2)若NO2和O2通入水中,总关系式为4NO2+O2+2H2O===4HNO3。
17
一轮 ·化学
3.氮氧化合物(用 NOx 表示)是大气污染的重要因素,根据 NOx 的性质特 点,开发出多种化学治理氮氧化合物污染的方法。
催化剂 (1)用氨可将氮氧化物转化为无毒气体。如 4NH3+6NO ==△=== 5N2+6H2O, 写出氨气转化 NO2 的化学方程式:________________________ ________________________________________________________,氧化产 物与还原产物的质量之比为________。
②__N_2_+__3_H_2___催__化__剂_____2_N__H_3_; 放电
③_N__2+__O__2_=_=或_=_=高_=_温=_=_=_2_N__O__。
5
一轮 ·化学
一轮 ·化学
3.氮的氧化物 (1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物, 如N2O、__N_O___、N2O3、NO2(或_N__2_O_4_)、N2O5,其中属于酸性氧化物 的是N2O3、N2O5。
23
考点 2 典型的氧化性酸——硝酸 1.物理性质
一轮 ·化学
24
2.化学性质
(1)不稳定性
高考化学一轮复习课件:《氮及其重要化合物》

B.由于 NH3(l)可自电离,2NH3 可写为
,
与 SiCl4 交换成
分生成 Si(NH2)4 和 NH4Cl 与题述反应原理相同,故 B 正确;
C.Cl2 与 NH3 反应生成了单质 N2,反应物没有互相交换成分,与题述反应原理不
同,故 C 错误;
D.
和 PCl3 互相交换成分生成了 H3PO3 和 HCl,与题述反应原理相同,故
Байду номын сангаас
若产生白色沉淀,则样品为亚硝酸钠
B
加到少量KMnO4溶液中,再加硫酸酸 化,振荡
若溶液褪色,则样品为亚硝酸钠
√C
先加到少量FeCl2溶液中,再加入稀盐 酸酸化,振荡
若溶液变黄色,则样品为亚硝酸钠
D
先加入少量Na2SO3溶液,再加入 BaCl2溶液和稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
解析:A.KClO3溶于水,电离出钾离子和氯酸根离子,亚硝酸钠溶于水电离 出钠离子和亚硝酸根离子,由于AgNO2沉淀可溶于稀硝酸,滴加硝酸银和足量 稀硝酸不能生成白色沉淀,A错误; B.氯化钠电离出的氯离子也可以被酸性高锰酸钾氧化,而使其褪色,B错误; C.亚硝酸有氧化性,可以把二价铁氧化为三价铁,溶液变为黄色,C正确; D.稀硝酸可以把亚硫酸根离子氧化为硫酸根离子,再加入氯化钡可以生成硫 酸钡白色沉淀,D错误;
D 正确;
8. (2022年新高考山东卷)下列试剂实验室保存方法错误的是
A. 浓硝酸保存在棕色细口瓶中
√C. 四氯化碳保存在广口塑料瓶中
B. 氢氧化钠固体保存在广口塑料瓶中 D. 高锰酸钾固体保存在棕色广口瓶中
解析:A.由于浓硝酸见光易分解,故浓硝酸需保存在棕色细口瓶中避光保存, A正确; B.氢氧化钠固体能与玻璃中的SiO2反应,故氢氧化钠固体保存在广口塑料瓶 中,B正确; C.四氯化碳是一种有机溶剂,易挥发,且能够溶解塑料,故其不能保存在广 口塑料瓶中,应该保存在细口玻璃瓶中,C错误; D.高锰酸钾固体受热后易分解,故需在棕色广口瓶中、阴冷处密封保存,D 正确;
高考专题氮及其化合物第三课件高三高考化学一轮复习PPT

2.化学性质:
(1)强酸性。 HNO3=H++NO3-。 (2)强氧化性。
①HNO3与金属反应时,不产生H2。 a.与除Au、Pt外大部分金属反应(如Cu):
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+ 4H2O b.常温下浓硝酸使Fe、Al钝化。
高考专题氮及其化合物第三课件高三 高考化 学一轮 复习PPT 【PPT 实用课 件】
高考专题氮及其化合物第三课件高三 高考化 学一轮 复习PPT 【PPT 实用课 件】
分析: 因最终生成物中Fe、Cu都是+2价,设n(Cu)=xmol、n(Fe)=ymol, 则64x+56y=9,2(x+y)=2.24/22.4×3。得x=0.075,y=0.075 因Fe是+2价,所以HNO3反应完全。据N原子守恒(HNO3为 200mL): n(HNO3)=2n(Cu)+2n(Fe)+n(NO)=0.4mol,c(HNO3)=2mol/L 原混合物中m(Cu)=0.完。剩余金属为Cu。 两次反应后溶液中的溶质为Fe(NO3)2和Cu(NO3)2各0.075mol,再 加入HNO3,反应为3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO+2H2O, HNO3过量,生成NO0.025mol。
高考专题氮及其化合物第三课件高三 高考化 学一轮 复习PPT 【PPT 实用课 件】
高考专题氮及其化合物第三课件高三 高考化 学一轮 复习PPT 【PPT 实用课 件】
①在反应前,打开弹簧夹,通入一段时间N2,目的是 _将__装__置__中__的__空__气__排__出_。 ②B中观察到的主要现象是___a_c____(填字母编号)。 a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 c.有无色气泡产生 ③C、E中所盛装的试剂不能是___a_____(填字母编号)。 a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
全国版高考化学一轮复习非金属及其化合物氮及其重要化合物PPT105页

36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。—ቤተ መጻሕፍቲ ባይዱ罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!
105
40、人类法律,事物有规律,这是不 容忽视 的。— —爱献 生
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
高三化学第一轮复习课件十三氮族元素

(3)氨气的还原性:
1* 氨跟氧气反应:
4NH3+5O2 催化剂 4NO+ 6H2O ;△H<0 2* 氨在纯氧中可燃烧: 4NH3+3O2 点燃 2N2+6H2O
3* 氨与氯气反应:
2 NH3+3 Cl2
N2+ 6 HCl (氨气适量)
8 NH3+3Cl2
N2 + 6 NH4Cl (氨气过量)
(孤对电子跟溶液里具有空轨道的氢离子通过配位键而
结合成离子晶体),因此__________水__合,能易力与较__强____
即___H_+_反__应__。氨气中氮元素为
。因
此在与一酸定反条应件能被________。 -3价即氮的最低价态
氧化
NH3+H2O
NH3·H2HO2O、NNHH43+、+NOHH3·-H2O
硝酸
(2)实验室制备
原理:NaNO3(S)+H2SO4(浓)=NaHSO4+HNO3↑ 微热 药品:固体硝酸钠,浓硫酸
装置:固液加热(曲颈甑)
收集:冷凝
硝酸的储存 (1)硝酸盛于棕色试剂瓶中,原因是硝酸见光分解。 (2)硝酸存放于低温处,原因是硝酸受热分解。 (3)盛硝酸的试剂瓶一定要用玻璃塞,而不能用软木塞或橡皮塞 ,原因是硝酸能腐蚀软木、橡胶。 (4)硝酸,特别是浓硝酸,久置发黄,原因是硝酸中溶解了硝酸 分解产物二氧化氮。 (5)浓硝酸敞口放置会变稀,原因是硝酸易挥发。 (6)大量浓硝酸,可用铝罐装,原因是硝酸在常温下使铝钝化。
溶液酸碱性: 碱性
氧化性
无
漂白性
无
酸性
有 有
NH3 和少量空气
高考化学 一轮复习 第四章 第13讲 氮及其化合物

二、氮的氧化物与 O2、H2O 混合计算 (1)3NO2+H2O===2HNO3+NO (2)NO、O2、H2O 之间的综合反应式是 4NO+3O2+2H2O===4HNO3 由此可知当体积比
<4∶3,余O2 V(NO)∶V(O2)=4∶3,恰好完全反应
>4∶3,余NO
(3)NO2、O2、H2O 之间的综合反应式是 4NO2+O2+2H2O===4HNO3 由此可知当体积比
(1) 甲同学拟用浓氨水和固体 NaOH 制取 NH3,并用 图Ⅰ装置作为 NH3 的发生装置。
写出固体 NaOH 的作用: ____________
(2)乙同学建议,把教材中实验室制取氨气的收集装置由大
试管改为集气瓶且瓶口向上来收集氨气,并确保不污染环境。
请你根据其设想回答:
①若用排空气法收集NH3,请在图Ⅱ的方框内画出其气体 收集装置和尾气吸收装置,标出所用的试剂(自选)名称。
特别提醒: (1)由于浓硝酸和稀硝酸都有比较强的氧化性,故它们与金 属反应时自身被还原成NO2或NO,并没有H2产生,故不能用 硝酸制取氢气。 (2)浓硝酸的氧化性比稀硝酸的强。 (3)王水不是水,是浓硝酸和浓盐酸按1∶3体积比混合成的 混酸。 (4)浓硝酸保存在棕色细口瓶中,瓶塞要用玻璃塞而不用橡 胶塞。
3.以下有关氨及铵盐的叙述中,不.正.确.的是( ) A.铵态氮肥不能与碱性物质如草木灰混合施用 B.氨的喷泉实验体现了氨的溶解性和氧化性 C.实验室里常用固体氯化铵与氢氧化钙反应制取少量氨 气 D.氨具有还原性,一定条件下可与氧化性的物质如氧气 发生反应 【答案】B
4.三瓶无色溶液,分别为NH4Cl、Na2CO3、NaOH,只 用一种试剂一次区分开,该试剂是( )
6.0.3 mol Cu和含1.2 mol HNO3的浓硝酸,充分反应后,
第13讲 氮及其化合物-高考化学一轮复习名师讲义
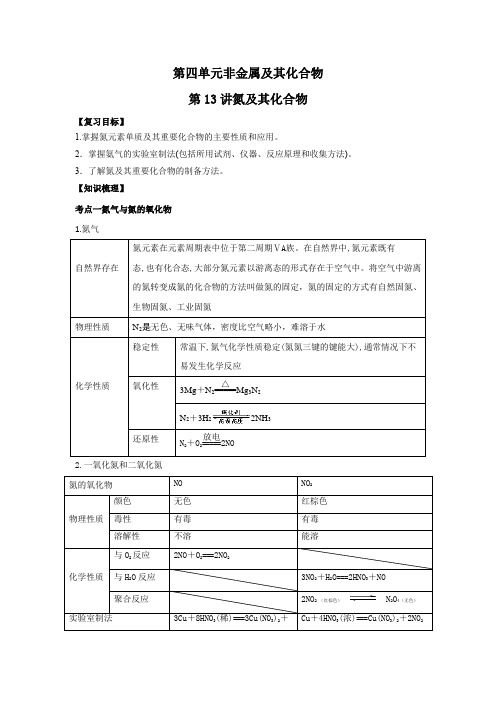
第四单元非金属及其化合物第13讲氮及其化合物【复习目标】1.掌握氮元素单质及其重要化合物的主要性质和应用。
2.掌握氨气的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
3.了解氮及其重要化合物的制备方法。
【知识梳理】考点一氮气与氮的氧化物1.氮气自然界存在氮元素在元素周期表中位于第二周期ⅤA族。
在自然界中,氮元素既有态,也有化合态,大部分氮元素以游离态的形式存在于空气中。
将空气中游离的氮转变成氮的化合物的方法叫做氮的固定,氮的固定的方式有自然固氮、生物固氮、工业固氮物理性质N2是无色、无味气体,密度比空气略小,难溶于水化学性质稳定性常温下,氮气化学性质稳定(氮氮三键的键能大),通常情况下不易发生化学反应氧化性3Mg+N2=====△Mg3N2N2+3H22NH3还原性N2+O2=====放电2NO2.一氧化氮和二氧化氮氮的氧化物NO NO2物理性质颜色无色红棕色毒性有毒有毒溶解性不溶能溶化学性质与O2反应2NO+O2===2NO2与H2O反应3NO2+H2O===2HNO3+NO聚合反应2NO2 (红棕色) N2O4(无色)实验室制法3Cu+8HNO3(稀)===3Cu(NO3)2+Cu+4HNO3(浓)===Cu(NO3)2+2NO2例题1、下列说法正确的是。
下列说法正确的是。
①用向上排空气法收集铜粉与稀硝酸反应产生的NO②密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2N A③燃料的脱硫脱氮、SO2的回收利用和NO x的催化转化都是减少酸雨产生的措施④氮元素有负化合价,正化合价和零价,因而常温下,N2既能与氧气反应,又能与H2反应⑤1 mol N2与4 mol H2反应生成的NH3分子数为2N A⑥NO可以是某些含低价氮物质氧化的产物⑦NO是亚硝酸的酸酐⑧氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质⑨工业合成氨属于人工固氮⑩制二氧化氮时,用水或NaOH溶液吸收尾气⑪用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2⑫N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2【解析】NO的密度与空气接近,且能与氧气反应生成NO2,NO不能溶于水,所以应该用排水法收集,①错误;NO与氧气反应生成二氧化氮,但常温下,二氧化氮与四氧化二氮之间存在平衡,所以产物的分子数小于2N A,②错误;燃料的脱硫脱氮、SO2的回收利用和氮氧化物的催化转化都可以减少SO2、氮氧化物的排放,所以可以减少酸雨的产生,③正确;N2在放电条件下才能与O2反应;在高温高压、催化剂条件下才能与H2化合生成NH3,④错误;N2与H2在一定条件下发生反应生成NH3,该反应是可逆反应,反应物不能完全转化为生成物,故1 mol N2与4 mol H2反应生成的NH3分子数小于2N A,⑤错误;NO中氮的化合价处于中间价态,它可以是还原产物,如HNO3→NO,也可以是氧化产物,如NH3→NO,⑥正确;HNO2的酸酐是N2O3,⑦错误;硫的氧化物不能形成光化学烟雾,⑧错误;工业合成氨属于人工固氮,⑨正确;二氧化氮与水反应产生NO,不能用水吸收,⑩错误;Br2(g)和NO2都具有强氧化性,都能使湿润的碘化钾淀粉试纸变蓝,⑪错误;氮气和氧气反应生成NO,得不到NO2,⑫错误。
第13讲氮及其化合物(检测)-2023年高考化学一轮复习”四点“卓越讲义(原卷版)

第13讲 氮及其化合物(精准检测卷)时间:50分钟一、选择题(12个小题,每小题只有一个正确选项,每题5分,共60分) 1.自然界中氮的部分循环过程如图,有关说法正确的是A .过程①和①均属于自然固氮B .X→Y 发生化合反应C .NH 3→N 发生氧化还原反应D .若为硫循环,X 在空气中点燃可得Y2.下列过程中,氮元素被氧化的是A .铵根离子的检验B .工业固氮C .大气固氮D .生物固氮3.在指定条件下,下列选项所示物质间转化能实现的是A .浓HNO 3(aq)Cu(s)−−−→NO(g)B .NH 3(g)2O ,Δ催化剂−−−→NO 2(g) C .NH 4Cl(s)()2Ca(OH)s Δ−−−−→NH 3(g) D .NO(g)()NaOH aq →NaNO 3(aq) 4.元素的价-类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。
结合氮及其化合物“价类”二维图,下列分析或预测正确的是A .N 2O 3、NO 2、N 2O 5均能与水反应生成酸,三者均为酸性氧化物B .HNO 3、HNO 3、NaNO 3、NH 3的水溶液均可以导电,四者均属于电解质C .可用浓盐酸检测输送NH 3的管道是否发生泄漏D .HNO 3具有强氧化性,可溶解铜、银、金等不活泼金属5.一定温度下,铜与稀3HNO 反应的过程如下:下列说法错误的是A .I 中生成的无色气体是NOB .III 的反应速率比I 快的原因是2NO 溶于水,对反应具有催化作用C .当活塞不再移动时,再抽入空气,铜可以继续溶解D .将上述1mL 无色气体与1mL 氧气混合通入水中,恰好能完全被水吸收 6.将体积比为3:1的2NO 和NO 混合气体(共4mol)依次通入下列三个分别装有足量①3NaHCO 饱和溶液、①浓硫酸、①过氧化钠的装置后,用排水法将残余气体收集起来,则收集到的气体(同温同压下测定)是A .20.5mol OB .0.67mol NOC .21mol NO 和20.25mol OD .22mol O 7.下列有关硝酸的说法不正确的是A .实验室常用稀硝酸与金属锌反应制备氢气B .用玻璃棒蘸取浓硝酸,靠近蘸有浓氨水的玻璃棒会冒白烟C .浓硝酸可与非金属单质例如碳反应,表现出强氧化性D .氮氧化物是大气污染物,会产生硝酸型酸雨和光化学烟雾等环境问题8.下列反应的离子方程式书写正确的是A .NH 4Cl 溶液中加入NaOH 浓溶液共热时反应的离子方程式为+4NH +OH -∆==NH 3↑+H 2OB .NO 2通入水中制硝酸:2NO 2+H 2O=2H ++3NO -+NOC .HNO 3溶液与氨水反应:H ++OH -=H 2OD .铜与浓硝酸的反应:Cu+4H ++23NO -=Cu 2++2NO↑+2H 2O9.称取4.08g 银、铜合金溶于一定量的浓硝酸中充分反应,金属全部溶解,产生的气体通入水中,再通入448mLO 2(标准状况),气体全部被水吸收,则该合金中铜的物质的量为 A .0.01mol B .0.02mol C .0.03mol D .0.04mol10.100mL 某混合酸中,c(HNO 3)为0.4mol/L ,c(H 2SO 4)为0.2mol/L 。
2018届一轮复习人教版 氮及其重要化合物 课件(53张)

第13课时
氮及其重要化合物
2.化学性质 (1)酸的通性(HNO3 与金属反应时不产生 H2)。 (2)不稳定性。 浓 HNO3 不稳定, 见光或受热易分解, 化学方程式为___________________________________。 黄 色,原因是 HNO3 分解产 ①久置的浓 HNO3 显____ 生的 NO2 溶于硝酸的缘故。 棕色磨口细口瓶 ②浓 HNO3 通常保存在____________________ 中且 橡胶塞 。 置于冷暗处,瓶塞不能用__________ (3)强氧化性
2.氨水B.氨水极易挥发出氨 C.氨与水结合生成的一水合氨(NH3·H2O),只有 - 少部分电离成 NH+ 和 OH 4 D.溶于水的氨大部分以 NH3 分子形式存在
【解析】NH3 溶于水后,大部分与水结合成一水合 - 氨的形式,只有少部分氨水电离成 NH+ 4 和 OH ,说明 氨水是弱电解质,C 正确;能使酚酞变红和具有挥发性 不能说明氨水的碱性较弱。
1. 某研究性学习小组借助如图所示的仪器 装置完成收集 NO 气体的实验。正确的操作 是( C ) A.从①口进气,用排水法集气 B.从①口进气,用排气法集气 C.从②口进气,用排水法集气 D.从②口进气,用排气法集气
【解析】NO遇空气立即被氧化,故不能用排气法集 气,只能用排水法集气。排水法集气时应短进长出。
版高考化学一轮总复习导学案全集【推荐下载】

书山有路勤为径;学海无涯苦作舟
版高考化学一轮总复习导学案全集
目录
专题一化学基础知识
第1讲化学实验基础1(仪器、装置、操作、实验安全)291 第2讲化学实验基础2(除杂、提纯与检验、实验评价)292 第3讲物质的分类物质的量的基本概念293
第4讲离子反应294
第5讲氧化还原反应295
第6讲元素周期律化学键296
专题二元素及其化合物
第8讲钠及其化合物298
第9讲镁、铝及其化合物300
第10讲铁、铜及其化合物302
第11讲氯气卤素305
第12讲碳、硅及其化合物307
第13讲硫及其化合物308
第14讲氮及其化合物310
专题三化学反应与能量变化
第16讲反应热盖斯定律312
第17 讲原电池及其应用314
第18讲电解池及其应用315
专题四化学反应速率化学平衡
第20讲化学反应速率317
专注下一代成长,为了孩子。
(新课标)高三化学一轮总复习-第4章 非金属元素(第13课时)氮及其重要化合物课件

氧化物得到 0.6 mol 电子,氮的氧化物再与氧气和水反应生成
硝酸,转移电子数也是 0.6 mol,即氧气得到 0.6 mol 电子,推断
出 O2 的物质的量为 0.15 mol,故标况下,需要氧气体积为:0.15 mol×22.4 L·mol-1=3.36 L。
【答2↑+2H2O
(1)实验室制备氨气的化学方程式为: _______________________________________________; (2)装置 B 中烧杯滴加酚酞溶液,并打开止水夹,挤压胶 头滴管观察到烧瓶内产生了__________,则说明氨气具有的性 质是______________________________________。
物质是碱石灰,其作用是除去氨气中的水蒸气;
(3)氨气与 CuO 反应生成 Cu、氮气和水,CuO 为黑色固
体,Cu 为红色固体,所以 C 中的现象是黑色粉末逐渐变为红色, 反应的化学方程式是 2NH3+3CuO==△===3Cu+N2+3H2O;
第13课时 氮及其重要化合物
2.化学性质 (1)酸的通性(HNO3 与金属反应时不产生 H2)。 (2)不稳定性。浓 HNO3 不稳定,见光或受热易分解,
化学方程式为___________________________________。 ①久置的浓 HNO3 显__黄__色,原因是 HNO3 分解产
压强突然减小,外界压强把烧杯中的水压入到烧瓶中,氨气溶
于水后形成弱碱性的氨水,酚酞遇碱变红,则观察到烧瓶内产
生红色喷泉,利用了氨气极易溶于水,形成的溶液显碱性;(3)
氨 气 与 水 反 应 生 成 一 水 合 氨 , 则 反 应 方 程 式 : NH3 +
H2O
高三化学一轮复习《氮及其化合物》.ppt

( CD) ( AB) ( A) (A)
(B ) (A ) (A )
(A )
四、硝酸
纯硝酸是 无 色、有 刺激性气味、易 挥发 液体
能跟水以 任意比例% ,
“发烟硝酸”的浓度为 98%
。
⑵化学性质
①强酸性
②不稳定性:(见光、受热易分解)
4HNO3
4NO2↑+O2↑+2H2O
N2+3H2
2NH3(正反应放热)
原料: 水、煤和空气
三步骤: 造气、净化、氨的合成与分离
条件
压强: 10MPa~30MPa
温度: 4000C ~5000C
催化剂: 铁触媒
1.喷泉实验的形成原理 (1)形成喷泉的原理: 形成喷泉最根本的原因是瓶内外存在压强差。当烧瓶内气体溶 于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气 压将液体压入烧瓶内,如此持续,最后液体将充满烧瓶。
铑合金丝更加红热
③ 吸收剩余的氨气和生成的水蒸气
④
看到有红棕色的气体产生
(2)氨被氯气氧化: ①2NH3+3Cl2==△===N2+6HCl,
△ ②8NH3+3Cl2=====N2+6NH4Cl。 (3)氨被氧化铜氧化:
△ 2NH3+3CuO=====3Cu+N2+3H2O。
3、铵盐的性质 ⑴结构:离子键、共价键,属离子晶体
浓硝酸因为溶解了 NO2 的缘故显 黄色 。
硝酸贮存: 试剂瓶 棕色 ;瓶塞 橡胶 : 避光
③强氧化性:
a.与金属反应
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(利用此反应实验室可以制备NO2、NO气体) 3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O (利用此反应可以洗涤附在器皿内壁上的银) 冷浓HNO3可使Al、Fe等金属表面生成一层 致密的氧化膜而发生钝化。
课堂新坐标2018版高考化学一轮复习第4章非金属及其化合物第4节氮及其化合物教师用书

第四节 氮及其化合物考点1| 氮气及其氧化物的性质[基础知识整合]1.自然界中氮的存在和氮的固定2.N 2的性质及应用(1)物理性质:无色无味的气体,密度比空气略小,难溶于水,熔点、沸点比O 2的低。
(2)化学性质N 2的电子式为 N ⋮⋮N ,结构式为N≡N。
①与H 2反应的化学方程式:N 2+3H 2 高温、高压催化剂2NH 3,N 2表现氧化性。
②与Mg 反应的化学方程式:N 2+3Mg=====点燃Mg3N 2,N 2表现氧化性。
③与O 2反应的化学方程式:N 2+O 2=====放电或高温2NO ,N 2表现还原性。
3.NO 、NO 2的比较22322425其中①N 2O 3、N 2O 5分别为HNO 2、HNO 3相应的酸性氧化物(酸酐)。
②NO 2与N 2O 4可相互转化2NO 2 N 2O 4。
[应用体验]1.(1)氮元素的非金属性很强,但N 2的化学性质特别稳定,其原因是什么? (2)溴蒸气和NO 2都为红棕色气体,如何区分?用湿润的淀粉KI 试纸或NaOH 溶液可以吗?[提示] (1)N 2的结构式为N≡N,N 原子间以三键结合,键稳定,难破坏,所以N 2的化学性质非常稳定。
(2)①用AgNO 3溶液,Br 2可与AgNO 3溶液反应生成浅黄色沉淀AgBr ;②用水,溶于水后有颜色的是Br 2,无颜色的是NO 2。
不能用湿润的淀粉KI 试纸或NaOH 溶液区分,因为这两种气体都有氧化性,都可以把KI 中的I -氧化成I 2,使试纸变蓝色。
NaOH 溶液可以吸收Br 2蒸气和NO 2而形成无色溶液。
2.实验探究:在进行NO 2溶于水的实验时有如图所示操作。
(1)将充满NO 2的试管倒扣在盛有水的水槽中,可观察到的现象是:红棕色气体逐渐变为无色,水位上升,最后水充满整个试管的23。
化学方程式为3NO 2+H 2O===2HNO 3+NO 。
(2)当向试管中通入O 2,现象是无色气体又变为红棕色气体,试管内液面上升至充满,继续通O 2试管内液面又下降。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第13讲氮及其化合物A组基础题组1.下列有关氮气用途的说法不正确的是( )A.作焊接金属的保护气B.制硝酸和化肥的原料C.食品袋中充氮气来防腐D.与氧气反应制NO从而制硝酸2.(2016山东聊城模拟)下列反应中,氨既表现还原性,又表现碱性的是( )A.2NH3+3CuO 3Cu+N2+3H2OB.4NH3+5O2 4NO+6H2OC.8NH3+3Cl2 N2+6NH4ClD.NH3·H2O N+OH-3.下列装置用于进行指定实验时,能达到实验目的的是( )A.用装置甲制备氨气B.用装置乙除去氨气中少量水C.用装置丙收集氨气D.用装置丁吸收多余的氨气4.在容积为672 mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。
下列有关叙述中,正确的是( )A.总反应可能为NO+NO2+O2+H2O 2HNO3B.总反应可能为4NO+8NO2+5O2+6H2O 12HNO3C.生成HNO3的物质的量浓度接近0.03 mol·L-1D.生成HNO3的物质的量浓度约为0.45 mol·L-15.(2016福建福州八中质检)对下列事实的解释正确的是( )A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定B.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化6.(2016湖南湘潭模拟)NH3是一种重要的化工原料,可以制备一系列物质(如图)。
下列有关表述正确的是( )A.NH4Cl和NaHCO3都是常用的化肥B.NH4Cl、HNO3和Na2CO3受热时都易分解C.NH3和NO2在一定条件下可发生氧化还原反应D.图中所涉及的盐类物质均可以水解7.38.4 g铜跟适量的浓硝酸反应,铜全部反应后,共收集到气体22.4 L(标准状况),反应消耗的硝酸可能是( )A.1.0 molB.1.6 molC.2.2 molD.2.4 mol8.下列有关实验原理或操作正确的是( )A.用干燥的pH试纸鉴别SO2和Cl2两种气体B.盐酸滴定氨水时,用甲基橙作指示剂C.实验室用图①装置制备并收集少量的NO2D.实验室用图②装置除去H2中混有的少量NH39.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如下图所示:下列有关判断正确的是( )A.若铜片为51.2 g,则生成0.2 mol NaNO3B.常温下,Cu遇浓硝酸发生钝化,不可能发生上述反应C.标准状况下收集的氮氧化物为20.16 LD.反应过程中生成的Cu(NO3)2既是氧化产物,也是还原产物10.某同学用下列装置(固定装置、加热仪器和橡胶管略)进行有关氨气制取的实验探究。
回答下列问题:(1)若用装置①制取NH3,其反应的化学方程式为;若要测定生成的NH3的体积,则必须选择的装置是(填装置序号),该装置中所盛试剂应具有的性质是。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是,分液漏斗中装的试剂是,收集装置应选择(填装置序号)。
B组提升题组11.(2016河北邯郸模拟)某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。
向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。
向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
下列分析或结果错误的是( )A.OA段产生的是NO,AB段的反应为Fe+2Fe3+ 3Fe2+,BC段产生氢气B.原混合酸中N物质的量为0.4 molC.第二份溶液中最终溶质为FeSO4D.取20 mL原混合酸加水稀释至1 L后溶液的pH=112.(2016安徽合肥模拟)将9 g铜和铁的混合物投入100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。
若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )A.原混合物中铜和铁各0.075 molB.稀硝酸的物质的量浓度为0.5 mol·L-1C.第一次剩余4.8 g金属为铜和铁D.再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO13.(2016安徽滁州模拟)某化学学习小组采用下列装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3 4NO2↑+O2↑+2H2O)。
请回答下列问题:(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈瓶中气体的颜色为,产生该气体的化学反应方程式是。
(2)装置C中盛有足量Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为(写化学式)。
其中的Ba(OH)2溶液(填“能”或“不能”)用Ca(OH)2溶液代替,理由是。
(3)装置B的作用是。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是(填序号)。
A.敞口观察集气瓶内气体的颜色变化B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红C.将带火星的木条伸入集气瓶中,观察木条是否复燃②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是。
14. (2016四川成都模拟)硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、用水吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。
试写出上述反应的化学方程式: 。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至后,迅速关闭K1,观察到U形管内的现象是。
②装置Ⅲ中发生反应的化学方程式为。
③蘸NaOH溶液的棉花团的作用是。
答案全解全析A组基础题组1.D 氮气的化学性质不活泼,能防止金属在高温下被空气中的氧气氧化,A正确;氮气可用于合成氨,氨可作制硝酸和化肥的原料,B正确;食品袋中充氮气可防止食品缓慢氧化而变质,C正确;氮气与氧气的反应很难进行,不能用氮气与氧气反应制NO,D错误。
2.C A、B项,氮元素的化合价升高,氨表现还原性;C项,氨既表现还原性,又表现碱性;D项,氨只表现碱性。
3.D 装置甲中试管口应稍向下倾斜,A错误;氨气能与浓硫酸反应,B错误;装置丙中只有气体的流入口,没有气体的流出口,C错误;氨气在水中的溶解度非常大,被水吸收时容易产生倒吸的现象,装置丁可以防止倒吸,D正确。
4.B V(NO2+NO)∶V(O2)=12∶5,因烧瓶中的气体最终均生成了HNO3,故所得溶液的体积与溶解的NO2、NO 体积相等,故c(HNO3)=[V(NO2+NO)÷22.4 L·mol-1]÷V(NO2+NO)=0.045 mol·L-1。
5.A 1 mol铜反应需要消耗4 mol HNO3,同时生成二氧化氮,污染环境,通常利用硝酸与氧化铜反应制取硝酸铜,与浓硝酸挥发性无关,故B项错误;铁与硝酸反应首先生成硝酸铁,溶液呈浅绿色是过量的铁与铁离子反应生成亚铁离子所致,故C项错误;硝酸为氧化性酸,与锌反应不能生成氢气,生成氮的氧化物等,与钝化无关,故D项错误。
6.C NaHCO3不是化肥,A错;Na2CO3受热不易分解,B错;题图中所涉及的盐类物质中NaCl不能水解,D错。
7.C 由关系式Cu+2HNO3(酸)~Cu(NO3)2,HNO3(氧化剂)~NO2(或NO),可知反应消耗的HNO3的物质的量为×2+=1.2 mol+1 mol=2.2 mol。
8.B 检验气体性质时试纸需润湿,A项错;不能用排水法收集NO2气体,C项错;若U形管中盛装大量液态干燥剂,将导致气体无法通过,D项错。
9.A 分析整个反应过程可知仅有两种元素的化合价发生变化,即Cu→Cu2+,HNO3→NaNO2,51.2 g Cu为0.8 mol,共失电子0.8 mol×2=1.6 mol,由得失电子守恒可知HNO3→NaNO2得1.6 mol电子,故产物中NaNO2的物质的量为0.8 mol,由Na原子守恒可知另一种产物NaNO3为0.2 mol,A正确;常温下,Cu能与浓硝酸反应,B错误;部分NO2会转化为N2O4,而N2O4在标准状况下不是气体,C错误;反应过程中生成的Cu(NO3)2是氧化产物,D错误。
10.答案(1)2NH 4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O ③⑦氨气难溶于该试剂,该试剂不易挥发,不与氨气反应(2)碱石灰(或CaO等合理答案) 浓氨水(或浓NH4Cl溶液等合理答案) ⑥解析(1)装置①适用于“固固加热”制取气体,制取NH3时可选用NH4Cl和Ca(OH)2。
若要测定NH3的体积,根据题给装置知必须用排液法,而NH3极易溶于水,故不能用排水法,所用的试剂必须不与NH3反应,也不易挥发,并且NH3应难溶于该试剂。
(2)装置②是“固液反应”制取气体的装置,制取NH3时,可用浓氨水和碱石灰(或CaO等)反应。
B组提升题组11.D 向其中一份中逐渐加入铜粉,最多能溶解19.2 g,消耗0.3 mol铜,据得失电子守恒计算可得生成0.2 mol NO;向另一份中逐渐加入铁粉,铁粉先跟氧化性强的硝酸反应生成NO,由图可知该反应消耗铁的物质的量是0.2 mol,根据得失电子守恒,生成的NO也是0.2 mol,此时硝酸根离子已经反应完,据氮原子守恒可知原HNO 3的物质的量为0.4 mol,B项正确;AB段的反应为Fe+2Fe3+ 3Fe2+,BC段产生氢气,OA段产生NO,A项正确;第二份溶液中最终溶质为FeSO4,C项正确;OA段和BC段共消耗H+ 1.0 mol,则原溶液中H+为2.0 mol,取20 mL原混合酸加水稀释至1 L后溶液中c(H+)=0.2 mol/L,即pH=0.7,D项错误。
12.A 第一次加稀硝酸时有金属剩余,溶解的4.2 g金属均被氧化为+2价,溶解的金属的物质的量为×3×=0.075 mol,金属的摩尔质量为=56 g·mol-1,是铁;第二次加稀硝酸后金属完全溶解,由题意可知Fe2+未被氧化,溶解的4.8 g金属也一定被氧化为+2价,金属的摩尔质量为=64 g·mol-1,是铜,故A正确、C错误;c(HNO3)==2 mol·L-1,B错误;再加100 mL稀2+参与反应生成0.025 mol NO,硝酸,反应为3Fe2++4H++N 3Fe3++NO↑+2H标准状况下体积为0.56 L,故D错误。
