医疗物资出口报关出口医疗物资声明
1声明模板(中文)-有国内注册证
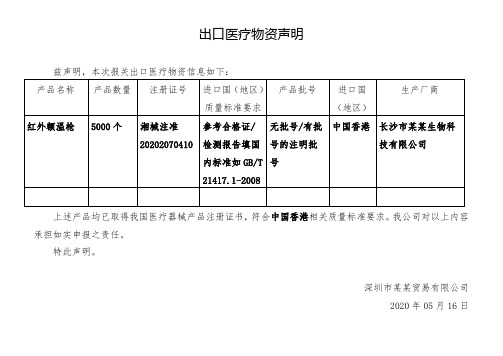
兹声明,本次报关出口医疗物资信息如下:
产品名称
产品数量
注册证号
进口国(地区)质量标准要求
产品批号
进口国
(地区)
生产厂商
红外额温枪
5000个
湘械注准20202070410
参考合格证/检测报告填国内标准如GB/T 21417.1-2008
无批号/有批号的注明批号
中国香港
长沙市某某生物科技有限公司
上述产品均已取得我国医疗器械产品注册证书,符合中国香港相关质量标准要求。我公司对以上内容承担如实申报之责任。
特此声明。ቤተ መጻሕፍቲ ባይዱ
深圳市某某贸易有限公司
2020年05月16日
医疗器械生产出口需要哪些资质

医疗器械生产企业出口的主要资质01营业执照。
02取得国内医疗器械生产许可证和医疗器械产品注册/备案证明。
进口国(地区)有要求的,生产企业还须获得药监部门医疗器械生产企业备案并申请出具《医疗器械产品出口销售证明》。
生产企业还需满足药监部门其他管理要求。
03取得进出口经营权。
当地商务部门办理对外贸易经营者备案登记手续,领取《对外贸易经营者备案登记表》。
如无进出口经营权,也可销售给取得进出口经营权的企业,再行出口。
04企业取得进出口经营权后,在海关办理登记手续并获取《中华人民共和国海关进出口货物收发货人报关注册登记证书》。
获得出口的技术能力工厂需拥有符合国外准入法规和标准要求的技术能力。
医疗物资国内外质量安全标准和准入要求可登陆“海关总署网站—总署概况—商品检验司—政策法规”栏目查询(不定期更新)。
提示:医疗器械产品种类和国外法规标准比较复杂,以出口美国口罩为例,出口美国需要FDA注册。
(1)美国FDA注册:FDA 510(K)上市前登记是向FDA提交的上市前报告。
根据FDA的要求,少数I类和大部分II类医疗器械在美国上市前,至少需要提前90天递交510(K)申请,用于很忙销售的器械至少与已合法销售的器械一样安全有效510(k)法规(21 CFR 807.92(a)(3))。
在申请者受到FDA声明器械“实质性等同”(SE)的新建格式指令之前,不可在美国销售。
510(k)申请材料必须包括诸如产品代码、标签、器械技术特性的总结、测试结果等其他的资料。
510(k)没有固定的格式或者模板.(2)FDA注册时必须指派一名美国公民(公司/社团)作为其代理人,该名代理人负责进行位于美国的过程服务,是联系FDA与申请人的媒介。
FDA注册是没有证书的,产品通过在FDA进行注册,将取得注册号码,FDA会给申请人一份回函(有FDA行政长官的签字),但不存在FDA证书一说。
(3)目前国内代理注册机构较多,建议出口企业应找信誉良好的注册代理机构。
进出口申报需提交的随附单证资料

进出口申报需提交的随附单证资料一、加工贸易及保税类报关单企业向海关申报进口时,属于加工贸易及保税类报关单的,合同、装箱清单、载货清单(舱单)等随附单证,可不向海关提交。
二、非加工贸易及保税类报关单企业向海关申报进口时,属于非加工贸易及保税类报关单,装箱清单、载货清单(舱单)等随附单证,可不向海关提交。
注意:上述单证,海关审核时如需要再提交。
申报出口货物企业向海关申报出口时(包括各类报关单),合同、装箱清单、载货清单(舱单)等随附单证,可不向海关提交。
注意:上述单证,海关审核时如需要再提交。
特殊货物申报出口防疫物资随着防疫物资出口量迅速增长,国家陆续出台了一系列政策加强监管:△《关于有序开展医疗物资出口的公告》(商务部、海关总署、国家药品监督管理局公告2020年第5号,以下简称“5号公告”)△《对医疗物资实施出口商品检验》(海关总署公告〔2020〕53号,以下简称“53号公告”)△《关于进一步加强防疫物资出口质量监管的公告》(商务部、海关总署、国家市场监督管理总局公告2020年第12号,以下简称“12号公告”)企业申报出口货物属于防疫物资时,按照申报情形不同,还需按要求提供相关随附单证。
情形一符合我国质量标准的新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计,按照“5号公告”要求提交“医疗器械产品注册证书”(可通过“国家药监局”网站查询)和“出口医疗物资声明”(书面或电子声明均可)。
医疗器械产品注册证书应为正本或正本扫描件。
情形二对于未获得我国药品监管部门批准的医疗器械产品注册证书,但获得国外标准认证或注册的新型冠状病毒检测试剂、医用口罩、医用防护。
医疗器械符合性声明简洁范本

医疗器械符合性声明医疗器械符合性声明1. 引言该符合性声明旨在确保我们的医疗器械符合适用的法规和标准要求。
我们承诺全面遵循相关法律法规,并按照国际标准制造和交付高质量、安全可靠的医疗器械。
2. 法规依从性我们的医疗器械符合以下法规和要求:[国家医疗器械监督管理法]()[ISO 13485:2023]() 医疗器械质量管理体系要求[FDA 510(k) 程序]()[CE认证]()我们的医疗器械经过严格的设计、测试和生产过程,满足相关法规和标准的所有要求。
3. 质量控制体系为确保我们的医疗器械的质量和符合性,我们建立了一套健全的质量控制体系,包括:管理层的承诺和领导设备和设施的合格性验证员工的培训和资质认证供应商评估和合作完善的产品记录和追溯体系不断改进的质量管理程序通过严格的质量控制体系,我们能够持续提供高品质的医疗器械,并确保其符合相关法规和标准。
4. 安全性和有效性评估我们确保我们的医疗器械具备充分的安全性和有效性。
我们进行了全面的风险分析和评估,并采取了相应的控制措施来降低风险。
我们进行了临床试验和性能评估,以确保我们的医疗器械在预期使用条件下具备良好的性能和效果,并不会对患者和医护人员的安全造成危害。
5. 跟踪和回收我们建立了跟踪和回收机制,以便及时掌握和回收存在安全问题的医疗器械。
我们积极与相关部门、医疗机构和用户进行沟通,并随时准备采取必要的措施来解决问题。
6. 符合性声明更新我们承诺及时更新该符合性声明,并确保它始终反映我们医疗器械的符合性情况。
我们将持续监督和改进我们的质量管理体系,以确保我们的医疗器械始终符合适用的法规和标准要求。
-以上是我们的医疗器械符合性声明,如果您对我们的符合性有任何疑问或意见,请随时与我们联系。
我们重视您的反馈,并致力于提供更安全、更可靠的医疗器械产品。
商务部白名单

商务部白名单:口罩白名单申请渠道(附申请材料及要求)为做好《商务部海关总署国家市场监督管理总局关于进一步加强防疫物资出口质量监管的公告》(2020年第12号)的落实工作,现就审核确认符合国外标准认证或注册的防疫物资生产企业名单有关工作通知如下:请各地方商务主管部门组织本地防疫物资生产企业自愿填报有关表格并提交相关证明材料(非医用口罩生产企业填写附件1,医用口罩等5类医疗物资生产企业填写附件2)。
地方商务主管部门会同本地医疗物资商业出口工作机制有关成员单位初步审核后,以工作机制办公室名义(本地商务主管部门代章)将汇总表(含电子版)统一报送至国家医疗物资商业出口工作机制办公室(商务部外贸司),同时抄送中国医药保健品进出口商会。
原则上每周报送一次,截止时间为每周三17:00。
非医用申请:填写说明:1. 填报范围仅限于获得国外认证或注册的非医用口罩;2. 请按产品填写,每个产品一行;3. 企业名称”栏请务必填写中英文名称,同一家企业的多个产品请依次填写,企业名称列不合并单元格;4. 产品名称”请列明中英文具体名称、规格、型号等;5. 请务必提交本表中已填写的国外认证关键材料扫描版,包括认证证书、检测报告等,并以证书名称命名该文件;6. 相关文件请统一放置到一个文件夹中,文件夹以企业中文名称命名,相关资质文件命名方式为:序号+企业中文名称缩写+产品名称+证书或检测报告名称;医用申请:填写说明:1. 填报范围仅限于五大类医用物资,即新冠病毒检测试剂、呼吸机、医用防护服、医用口罩、红外体温计;2. 请按产品填写,每个产品一行;3. “企业名称”栏请务必填写中英文名称,同一家企业的多个产品请依次填写,企业名称列不合并单元格;4. “产品名称”请列明中英文具体名称、规格、型号等,并注明无菌或非无菌;5. 同一产品出口不同国家(地区),请在“进口国(地区)”单元格中合并填写,无须每个国家一行;6. 请务必提交本表中已填写的国外认证和注册文件,在“资质文件”列的同一个单元格中按序号列明;7. 本表格中已填写的“资质文件”,请统一放置到一个文件夹中,文件夹以企业中文名称命名,相关资质文件命名方式为:序号+企业中文名称缩写+产品名称+证书或检测报告名称,序号请务必与表格中“资质文件”列的序号相同;8. 其他:原则上产品出口应满足进口国标准,如未在进口国注册,请提供对方国授权进口许可的相关证明文件并在合同中约定。
医疗器械符合性声明

医疗器械符合性声明医疗器械符合性声明引言医疗器械符合性声明是一种宣称医疗器械符合相关法规和标准的文件。
这个文件通常由医疗器械生产企业或供应商提供,旨在确保其所生产或供应的医疗器械在法律和质量要求方面的符合性。
法规要求医疗器械行业是一个高度规范化的行业,不同国家和地区有不同的法规要求。
在美国,医疗器械的市场准入和使用受到美国食品药品监督管理局(FDA)的严格监管。
在欧洲,医疗器械的市场准入和使用受到欧洲医疗器械指令(Medical Device Directive)的规范。
根据这些法规,医疗器械生产企业或供应商需要提供符合性声明,以证明其所生产或供应的医疗器械符合相关的法规要求。
这些法规要求通常涉及医疗器械的安全性、有效性、质量控制和生产监管等方面。
医疗器械符合性声明的内容医疗器械符合性声明通常包括以下几个方面的内容:1. 公司信息:包括医疗器械生产企业或供应商的名称、地质和等信息,以便与相关监管机构进行联系和沟通。
2. 医疗器械描述:对所生产或供应的医疗器械进行详细的描述,包括器械的名称、型号、规格等信息。
这些信息有助于确保医疗器械符合法规的具体要求。
3. 法规和标准:列出适用的法规要求和相关的标准,以证明所生产或供应的医疗器械符合相关的法规和标准。
这些法规和标准可能涉及医疗器械的设计、制造、销售和使用方面的要求。
4. 符合性证明:提供相关的报告、证书或其他文件,证明所生产或供应的医疗器械符合法规和标准要求。
这些证明文件通常由第三方机构进行和评估,并确认医疗器械的合规性。
医疗器械符合性声明的重要性医疗器械符合性声明是医疗器械行业的重要文件之一,它对医疗器械生产企业和供应商具有重要的意义。
,医疗器械符合性声明是一种法律要求。
在许多国家和地区,医疗器械的生产和供应受到严格的法规控制。
提供符合性声明是企业遵守法规要求的一种必要手段,可以防止违反相关法律的风险。
,医疗器械符合性声明是验证医疗器械合规性的重要凭证。
医疗器械产品出口销售证明书附页
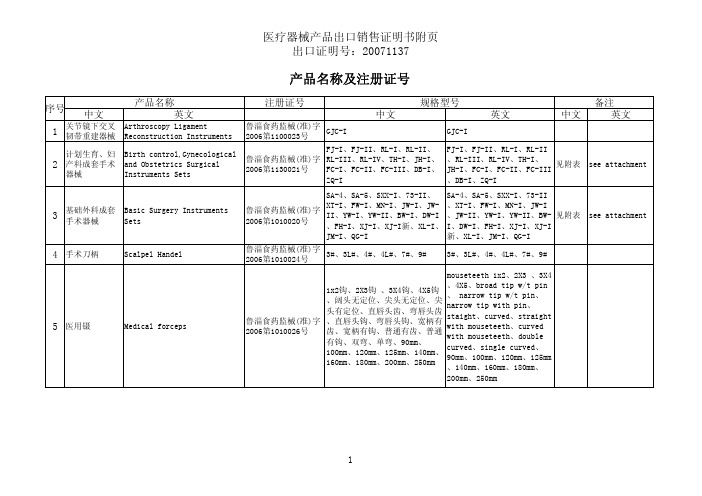
注册证号中文英文中文英文中文英文1关节镜下交叉韧带重建器械Arthroscopy LigamentReconstruction Instruments鲁淄食药监械(准)字2006第1100023号GJC-I GJC-I2计划生育、妇产科成套手术器械Birth control,Gynecologicaland Obstetrics SurgicalInstruments Sets鲁淄食药监械(准)字2006第1130021号FJ-I、FJ-II、RL-I、RL-II、RL-III、RL-IV、TH-I、JH-I、FC-I、FC-II、FC-III、DB-I、ZQ-IFJ-I、FJ-II、RL-I、RL-II、RL-III、RL-IV、TH-I、JH-I、FC-I、FC-II、FC-III、DB-I、ZQ-I见附表see attachment3基础外科成套手术器械Basic Surgery InstrumentsSets鲁淄食药监械(准)字2006第1010020号SA-4、SA-5、SXX-I、73-II、XT-I、FW-I、MN-I、JW-I、JW-II、YW-I、YW-II、BW-I、DW-I、FH-I、XJ-I、XJ-I新、XL-I、JM-I、QG-ISA-4、SA-5、SXX-I、73-II、XT-I、FW-I、MN-I、JW-I、JW-II、YW-I、YW-II、BW-I、DW-I、FH-I、XJ-I、XJ-I新、XL-I、JM-I、QG-I见附表see attachment4手术刀柄Scalpel Handel鲁淄食药监械(准)字2006第1010024号3#、3L#、4#、4L#、7#、9#3#、3L#、4#、4L#、7#、9#5医用镊Medical forceps鲁淄食药监械(准)字2006第1010026号1x2钩、2X3钩 、3X4钩、4X5钩、阔头无定位、尖头无定位、尖头有定位、直唇头齿、弯唇头齿、直唇头钩、弯唇头钩、宽柄有齿、宽柄有钩、普通有齿、普通有钩、双弯、单弯、90mm、100mm、120mm、125mm、140mm、160mm、180mm、200mm、250mmmouseteeth 1x2、2X3 、3X4、4X5、broad tip w/t pin、 narrow tip w/t pin、narrow tip with pin、staight、curved、straightwith mouseteeth、curvedwith mouseteeth、doublecurved、single curved、90mm、100mm、120mm、125mm、140mm、160mm、180mm、200mm、250mm规格型号产品名称产品名称及注册证号序号备注注册证号中文英文中文英文中文英文规格型号产品名称产品名称及注册证号序号备注6止血钳Haemostatic Forceps鲁淄食药监械(准)字2006第1010030号无直钩、弯无钩、直有钩、弯有钩、小弯、中弯、大弯、直蚊式、弯蚊式、124.5mm、125mm、139mm、140mm、158mm、159mm、160mm、178mm、179mm、180mm、197mm、200mm、213mm、217mm、217.5mm、218m、219.5mm、220mm、238mm、240mm、243mm、247.5mmstriaght w/t mouseteeth、curved w/t mouseteeth、striaght with mouseteeth 、curved w/t mouseteeth、slight curved、medium curved、storng curved、straight mosquito、curved mosquito、124.5mm、125mm 、139mm、140mm、158mm、159mm、160mm、178mm、179mm、180mm、197mm、200mm、213mm、217mm、217.5mm、218m、219.5mm、220mm、238mm、240mm、243mm、247.5mm 7帕巾钳Towel Forceps鲁淄食药监械(准)字2006第1100027号90mm、110mm、140mm、90mm、110mm、140mm、8医用剪Surgical Scissors鲁淄食药监械(准)字2006第1100025号直头、弯头、直圆头、弯圆头、直尖头、弯尖头、直尖圆头、弯尖圆头、138mm、140mm、158mm、160mm、178mm、180mm、200mm 、220mm、250mmstraight、curved、straight blunt/blunt、curved blunt/blunt、straight sharp/sharp、cruved sharp/sharp、straight sharp/blunt、cruved sharp/blunt、138mm 、140mm、158mm、160mm、178mm、180mm、200mm、220mm、250mm注册证号中文英文中文英文中文英文规格型号产品名称产品名称及注册证号序号备注9持针钳Needle Holders鲁淄食药监械(准)字2006第1010028号直型细针、弯型细针、双弯型细针、左角型细针、右角型细针、端式细针、直型粗针、弯型粗针、双弯型粗针、左角型粗针、右角型粗针、端式粗针、直型无损伤针、弯型无损伤针128-250mmstraight withoutgroov,curved without groov,double curvedwithout groov,end without groov,straight with groov,curved withgroov,double curved with groov,left-angled with groov,right-angled with groov,end withgroov,stright atraumatic needles,cruved atraumatic needles,full length 128mm-250mm 10口腔科类成套手术器械Oral Surgery Instruments Sets鲁淄食药监械(准)字2006第1060022号BY-I、CK-IBY-I、CK-I见附表see attachment11组织钳Tissue Forceps鲁淄食药监械(准)字2006第1010029号140mm、155mm、160mm、180mm、190mm、210mm、240mm140mm、155mm、160mm、180mm、190mm、210mm、240mm12海绵钳Sponge forceps鲁淄食药监械(准)字2006第1010031号直无齿、弯无齿、直有齿、弯有齿、12X180、8X180、10X180、12X180、8X220、8X250、10X220、10X250、12X220、12X250srtaight with teeth、straigh w/t teeth、curvedwith teeth、curved w/tteeth、12X180、8X180、10X180、12X180、8X220、8X250、10X220、10X250、12X220、12X25013颅脑手术头架Head Resting System鲁食药监械(准)字2005第2030009号(更)TJ-II、TJ-III TJ-II、TJ-III注册证号中文英文中文英文中文英文规格型号产品名称产品名称及注册证号序号备注14颅脑神经外科成套手术器械Neuro Surgery Instruments Set鲁食药监械(准)字2005第2030008号(更)SS-2、SS-3、SSL-I、SSL-II、SSX-I、BC-I SS-2、SS-3、SSL-I、SSL-II、SSX-I、BC-I 见附表see attachment15颈椎腰椎外科成套手术器械CervicalVertebra,Intervertebra Disc Surgiacal Instruments Sets 鲁食药监械(准)字2005第2100007号(更)ZX-I、JZ-IIZX-I、JZ-II见附表see attachment16胸腔心血管外科手术器械Thoracic and Cardiovascular Surgical Instruments 鲁食药监械(准)字2005第2070006号(更)XW-I,XZ,XZ-I,XZ-II XW-I,XZ,XZ-I,XZ-II 见附表see attachment17血管吻合轮Vessel Suturing Rings 国食药监械(准)字2007第3461165号 1.5、2、2.5、3、3.5、4、5、6、7、8、9.5、11(mm) 1.5、2、2.5、3、3.5、4、5、6、7、8、9.5、11(mm)18综合电动器械Orthopedic Electro-Surgical Motors 鲁食药监械(准)字2005第2100054号(更)XKL-II,XKL-III,XGD-I,XGD-II,XGD-III XKL-II,XKL-III,XGD-I,XGD-II,XGD-III 见附表see attachment19五官科成套手术器械Eye,Ear,Nose and Throat Surgical Instrumets Sets鲁淄食药监械(准)字2006第1010019号WG-IWG-I见附表see attachment。
出口证明书

1.一般产地证(c/o)一般原产地证书是证明货物原产于某一特定国家或地区,享受进口国正常关税(最惠国)待遇的证明文件。
它的适用范围是:征收关税、贸易统计、保障措施、歧视性数量限制、反倾销和反补贴、原产地标记、政府采购等方面。
申请一般产地证:领证时需要提交如下资料: 1.《原产地证明书申请书》一份;2.《一般原产地证明书(co)》一套;3.正式出口商业发票正本一份,如发票内容不全,另附装箱单;(盖章,不得涂改)4.含有进口成分的产品,必须提交《产品成本明细单》;5.签证机构需要的其他单据。
6.缴纳签证费35元。
2.普惠证(form a )全称:generalized system preferences certificate of original form a 普惠制原产地证书是具有法律效力的我国出口产品在给惠国享受在最惠国税率基础上进一步减免进口关税的官方凭证。
目前给予我国普惠制待遇的国家共36个:欧盟25国(比利时、丹麦、英国、德国、法国、爱尔兰、意大利、卢森堡、荷兰、希腊、葡萄牙、西班牙、奥地利、芬兰、瑞典、波兰、捷克、斯洛伐克、拉脱维亚、爱沙尼亚、立陶宛、匈牙利、马耳他、塞浦路斯、斯洛文尼亚)、挪威、瑞士、土耳其、俄罗斯、白俄罗斯、乌克兰、哈萨克斯坦、日本、加拿大、澳大利亚和新西兰。
申请普惠制原产地证书, 领证时需要提交如下资料:1.《原产地证明书申请书》一份;2.《普惠制原产地证明书(form a)》一套;3.正式出口商业发票正本一份,如发票内容不全,另附装箱单;(盖章,不得涂改)4.含有进口成分的产品,必须提交《产品成本明细单》5.复出口日本的来料加工产品或进料加工产品需提交《从日本进口原料证明书》;6.签证机构需要的其他单据。
7..缴纳签证费40元。
3.、《〈中国-东盟自由贸易区〉优惠原产地证明书》(form e)自2004年1月1日起,凡出口到东盟的农产品(hs第一章到第八章)凭借检验检疫机构签发的《中国-东盟自由贸易区》(form e)优惠原产地证书可以享受关税优惠待遇。
某医院医疗物资采购及设备管理制度

某医院医疗物资采购及设备管理制度设备调拨制度 (1)医疗器械使用管理制度 (2)医疗设备报废制度 (3)医疗设备购置及引进制度 (4)医疗设备科工作制度 (5)医疗器械管理制度 (7)大型医疗器械购置论证制度 (14)医疗设备科招标采购制度 (14)医疗器械档案管理工作制度 (16)医用计量器具管理办法 (17)计量器具周期检定制度 (18)医疗器械技术组工作制度 (19)医疗器械应用分析制度 (19)一次性植入人体医疗器械管理制度 (20)医疗器械安全管理制度 (21)医疗器械不良事件报告制度 (22)医疗器械上岗培训考核制度 (23)医疗设备科急救物资应急保障预案 (24)医疗设备处政治、业务学习制度 (25)医疗设备维修保养制度 (27)设备调拨制度一、设备有价或无价向外调拨时,必须履行设备调拨手续,并经有关领导审核批准后,方能向外调拨。
二、调拨设备必须保证医疗业务正常工作,按设备价格,年限和数量等核算计价。
三、院内设备调拨手续有设备调出部门先提出设备调出理由,经设备管理部门审核,由设备调入部门提出申请,经有关领导批准后方可调拨。
四、院外设备调拨手续,由设备调出部门提出设备调拨申请,经设备管理部门审核,被调拨设备在本院确实已经无法使用,但调拨院外确实有使用价值,报请院领导批准后方可有偿调拨。
医疗器械使用管理制度(一)正确使用1.医疗器械最终用户部门应根据操作手册,对初次使用的医疗器械(设备)的医护人员进行细致认真的使用前培训及考核。
2.医疗器械最终用户部门应指派专人负责收集和保管所使用的医疗器械操作手册等资料。
3.医疗器械最终用户部门应针对不同的医疗器械(设备)培养技术骨干,建立部门内技术支持。
4.医疗器械最终用户部门应对相关医疗器械(设备)的操作进行定期考核,以保证下属医护人员对医疗诊断或治疗设备的正确有效操作。
提高诊断准确率或有效治疗率。
(二)安全使用1.保证患者安全:在对医疗器械操作时首先应保证被诊断或被治疗的患者安全。
出口产品说明书模板

出口产品说明书模板篇一:出口产品包装流程说明出口产品包装流程说明一、产品包装前检验和标签制做。
1、确认产品安装正确,外部螺钉都己拧牢。
轻摇动产品听内部是否有异响,大件产品可在平整桌面翻滚。
2、查看外观有无损伤后清洁表面,射频连接器用棉签清洁内孔。
3、打印产品型号标签,内容包括:产品型号、最大输入功率、频段、输入电压、出厂日期、S/N号。
共2纸,产品与外包装箱上各一张。
4、后板粘贴型号标签、防静电标签,面板粘贴LOGO、型号标牌。
LOGO和型号标牌根据产品的设计定,有些产品LOGO和型号己雕刻在面板上。
5、外部射频连接器套防尘帽,所有开关都己在“关”的位置。
6、产品外观拍照留底,包括前、后、侧、顶四面。
7、称重。
二、包装1、产品外套防静电袋,封口处贴防静电标签。
12、准备好产品说明书和测试数据手册,分别用透明袋包好。
测试数据手册袋子外部应贴标签,内容包括:产品型号和S/N号。
3、准备包装纸箱和珍珠棉,纸箱封口用带纤维的湿水纸,封口处应美观。
4、依次装入珍珠棉、产品、说明书、配套线缆等(电源线、数据线),每个步骤都应拍照。
5、装入完备后封口,在纸箱的顶面和底面打钉。
6、纸箱外部贴产品型号标签、纸箱防护标签、公司LOGO标签。
7、纸箱外观拍照留底,产品外观、包装过程、纸箱外观等所有照片都上传公司公共盘的目录内,以产品S/N号新建文件夹将此号的相关照片存入。
8、称重,测量外尺寸。
三、入库1、告知入库产品型号、S/N号,数量。
2、交接产品相关照片及存放位置。
3、告知产品净重量、包装外尺寸。
4、接收人需核对相关信息。
四、发货1、接到发货通知,需知型号、数量。
2、根据发货单到仓库提货。
23、调出所提产品的相关信息,包括:S/N号、尺寸、重量、照片。
4、转交发货人发货。
篇二:产品说明书范文第二部分产品篇目录一(项目定位(可完成) ................................................3二(项目总体规划(需规划补充) .......................................34三、单体设计 (38)1. 建筑形式与风格特点 ..............................................382. 外立面:提供参考图片及相应建筑风格的演变历史及人文背景 (38)3. 入户大厅、标准层设计标准 ........................................384. 电梯及电梯厅设臵 ................................................385. 架空层功能设臵及利用 ............................................40四、产品户型 (40)1. 户型配比 ........................................................402. 户型设计优化、调整建议(包含户型、门窗等) (40)33. 户型面积及配比、面积分摊及测算依据 (40)4. 使用功能特点(附设计图) ........................................40五、设备、设施 (40)1. 室内新风系统 ....................................................402. 玻璃隔热膜等 ....................................................413. 智能化、安防系统建议 ............................................414. 新材料、新技术、新设备建议 ......................................415. 项目、功能、品牌、厂家、性能、价格、安装及品牌一览表 (41)6. 设计单位及实施单位 ..............................................41六、建材、装修装饰 (41)1. 项目与功能:品牌、厂家、性能、价格、安装 (41)2. 品牌与型号:注明典型的应用项目及优、缺点 (41)七、公用配套设臵 (41)1. 功能、面积、位臵一览表 ..........................................412. 使用方案、说明功能及经营方式,给客户生活带来的利好 (41)4八、园林景观设计 (43)1. 项目、功能、布局一览表:示范区为重点 ....(转载于: 小龙文档网:出口产品说明书模板) (44)2. 园林景观主题、特色 ..............................................443. 园林景观具体概念、方案及亮点设臵 (44)4. 园林效果控制 ....................................................445. 设计单位及实施单位及主管人员业绩、特长 (44)九、项目服务配套 (44)1. 客户中心服务要求 ................................................442. 物管公司介绍 ....................................................443. 物管公司服务标准要求 ............................................444. 管理方案、公约、承诺、合同 ......................................44十、营销示范展示区要求 (44)1. 销售中心面积及功能 ..............................................442. 样板房设臵(楼层、套数、风格) ..................................4553. 看房通道要求 ....................................................464. 示范区园林设计要求 ..............................................46十一、开盘后上述情况的月报 ...........................................46产品篇是对项目产品设计策划方案的诠释,是销售人员介绍产品的依据。
医疗耗材配送保障能力及售后服务情况说明 医疗耗材配送 承诺书

医疗耗材配送保障能力及售后服务情况说明医疗耗材配送承诺书随着医疗技术的提高和医疗需求的增加,医疗耗材市场的竞争也日益激烈。
在这个竞争激烈的市场背景下,医疗耗材供应商不仅需要有良好的产品质量和价格竞争力,还需要具备良好的配送和售后服务保障能力。
本文将从医疗耗材配送和售后服务两个方面说明供应商的保障能力及承诺。
一、医疗耗材配送保障能力医疗耗材作为医疗器械的一大类,需要在运输过程中遵循一定的规则和标准来保证其质量和安全性。
因此,供应商需要具备良好的配送保障能力,以确保医疗耗材能够安全、准确、及时地送到客户手中。
1. 仓储管理供应商需要有一个完善的仓储管理系统,对医疗耗材进行分类、标记、存储、检测等操作,确保货物的质量和安全。
同时,供应商还需根据客户的实际需求,进行合理的库存储备,以满足客户随时需要的要求。
2. 物流配送物流配送是医疗耗材供应商的重要环节之一,供应商需要合理规划路线、选择合适的配送方式、采取有效措施确保配送安全。
同时,供应商还需根据客户需求和实际情况,提供定制化的送货服务,满足客户的不同要求。
3. 售后服务在医疗耗材配送过程中,难免会出现一些意外情况,如货物损坏、丢失等。
供应商需要建立完善的售后服务机制,及时响应客户投诉、解决问题,以尽可能地减少客户的损失和不满意。
二、售后服务情况说明供应商提供良好的售后服务是保障客户利益的重要手段。
可以从以下几个方面说明供应商的售后服务情况:1. 维修服务医疗耗材的质量和安全性直接影响到患者的健康和生命,一旦出现质量问题,供应商应及时提供维修服务。
供应商需要建立完善的维修服务机制并配备专业的技术人员,确保客户在使用过程中及时得到帮助。
2. 退换货服务由于医疗耗材的特殊性和价格较高,客户在购买后难免会出现退换货的需求。
供应商需要建立良好的退换货服务机制,确保客户在发生退换货情况时能够及时得到处理,以维护客户利益和营造良好的供应商形象。
3. 储备服务供应商需要建立完善的储备服务体系,及时储备医疗耗材以满足客户的紧急需求。
医疗采购员岗位职责

医疗采购员岗位职责
医疗采购员的主要职责是负责医疗设备、药品、耗材及其他医
疗用品的采购、管理和分配工作。
具体岗位职责如下:
1. 采购计划:根据医疗机构的实际需求和预算,制定年度、季
度和月度的采购计划,明确采购品种和数量。
2. 供应商管理:负责与供应商建立和维护良好的合作关系,做
好供应商的资质审核、合同签订、出货跟踪等工作。
3. 采购收货:组织采购人员验货、收货,并确保采购品质量符
合规定标准和医疗机构的实际需要。
4. 采购入库:对采购的物品进行计量、报关、放行等手续,按
照规定将采购入库到医疗机构的库房。
5. 物资管理:负责对医疗机构的物资进行分类、编码、清点和
监管,实现物资的合理分配和使用。
6. 库存管理:制定库存管理规定,监督和管理医疗机构的库存,保证库存的安全和合理利用。
7. 采购成本管理:负责制定采购价格、材料配比、采购预算等,控制采购成本,实现采购成本的降低。
8. 采购流程管理:建立完善的采购流程,包括需求申请、审批、招标、评价、中标、合同签订等环节,确保整个采购过程的规范和
透明。
9. 市场调查:通过市场调查和信息收集,了解市场动态,及时
调整采购计划和供应商选择,确保采购质量和效益。
10. 协调沟通:与相关部门和供应商保持密切联系,及时解决
采购中的问题和难点,促进各环节之间的协调和沟通。
总之,医疗采购员的岗位职责涉及到采购计划、供应商管理、
采购收货、物资管理、库存管理、采购成本管理、采购流程管理、
市场调查和协调沟通等方面,需要具备深厚的医疗知识和采购技能,熟悉相关政策法规和流程,善于沟通和协调。
医疗器械 符合性声明

医疗器械符合性声明符合性声明1. 引言本文档旨在声明我们公司(以下简称“申报人”)所生产的医疗器械符合相关法规和标准的要求。
该符合性声明合用于我们公司生产的所有医疗器械产品。
2. 产品描述在本章节中,我们将对我们生产的医疗器械产品进行详细描述,包括产品名称、型号、用途、技术参数等。
3. 法规和标准我们公司的医疗器械产品符合以下法规和标准的要求:- 国家和地区的医疗器械注册要求:我们的产品已获得相关机构的注册,并符合该国家或者地区的医疗器械注册要求。
- 产品安全和性能标准:我们的产品符合国际标准ISO XXXX或者相关国家标准XXX的要求。
4. 质量管理体系我们公司已建立并实施了符合国际标准ISO XXXX的质量管理体系。
该体系覆盖了从产品设计、生产、包装、配送到售后服务的全过程,并确保我们的医疗器械产品在生产过程中向来符合质量、安全和性能要求。
5. 风险管理我们公司已对医疗器械产品的相关风险进行了评估,并采取了必要的控制措施来降低风险。
我们致力于提供安全可靠的医疗器械产品,并在使用说明书中提供了相关的警示和注意事项。
6. 产品性能验证我们通过严格的产品性能验证测试,以确保我们的医疗器械产品的性能符合预期要求。
我们已对每一个产品进行了充分的测试和验证,并保留了相应的测试记录和结果。
7. 产品标识和说明我们的医疗器械产品已正确标识和包装,包括产品名称、型号、生产日期、保质期等信息。
我们在产品包装中提供了清晰易懂的使用说明书和警示标签,以匡助用户正确使用产品。
8. 监管合规性我们公司积极协助相关监管机构进行监管审核和产品检查。
我们承诺遵守所有与我们的医疗器械产品相关的法规和标准,并及时履行任何相关法规和标准要求的变更。
9. 售后服务我们提供全面的售后服务,包括产品质量投诉和问题处理。
我们始终秉承“客户至上”的原则,确保用户对我们的医疗器械产品的使用满意。
10. 本文档所涉及附件如下:- 产品说明书- 证书和批准文件- 相关测试报告和验证记录- 参考文献和法规标准列表11. 本文档所涉及的法律名词及注释:- ISO: International Organization for Standardization,国际标准化组织。
浅析海关企业信用管理

浅析海关企业信用管理作者:聂相玲来源:《商情》2020年第21期【摘要】社会信用体系的建立和完善是我国社会主义市场经济不断走向成熟的重要标志之一。
它是以相对完善的法律、法规体系为基础;以建立和完善信用信息共享机制为核心;以信用服务市场的培育和形成为动力;以信用服务行业主体竞争力的不断提高为支撑;以政府强有力的监管体系作保障的国家社会治理机制。
海关作为政府监管部门之一,在信用建设方面,走在了前列。
本文从海关企业信用管理制度入手,分析了当前我国外贸企业信用建设的不足,剖析了海关企业信用管理制度,有利于提高企业的信用管理和信用风险意识。
【关键词】海关信用管理外贸企业认识对策“一带一路”战略的实施,促进了沿线国家的联手合作,为全球均衡可持续发展增添了新动力,同时也带动了我国外贸行业的繁荣发展。
在稳定的外贸经济形势下,信用成为企业发展的又一助力,信用将在企业以后的生产经营中体现出越来越重要的作用。
海关作为政府监管部门之一,在信用建设方面,通过海关企业信用管理,走在了前列。
我国海关企业信用管理主要为三大内容:国际AEO互认、信用管理、联合激励与惩戒。
一、海关企业信用管理有关政策和管理措施解读(一)国际AEO互认2005年6月,世界海关组织(WCO)第105/106次年会通过了《全球贸易安全与便利标准框架》(以下简称《标准框架》),提出了经认证的经营者制度(AEO)。
其内容涉及海关的全面业务和全方位改革方向,描述和规划了现代海关发展的模式和蓝图,代表了海关的未来发展方向。
“经认证的经营者”(简称AEO (Authorized Economic Opera-for)),按照国际通行规则,海关对信用状况、守法程度和安全管理良好的企业进行认证认可,对i压过认证的企业给予通关优惠便利。
“认证企业”就是中国海关的AEO,适用我国与其他互认国家(地区)海关的优惠待遇。
AEO互认的便利措施主要体现在:适用较低的查验率、简化单证审核、优先办理进出口货物通关手续、为高级认证企业设立协调员,解决通关中遇到的问题、因不可抗力中断国际贸易恢复后优先通关等。
医疗器械的出口合同

医疗器械出口合同甲方(出口方):_____________________________________地址:_____________________________________________联系电话:__________________________________________法定代表人:_______________________________________乙方(进口方):_____________________________________地址:_____________________________________________联系电话:__________________________________________法定代表人:_______________________________________根据《中华人民共和国合同法》及相关国际贸易法规,甲乙双方在平等、自愿的基础上,就医疗器械的出口事宜达成如下协议:一、合同标的1.1 产品名称:_____________________________________1.2 产品型号及规格:______________________________1.3 数量:__________________________________________1.4 单价:人民币/美元________元/单位(大写:_________________元/单位)1.5 总金额:人民币/美元________元(大写:_________________元)二、质量标准及检验2.1 甲方所提供的医疗器械应符合中国及进口国相关法律法规的质量标准,并提供相应的合格证书、检验报告及必要的国际认证文件。
2.2 乙方有权在货物装运前对产品进行检验,甲方应给予配合并提供必要的技术资料和样品。
2.3 如乙方在检验中发现产品质量不符合合同约定,有权要求甲方更换不合格产品或退货。
医疗器械 符合性声明

医疗器械符合性声明医疗器械符合性声明本符合性声明(以下简称“声明”)旨在确认和保证该医疗器械符合相关法规和标准的要求。
本声明适用于符合性评估和符合性申报的医疗器械,并在产品投放市场前提供给相关监管机构。
1、引言本章节概述了声明的目的和适用范围。
1.1 目的本声明的目的是确认所述医疗器械符合适用的法规、标准以及相关要求,并提供必要的支持文件和测试报告,以便满足市场准入的要求。
1.2 适用范围本声明适用于所有所述医疗器械及其相关附件,具体规定如下所列。
2、适用法规和标准本章节详细介绍适用于医疗器械的法规和标准,并提供相应的法规名词注释。
2.1 法规名词和注释- 法规1:根据机构制定的医疗器械市场准入的法规,确保医疗器械符合安全和有效性的要求。
- 法规2:根据机构制定的医疗器械质量管理的法规,确保医疗器械在制造过程中符合质量管理的要求。
- 法规3:根据机构制定的医疗器械标志和标签的法规,确保医疗器械的标志和标签符合法规规定的要求。
2.2 标准名词和注释- 标准1:医疗器械质量管理体系标准,规定了医疗器械制造企业应当建立的质量管理体系要求。
- 标准2:医疗器械技术要求标准,规定了医疗器械应当具备的技术性能和安全性要求。
- 标准3:医疗器械标志和标签标准,规定了医疗器械的标志和标签应当符合的要求。
3、符合性评估本章节描述了对医疗器械的符合性评估过程,包括评估方法、测试流程和相关文件的准备。
3.1 评估方法根据法规和标准的要求,通过以下方法对医疗器械进行符合性评估:- 文件审查:审核和分析相关文件,包括设计文件、技术文件、测试报告等。
- 实验测试:进行相关物理、化学和生物学测试,以验证医疗器械的技术性能和安全性。
- 现场检查:对生产过程和质量管理体系进行审核和检查。
3.2 测试流程本节详细描述了医疗器械的测试流程,包括测试项目、设备和方法。
3.3 支持文件本节了用于支持医疗器械符合性申报的文件,包括测试报告、技术文件、产品标志和标签等。
《企业统计学》课程思政教学案例(一等奖)

《企业统计学》课程思政教学案例(一等奖)一、课程简介《企业统计学》全面介绍了现代企业经营统计的基本内容和方法,是经济统计学专业本科学生的核心课程,在培养企业统计技术人才的全局中,占有重要地位。
课程遵循OBE理念,针对专业的培养目标和毕业要求,制定课程培养目标,旨在培养学生能够以批判性的思维发现、辨析、质疑、评价企业生产经营统计领域的现象和问题,使学生能够构建起经济统计学专业思维体系,坚定学习经济统计学专业和从事经济统计工作的信心,同时通过深刻认识企业统计工作,感受中国力量、中国制造、中国精神、中国故事,感受作为新一代青年统计工作者的责任与担当。
随着互联网技术的飞速发展,和数字经济时代的到来,企业数据的统计和应用问题不仅引起了微观企业的关注,也逐渐发展成为了学术界研究领域的前沿话题。
因此,该课程的学习,有利于学生毕业后在企业从事统计实践工作,也有助于学生的进一步深造。
二、教学目标(一)课程思政教学目标1.通过贯穿“统计质量”的理念和目标,帮助学生强化对企业生产过程质量统计背后的价值理解和认同(思政目标),使学生理解企业生产经营过程中的质量过程控制统计指标(教学目标)。
2.通过线上线下、多元化的教学形式和方法的应用,使学生理解生产过程的质量统计在企业实际生产经营中的重要性,实现本讲课的教学目标,将充满正能量的主流价值观传递给学生,进而体现本讲课程的思政目标。
(二)案例如何体现课程思政教学目标1.结合近年来企业产品质量问题案例,对企业质量管理和质量统计指标进行讲解和分析,突出指标体系中对过程质量控制的指标讲解,使学生通过切身体验和具体的企业产品质量案例更好的理解企业质量过程控制对企业改革、转型和可持续发展的重要引导作用,从而强化学生对企业质量统计的价值理解和认同。
2.通过中国企业在当前全球经济一体化中的卓越进步和世界贡献,帮助学生厚植爱国主义情怀,坚定中国立场,认清和勇挑时代担当,并在此过程中引入中国企业的作用和贡献,能够让学生自然地将爱国主义情怀倾注到自己的专业中去,以中国统计人的职业担当为己任,坚固自己的学习信心。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(含规格、型号)
Product Name
(including specifications and model)
产品数量
Product Quantity
国外质量
标准名称
The Name ofQuality Standards ofthe ForeignCountry
国外质量标准要求
Quality Requirements of the Foreign Country
特此声明。
公司名称(盖章)
Company Name(Seal)
年 月 日
Day/Month/Year
下载医疗物资声明
出口医疗物资声明
Export Declaration of Medical Supplies
兹声明,本次报关出口医疗物资信息如下:
We hereby declareas follows theexport information of medical supplies for this customs declaration:
进口国(地区)
Importing Country/ Region
生产
厂商
Producer
上述产品取得***质量标准认证(注册),符合**国(地区)相关质量标准和安全要求。我公司对以上内容承担如实申报之责任。
The above products are certified or registered by ***quality standards and compliant with relevant quality standards and safetyrequirements of *** country/region. Our company is responsible for the truthful declaration of the above information.
