高二化学芳烃PPT优秀课件
有机化学六章芳烃.ppt.Convertor

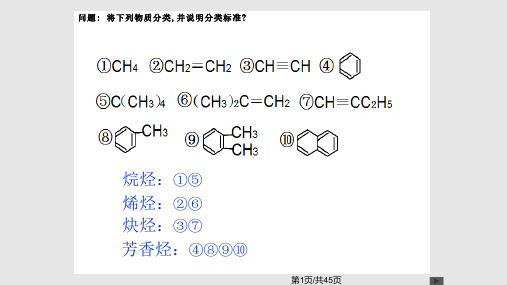
第六章芳烃芳烃是芳香族碳氢化合物的简称。
一般情况下,把苯及其衍生物称为芳香族化合物。
其中分子中只含一个苯环的芳烃叫做单环芳烃。
芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的物质。
现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味,也不一定含有苯环结构。
芳香烃具有其特征性质——芳香性(易取代,难加成,难氧化)。
第一节单环芳烃的结构、异构和命名一、单环芳烃的结构苯是单环芳烃中最简单最重要的化合物,也是所有芳香族化合物的母体。
1. 凯库勒构造式根据元素分析得知苯的分子式为C6H6。
仅从苯的分子式判断,苯应具有很高的不饱和度,显示不饱和烃的典型反应—加成、氧化、聚合,然而苯却是一个十分稳定的化合物。
通常情况下,苯很难发生加成反应,也难被氧化,在一定条件下,能发生取代反应,称为“芳香性”。
1865年凯库勒从苯的分子式出发,根据苯的一元取代物只有一种,说明六个氢原子是等同的事实,提出了苯的环状结构。
这个式子虽然可以说明苯分子的组成以及原子间连接的次序,但这个式子仍存在着缺点,它不能说明苯既然含有三个双键,为什么苯不起类似烯烃的加成反应?环己烯的氢化热为119.6kJ/mol,如果苯的构造式用凯库勒式表示的话,苯的氢化热为环己烯氢化热的三倍。
119.6×3=358.8KJ/mol 。
实际上苯的氢化热是208.4KJ/mol,比预计的数值低150.4KJ/mol。
2.闭合共轭体系根据现代物理方法(如X射线法,光谱法等)证明了苯分子是一个平面正六边形构型,键角都是120℃ ,碳碳键的键长都是0.1397nm。
按照轨道杂化理论,苯分子中六个碳原子都以sp2杂化轨道互相沿对称轴的方向重叠形成六个C-C σ键,组成一个正六边形。
每个碳原子各以一个sp2杂化轨道分别与氢原子1s轨道沿对称轴方向重叠形成六个C-H σ键。
由于是sp2杂化,所以键角都是120℃,所有碳原子和氢原子都在同一平面上。
高二理化生选修芳香烃PPT课件
第18页/共45页
【苯的硝化反应——实验思考】
1、如何混合硫酸和硝酸的混合液?
① 先将浓硝酸注入大试管中,再慢慢注入浓硫酸,并及时摇匀 和冷却。② 向冷却到50-60℃后的混酸中逐滴加入苯,充分振荡, 混和均匀。切不可将浓硝酸注入浓硫酸中,因混和时要放出大 量的热量,以免浓硫酸溅出,发生事故。
4. 生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验 结果是否可靠?为什么?如何除去混在HBr中的溴蒸气?
第14页/共45页
设计制备溴苯实验方案——改进 苯与溴的反应
第15页/共45页
+ HNO3(浓) 浓H2SO4 50~60℃
NO2 + H2O
➢硝基苯是苦杏仁味的、无色油状液体,不溶于水 且密度比水大,有毒.(因溶有NO2而显淡黄色)
当时,煤焦油被当作废物扔掉,污染环境,造成公 害。随着炼焦工业的发展,煤焦油的堆积也愈来愈严 重,煤焦油的利用就成为当时生产中迫切需要解决的 一个重要的环境和社会问题。
第2页/共45页
芳香烃及其化合物的来源
历史回顾
后来,以法拉第为代表的科学家对煤焦油产生了 兴趣,并从煤焦油中分离出了以芳香烃为主的多种重 要芳香族化合物,又以这些芳香族化合物为原料合成 了多种染料、药品、香料、炸药等有机产品。到十九 世纪中叶,形成了以煤焦油为原料的有机合成工业。
2. 分别写出苯与氧气反应,与氢气加成,与溴和浓硝 酸发生取代的化学方程式。(P37)
第8页/共45页
1)苯的氧化反应:在空气中燃烧
2C6H6+15O2
点燃
12CO2+ 6H2O
有机化学-第八章芳烃ppt课件

第 八 章 芳 烃
当苯环上有俩不同取代基,按照下列顺序决定哪个取代基和苯 环一起作为母体:羧基-COOH > 醛基-CHO > 羟基-OH > 烯基-C=C-或炔基 > 氨基-NH2 > 烷氧基-OR > 烷基-R > 卤 素-X > 硝基-NO2 > 亚硝基-NO 当苯环上有三取代基时,先选出母体官能团,并把它编号为1 ,其他的官能团按编号最小原则顺时针或逆时针沿苯环编号, 书写官能团时依然按照取代基次序原则先后书写; 了解联苯的编号与命名; 了解萘的编号和α 位β位; 练习题 8.1 8.2
①
② •
傅克反应的局限性: 傅克反应是一个亲电取代反应,凡是苯环上连有硝基-NO2、 磺酸基-SO3H、氰基-CN或者羰基-CO-R等吸电子基团,将直 接降低苯环电子云密度而导致傅克反应不能发生; 傅克烷基化反应经过碳正离子中间体,碳正离子重排严重,常 使引入苯环的烷基不是以前的烷基; 克服碳正离子重排方法是酰化后再经克莱门森还原为烷基。
练习题 8.9 练习题 8.10
2.芳烃的化学反应
第 八 章 芳 烃
苯的加成和氧化反应 苯环相比烯烃,加成条件非常特殊。
H , N i 2 4 0 0 ~ 5 0 0 C
C l C l C l C l C l C l
C l 2 u l t r a v i o l e t
氧化反应:
O , V O 2 2 5 4 0 0 ~ 5 0 0 C
O O H S O
苯与浓硫酸或发烟硫酸(SO3与硫酸的混合物)反应,可在苯 环上引入磺酸基而生成苯磺酸。 磺化反应是可逆反应,即苯磺酸与稀酸一起加热可返回苯与硫 酸;
有机化学第08章 芳香烃(共201张PPT)

再比较 4式和5式
4
催化 剂
+ H2 压 力, 溶剂
112.3KJ mol-1
5
催 化剂
+ H2
压力 ,溶 剂
按上面的计算和结论,5 式若为共轭三烯结构,当加一 分子氢时,氢化热应为-112.3-(-7.2) = -105.1 KJ mol -1。
催化剂
+ H2 压力,溶剂
(Z)
H?
(Z)
- 105.1 KJ mol -1
4 苯具有特殊的稳定性---从氢化热数据看苯的内能。
环己烯 环己二烯
环己三烯
苯
氢化热(kJ / mol) 119.5 (测定)
231.8 (测定)
119.53=358.5 208.5 (根据假设计算) (测定)
每个C=C的平均氢化热 119.5
115.9
119.5
69.5
(kJ / mol)
从整体看: 苯比环己三烯的能量低 苯比环己二烯的能量低
119.5 KJ mol-1
3
催化 剂
+ 2H2 压力,溶剂
231.8 KJ mol-1
4
催化 剂
+ H2 压力,溶剂
112.3KJ mol-1
(Z)
5.
催化剂
+ H2 压力,溶剂
H?
(Z)
6. CH2=CH-CH=CH-CH=CH2 + 3 H2 CH3(CH2)4CH3 -337 KJ mol-1
反键轨道
E 成键轨道
共振论
Ⅰ
Ⅱ
贡献大
键长,键角完全 相等的等价结构
Ⅲ
Ⅳ
Ⅴ
贡献小
键长、键角不等 的不等价结构
第七章 芳 烃.ppt

CH 3 CH
CH 3
异丙基苯
叔丁基苯
NO 2
Cl
硝基苯
氯苯
上一内容 下一内容 回主目录
返回
当苯环上连有 -COOH、 -SO3H、-NH2、-OH、-CHO、
-CH=CH2或R较复杂时,则把苯环作为取代基。例如:
COOH
SO3H
CHO
OH
NH 2
返回
7—2 单环芳烃的异构和命名
一、 异构现象 1、烃基苯有烃基的异构 例如:
CH 2CH 2CH 3
CH 3 CH
CH 3
2、二烃基苯有三种位置异构
例如:
R R'
R
R
R'
R'
上一内容 下一内容 回主目录
返回
3、 三取代苯有三种位置异构
例如:
R R''
R' R''
R
R'' R'
R R'
+ CH3CH2CH2Cl AlCl 3
CH 3
CH CH 3
+
CH 2CH2CH 3
异丙苯(65~69%) 正丙苯(35~31%)
原因:反应中的活性中间体碳正离子发生重排,产 生更稳定的碳正离子后,再进攻苯环形成产物。
3°烷基化反应不易停留在一元阶段,通常在反应中 有多烷基苯生成。
上一内容 下一内容 回主目录
+ CH3CH2
CH 2CH 3 H
H+
CH2CH3 + HBr AlCl 3
此反应中应注意以下几点: 1°S常nC用l4的、催Zn化Cl剂2、是H无3P水OA4、lCHl32,SO此4等外都F有eC催l3、化B作F用3、。无水HF、
有机化学第五章芳烃PPT课件

甲苯
乙苯
异丙苯
(2)当苯与烯、炔相连时,习惯上把苯作取代基,不饱和
烃作母体。
-CH=CH2
-C≡CH
苯乙烯(或乙烯第苯1)1页/共114页
苯乙炔
(3) 若烃基的碳链较长或烃链上含有多个苯环时,一般把苯 作取 代基,烃作母体。
CH3 CH3
CH3CH2CH2-CH—CH-CH2
C
2,3-二甲基-1-苯基己烷
的分子,它的真实结构可以用几个经典结构式共同来表示。 这些参与了结构组成的经典结构叫做共振结构式,也叫极
限结构式。
第19页/共114页
+ - ……
O OC
O
O OC
O
OC O O
(二) 共振论的规则 共振结构式的本质是用价键结构式来反映共轭体
系中P电子离域的范围,即用多个合理的价键结构 式来描述电子的瞬间运动状态。
D. 在满足八电子体的共振结构式中,有电荷分离, 负电荷应在电负性较大的原子上。
O
CH3—C—CH2
O-
CH3—C CH2
第24页/共114页
稳定
E. 两个带有相同电荷的原子相隔越近、两个带有相 反电荷的原子 相隔越远,共振式能量高,不稳定, 对杂化体的贡献小
H E
+
+O N
不稳定
O-
三、共振论的优点和缺点 总结:共振论认为共振是一种稳定因素,参与共振 的共振式越多,杂化体越稳定;2)通常以能量最低, 稳定性最高的共振结构为标准,其真实分子即共振 杂化体所降低的能量叫共振能。
芳烃—— 芳香族碳氢化合物
(1)碳氢比高 如:
C : H = 1 : 1 C : H = 10 : 8
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
机理:
δ+ δ F eC l3+ l C l C
C l++eC l4 - F
+ Cl+
+
Cl
H C l +
FeCl4-
Cl
重新析出:
催化剂
+HCl + eClF 3
Cl Cl
Cl + Cl2 FeCl3
活性顺序:F > Cl > Br > I
Cl + Cl
机理:
δ+ δ F eC l3+ l C l C
稳定性
不稳
稳
共振能: 119.6×3-208.16=150.5KJ/mol
二 同分异构现象及命名P.220
1 一取代
C H 3
C H 3
C H C H 3
N O 2
C l
A
甲(基)苯 异丙苯
硝基苯 氯苯
B 含-COOH、-OH、NH2、-SO3H时,苯环作取代 基:
C O性质P.223
1 亲电取代反应(芳烃的典型反应) P.223
简略机理:
快
+ E+
慢
E+
H
E SP 3
+
亲电试剂 π-络合物
σ-络合物
快
E +
H +
E+ = X+、NO2+、SO3H+、R+、RCO+。
(1) 与X2的反应
a
+ 2C 或 FlF e3C e, l
Cl + HCl
富电子 缺电子
H C H 2C H 3
CH3CH2
AlCl4-
+ H2O+AlCl3
+
C H 3C H 2C H 2
无A 水 lC l3
lC
CH 2CH 2CH 3 C H 3
CHCH3
+ 70 %
a 烷基化:在苯环上引入烷基 Lewis酸2、 :F Z3e、 nC CB 3l等 l F
+ CH3CH2Cl 无A 水 lCl3
(或:RX、ROH、烯烃)
CH2CH3 + HCl
机理:
C H 3 δ C + H 2δlC +A lC l3
AlCl4-
+
+ CH3CH2
特点?缺电子
+
C H 3C H 2 +
C=C
C-C
H C
H C
HC
CH
CC
H
H
苯分子中p轨道示意图
3. 分子轨道理论
三个节面
ψ6 ψ4 二个节面 ψ5
ψ2 一个节面 ψ3 ψ1
无节面
4 共振论的解释
极限式 A
极限B 式
共振能:由于共振,体系的能量降低之值,相当于分子轨道 理论中的离域能。
环己烯
氢化热
119.6KJ/mol
苯 208.16KJ/mol
比较
CH3
氯化苄(苯氯甲烷)
CH2Cl
光照
光照
CHCl2 光照
Cl2
Cl2
Cl2
自由基取代:烷烃,需光照hν。
CCl3
(2) 硝化反应 a
混酸
+
HNO3
H2SO4 50-60℃
NO2
+
H2O
黄色油状液体(>1),苦杏仁味, 有毒,可作有机溶剂。
NO2
+
HNO3(发烟)
H2SO(4 发烟)
100℃
NO2 + H2O
b 二磺化 SO3H 发烟H2SO4
200-400℃
c 甲苯的磺化
CH3
H2SO4
室温
CH3 SO3H +
SO3H
间-苯二磺酸
SO3H
CH3
d 逆反应及其用途
SO3H
SO 3HH +
+H 2SO 4 (去磺化反应)
用途:可用于有机合成或分离提纯。
分离:苯与环己烷 上层(油层):
分液
H2SO4
SO3H 下层(水层):
NH2
OH COOH
SO3H
对-氨基苯磺酸
邻-羟基苯甲酸
3 三取代
CH3
1 2
3
CH3
CH3
5 CH3
CH3 1
2
3 CH3 4
1,2,3- 三甲苯 (连-三甲苯)
1,3,5- 三甲苯 ( 均- 三甲苯)
CH3
1
5 4
2 CH3
3
CH3
1,2,4- 三甲苯
( 偏 - 三甲苯)
4 取代基很复杂时,将取代基看作母体,苯环作取代基。
H3O+
e 氯磺化反应:与氯磺酸(ClSO3H)的反应
O +CS lOH
O
O S Cl O
苯磺酰氯
苯磺酰氯很活泼,可用于合成磺胺类药物,如:
O NHC3CH
O NHCCH3
O NHCCH 3
ClS3O H
NH3·H 2O
乙酰苯胺
水解
NH2
SO2Cl
磺胺
SO 2 NH 2
SO2NH2
(4) 傅-克(Friedel—Crafts)反应
脂肪烃:烷、烯、炔、脂环烃等
烃
单环 如
CH3
芳香烃:
多环 如
非苯芳烃 如
-
难加成,难氧化,易取代,环稳定。
第八章 芳 烃
第一节 苯及其同系物
一 苯的结构
1. Keküle式
C6H6
优点:说明苯分子的组成 C6H6 及连接次序。 缺点:
A.不能解释苯的特殊稳定性 和不发生加成反应。
B.不能解释只有一种邻二甲 苯。
例 C 5 H3C4 H2C3 HC2 H=CH 1 2
(苯基)
3- 苯基-1-戊烯
苯基:
、C6H5 、Ph
苄基(苯甲基): CH2
附
芳香烃基:Ar-
脂肪烃基:R-
三 物理性质P.223
1 苯环
(μ =0)
不溶于水; 非极性有机溶剂。
2 苯及其同系物,一般有毒。
3 苯的沸点b.p. 81℃,比水轻。
苯甲酸
苯胺
苯磺酸
2 二取代
CH3
CH3
CH3
CH3
CH3
邻- 二甲苯 (o)-
间- 二甲苯
CH3
对-二甲苯
(m)-
(p)-
CH3
COOH
C2H5
Cl
CH3
邻- 氯甲苯 间- 甲基苯甲酸
NO2
对- 硝基乙苯
若同时含有多种取代基,首先选好母体,依次编号,选择母 体顺序如下:-OR、-R、-NH2、-OH、-COR、-CHO、-CN、 -CONH2、-COX、-COOR、-SO3H、-COOH、正离子如NR3+等。
CH3 CH3
(Ⅰ)
CH3 CH3
(Ⅱ)
2 杂化轨道理论(芳香六隅体)
C6H6
H
H
H
120°
H
sp2
H
H
π6 6
H H
H
H H
H
特点:a 六个C、六个H同处一平面,正六边形,键角为120°。
b 离域大π键
能量低,稳定。
π电子在上、下方自由流动电子云密
度大。参见P.218图8-1
键长平均化: 1.34Å<1.39Å<1.54Å
NO2
b
CH3
+
H2SO4
HNO3 30℃
CH3 NO2 +
CH3
NO2
(3) 磺化反应 a 一磺化
O
δ- δ+
HO S OH
O
+ H2SO4 70-80℃
实例:合成洗涤剂
SO3H
苯磺酸: ~H2SO4, 强酸,易溶于水。
C12H25
C12H25
H2SO4 SO3H
C12H25 SO3-Na+
主要成份
C l++eC l4 - F
+ Cl+
+
Cl
H C l +
FeCl4-
Cl
+HCl + eClF 3
重新析出:催化剂
Cl + Cl2 FeCl3
Cl Cl
Cl +
Cl
活性顺序:F > Cl > Br > I
b
CH3
CH3
CH3
+ Cl2 FeCl3
+
Cl
Cl
亲电取代:在苯环,需催化剂(如Fe,FeCl3)。
