高三化学大一轮复习单元复习监测题十镁和铝2017102319.doc
高考化学一轮复习 第10讲 镁、铝及其重要化合物课时作业-人教版高三全册化学试题

第10讲镁、铝及其重要化合物(建议用时:40分钟)一、选择题(每题6分,共66分)1.下列关于铝及其化合物的叙述正确的是( )A.铝罐可久盛食醋B.氢氧化铝可作胃酸的中和剂C.明矾用作净水剂不涉及化学变化D.铝与Fe2O3发生铝热反应,反应后固体物质增重答案 B解析铝罐容易受食醋中的醋酸腐蚀而损坏,无法久盛食醋,A错;明矾用作净水剂是利用Al3+水解生成的氢氧化铝胶体的吸附性,涉及化学变化,C错;铝与氧化铁反应,反应前后都是固体,质量不变,D错。
2.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是( ) A.此法的优点之一是原料来源丰富B.第④步也可采用电解MgCl2溶液的方法C.①②③步骤的目的是从海水中提取MgCl2D.以上提取镁的过程中涉及化合、分解和复分解反应答案 B解析电解MgCl2溶液得不到金属镁,B错误。
3.下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )①NaHC O3②(NH4)2SO3③Al2O3④Al(OH)3⑤AlA.全部B.只有①③④⑤C.只有③④⑤ D.只有②③④⑤答案 A解析弱酸的酸式盐、弱酸的铵盐、Al、Al2O3、Al(OH)3等物质既可与强酸反应又可与强碱反应,故选A。
4.镁、铝单质的化学性质以相似性为主,但也存在某些重大差异性,下列物质能用于证明二者存在较大差异性的是( )①CO2②盐酸③NaOH溶液④CuSO4溶液A.①④ B.②③ C.①③ D.②③④答案 C解析镁能与CO2反应而铝不能,铝能与NaOH溶液反应而镁不能。
5.足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是( ) A.氢氧化钠溶液B.稀硫酸C.盐酸D.稀硝酸答案 A解析A项,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,1 mol Al消耗1 mol NaOH;B项,2Al+3H2SO4===Al2(SO4)3+3H2↑,1 mol Al消耗1.5 mol H2SO4;C项,2Al+6HCl===2AlCl3+3H2↑,1 mol Al消耗3 mol HCl;D项,Al和稀硝酸反应不放H2。
高考化学第一轮总复习专题检测铝及其化合物(含答案).doc

学习必备欢迎下载第二讲铝及其化合物一、选择题1.将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是()- 1A.3 mol ·L盐酸- 1B.4 mol ·L HNO 3溶液- 1C.5 mol ·L NaOH 溶液- 1D.18.4 mol L· H2 SO4溶液解析 B 项中硝酸和 D 项中浓硫酸与金属反应不产生氢气; C 项中 NaOH 溶液只与铝反应而不与镁反应,而 A 项中盐酸与镁和铝均能反应, A 项正确。
答案 A2.在 Al 2(SO4)3和 MgSO4的混合溶液中,滴加 NaOH 溶液,生成沉淀的量与滴入NaOH 溶液的体积关系如右图所示,则原混合液中 Al 2(SO4)3与 MgSO4的物质的量浓度之比为 ()。
A.6∶1B.3∶1C.2∶1D.1∶2解析溶解 Al(OH) 3耗碱 10 mL,则生成Al(OH) 3耗碱为30 mL ,生成Mg(OH) 2耗碱 (50-30)mL ,故 Al 3+与 Mg 2+浓度之比 1∶1,则 Al 2(SO4)3与MgSO4的物质的量浓度之比为1∶2。
答案 D3.下列除去杂质的方法不正确的是()。
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量 Al 3+C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水D.Al(OH) 3中混有少量 Mg(OH) 2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤解析Al 可与烧碱溶液反应,而Mg 不能反应, A 项正确; Al(OH) 3只能溶于强碱,不溶于氨水, B 项错误; CaO 吸水生成 Ca(OH)2,再蒸馏乙醇蒸发分离, C 项正确; Mg(OH) 2不与烧碱反应, Al(OH) 3溶于烧碱生成 NaAlO 2,再通入过量 CO2又生成 Al(OH) 3, D 项正确。
高三总复习专题镁、铝.doc

高三总复习专题:镁、铝一、选择题1.镁粉在焰火、闪光粉中是不可少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却气体的是(1)空气 (2)CO 2 (3)Ar (4)H 2 (5)N 2 A .(1)(2) B .(2)(3) C .(3)(4) D .(4)(5)2.由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是 A 、锌 B 、铁 C 、铝 D 、镁3.有甲、乙、丙、丁四种金属,将甲、乙用导线相连放人稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H 2析出,已知四种金属中有一种是铜,根据以上实验判断铜是 A 甲 B 乙 C 丙 D 丁 4.镁、铝都是较活泼的金属,下列描述正确的是A .镁的硬度比铝稍大,熔沸点都比铝高B .镁铝都能跟稀盐酸、稀硫酸、强碱反应C .镁在点燃条件下可以跟二氧化碳起反应,铝在一定条件下可以跟氧化铁发生反应D .铝热剂是镁条、铝粉和氧化铁的混合物5.冶金工业上常用电解熔融MgCl 2而不用电解MgO 的方法制取镁,其原因是A .熔融的MgO 不导电B .MgO 分子间作用力很大C .MgO 熔点高D .MgO 属原子晶体6.将物质的量都为amol 的Na 和Al 一同放入mg 足量水中,所得溶液的密度为dg/cm 3,则此溶液的物质的量浓度为 A .m a ad +40 mol/L B .m a ad +461000mol/L C .m a ad +471000mol/L D .ma ad+501000mol/L7.在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。
然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图,则下列说法正确的是 A.铝球一定是空心的B.左边烧杯中的溶液质量减少了C.去掉两烧杯杠杆仍平衡D.右边铁球上出现红色8.下列各组离子在溶液中不能大量共存,且加入过量NaOH 溶液或过量稀盐酸均能得到澄清溶液的是A.Fe 3+、Cl -、Na +、SO 42-B.Al 3+、Na +、CO 32-、NO 3-C.Ag +、Na +、SO 42-、NO 3-D.AlO 2-、CO 32-、K +、Na +9.bL 硫酸铝溶液中含有agAl 3+,则溶液中SO 2-4的物质的量的浓度为 A.3a/2b mol/L B.a/27b mol/LC.a/18b mol/LD.2a/81b mol/L10.有MgCl 2、Al 2(SO 4)3的混合溶液,向其中不断加入NaOH 溶液得到的沉淀量与加入的NaOH 溶液的关系如图所示,则溶液中C (Cl ¯)与C (SO 42-)之比为A.1∶1B.2∶3C.3∶2D.2∶111.向下列溶液中加入氨水直至过量,最终能得到无色澄清溶液的是 A Al 2(SO 4)3溶液 B AgNO 3溶液 C CuSO 4溶液 D MgCl 2溶液12.只用一种试剂就可以鉴别NaCl 、Na 2S 、NaAlO 2、NaHCO 3四种无色溶液、此试剂可能是 A 、AlCl 3溶液 B 、BaCl 2溶液 C 、盐酸 D 、NaOH 溶液13.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大 A .AlCl 3 B .HCl C .CO 2 D .NaHSO 414.一瓶失去标签的盐溶液,若向其中分别加入少量烧碱溶液,纯碱溶液和硫化钠溶液,结果都生成沉淀,而且沉淀是同种物质,则该盐是A、Al2(SO4)3B、AgNO3C、MgCl2D、CuSO415.既能跟明矾溶液反应,又能跟适量NH4HSO4溶液反应生成白色沉淀的是A. FeCl3溶液 B.NaHCO3溶液 C.KAlO2溶液 D.Ba(OH)2溶液16.现有20mLMgCl2和AlCl3的混合溶液,其中[Mg2+]=0.2mol/L、[Cl—]=1.3mol/L.要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4mol/L NaOH溶液A.140mL B.120mL C.100mL D.80mL17.下列操作中,始终不能观察到白色沉淀的是A.将少量氨水滴入氯化铝溶液中 B.将少量氢氧化钠滴入氯化铝溶液中C.将少量氯化铝溶液滴入氢氧化钠溶液中 D.将少量偏铝酸钠溶液滴入氢氧化钠溶液中18.某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成.该溶液加入NaOH溶液出现白色沉淀;加入稀H2SO4也出现白色沉淀,并放出气体.据此分析,下述组合判断正确的①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3 ④肯定有NaHCO3或Na2CO3⑤肯定没有MgCl2A.①②③B.①③C.②④D.①③⑤19.固体物质A与稀硫酸反应生成溶液C,C与氢氧化钠溶液反应生成沉淀B,B加热又转变为A,则A可能是A.BaO B.CuO C.Fe2O3 D.Na2O20.当向下列各组溶液中分别通入CO2后,可能产生白色沉淀的是①澄清石灰水②MgCl2和BaCl2混合溶液③NaAlO2溶液④CaCl2和氨水的混合溶液⑤Ca(HCO3)2溶液A.①③④ B.②③④ C.①③ D.②④⑤21.某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:(1)称取样品ag,该实验使用的仪器名称为________.(2)将样品溶解于足量稀盐酸中,过滤,滤液中主要含有_______________,滤渣中含有________________.该溶解、过滤实验中使用的仪器有 ________ _。
高考化学一轮总复习 镁铝及其重要化合物作业高三全册化学试题

回夺市安然阳光实验学校镁、铝及其重要化合物一、选择题1.镁、铝性质相似,下表中对两者的对比不正确的是( )选项反应铝镁A 与非金属反应能被Cl2、O2氧化能与N2、O2反应B 与水反应能与沸水反应反应很困难C 与碱反应能溶于强碱溶液不反应D与某些氧化物反应能与Fe2O3、MnO2、Cr 2O 3等金属氧化物发生铝热反应能在CO2中燃烧【解析】选B。
镁铝均可与部分非金属反应,A项正确;镁的金属性强于铝,铝与水反应很困难,镁能与沸水反应,B错误;铝可与强碱溶液反应生成氢气,镁不反应,C正确;铝可与部分金属氧化物发生铝热反应,镁可与CO2反应,D正确。
2.(2019·衡水模拟)在铝制易拉罐中收集满CO2,加入过量的NaOH溶液,立即封口并振荡,可以发现易拉罐先咔咔作响,变瘪,然后再次鼓起来,其过程中没有涉及的化学反应是( )A.Al(OH)3分解B.CO2+OH-C.Al+OH-+H2OD.Al2O3+OH-【解析】选A。
NaOH溶液先与CO2反应,气压减小,易拉罐变瘪;再与铝表面的Al2O3反应,最后与Al反应,生成H2,易拉罐变鼓。
3.(2019·厦门模拟)向Fe和Al2O 3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )A.通入过量Cl2:Cl-、S、Fe2+、Al3+B.加入过量NaOH溶液:S、Na+、Al、OH-C.加入过量氨水:N、S、Na+、AlD.加入过量NaNO3溶液:N、S、Fe2+、Al3+【解析】选B。
A、Fe2+被氯气氧化成Fe3+,不能大量存在,故错误;B、Fe和硫酸反应:Fe+2H+Fe2++H2↑,Al2O3和硫酸反应:Al2O3+6H+2Al3++3H2O,加入NaOH后,发生Fe2++2OH-Fe(OH)2↓、Al3++4OH-Al+2H2O,故正确;C、加入氨水:Fe2++ 2NH3·H2O Fe(OH)2↓+2N、Al3++3NH3·H2O Al(OH)3↓+3N,氢氧化铝不溶于弱碱,此溶液中不含Al,故错误;D、N在酸性条件下具有强氧化性,能把Fe2+氧化成Fe3+,故错误。
高三化学一轮复习第10章镁铝 第2节 镁和铝的重要化合物习题详解(含解析)(实验班)

第二节 镁和铝的重要化合物一、选择题1.化学在生产和日常生活中有着重要的应用。
下列说法不正确的是( )。
A .明矾水解形成的()3Al OH 胶体能吸附水中悬浮物,可用于水的净化 B .在海轮外壳上镶入锌块,可减小船体的腐蚀速率 C .MgO 的熔点很高,可用于制作耐高温材料 D .电解2MgCl 饱和溶液,可制得金属镁 解答:本题考查化合物的应用。
解:明矾净水的原理是()323Al 3H OAl OH ++(胶体)3H ++,利用()3Al OH (胶体)的吸附性进行净水,选项A 正确。
轮船外壳的主要成分是钢铁,铁在海水中易被腐蚀。
镶入比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率,选项B 正确。
氧化镁的熔点是2852℃,可用于制作耐高温材料,选项C 正确。
电解2MgCl 饱和溶液,发生化学反应:()22222MgCl 2H O Mg OH H Cl +−−−→+↑+↑通电,不会产生金属镁,电解熔融的2MgCl 能制取单质镁,发生的反应22MgCl Mg Cl −−−→+↑通电。
所以选项D 错误。
本题答案为选项D 。
2.甲、乙两烧杯中分别装有相同体积、相同pH 的氨水和NaOH 溶液,各加入10mL 0.1mol L /3AlCl 溶液,两烧杯中都有沉淀生成。
下列判断正确的是( )。
A .甲中沉淀一定比乙中的多B .甲中沉淀可能比乙中的多C .甲中沉淀一定比乙中的少D .甲中和乙中的沉淀可能一样多解答:本题考查()3Al OH 的两性。
解:根据氢氧化铝的性质,能溶于氢氧化钠但不溶于氨水,所以两烧杯中生成的都是氢氧化铝沉淀;相同体积相同pH 的两溶液中的溶质氨水大于氢氧化钠,当两者均不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠恰好时,生成的沉淀一样多;氨水和氢氧化钠都过量时,生成的沉淀氨水多;可知选项B 、D 正确。
高考化学一轮复习 《镁和铝》精练

冠夺市安全阳光实验学校2011高考化学一轮复习精练习题精练1.把镁粉中混入的少量铝粉除去,应选用的试剂是( )A.盐酸B.氯水C.烧碱溶液D.纯碱溶液解析:盐酸跟镁、铝都反应,A错。
氯水中存在游离氯,是氧化剂,镁、铝都有还原性,是还原剂,都会和氯反应;氯水中有氯和水反应的生成物——盐酸和次氯酸,镁、铝都会跟酸反应,B错。
烧碱是氢氧化钠,铝有,可以跟氢氧化钠溶液反应放出氢气,铝变成偏铝酸钠溶于水,镁不反应而分离,2Al+2NaOH+2H2O====2NaAlO2+3H2↑,C对。
纯碱溶液,是碳酸钠溶液,镁、铝都不与之反应,D错。
答案:C2.镁比铝元素的金属性强,以下说法不能说明这一点的是()A.氢氧化镁是中强碱而氢氧化铝具有B.铝在冷的浓硫酸中钝化而镁不钝化C.氯化镁的熔点比氯化铝的熔点高D.镁能与沸水发生置换反应而铝不能解析:金属性强弱的比较,可以比较金属最高价氧化物对应水化物碱性强弱,比较金属单质跟水或酸置换氢的能力;另外MgCl2熔点高于AlCl3,可比较镁、铝金属性强弱。
因阴离子相同,Mg2+半径大于Al3+,若同为离子化合物,则应AlCl3熔点高,现MgCl2熔点高是因MgCl2为离子化合物,而AlCl3不属于离子化合物,说明金属性镁强于铝。
答案:B3.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是()A.Al2(SO4)3B.NaOHC.BaCl2D.FeSO4解析:丁溶液滴入乙溶液,有白色沉淀;继续滴入丁溶液白色沉淀消失,判断丁为NaOH、乙为Al2(SO4)3。
将NaOH溶液滴入甲,无现象,则甲为BaCl2、丙为FeSO4。
答案:D4.将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是()A.3 mol·L-1 HClB.4 mol·L-1 HNO3C.8 mol·L-1 NaOHD.18 mol·L-1 H2SO4解析:A.Mg、Al都与盐酸反应放出H2。
高三化学一轮复习镁铝图像练习含答案

镁铝图像及计算一.选择题1.下列说法在一定条件下可以实现的是()①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液体系为中性⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体A.①②③④⑤⑥B.②④⑤⑥C.①②③⑤D.③④⑤⑥2.下列液体中,不会出现丁达尔效应的分散系是 ( )①鸡蛋白溶液②水③淀粉溶液④硫酸钠溶液⑤沸水中滴入饱和FeCl3溶液⑥肥皂水⑦碘溶于酒精配成碘酒A.②④B.①③ C.⑤⑥ D.④⑦3“银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质。
其反应原理之一为:Ag+2H2S+O2→Ag2S+H2O。
当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原。
以下说法不正确的是( )A.上述验毒反应的氧化产物和还原产物的物质的量之比为1∶1B.银针复原发生的反应可能为:3Ag2S+2Al=6Ag+Al2S3C.当银针变黑时,所检验的物质有毒D.银针验毒时,Ag被氧化4.近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。
假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的A.铝质轻,便于运输、贮存,且安全B.铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制C.在地球上,铝矿资源比较丰富D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础5.已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。
向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是()。
A: B: C: D:6.在给定条件下,下列选项所示的物质间转化均能实现的是A.B.C.D.7.向甲溶液中滴加(或通入)乙溶液(或气体),生成沉淀的质量与加入乙的关系符合下图的是()A.向硫酸铝溶液中通入氨气B.向NaAlO2溶液中滴加盐酸C.向澄清石灰水中通CO2 D.向硫酸铝溶液中滴加氢氧化钠溶液8.向100mL0.1mol.L﹣1的AlCl3溶液中,加入1mol.L﹣1的NaOH溶液VmL后,再滴加1mol.L﹣1盐酸.滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如下图所示的关系,则加入的NaOH溶液的体积为()A.10mL B.30mL C.40mL D.50mL9.Zn(OH)2是两性氢氧化物,和强酸反应时生成Zn2+,跟强碱反应时生成ZnO22-.现有三份等物质的量浓度、等体积的MgCl2、ZnCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如下图所示,则与MgCl2、ZnCl2、AlCl3三种溶液一一对应的正确图象是()A.③②①B.③②④C.③⑤① D.③⑤④10.某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
高考化学一轮复习基础训练:镁铝及其化合物【答案+详解】

镁、铝及其化合物1.下列关于铝及其化合物的叙述正确的是( )A.氧化铝坩埚可用于熔融NaOH实验B.铝与Fe2O3发生铝热反应,反应后固体物质增重C.氧化铝熔点很高,可作耐火材料D.明矾用作净水剂,可以除去废水中的铜离子1.解析:A项,氧化铝能与NaOH反应,氧化铝坩埚不能用于熔融NaOH实验,错误;B项,根据质量守恒定律,反应后固体物质的质量不变,错误;C项,氧化铝熔点很高,可用于制耐火砖、耐火坩埚、耐火高温实验仪器,正确;D项,明矾净水时Al3+水解生成Al(OH)3胶体,可吸附水中不溶于水的杂质形成沉淀,从而起到净水作用,错误。
答案:C2.下列有关说法不正确的是( )A.Al(OH)3在用于治疗胃酸过多类疾病时表现出弱碱性B.氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3·H2O===Al(OH)3↓+3NH+4C.Al(OH)3可用于中和馒头制作过程(如发酵阶段)中产生的酸D.Al2O3可用于制作耐火材料而Al(OH)3不能2.解析:治疗胃酸过多时要消耗胃中的酸,因此Al(OH)3表现出碱性,A项正确;Al(OH)3不溶于氨水,B项正确;馒头制作过程中加小苏打是用于发泡和中和酸的,不用Al(OH)3,C项错误;耐火材料本身有良好的热稳定且熔点很高,而Al(OH)3受热易分解,D项正确。
答案:C3.下列叙述正确的是( )①含有大量AlO -2的溶液中,NH +4、NO -3、H +、Cl -可以大量共存 ②0.1 mol ·L -1的AlCl 3溶液中,Na +、K +、SO 2-4、HCO -3可以大量共存③向AlCl 3溶液中加入过量的稀氨水,发生反应:Al 3++4NH 3·H 2O===AlO -2+4NH +4+2H 2O④加入铝粉能放出H 2的溶液中,Ca 2+、Fe 2+、Cl -、NO -3一定能够大量共存⑤用NaOH 溶液除去铝条表面的氧化膜:Al 2O 3+2OH -===2AlO -2+H 2O⑥依据铝热反应原理,能发生反应2Al +3MgO=====高温3Mg +Al 2O 3⑦向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO 2-4+2Ba 2++Al 3++4OH -===2BaSO 4↓+AlO -2+2H 2O⑧常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH 溶液 A .⑤⑦ B .③⑤ C .④⑥ D .⑦⑧3.解析:①含大量AlO -2的溶液呈碱性,H +不能大量存在,错误;②Al 3+与HCO -3发生双水解反应:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑,不能大量共存,错误;③Al(OH)3不溶于NH 3·H 2O ,错误;④加入铝粉放出H 2的溶液,可能呈酸性,也可能呈碱性,若呈酸性,不能存在NO -3,若呈碱性,Ca 2+、Fe 2+不能大量共存,错误;⑥金属性:Mg>Al ,铝不能置换出Mg ,错误;⑧常温下,铝在浓硝酸中钝化,错误。
高三化学一轮复习第10章镁铝第1节镁和铝的性质习题详解(含解析)(实验班)

第一节镁和铝的性质一、选择题1.下列有关金属铝及其化合物的叙述中正确的是()。
A.铝在常温下不能与氧气反应B.铝不能与氯气反应C.铝既能溶于酸,又能溶于碱D.氧化铝只能与酸反应,不与碱反应解答:本题考查铝的单质及其化合物的性质。
解:铝在常温下可和O反应生成致密的氧化膜,选项A错误;2铝与氯气反应生成氯化铝,选项B错误;铝在元素周期表中位于金属与非金属的分界线上,既能与酸又能与强碱反应,选项C正确;氧化铝是两性氧化物,既能与酸反应又能与碱反应,选项D错误。
本题答案为选项C。
2.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是()。
A.盐酸的浓度B.铝条的表面积C.溶液的温度D.加少量Na SO晶体24解答:本题考查外界条件对化学反应速率的影响。
解:盐酸的浓度越大反应速率越大,选项A错误。
铝与酸接触的表面积越大,反应速率越大,选项B错误。
溶液的温度越大,反应速率越大,选项C错误。
加少量Na SO不影响氢离子浓度,对反应速率无影响,选项D正确。
24本题答案为选项D。
3.镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图10-5所示。
反应中镁和铝的()。
A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3解答:本题考查镁铝与酸反应的简单计算。
解根据图像分析镁铝与酸反应放出的氢气一样多。
根据化学方程式可知:Mg~H;2Al~23H;物质的量之比为3∶2;选项A正确。
2质量之比(243)(272)43∶∶,选项B错误。
=⨯⨯=摩尔质量之比为24∶27=8∶9,选项C 错误。
由图像可知生成相等体积的氢气所需时间之比为2∶3,所以反应速率之比为3∶2,选项D 错误。
本题答案为选项A 。
4.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )。
A .2mol /L 24H SO 溶液 B .18mol L /24H SO 溶液 C .6mol /L KOH 溶液D .3mol /L 3HNO 溶液解答:本题考查镁铝与各种酸的反应。
高三一轮复习《镁铝及其化合物》知识点过关检测试题

镁铝知识点过关检测试题1.某无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是()A. Cl-、SO42-、Na+、K+B. K+、ClO-、Na+、NO3-C. HCO3-、Na+、NO3-、K+D. NO3-、Ba2+、Cl-、NH4+2.下列说法正确的是A.无色溶液中可能大量存在Al3+、NH+4、Cl-、AlO2-B.铝与Fe2O3发生铝热反应后固体质量增加C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO-2+4NH+4+2H2OD.氢氧化铝可作胃酸的中和剂3.下列除去杂质的方法不正确的是A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量Al3+C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥,得到MgO 4.下列各组物质,不能按abc(“→”表示反应一步完成)关系转化的是选项 a b cA Al2O3NaAlO2Al(OH)3B AlCl3Al(OH)3NaAlO2C Al Al(OH)3Al2O3D MgCl2Mg(OH)2MgO5.将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72 L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2 L。
则原合金样品中镁的质量为A.4.8 g B.6 g C.9.6 g D.12 g6.1 L某混合溶液中,溶质X、Y浓度都为0.1 mol·L-l,向混合溶液中滴加某溶液Z(0.1 mol·L-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是A.氯化铝、氯化铁、氢氧化钠B.氯化铝、氯化镁、氢氧化钠C.偏铝酸钠、氢氧化钡、硫酸D.偏铝酸钠、氯化钡、硫酸7.足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是A.氢氧化钠溶液B.稀硫酸C.盐酸D.稀硝酸8.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。
江西省玉山县2018届高三化学大一轮复习单元复习监测题十镁和铝2017102319

单元复习监测题十镁和铝(十.镁和铝)注意:答题前,请考生先将自己的班级、姓名、登分表序号填写清楚。
班级:高三()姓名:登分表序号题号1~10 11 12 13 14 总分得分选择题使用2B铅笔填涂;非选择题使用0.5毫米黑色字迹的签字笔填写,要求字体工整。
一.本大题包括10个小题(每小题5分,共50分)。
每小题只有一个选项符合题目要求。
1 2 3 4 5 6 7 8 9 10[ A ] [ A ] [ A ] [ A ] [ A ] [ A ] [ A ] [ A ] [ A ] [ A ][ B ] [ B ] [ B ] [ B ] [ B ] [ B ] [ B ] [ B ] [ B ] [ B ][ C ] [ C ] [ C ] [ C ] [ C ] [ C ] [ C ] [ C ] [ C ] [ C ][ D ] [ D ] [ D ] [ D ] [ D ] [ D ] [ D ] [ D ] [ D ] [ D ]1.以下指定物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是:①NaHCO3 ②(NH4)2S ③Al2O3 ④Al(OH)3 ⑤AlA.①③④B.②③④C.①②⑤D.全部2.某无色透明溶液,能与铝反应放出氢气,此溶液中一定大量共存的离子组是A. NO3-、Na+、Cl-、Ba2+B. SO2、Na+、HCO 、K+43C. NO3-、Mg2+、Cl-、Ba2+D. Cu2+、Cl-、Fe2+、SO243.欲使明矾溶液中的Al3+完全沉淀下来,适宜的试剂是A. NaOH溶液B. 盐酸C. 氨水D. CO2气体4.向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。
下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)5.将钠、镁、铝各0.3mo l 分别放入100mL 0.5mol/L 的稀硫酸中,同温、同压下产生的气体体积之比为A.1∶2∶3 B.6∶3∶2 C.3∶1∶1 D.1∶1∶16.在托盘天平两盘中各放一只大小和质量相同的烧杯,两烧杯中都盛有1 mol/L的稀硫酸100 mL,然后分别向两烧杯中加入一定质量的Mg与Al,充分反应后天平仍保持平衡,则Mg、Al 的质量分别是A.2.4 g Mg、1.8 g Al B.5 g Mg、5 g Al C.2 g Mg、2 g Al D.1.2g Mg、1 g Al7.铝在人体中积累可使人慢性中毒,世界卫生组织已经正式将铝确定为“食品污染源之一”而加以控制。
高中化学 一轮复习人教版 镁、铝及其化合物 单元测试(word版)

镁、铝及其化合物一、选择题:本题共7小题,每小题2分,共14分。
每小题只有一个选项符合题意。
1.化学在生产和日常生活中有着重要的应用。
下列说法不正确的是()A.铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀B.铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属C.电解AlCl3饱和溶液可制得金属铝D.Al2O3、MgO的熔点很高,可用于制作耐高温材料2.某同学通过下列实验探究铝及其化合物的性质,操作正确且能达到目的的是() A.实验室中将NH3·H2O滴入Al2(SO4)3溶液中,制备Al(OH)3沉淀B.将一块铝箔用砂纸打磨后立即在酒精灯上点燃,观察铝燃烧的火焰C.将Al(OH)3沉淀转入蒸发皿中加足量稀盐酸,加热蒸干得无水AlCl3固体D.将铝置于装有浓硫酸的试管中再加水,探究Al在不同浓度硫酸中的反应3.室温下,以下各组离子在指定溶液中能大量共存的是()A.pH=7的溶液中:Al3+、K+、Cl-、NO-3B.1 mol·L-1偏铝酸钠溶液中:K+、Mg2+、HCO-3、Cl-C.1 mol·L-1烧碱溶液中:Na+、K+、AlO-2、SiO2-3D.0.1 mol·L-1明矾溶液中:Na+、NH+4、AlO-2、SO2-44.下列物质的制备方法正确的是()A.氯化铝溶液和硫化钠溶液反应制备Al2S3B.用镁粉和空气反应制备Mg3N2C.蒸发氯化镁溶液可制得无水MgCl2D.在干燥的氯化氢气流中加热氯化铝结晶水合物制备AlCl35.下列反应的离子方程式书写正确的是()A.硫酸铝溶液中滴加过量氨水:4NH3·H2O+Al3+===AlO-2+4NH+4+2H2OB.向硫酸铝铵溶液中滴加少量NaOH溶液:NH+4+OH-===NH3·H2OC.向偏铝酸钠溶液中通入足量CO2:2AlO-2+CO2+3H2O===2Al(OH)3↓+CO2-3D.在碱性条件下铝粉可以将NO-3还原为N2:10Al+6NO-3+4OH-===10AlO-2+3N2↑+2H2O6.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是()A.试剂X可以是硫酸B.反应①过滤后所得沉淀1为氧化铁C.图中所示转化中:Al2O3→Al可选用热分解法D.反应②的离子方程式为2AlO-2+CO2+3H2O===2Al(OH)3↓+CO2-37.某实验小组对一含有Al3+的未知溶液进行了如下探究:(1)滴入少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的NaOH溶液,白色沉淀明显减少。
高三化学一轮复习镁铝单元过关检测题鲁科版必修1

镁铝练习一、选择题:(每题4分)1、镁铝合金因坚硬、轻巧、美观、干净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护拦等,下列与这些用途无关的性质是()A、不易生锈B、导电性好C、密度小D、强度高2.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝定为“食品污染源之一”而加以控制。
铝鄙人列使用场合必需加以控制的是( )①制铝锭②制易拉罐③制电线电缆④制牙膏皮⑤用明矾净水⑥制炊具⑦用明矾和小苏打作食品膨化剂⑧用A l(O H)3制成药片治胃病⑨制防锈油漆A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑨C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧3、定向爆破建筑物时,应同时定向堵截钢筋和炸碎水泥,除要用适量的火药以外,还需用()A.氧炔焰 B.铝热剂 C.液氧 D.电弧4、下列制取单质的反映中,化合物作还原剂的是:()A、用溴与碘化钠反映制碘B、用锌和稀硫酸反映制取氢气C、镁在点燃的条件下与CO2反映生成单质CD、铝和二氧化锰反映冶炼锰5、铝分别与足量的稀盐酸和氢氧化钠溶液反映,当两个反映放出的气体在相同状况下体积相等时,反映中消耗的HCl和NaOH的物质的量之比为()A、1:1B、2:1C、3:1D、1:36、下列四种物质只能跟NaOH溶液感化不能跟盐酸感化是()A、NaHSB、NaAlO2C、KHSO4D、CH3COONH47、把Ba(OH)2溶液滴入明矾溶液中,使SO42—全部转化为BaSO4沉淀,此时铝元素的主要存在形式是()A、Al3+B、Al(OH)3C、AlO2—D、Al3+ 和Al(OH)38、下列各组物质的稀溶液彼此反映,无论是前者滴入后者,还是后者滴入前者,反映现象相同的是()A、Na2CO3、HClB、AlCl3、NaOHC、Na[Al(OH)4]、H2SO4D、Ba(HCO3)2、Ba(OH)29、(双选)下列物质的溶液中通入过量的CO2,仍有沉淀的是:()A、CaCl2B、NaAlO2C、Ca(ClO)2D、Na2SiO310、对于Al与氢氧化钠的水溶液反映,作氧化剂的是()A、AlB、NaOHC、NaOH和H2OD、H2O双选11、有镁铝混合粉末10.2g,将它溶于500mL 4mol/L的盐酸里,若要使沉淀质量达到最大值,则需加入2mol/L的氢氧化钠溶液的体积为()A、100mLB、500mLC、1000mLD、1500mL12、下列各离子加入强酸或强碱后,都能使其离子浓度降低的是()A、Al3+B、AlO2¯C、HCO3-D、Mg2+13、下列各组离子在溶液中能大量共存,且能与铝反映放出H2的是( )A、Na+、H+、Ba2+、 NO3-B、 K+、Na+、HCO3-、OH-C、H+、Mg2+、 HCO3-、SO42-D、Ba2+、 Cl-、 NO3-、OH-14.下列物质后面的括号中为杂质,最后一种为除杂试剂,其中正确的是( )A、MgO (Al2O3), NaOH溶液B、Mg(OH)2 [Al(OH)3],稀HClC、Al (Mg), KOH溶液D、Cu (Mg), 浓的NaOH溶液15、(双选)以稀H2SO4和NaOH溶液及铝为原料用三种途径制取等量的Al(OH)3甲:Al→Al2(SO4)3→Al(OH)3; 乙: Al→NaAlO2→Al(OH)3有关叙述正确的是( )A、三者消耗的原料一样多B、甲消耗的原料最多C、乙消耗的原料最少D、丙消耗的原料最少16.用相等质量的钠进行下列实验,生成H2最多的是( )A、Na与足量水反映B、Na与足量的盐酸反映C、将Na用铝箔包好,刺孔后放入足量水中D、Na与AlCl3溶液反映17、在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。
高三化学一轮复习 镁铝及其化合物双基过关检测试题高三全册化学试题

证对市爱幕阳光实验学校镁、铝及其化合物〔考试时间:60分钟总分值:100分〕考点一:| 含量丰富的金属单质—镁和铝〔判断题每题1分,单行选择题每题4分,共26分〕1.判断以下描述的正误(正确的打“√〞,错误的打“×〞)。
(1)铝罐可久盛食醋、浓硫酸,常温下,也可用浓硫酸除去铝外表的铜镀层。
( ×)(2)Al、盐酸、NaOH溶液三者之间两两均能发生放热反。
( √)(3)Al溶于NaOH溶液中产生气体的离子方程式为2Al+2OH-+2H2O===2AlO-2+3H2↑。
( √)(4)铝与Fe2O3发生铝热反后固体物质的质量会增加。
( ×)(5)常温下,相同的铝片中分别参加足量的浓硝酸和稀硝酸,浓硝酸中铝片溶解的速率更快。
( ×)(6)工业上分别用电解熔融状态的Al2O3和MgCl2溶液来制备金属Al和Mg。
( ×)(7)铝制品在空气中能稳存在是因为铝不活泼。
( ×)(8)铝箔插入稀硝酸中无现象,说明铝箔外表被HNO3氧化,形成致密的氧化膜。
( ×)(9)用坩埚钳夹住一小块砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来( ×)(10)除去镁粉中混有的少量铝粉:参加过量烧碱溶液充分反,过滤、洗涤、枯燥( √)2.以下变化不能通过一步化学反直接完成的是( B)A.Al(OH)3―→Al2O3 B.Al2O3―→Al(OH)3 C.Al―→Al2O3 D.Al2O3―→AlO-23.将5.4 g Al投入200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反后有金属剩余。
该溶液可能是( D)A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液4.体积、物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加质量的铝,生成氢气的体积比为5∶6(相同条件下),那么甲、乙两烧杯中的反情况可能是( B)A.甲、乙中都是铝过量 B.铝过量、乙中碱过量C.酸过量、乙中铝过量 D.酸过量,乙中碱过量5.甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别参加质量的铝粉,反结束后测得生成的气体体积之比为1∶2,那么参加的铝粉的质量为( A)A.5.4 g B.3.6 g C.2.7 g D.1.8g考点二:| 铝的重要化合物—氧化铝、氢氧化铝〔判断题每题1分,单行选择题每题4分,共32分〕1.判断正误(正确的打“√〞,错误的打“×〞)。
高三化学一轮复习镁铝知识点及练习题词(有问题详解)
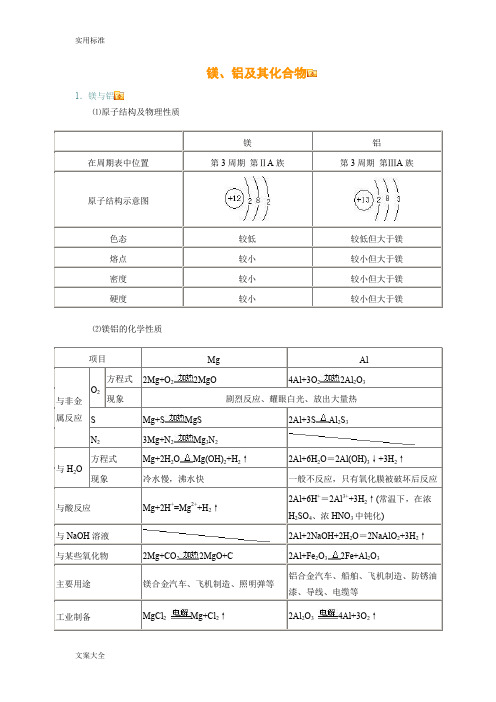
镁、铝及其化合物1.镁与铝⑴原子结构及物理性质⑵镁铝的化学性质22Mg+S2Al+3S2O232.镁和铝氧化物的对比3.镁和铝的氢氧化物2Al(OH)334.铝及其化合物间相互转化、铝三角及相关图象知识拓展:⑴Al(OH3)的两性:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离当向Al(OH)3中加入酸溶液,平衡向碱式电离方向移动,使Al(OH)3溶解。
当向Al(OH)3中加入强碱溶液时,平衡向酸式电离方向移动,使Al(OH)3溶解。
⑵铝热反应及应用:2Al + Fe2O32Fe + Al2O3;4Al + 3MnO23Mn + 2Al2O3铝热剂――铝粉和金属氧化物;助燃剂――KClO3;引燃剂――镁条。
铝热反应应用:焊接钢轨,冶炼熔点较高的金属如:钒、铬、锰等。
⑶既能与强酸又能与强碱反应的物质:①金属单质:Al;②两性氧化物:Al2O3;③两性氢氧化物Al(OH)3;④弱酸的酸式盐:NaHCO3、NH4HCO3等;⑤弱酸铵盐:(NH4)2CO3、(NH4)2S等。
知能训练一、选择题1.氧化还原反应在生产、生活中具有广泛的用途。
下列做法中涉及到铝元素的还原性的是()A.明矾净化水B.用氢氧化铝治疗胃酸过多C.用铝制容器存放浓硫酸D.电解熔融氧化铝制单质铝2.下列有关金属铝及其化合物的叙述正确的是()A.铝在冷的浓H2SO4或浓HNO3中不发生化学反应B.铝既能与酸反应,又能与碱反应,因此铝是两性金属C.工业上制取铝是通过H2还原Al2O3得到D.铝粉在氧气中剧烈燃烧并产生耀眼的白光3.下列有关铝及其化合物的叙述正确的是()A.铝粉与氧化镁共热可制取金属镁B.足量的铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生等量的氢气C.工业上用电解熔融Al2O3的方法冶炼铝D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面放出氢气4.下列各种物质既能与强酸溶液反应又能与强碱溶液反应的是()①Al②AlCl3③Na[Al(OH)4]④Al(OH)3⑤Al2O3⑥NaHCO3A.①②③④⑤⑥B.①③④⑤C.④⑤D.①④⑤⑥5.下列离子方程式正确的是()A.铝与NaOH溶液反应:Al+6OH-===[Al(OH)4]-+H2↑B.向AlCl3溶液中滴入过量氨水:Al3++4NH3·H2O===[Al(OH)4]-+4NH+4C.Al2O3与NaOH溶液反应:Al2O3+2OH-+3H2O===2[Al(OH)4]-D.Ba(OH)2溶液与明矾溶液反应至Al3+完全沉淀:Ba2++3OH-+Al3++SO2-4 ===Al(OH)3↓+BaSO4↓6.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。
镁和铝习题(第一轮复习同步习题)(3)

11-1 镁和铝习题(4)班级:______姓名:_________一、选择题(每小题6分,共66分。
每小题有1 ~ 2个正确答案)1、已知有钠、钾及钠钾合金,对于它们三者熔点高低,正确的是()A、钠>钾>钠钾合金B、钠钾合金>钠>钾C、钠>钠钾合金>钾D、钾>钠钾合金>钠2、铝加入下列物质中会产生气体的是()A、熔融NaOHB、KOH溶液C、Na2O2固体D、Na2O2和水的混合物3、把铝粉和FeO粉末配成铝热剂,分成两等分,前一份在高温下恰好完全反应,然后将生成物跟足量的盐酸完全反应;后一份直接加入足量的NaOH溶液使之充分反应,则前后两种情况下气体的物质的量之比是()A、1:1B、1:3C、3:4D、8:94、铝热剂中铝的作用是()A、催化剂B、氧化剂C、还原剂D、填充剂5、将硅、镁、铝的混合物分为质量相等的两份。
一份跟足量的NaOH溶液反应,另一份跟足量的盐酸的反应,最终产生的H2一样多。
则镁与硅的物质的量之比为()A、2:1B、4:1C、1:1D、3:16、将mg Mg投入盛有足量盐酸的烧杯中和将mg Na投入盛有足量水的铝制容器中,问两容器及最后增重情况()A、加Mg的增重多B、加钠的增重多C、两个一样多D、无法确定7、同温同压下,分别将Mg、Ca、Fe、Al投入质量相等的足量稀盐酸中,充分反应后,所得4种溶质的质量仍相等,则投入的Mg、Ca、Fe、Al 4种金属的质量关系是()A、Fe>Ca>Mg>AlB、Mg=Ca=Fe=AlC、Al>Mg>Ca>FeD、Al>Mg>Fe>Ca8、下列各组试剂,只用试管和胶头滴管,不用任何其他试剂不可以鉴别的是()A、KOH和Al2(SO4)3B、稀HCl和Na2CO3C、CaCl2和Na2CO3D、Ca(OH)2和H3PO49、已知反应:甲+乙=丙+丁,其中甲、乙为都含A元素的化合物,丙为由A元素组成的单质,则A是()A、稀有气体元素B、非金属元素C、金属元素D、都有可能10、等物质的量的Mg和Al均匀混合后,取4份等质量的该混合物,分别加入到足量的下列溶液中,充分反应后,放出H2最多的是()A、2mol/L H2SO4B、2mol/L HNO3C、2mol/L NaOHD、2mol/L NH3·H2O11、Al溶于NaOH溶液中,Al失去1mole-时,消耗的氧化剂为()A、1molB、2molC、3molD、4mol二、填空题(18分)12、有甲、乙、丙3位同学做制备Al(OH)3的实验,桌上放同样药品:231g 70%的H2SO4溶液,含有20%苛性钾的烧碱140g,足量的铝屑,水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单元复习监测题十 镁和铝(十. )注意:答题前,请考生先将自己的班级、姓名、登分表序号填写清楚。
选择题使用2B 铅笔填涂;非选择题使用0.5毫米黑色字迹的签字笔填写,要求字体工整。
一.。
1.以下指定物质中既能与稀H 2SO 4反应, 又能与NaOH 溶液反应的是:①NaHCO 3 ②(NH 4)2S ③Al 2O 3 ④Al(OH)3 ⑤AlA .①③④B .②③④C .①②⑤D .全部2.某无色透明溶液,能与铝反应放出氢气,此溶液中一定大量共存的离子组是A. NO 3-、Na +、Cl -、Ba 2+B. SO -24、Na +、HCO -3、K+ C. NO 3-、Mg 2+、Cl -、Ba 2+D. Cu 2+、Cl -、Fe 2+、SO -243.欲使明矾溶液中的Al 3+完全沉淀下来,适宜的试剂是A. NaOH 溶液B. 盐酸C. 氨水D. CO 2气体4.向MgSO 4和Al 2(SO 4)3的混合溶液中, 逐滴加入NaOH 溶液。
下列图象中, 能正确表示上述反应的是 (横坐标表示加入NaOH 溶液的体积, 纵坐标表示反应生成沉淀的质量)5.将钠、镁、铝各0.3mol 分别放入100mL 0.5mol/L 的稀硫酸中,同温、同压下产生的气体体积之比为A .1∶2∶3B .6∶3∶2C .3∶1∶1D .1∶1∶1 6.在托盘天平两盘中各放一只大小和质量相同的烧杯,两烧杯中都盛有 1 mol/L 的稀硫酸100 mL ,然后分别向两烧杯中加入一定质量的Mg 与Al ,充分反应后天平仍保持平衡,则Mg 、Al 的质量分别是A .2.4 g Mg 、1.8 g AlB .5 g Mg 、5 g AlC .2 g Mg 、2 g AlD .1.2g Mg 、1 g Al 7.铝在人体中积累可使人慢性中毒,世界卫生组织已经正式将铝确定为“食品污染源之一”而加以控制。
铝在下列场合须加以控制的是:①制铝锭 ②制易拉罐 ③制电线、电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制成药片治胃病 ⑨制防锈油漆A .②④⑤⑥⑦⑧ B.②⑤⑥⑦⑨ C .①②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧8.下列反应中,反应后固体物质增重的是A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液9.近年来,科学家在探索利用铝粉作燃料的可能性,期望铝能成为一种石油的替代物。
假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的A.铝质轻,便于运输、贮存,且安全B.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制C.在地球上,铝矿资源丰富D.现代电解冶铝的工业技术已为铝作为新能源奠定了重要基础10.将一定质量的镁和铝的混合物投入100 mL盐酸中,固体物质的量与加入NaOH溶液的体积关系如图所示。
若不考虑金属和盐酸反应时HCl的挥发,则下列说法正确的是A.镁和铝的总质量为9 gB.盐酸的物质的量浓度为5 mol·L-1C.NaOH溶液的物质的量浓度为2.5 mol·L-1D.生成的氢气在标准状况下的体积为11.2 L二.非选择题:(共50分)11.(12分)有A、B、C、D、E五种化合物,其中A、B、C、D都是含Al元素的化合物,F是一种气体,在标准状况下,F的密度是相同条件下空气密度的1.103倍。
各化合物之间能够发生如下反应:Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+3 (NH4)2SO4① A + NaOH → D + H2O ② B A + H2O③ C + NaOH(适量)→ B + H2O ④ E + H2O → NaOH + F(1)A、B、C、D的化学式分别为:A 、B 、C 、D 。
(2)1 mol C和2 mol E在水溶液中发生反应的化学方程式为;其中氧化剂是,氧化产物是。
(3)已知C溶液和D溶液混合后,也有白色沉淀B析出,其化学方程式为:。
12.(12分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。
已知实验中可能会发生下列反应:①2Mg+O 22MgO ②3Mg+N 2Mg3N2③2Mg+CO 22MgO+C ④Mg+H2O MgO+H2↑⑤Mg3N2+6H2O3Mg(OH)2↓+2NH3↑可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
请回答下列问题:(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是。
(2)连接并检查实验装置的气密性。
实验开始时,打开自来水的开关,将空气从5 L的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果影响是;原因是。
(4)请设计一个实验,验证产物是氮化镁。
13.(12分)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。
某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:请回答下列问题:(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有溶液的烧杯中,充分搅拌后经、 (填操作方法)、干燥后可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:其中装置A的作用是________________________________________________________。
(4)写出过程④中发生反应的化学方程式_________________________________________。
14.(14分)明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。
某校研究小组利用明矾石制备氢氧化铝的流程如下:(1)“焙烧”过程中反应的化学方程式为Al2(SO4)3+Al2O3+______↑。
(2)分离溶液和废渣的操作是;“溶解”时反应的离子方程式为。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________________________________________________。
(4)“母液”中可回收的物质是。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。
十、镁和铝1. D2. A3. C4. D5. C6. B7. A8. B9. D 10.A11.(12分)(1)A、Al2O3 B、Al(OH)3 C、AlCl3 D、NaAlO2(2)AlCl 2Na O NaAlO O 3NaCl 32222+=+↑+ Na O 22 O 2(3)()AlCl 3NaAlO 6H O 4Al OH 3NaCl 3223++=↓+12. (12分)(1)B 目的是除去空气中的水蒸气,避免反应④发生;D 目的是除去空气中的CO 2,避免反应③发生;F 目的是除去空气中的O 2,避免反应①发生 (2) j→h→g→d→c→k→l(或l →k)→a→b(或b→a)(3)制得的氮化镁将不纯 A 装置没有排完空气前就加热会使空气中的氧气、CO 2、水蒸气等与镁反应(4)取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁 13.(12分)(1)石灰乳原料丰富,成本低 (2) MgCl 2 过滤 洗涤(3)制备干燥的HCl 气体 (4) MgCl 2(熔融)=====电解Mg +Cl 2↑14.(14分) (1)2 3 2 9 SO 2 (2)过滤 Al 2O 3+2OH -=2AlO 3-+H 2O(3)取最后一次洗涤的滤液于试管中,滴加BaCl 2溶液,若无白色沉淀生成,则证明已洗涤干净 (4)K 2SO 4、Na 2SO 4 (5)468精美句子1、善思则能“从无字句处读书”。
读沙漠,读出了它坦荡豪放的胸怀;读太阳,读出了它普照万物的无私;读春雨,读出了它润物无声的柔情。
读大海,读出了它气势磅礴的豪情。
读石灰,读出了它粉身碎骨不变色的清白。
2、幸福幸福是“临行密密缝,意恐迟迟归”的牵挂; 幸福是“春种一粒粟,秋收千颗子”的收获. 幸福是“采菊东篱下,悠然见南山”的闲适;幸福是“奇闻共欣赏,疑义相与析”的愉悦。
幸福是“随风潜入夜,润物细无声”的奉献;幸福是“夜来风雨声,花落知多少”的恬淡。
幸福是“零落成泥碾作尘,只有香如故”的圣洁。
幸福是“壮志饥餐胡虏肉,笑谈渴饮匈奴血”的豪壮。
幸福是“先天下之忧而忧,后天下之乐而乐”的胸怀。
幸福是“人生自古谁无死,留取丹心照汗青”的气节。
3、大自然的语言丰富多彩:从秋叶的飘零中,我们读出了季节的变换;从归雁的行列中,我读出了集体的力量;从冰雪的消融中,我们读出了春天的脚步;从穿石的滴水中,我们读出了坚持的可贵;从蜂蜜的浓香中,我们读出了勤劳的甜美。
4、成功与失败种子,如果害怕埋没,那它永远不能发芽。
鲜花,如果害怕凋谢,那它永远不能开放。
矿石,如果害怕焚烧(熔炉),那它永远不能成钢(炼成金子)。
蜡烛,如果害怕熄灭(燃烧),那它永远不能发光。
航船,如果害怕风浪,那它永远不能到达彼岸。
5、墙角的花,当你孤芳自赏时,天地便小了。
井底的蛙,当你自我欢唱时,视野便窄了。
笼中的鸟,当你安于供养时,自由便没了。
山中的石!当你背靠群峰时,意志就坚了。
水中的萍!当你随波逐流后,根基就没了。
空中的鸟!当你展翅蓝天中,宇宙就大了。
空中的雁!当你离开队伍时,危险就大了。
地下的煤!你燃烧自己后,贡献就大了6、朋友是什么?朋友是快乐日子里的一把吉它,尽情地为你弹奏生活的愉悦;朋友是忧伤日子里的一股春风,轻轻地为你拂去心中的愁云。
朋友是成功道路上的一位良师,热情的将你引向阳光的地带;朋友是失败苦闷中的一盏明灯,默默地为你驱赶心灵的阴霾。
7、一粒种子,可以无声无息地在泥土里腐烂掉,也可以长成参天的大树。
一块铀块,可以平庸无奇地在石头里沉睡下去,也可以产生惊天动地的力量。
一个人,可以碌碌无为地在世上厮混日子,也可以让生命发出耀眼的光芒。
8、青春是一首歌,她拨动着我们年轻的心弦;青春是一团火,她点燃了我们沸腾的热血;青春是一面旗帜,她召唤着我们勇敢前行;青春是一本教科书,她启迪着我们的智慧和心灵。
