011.氨咖黄敏胶囊中间产品质量标准02
氨咖黄敏胶囊工艺规程

(2)调配:将称量后原辅料分三份分别为
原辅料
料号及色别
对乙酰氨基酚(㎏)
马来酸氯苯那敏(㎏)
咖啡因
(㎏)
人工牛黄
(㎏)
淀粉
制糊淀粉
(㎏)
柠檬黄(㎏)
胭脂红(㎏)பைடு நூலகம்
A白色
41.00
0.16
2.40
———
2.31
1.53
——
——
B黄色
38.00
4.9铝塑包装
4.9.1工艺条件:30万级洁净区;温度:18—26℃;相对湿度:45—65%
标题:
氨咖黄敏胶囊工艺规程
总页-分页
咖啡因 15g7.20kg
人工牛黄 10g4.80kg
淀粉 适量11.52kg
制成 1000粒48万粒
3.2处方依据:《国家药品标准》WS-10001-(HD-0276)-2002
3.3制法:取对乙酰氨基酚、马来酸氯苯那敏、咖啡因、人工牛黄和辅料适量,制成颗粒,分装,即得。
3.4生产工艺流程图:(见附图)
1.3产品剂型:胶囊剂
2.产品概述:
2.1性状:本品为胶囊剂,内容物为着色混合颗粒。
2.2适应症:用于感冒引起的鼻塞,头痛、咽喉痛、发热等。
标题:
氨咖黄敏胶囊工艺规程
总页-分页
13-2
版号
A/0
文件编号
DS-P23-001
2.3用法用量:口服,一次1-2粒,一日3次。
2.4规格:本品为复方制剂,其组分为每粒含对乙酰氨基酚250mg、咖啡因15mg、马来酸氯苯那敏1mg、人工牛黄10mg。
氨咖黄敏胶囊

取样品按照 “2.3 ” 项与 “ 2.5” 项的检验方法进行含量测定, 并与现行标准方法测定的结果比较, 见表 。
3讨论
3.1现行标准采用外指示剂法 (重氮化滴定法)测定氨咖黄敏胶囊中对乙酰氨基的含量, 该法操作较繁琐费时, 滴定终点难判断 (终点不易掌握, 易过终点) 。紫外分光光度法具有操作简便、 快速和结果准确等优点, 经稳定性、 重复性、 回收率等试验, 证明本法可代替重氮化滴定法测定氨咖黄敏胶囊中对乙酰氨基酚的含量。
3.2氨咖黄敏胶囊中其它成分如咖啡因、 马来酸氯苯那敏、 人工牛黄等含量较少, 在紫外光谱扫描中,结果在 的波长处没有紫外吸收特征 (见图) , 因此不会对本法造成干扰, 不影响测定结果准确性。
2.4 测定波长的选择
取对照品溶液与供试品溶液,在200-400nm 波长范围内扫描,在257波长处有最大吸收(见图),本实验采用257nm为测定波长。
2.5测定方法
取供试品溶液,照分光光度法,在 257nm波长处测定吸收度,按对乙酰氨基酚C8H9NO2的吸收系数(E1cm1%)为715计算含量。
2.3 供试品溶液的制备
取氨咖黄敏胶囊20粒,按照胶囊剂的装量差异
项下检查,取得平均粒重,取其内容物混合均匀,精密称取适量(约相当于对乙酰氨基酚40mg,置250ml 量瓶中,加入0.4%氢氧化钠溶液 50ml 与水50ml ,振摇15min,使对乙酰氨基酚溶解,加水至刻度,摇匀,滤过,弃初滤液,精密量取续滤液5ml置100ml量瓶中,加0.4%氢氧化钠溶液10ml,加水至刻度,摇匀,作为供试品溶液。
2.7稳定性试验
取供试品溶液 (批号: ) , 每隔一定时间内测定其吸收度结果表明在12h 内供试品溶液的
氨咖黄敏胶囊工艺规程

1、目的:建立氨咖黄敏胶囊工艺规程,作为全面指导生产和控制质量的基准性技术文件。
2、适用范围:适用于氨咖黄敏胶囊生产。
3、责任者:车间管理人员、质量监督员、操作人员。
4、内容:4.1产品概述:4.1.1 名称:通用名:氨咖黄敏胶囊英文名:Paracetamol,Caffein,Atificial cow-bezoar And Chlorphenamine Maleate Capsules4.1.2产品代码:C0254.1.3剂型:胶囊剂。
4.1.4性状:本品为胶囊剂,其内容物为着色颗粒和粉末。
4.1.5规格:本品为复方制剂,每粒含对乙酰氨基酚250mg、咖啡因15mg、马来酸氯苯那敏 1mg,人工牛黄10mg。
4.1.6批量:150.0万粒4.1.7适应症:适用于缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。
4.1.8用法用量:口服。
成人:一次1-2粒,一日3次。
4.1.9贮藏:密封,在阴凉干燥处保存。
4.1.10有效期:2年。
4.1.11包装:材质:铝箔、PVC包装: 10粒/板×50板/盒×60盒;12粒/板×1板/盒×400盒; 12粒/板×2板/盒×400盒;4.1.12申报批准文号的沿革:首次86年12月27日批准,文号为皖卫药准字(86)348号;96年10月21日省卫生厅变更文号为皖卫药准字(1996)第102094;2001年8月6日省药监局统一变更文号为皖药准字(2001)第X004528号;2003年国家食品药品监督管理局统一换发文号为国药准字H34022182。
4.1.13 执行标准:国家药品标准WS-10001-(HD-0276)-2002-2006 4.1.14处方:配料处方(150.0万粒)注:所投原料折算: 对乙酰氨基酚:150.0万片×0.25g ÷1000÷对乙酰氨基酚原料干品百分含量 =所投对乙酰氨基酚原料量(kg ) 咖啡因:150.0万片×0.15g ÷1000÷咖啡因原料干品百分含量 =所投咖啡因原料量(kg ) 4.2 生产工艺流程图及生产工艺示意图: 4.2.1生产工艺流程图:检验4.2.2生产工艺示意图:* 质控点 工艺流向工序物料万级洁净区,温度控制为18℃ — 26℃;湿度45% — 65%4.3 操作过程及工艺条件:4.3.1 进入洁净区的岗位操作人员,必须严格按照《进出洁净区更衣程序》(JMSOPWS02502)进行更衣后经人流通道进入洁净区。
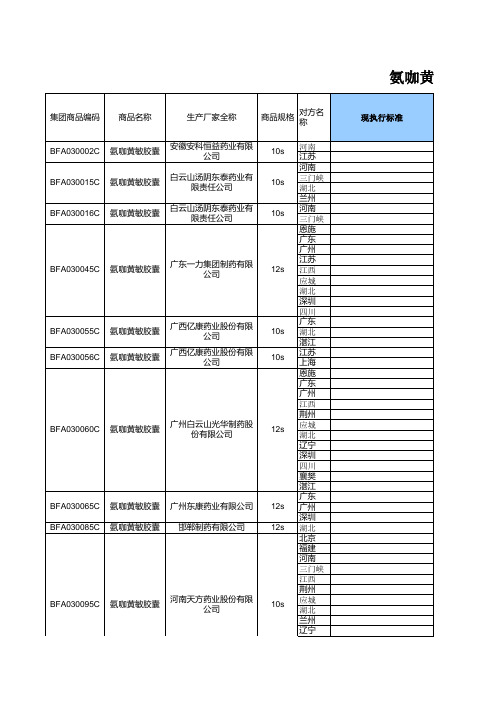
氨咖黄敏胶囊标准修订执行情况表
氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊 氨咖黄敏胶囊
上海世康特制药有限公 司 上海世康特制药有限公 司 兰州佛慈制药股份有限 公司 四川彩虹制药有限公司 甘肃省西峰制药有限责 任公司 锦州九洋药业有限责任 公司 锦州九洋药业有限责任 公司 安阳中智药业有限责任 公司 锦州九泰药业有限责任 公司 辽宁王牌速效制药有限 公司 辽宁王牌速效制药有限 公司 甘肃新兰药药业有限公 司 吉林道君药业股份有限 公司 吉林道君药业股份有限 公司
氨咖黄敏胶囊
四川蜀中制药有限公司
BFA030277C
氨咖黄敏胶囊
四川蜀中制药有限公司
BFA030278C
氨咖黄敏胶囊
四川蜀中制药有限公司
BFA030315C
氨咖黄敏胶囊
亚宝药业太原制药有限 公司
BFA030316C
氨咖黄敏胶囊
亚宝药业太原制药有限 公司
应城 湖北 喀什 库尔勒 兰州 辽宁 10s 临沂 绵阳 内蒙古 青岛 山东 上海 深圳 四川 遂宁 温州 襄樊 新疆 伊犁 湛江 重庆 万州 阿克苏 北京 江西 荆州 湖北 10s 喀什 库尔勒 兰州 内蒙古 伊犁 辽宁 福建 广东 广州 库尔勒 12s 上海 深圳 温州 新疆 伊犁 库尔勒 10s 四川 广东 河南 12s 三门峡 江苏 深圳 河南 12s*50板 三门峡 山东
10s 10s
辽宁 河南 三门峡 绵阳 四川 重庆 万州 四川 重庆 万州 恩施 湖北 兰州 四川 万州 河南
BFA030355C
氨咖黄敏胶囊
10s
BFA030365C
测定氨咖黄敏胶囊中马来酸氯苯那敏含量的方法分析

表 2 含 量 测 定 结 果
批 号 丹皮 酚含量 ( m g , g )
0 . 4 3
含量 测 定项 下 方 法 , 我 们 选用 2 7 4 n m为 检测 波 长 , 在此条件下 ,
1 2l 1 Ol 1 2l 1 0 2 1 2 l 1 0 3
0 . 4 5 0 . 4 0
【 1 1 国家药典委 员会 . 中华人 民共和 国药典 ( 一部 ) I M】 . 北京 : 化 学工
业 出版 社 . 2 0 1 0: 1 6 0 .
3 . 1流动相 选择 : 本试 验选 用 甲醇一 水 系统作 流动 相 , 经 多次 试验 , 参 考文献
用 甲醇一 水( 6 0 : 4 0 ) 洗 脱 能 使 样 品 中丹 皮 酚峰 与 相邻 峰 达 到 良好 分离, 在此 条件下 , 与相 邻 色谱 峰达到 基线 分离 , 峰形 对称 。 3 . 2检测波 长 的选择 : 用 甲醇制 备丹 皮酚 对照 品溶液 , 进 行紫 外扫 描, 结果 : 在2 7 4 n m处有最 大吸收 。参 考药典 2 0 1 0 版牡 丹皮 药材l 】 l
2 方 法
表 2 有机成分 比例对线性关系和加样 回收率的影响
注: 与2 0 %时比较差 异 显著 ( P < O . 0 5 ) 。 液, 分 别在 1 2 h内每 隔 2 h 进 行一 次 进样 , 而后 统 计测 定 结果 , 结 果 发现 R S D - 2 0 . 8 8 %, 结果 表 明 , 在1 2 h内对照 溶 液 中马 来酸 氯 苯 那敏 峰 面积未 发生 显著 改变 , 稳定 性 良好 。
1 材 料 与方 法
1 . 1 实验 仪 器 :本 次 实验 中所 用 仪器 为 A g l i e n t 1 1 0 0型高 效 液相 色谱 仪 , G1 3 1 3 A 自动进 样 器 , G I 3 1 2 A二 元 泵 , A g i l e n t C h e m s t a — t i o n 工作 站 , G 1 3 1 4 A V WD紫外 检测 器 ; 岛津 U V 2 4 5 0 紫 外可 见分 光光度 计 以及 塞多利 斯 B P 2 1 1 D电子天平 。 1 . 2试剂 与药 品 : 所 用试 剂包括 : 磷 酸二 氢铵 ( 分析纯 ) 、 乙腈 ( 色谱 纯) 、 磷酸( 分析 纯 ) , 水 为超 纯水 。实验 中马 来 酸氯 苯那 敏对 照 品 来 自中 国药 品生物 制品检 定所 , 含量 9 9 . 7 %。 1 I 3色谱 条 件 :本 次实 验 所用 色 谱柱 为 I n e  ̄ s i l O D S S P ,规格 为 4 . 6 m m  ̄ 2 5 0 m m, 5 u m, 所用 流 动 相 为 : ( 磷酸二氢铵 1 1 . 5 g , 加水 溶 解, 加h n L 磷酸 , 加水 定 容 1 0 0 0 m I ) : 乙腈 ( 8 0 : 2 0 ) , 柱温为 3 O ℃, 流速 控 制在 1 . 0 m l / m i n , 进样 量 为 2 0 u L , 波长 为 : 2 6 2 n m, 外 标法 计 算 含量 _ _ 1 。 1 . 4统计 学 方法 : 研究 中所得 相关 数 据采 用 S P S S 1 4 . 0统计 学 数据 处 理 软件进 行 处理 分 析 , 针 对计 数 资料 和组 间对 比分 别 t 检 验 和 x 检验, 在P < 0 . 0 5时 , 视 为差 异具 有统计 学 意义 。
[整理]19氨咖黄敏胶囊工艺规程
![[整理]19氨咖黄敏胶囊工艺规程](https://img.taocdn.com/s3/m/4ba52a8e1a37f111f0855b05.png)
氨咖黄敏胶囊工艺规程山西信谊制药有限公司质量保证部二OO二年目录1、产品概况2、处方和依据3、生产工艺流程图4、操作过程及工艺条件5、设备一览表及主要设备生产能力6、工艺(环境)卫生、技术安全及劳动保护7、原辅料消耗定额、技经指标及计算方法8、包装要求、说明书、贮藏方法9、原辅料、中间产品及成品的质量标准和技术参数10、劳动组织与岗位定员11、支持文件12、附页氨咖黄敏胶囊工艺规程1.产品概况1.1产品名称:氨咖黄敏胶囊曾用名:速效感冒胶囊汉语拼音:Ankahuangmin Jiaonang英文名称:Paracetamol,Caffein,Atificial Cow-bezoar and Chlorphenmine Maleate Capsules1.2规格:0.276 g,本品为复方制剂,每粒含对乙酰氨基酚250mg、咖啡因15mg、人工牛黄10mg、扑尔敏1mg。
1.3执行标准: 《国家药品监督管理局药品标准》化学药品地方标准上升国家标准第三册WS-10001-(HD-0267)-2002批准文号: 国药准字H14022999剂型:胶囊剂1.4主要技术质量要求:性状: 红黄胶囊,内容物为橙黄色颗粒1.5崩解时限: 30分钟1.6成品率: ≥97.5%1.7含量限度: 本品含对乙酰氨基酚(C8H9NO2)应为标示量的93.0-107.0%;含咖啡因(C8H10N4O2·H2O)应为标示量的90.0%-110.0%。
1.8有效期:二年2.处方和依据:2.1 处方: 原辅料名称每万片用量(g) 原辅料处理对乙酰氨基酚2500 过100目筛咖啡因150 过100目筛人工牛黄100 过100目筛扑尔敏30 过100目筛糊精300 过100目筛10%淀粉浆600制成10000片2.2依据: 《山西省药品标准》1990年版2.3每粒成份及含量3.生产工艺流程图:3.1生产工艺流程总图:(另附)3.2制粒生产工艺流程图(30万粒/粒)(见下页):3.3胶囊填充生产工艺流程图:颗粒填充1#空心胶囊帽红、体黄车速3.5万粒/小时拣粒QA抽样装桶4. 操作过程及工艺条件:4.1 原辅料处理:4.1.1 按前处理的SOP 执行。
氨咖黄敏胶囊工艺规程(参考Word)

氨咖黄敏胶囊工艺规程山西信谊制药有限公司质量保证部二OO二年目录1、产品概况2、处方和依据3、生产工艺流程图4、操作过程及工艺条件5、设备一览表及主要设备生产能力6、工艺(环境)卫生、技术安全及劳动保护7、原辅料消耗定额、技经指标及计算方法8、包装要求、说明书、贮藏方法9、原辅料、中间产品及成品的质量标准和技术参数10、劳动组织与岗位定员11、支持文件12、附页氨咖黄敏胶囊工艺规程1.产品概况1.1产品名称:氨咖黄敏胶囊曾用名:速效感冒胶囊汉语拼音:Ankahuangmin Jiaonang英文名称:Paracetamol,Caffein,Atificial Cow-bezoar and Chlorphenmine Maleate Capsules1.2规格: 0.276 g,本品为复方制剂,每粒含对乙酰氨基酚250mg、咖啡因15mg、人工牛黄10mg、扑尔敏1mg。
1.3执行标准: 《国家药品监督管理局药品标准》化学药品地方标准上升国家标准第三册WS-10001-(HD-0267)-2002批准文号: 国药准字H14022999剂型:胶囊剂1.4主要技术质量要求:性状: 红黄胶囊,内容物为橙黄色颗粒1.5崩解时限: 30分钟1.6成品率: ≥97.5%1.7含量限度: 本品含对乙酰氨基酚(C8H9NO2)应为标示量的93.0-107.0%;含咖啡因(C8H10N4O2·H2O)应为标示量的90.0%-110.0%。
1.8有效期:二年2.处方和依据:2.1 处方: 原辅料名称每万片用量(g) 原辅料处理对乙酰氨基酚 2500 过100目筛咖啡因 150 过100目筛人工牛黄 100 过100目筛扑尔敏 30 过100目筛糊精 300 过100目筛10%淀粉浆 600制成 10000片2.2依据: 《山西省药品标准》1990年版2.3每粒成份及含量3.生产工艺流程图:3.1生产工艺流程总图:(另附)3.2制粒生产工艺流程图(30万粒/粒)(见下页):3.3胶囊填充生产工艺流程图:颗粒填充1#空心胶囊帽红、体黄车速3.5万粒/小时拣粒QA抽样装桶4. 操作过程及工艺条件: 4.1 原辅料处理:4.1.1 按前处理的SOP 执行。
氨咖黄敏胶囊工艺规程

氨咖黄敏胶囊工艺规程山西信谊制药有限公司质量保证部二OO二年目录1、产品概况2、处方和依据3、生产工艺流程图4、操作过程及工艺条件5、设备一览表及主要设备生产能力6、工艺(环境)卫生、技术安全及劳动保护7、原辅料消耗定额、技经指标及计算方法8、包装要求、说明书、贮藏方法9、原辅料、中间产品及成品的质量标准和技术参数10、劳动组织与岗位定员11、支持文件12、附页氨咖黄敏胶囊工艺规程1.产品概况1.1产品名称:氨咖黄敏胶囊曾用名:速效感冒胶囊汉语拼音:Ankahuangmin Jiaonang英文名称:Paracetamol,Caffein,Atificial Cow-bezoar and Chlorphenmine Maleate Capsules1.2规格:0.276 g,本品为复方制剂,每粒含对乙酰氨基酚250mg、咖啡因15mg、人工牛黄10mg、扑尔敏1mg。
1.3执行标准: 《国家药品监督管理局药品标准》化学药品地方标准上升国家标准第三册WS-10001-(HD-0267)-2002批准文号: 国药准字H14022999剂型:胶囊剂1.4主要技术质量要求:性状: 红黄胶囊,内容物为橙黄色颗粒1.5崩解时限: 30分钟1.6成品率: ≥97.5%1.7含量限度: 本品含对乙酰氨基酚(C8H9NO2)应为标示量的93.0-107.0%;含咖啡因(C8H10N4O2·H2O)应为标示量的90.0%-110.0%。
1.8有效期:二年2.处方和依据:2.1 处方: 原辅料名称每万片用量(g) 原辅料处理对乙酰氨基酚2500 过100目筛咖啡因150 过100目筛人工牛黄100 过100目筛扑尔敏30 过100目筛糊精300 过100目筛10%淀粉浆600制成10000片2.2依据: 《山西省药品标准》1990年版2.3每粒成份及含量3.生产工艺流程图:3.1生产工艺流程总图:(另附)3.2制粒生产工艺流程图(30万粒/粒)(见下页):3.3胶囊填充生产工艺流程图:颗粒填充1#空心胶囊帽红、体黄车速3.5万粒/小时拣粒QA抽样装桶4. 操作过程及工艺条件:4.1 原辅料处理:4.1.1 按前处理的SOP 执行。
氨咖黄敏胶囊 标准

氨咖黄敏胶囊标准标准号WS-10001-(HD-0276)-2002药品名称氨咖黄敏胶囊药品英文名Paracetamol, Caffein, Artificial Cow-bezoar and Chlorphenamine Maleate Capsules主要成分本品每片含对乙酰氨基酚(C8H9NO2)应为标示量的93.0%~107.0%;含咖啡因(C8H10N4O2·H2O)应为标示量的90.0%~110.%。
处方对乙酰氨基酚250g咖啡因15g马来酸氯苯那敏1g人工牛黄10g制成1000粒性状本品为胶囊剂,内容物为着色混合颗粒。
鉴别(1)取本品1粒,除去胶囊,研细,加氯仿5ml,使对乙酰氨基酚与马来酸氯苯那敏溶解,滤过,取续滤液作为供试品溶液;另取对乙酰氨基酚对照品与马来酸氯苯那敏对照品,加氯仿制成1ml含对乙酰氨基酚10mg,马来酸氯苯那敏0.15mg的溶液(必要时滤过)作为对照品溶液。
照薄层色谱法(中国药典2000年版二部附录V B)试验,吸取上述两种溶液10ml左右点于同一硅胶G 板上,以甲醇-浓氨溶液(20︰0.15)为展开剂,展开后,晾干,熏以碘蒸汽,供试品与对照品所显主斑点的位置与颜色应相同。
(2)取本品适量(约30.0mg咖啡因),研细,置分液漏斗中,加0.4%的氢氧化钠溶液20ml,振摇溶解后,加氢仿10ml,振摇,分离氯仿层,滤过,滤液置水浴上蒸干,残渣加1ml盐酸溶解后,再加氯酸钾0.1g,再置水浴上蒸干,此残渣遇氨气即显紫色,再加氢氧化钠试液数滴,紫色即消失。
(3)取本品10粒,取出内容物,研细,加氯仿50ml,振摇,滤过,滤液置水浴上蒸干。
残渣加60%醋酸溶液2ml,搅拌使胆酸溶解,再滤过,取滤液约1ml,置试管中,加新制的糠醛水溶液(1︰100)1ml与硫酸溶液(取硫酸50ml与水65ml混合制成)13ml,在70℃水浴中加热,溶液显蓝紫色。
检查应符合胶囊剂项下有关的各项规定(中国药典2000年版二部附录I E)。
氨咖黄敏胶囊生产工艺规程

氨咖黄敏胶囊生产工艺规程一、产品名称1.通用名称氨咖黄敏胶囊2.英文名称Paracetamol,Caffein,Atificial Cow-bezear and Chlorphenamine Maleate Capsules二、剂型:胶囊剂三、历史沿革四、1、处方:对乙酰氨基酚250g咖啡因15g马来酸氯苯那敏1g人工牛黄10g制成1000粒处方依据:药品标准WS-10001-(HD-0276)-2002。
2、规格:对乙酰氨基酚250mg、咖啡因15mg、马来酸氯苯那敏1mg、人工牛黄10mg五、生产工艺操作要求1、制剂处方对乙酰氨基酚75 kg咖啡因 4.5 kg马来酸氯苯那敏0.3 kg人工牛黄 3 kg淀粉 37.2kg制成 30万粒2、概述:本品为胶囊剂。
容物为着色混合颗粒,抗感冒药,每粒含对乙酰氨基酚0.25g ,马来酸氯本那敏 0.001g ,人工牛黄 0.01g ,咖啡因 0.015g 。
本品含对乙酰氨基酚应为标示量的93.0-107.0%。
我厂控制标准为95.0-105.0%;咖啡因应为标示量的90.0-110.0%,控标准为93.0%-107.0%。
3、工艺流程及考前须知〔1〕工艺流程:称取处方量的各种主药、淀粉等备用。
〔1.1〕 ①制粒:各种主药−−−→−加适量辅料混合均匀−−−→−糊精浆%8制成适宜软材−−−→−目尼龙筛24制湿颗粒。
②滚圆:湿颗粒倒入糖衣锅−−−−→−分钟左右转动10加适量母粉−−−−→−分钟左右转动10依次喷水、加母粉。
如此反复屡次至颗粒的圆整度、大小至所需,得水泛丸。
水泛丸−−−−−−−→−分钟左右加色素、转动10选粒−−−→−目筛、3016枯燥−−→−︒c 80-70选粒得白、红、绿、黄四种颜色干颗粒备用。
〔1.2〕将四种颜色颗粒混合后−−−→−化验合格装入0号胶囊−−−→−化验合格铝塑包装 包装−−−→−化验合格入库。
30万级干净区〔2〕考前须知〔2.1〕半成品待检期间应密封在塑料袋中。
氨咖黄敏胶囊说明书范文_氨咖黄敏胶囊副作用

氨咖黄敏胶囊说明书范文_氨咖黄敏胶囊副作用成份本品为复方制剂,每粒含对乙酰氨基酚250毫克,咖啡因15毫克,马来酸氯苯那敏1毫克,人工牛黄10毫克。
性状本品为胶囊剂,内容物为着色混合颗粒。
作用类别本品为感冒用药类非处方药药品。
适应症适用于缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。
规格复方用法用量口服。
成人,一次1~2粒,一日3次。
不良反应有时有轻度头晕、乏力、恶心、上腹不适、口干、食欲缺乏和皮疹等,可自行恢复。
禁忌严重肝肾功能不全者禁用。
注意事项1.用药3-7天,症状未缓解,请咨询医师或药师。
2.服用本品期间不得饮酒或含有酒精的饮料。
3.不能同时服用与本品成份相似的其他抗感冒药。
4.前列腺肥大、青光眼等患者以及老年人应在医师指导下使用。
5.肝、肾功能不全者慎用。
6.孕妇及哺乳期妇女慎用。
7.服药期间不得驾驶机、车、船、从事高空作业、机械作业及操作精密仪器。
8.如服用过量或出现严重不良反应,应立即就医。
9.对本品过敏者禁用,过敏体质者慎用。
10.本品性状发生改变时禁止使用。
11.请将本品放在儿童不能接触的地方。
12.儿童必须在成人监护下使用。
13.如正在使用其他药品,使用本品前请咨询医师或药师。
孕妇及哺乳期妇女用药孕妇及哺乳期妇女慎用。
药物相互作用1.本品不应与含有酒精的饮料、巴比妥类、笨妥英钠及氯霉素同服。
2.长期服用本品或与其它解热镇痛药同服有增加肾毒性之危险。
3.如正在服用其它药品。
使用本品前请咨询医师或药师。
药理作用本品中对乙酰氨基酚能抑制前列腺素合成,有解热镇痛作用;咖啡因为中枢兴奋药,能增强对乙酰氨基酚的解热镇痛效果,并减轻其他药物所致的嗜睡、头晕等中枢抑制作用;马来酸氯苯那敏为抗组胺药,能减轻流涕、鼻塞、打喷嚏症状;人工牛黄具有解热、镇惊作用。
贮藏密封、干燥处保存。
包装铝塑包装,每盒12粒,每盒10粒。
有效期24个月执行标准国家食品药品监督管理局硬片标准WS-10001-(HD-0276)-2002-2006氨咖黄敏胶囊说明书【药品名称】通用名称:氨咖黄敏胶囊英文名称:拼音名称:anjiahuangminjiaonang【成份】本品为复方制剂,每粒含对乙酰氨基酚250毫克,咖啡因15毫克,马来酸氯苯那敏1毫克,人工牛黄10毫克。
氨咖黄敏胶囊说明书

氨咖黄敏胶囊说明书氨咖黄敏胶囊主要是缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。
具体说明请看下文的氨咖黄敏胶囊说明书:【药品名称】通用名称:氨咖黄敏胶囊【成份]】本品为复方制剂,每粒含对乙酰氨基酚0.25克,咖啡因15毫克,马来酸氯苯那敏1毫克,人工牛黄10毫克。
辅料为:淀粉。
【功能主治】本品适用于缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。
【性状】本品为胶囊剂,内容物为着色混合颗粒。
【作用类别】本品为感冒用药类非处方药药品。
【适应症】适用于缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。
【规格】每粒含对乙酰氨基酚0.25克,咖啡因15毫克,马来酸氯苯那敏1毫克,人工牛黄10毫克。
【用法用量】口服。
成人,一次1~2粒,一日3次。
【不良反应】有时有轻度头晕、乏力、恶心、上腹不适、口干、食欲缺乏和皮疹等,可自行恢复。
【禁忌】严重肝肾功能不全者禁用。
【注意事项】1.用药3-7天,症状未缓解,请咨询医师或药师。
2.服用本品期间不得饮酒或含有酒精的饮料。
3.不能同时服用与本品成份相似的其他抗感冒药。
4.前列腺肥大、青光眼等患者以及老年人应在医师指导下使用。
5.肝、肾功能不全者慎用。
6.孕妇及哺乳期妇女慎用。
7.服药期间不得驾驶机、车、船、从事高空作业、机械作业及操作精密仪器。
8.如服用过量或出现严重不良反应,应立即就医。
9.对本品过敏者禁用,过敏体质者慎用。
10.本品性状发生改变时禁止使用。
11.请将本品放在儿童不能接触的地方。
12.儿童必须在成人监护下使用。
13.如正在使用其他药品,使用本品前请咨询医师或药师。
【药物相互作用】1.与其他解热镇痛药同用,可增加肾毒性的危险。
2.本品不宜与氯霉素、巴比妥类(如苯巴比妥)等并用。
3.如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
氨咖黄敏胶囊中咖啡因含量测定不确定度的报告

氨咖黄敏胶囊中咖啡因含量测定不确定度的报告
朱玲;汪民海
【期刊名称】《安徽医药》
【年(卷),期】2009(013)010
【摘要】目的对氨咖黄敏胶囊中咖啡因含量测定结果的可信性、有效性,测量其不确定度.方法通过分析测定过程和步骤,确定不确定度的来源,量化不确定度分量,计算合成不确定度和扩展不确定度.结果建立了用碘量回滴法测定氨咖黄敏胶囊中咖啡因含量不确定度,计算各分量的不确定度,然后计算出合成不确定度为1.12×10-3,扩展不确定度为0.002.结论为氨咖黄敏胶囊中咖啡因含量测定的可信度提供一种数学判断方法,对氨咖黄敏胶囊的质量控制具有指导意义.
【总页数】3页(P1191-1193)
【作者】朱玲;汪民海
【作者单位】安徽省黄山市药品检验所,安徽,黄山,245000;安徽省黄山市药品检验所,安徽,黄山,245000
【正文语种】中文
【相关文献】
1.水泥中氯离子含量测定的不确定度分析报告 [J], 许晖
2.氨咖黄敏胶囊中对乙酰氨基酚和咖啡因的含量测定 [J], 赵燕
3.氨咖黄敏胶囊中对乙酰氨基酚、咖啡因含量的测量不确定度评定 [J], 范剑;米振清
4.乳粉中硝酸盐及亚硝酸盐含量测定的不确定度评估报告 [J], 富莉静;杜全珍
5.饮料中咖啡因含量测定不确定度 [J], 顾晓丹
因版权原因,仅展示原文概要,查看原文内容请购买。
氨咖黄敏胶囊中马来酸氯苯那敏含量及含量均匀度测定

氨咖黄敏胶囊中马来酸氯苯那敏含量及含量均匀度测定吴珺;吴虹萍【期刊名称】《中国药业》【年(卷),期】2008(017)009【摘要】目的建立高效液相色谱(HPLC)法,测定氨咖黄敏胶囊中马来酸氯苯那敏含量及含量均匀度.方法采用Agilent C18柱(150mm×4.6 mm,5μm),以甲醇-0.01 mol/L磷酸二氢钾-0.02 mol/L庚烷磺酸钠(58.5:35.5:6)为流动相,流速为1 mL/min,检测波长为215 nm,柱温为25℃.结果马来酸氯苯那敏质量浓度在11.99~47.98μg/mL(r=0.999 8)范围内与峰面积线性关系良好,平均加样回收率为99.17%,RSD=0.2%(n=6).结论 HPLC 法简便、快速,重现性良好.【总页数】2页(P32-33)【作者】吴珺;吴虹萍【作者单位】江苏省泰州市药品检验所,江苏,泰州,225300;江苏省兴化市第四人民医院,江苏,兴化,225741【正文语种】中文【中图分类】R927.2;R971+.1【相关文献】1.高效液相色谱法测定复方锌布颗粒剂中马来酸氯苯那敏的含量及含量均匀度 [J], 冯璐2.HPLC法测定银菊感冒胶囊中马来酸氯苯那敏的含量及含量均匀度 [J], 荀秀彪;张顺平3.氨金黄敏颗粒中对乙酰氨基酚和马来酸氯苯那敏含量测定及含量均匀度方法研究[J], 李美芳;陈承贵;蔡锦雄;肖丽和4.HPLC法同时测定复方金刚烷胺氨基比林片中氨基比林和马来酸氯苯那敏的含量及含量均匀度 [J], 刘凯双;闫研;殷果;王铁杰5.高效液相色谱法测定复方银翘氨敏胶囊中马来酸氯苯那敏含量及含量均匀度 [J], 吴晓燕;唐琨;尚春燕因版权原因,仅展示原文概要,查看原文内容请购买。
浅谈氨咖黄敏胶囊的质量分析

浅谈氨咖黄敏胶囊的质量分析【摘要】目的:旨在分析和评价氨咖黄敏胶囊的总体质量以及现行质量标准的可行性,为日后临床用药提供参考。
方法:随机抽取103批氨咖黄敏胶囊进行试验,利用现行氨咖黄敏胶囊的法定检验标准和探索性研究两种方法进行试验,评估了其质量状况。
结果:通过抽样的方式随机选择了103批氨咖黄敏胶囊进行检验,合格率为百分百,通过探索性研究检验,合格率仅为32%。
结论:通过试验评价发现,氨咖黄敏胶囊按照现行标准进行检验,质量良好,但现行检验标准往往因设备简单、检验流程简便的特征,使得无法全面有效的分析药品质量,容易引起用药安全问题,因此有必要进一步分析药品质量标准,保证用药安全。
【关键词】质量;氨咖黄敏胶囊;伤风胶囊;感冒氨咖黄敏胶囊也就是过去我们一直说的速效伤风胶囊,是临床诊疗中常用的感冒药品,为复方制剂,主要成分包含了咖啡因、乙酰氨基酚、人工牛黄、马来酸氯苯拉等,其在国家标准第三册中收录。
氨咖黄敏胶囊中的乙酰氨基酚成分能有效抑制前列腺素的合成,能够解热镇痛,对流行性感冒有着良好的治疗效果,同时这些成分还能有效的减轻流鼻涕、鼻塞以及打喷嚏等症状。
马来酸氯苯那敏本身属于抗组胺药,能减轻各种感冒症状。
人工牛黄则有着解热镇惊的效果,能减轻流鼻涕等感冒症状,在过去很长一段时间内,这种药物被作为感冒治疗的主要药品。
自药品研制以来,产品不良反应极少,即使出现不良反应也仅仅表现出头晕、乏力、恶心以及食欲不振等症状,对人体的整体不良影响并不是很大。
但在过去氨咖黄敏胶囊生产中,由于大多企业采用硅胶G板测定,在测定中只能同时对药品中的乙酰氨基酚和马来酸氯苯那敏进行鉴定,牛黄成分的鉴定一直十分薄弱,因此文章在原版标准定型检验基础上寻找出其中不足之处,提出了改进策略。
1、仪器与药物经过国家药监局网站罗列的氨咖黄敏胶囊生产企业而言,全国共有554个,生产批文也有554个,其中广州白云山光华制药股份有限公司为药品生产研发厂,其他为授权生产商,本次检验抽取了江苏11个城市的氨咖黄敏胶囊进行鉴定,具体的企业分布情况如表1所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨咖黄敏胶囊中间产品质量标准
1.主题内容与适用范围
本标准适用于氨咖黄敏胶囊中间产品质量检验。
2. 产品代码
2.1 ZJ/2006。
3.质量标准的依据
国家食品药品监督管理局国家药品标准WS-10001-(HD-0276)-2002-2006。
4.产品规格
4.1 复方
5.包装形式
5.1双层塑料袋密封包装
6.取样与检验操作规程编号
6.1 取样操作规程编号:SOP-QC-003-02
6.2 检验操作规程编号:SOP-ZL(05)-011-02
7.定性和定量的限度要求
7.1 性状:本品为着色颗粒和粉末。
7.2 水分:不得过7.0%。
7.3 装量差异:不得过±9.0%。
7.4 崩解时限:不得过25分钟。
7.5 含量测定:本品含对乙酰氨基酚(C
8H
9
NO
2
)应为83.04%~91.78%;含咖啡因(C
8
H
10
N
4
O
2
·H
2
O)
应为4.82%~5.66%。
8.贮存条件和注意事项
8.1贮存条件密封,在阴凉干燥处保存。
8.2注意事项避免微生物污染。
9.复验期
6个月。
10.培训要求
10.1 培训部门:质量管理部。
10.2 需培训岗位:质量控制部、质量保证部、生产技术部、生产车间相关岗位员工。
11.变更历史。
