(名优专供)河北省衡水中学高三化学一轮复习氧族元素1实验(pdf)
2024届高考一轮复习化学教案(通用版):氧族元素

微专题·大素养❾ 氧族元素【知识基础】1.氧族元素的递变规律 (1)氧族元素概况 包括氧(O )、硫(S )、硒(Se )、碲(Te )、钋(Po )、(Lv )六种元素。
常温下,单质除氧为气体外,其余均为固体,氧、硫、硒为典型的非金属元素,碲为类金属,钋、为金属。
特别提醒①除K +、Na +外,一般的金属硫化物难溶于水,如:FeS 、ZnS 、CuS 等。
②金属硫化物在空气中灼烧,生成金属氧化物和SO 2,如:2ZnS +3O 2=====△2ZnO +2SO 2。
2.臭氧3.过氧化氢(1)结构特别提醒①除MnO2外,Fe2+、Mn2+、Cu2+、Cr3+等也均能催化H2O2的分解;H2O2在碱性环境中的分解远比在酸性环境中的快。
②H2O2作氧化剂时,其还原产物一般为水,不引入杂质且对环境无污染,因而又称为绿色氧化剂,常用于除去具有还原性的杂质离子。
4.Se、Te及其化合物(1)硒及其化合物的性质①单质硒及其氢化物在空气中燃烧可得到SeO2。
②SeO2的氧化性比SO2强,属于中等强度的氧化剂,可氧化H2S、NH3等:SeO2+2H2S===Se+2S+2H2O;3SeO2+4NH3===3Se+2N2+6H2O。
③亚硒酸可作氧化剂,能氧化SO2:H2SeO3+2SO2+H2O===2H2SO4+Se,但遇到强氧化剂时表现还原性,可被氧化成硒酸:H2SeO3+Cl2+H2O===H2SeO4+2HCl。
(2)碲及其化合物的性质①碲在空气或纯氧中燃烧生成TeO2。
②TeO2是不挥发的白色固体,微溶于水,易溶于强酸、强碱,如TeO2+2NaOH===Na2TeO3+H2O。
③TeO2(H2TeO3)具有氧化性和还原性H2TeO3+2SO2+H2O===2H2SO4+TeH2TeO3+Cl2+H2O===H2TeO4+2HCl(3)硒和碲的化合物均有毒。
5.SOCl2、S2Cl2的制备及性质(1)亚硫酰氯(SOCl2)①SOCl2的结构式为,易发生水解反应:(由于生成的H2SO3易分解为SO2和H2O,所以总反应方程式为SOCl2+H2O===2HCl +SO2↑)。
衡水中学2023届高三上学期化学试卷及答案

河北省衡水中学2023届上学期高三年级一调考试化学本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
共8页,总分100分,考试时间75分钟。
可能用到的相对原子质量:Li 7 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32Cl 35.5 K 39 Fe 56 Co 59 Cu 64第Ⅰ卷(选择题共45分)一、选择题:本题共15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.《天工开物》中述及铜的开采与冶炼:凡铜砂……淘洗去土滓,然后入炉煎炼,其熏蒸旁溢者为自然铜……色似干银泥……凡铜质有数种:有与铅同体者,其煎炼炉法,傍通高低二孔,铅质先化,从上孔流出。
下列有关说法错误的是A.“淘洗去土滓”属于原料的富集B.炼制所得自然铜为合金C.铜与铅混合物的分离过程利用了物质的熔点不同D.可用热分解法冶炼铜2.用如图实验装置进行相应实验,能达到实验目的的是A.用①装置检验溶液中是否含有钾元素B.用②装置可制备、干燥、收集氨C.用③装置除去CO2中含有的少量SO2D.用④装置蒸干饱和AlCl3溶液制备AlCl3晶体3.SO2在生产、生活和科学研究中有着广泛的应用。
下列关于SO2的说法错误的是A.制备硫酸后含SO2的尾气大量排放至空气中会形成酸雨B.在葡萄酒中添加SO2作抗氧化剂利用了SO2的还原性C.SO2与H2S混合,产生淡黄色固体,体现了SO2的氧化性D.将SO2通入滴有酚酞的NaOH溶液中,红色褪去,向褪色后的溶液中滴加NaOH溶液,红色复现,体现了SO2的漂白性4.在一个恒温、恒容的密闭容器中,有两个可左右自由滑动的密封隔板(a、b),将容器分成三部分,已知充入的三种气体的质量相等,当隔板静止时,容器内三种气体所占的体积如图所示。
下列说法中错误的是A .分子数目:)(2)()(Y =Z =X N N NB .若Y 是O 2,则X 可能是CH 4C .气体密度:)(2)()(Y =Z =X ρρρD .X 和Z 分子中含有的原子数可能相等5.某探究学习小组成员欲用NaClO 固体配制480 mL 0.2 mol ·L -1的消毒液。
02 衡水中学高三化学一轮复习资料——化学物质及其变化
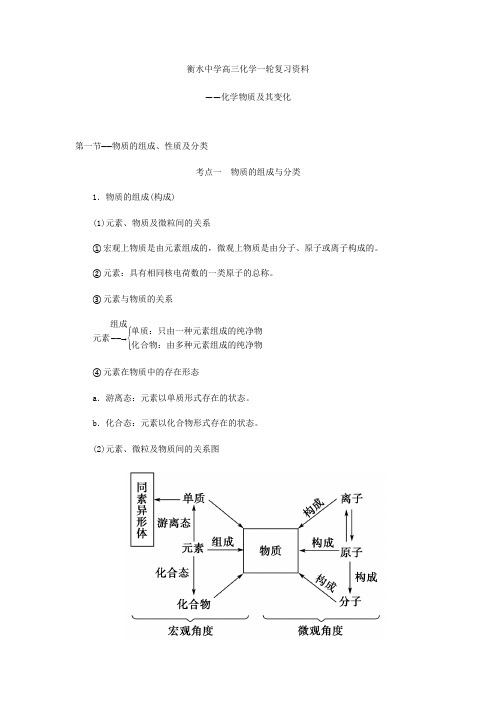
衡水中学高三化学一轮复习资料——化学物质及其变化第一节——物质的组成、性质及分类考点一 物质的组成与分类1.物质的组成(构成) (1)元素、物质及微粒间的关系①宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
②元素:具有相同核电荷数的一类原子的总称。
③元素与物质的关系元素――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物④元素在物质中的存在形态a .游离态:元素以单质形式存在的状态。
b .化合态:元素以化合物形式存在的状态。
(2)元素、微粒及物质间的关系图(3)同素异形体①由同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:a.原子个数不同,如O2和O3;b.原子排列方式不同,如金刚石和石墨。
②同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化。
2.简单分类方法及其应用(1)分类方法常用的两种方法是交叉分类法和树状分类法。
①交叉分类法示例②树状分类法示例(2)分类方法的应用Ⅰ.认识物质间的转化和性质③、④的化学方程式分别为: Ca(OH)2+CO2===CaCO3↓+H2OC +O2=====点燃CO2Ⅱ.认识化学反应的分类依据分解反应 置换反应 吸热 放热考点阐释:规避物质分类的“三大误区”误区一 误认为由相同元素组成的物质一定是纯净物。
(1)若某物质是由一种元素的单质混合而成,如O2、O3组成的混合气体就是混合物,由12C 和13C 组成的石墨则是纯净物。
(2)分子式相同的化合物可能存在同分异构体,最简式相同的化合物不一定是同一物质。
如C4H10的结构有正丁烷和异丁烷,二者组成混合物;C2H2与C6H6最简式相同,但前者为乙炔,后者为苯。
误区二误认为溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱。
(1)NaHSO4、CuSO4、NH4Cl溶液呈酸性,这些物质均属盐。
(2)Na2CO3、NaHCO3溶液呈碱性,这些物质均属盐。
高三化学第一轮复习氧族元素复习教案

氧族元素教、学法指导:一、主要内容1、理解氧族元素单质和化合物的性质递变规律2、利用元素周期律和其他规律推断或预测VIA族元素单质及化合物性质3、掌握S的性质、掌握SO2的性质,了解SO2的用途、了解SO2的污染,提高环保意识4、掌握O3及H2O2的重要性质,掌握同素异形体的概念5、掌握浓硫酸的特性和浓硫酸的稀释方法、了解SO42—的检验原理及方法、了解硫酸、常见的硫酸盐的用途6、了解接触法制硫酸的化学反应原理、生产过程和典型设备7、了解硫、氮、碳的氧化物对大气的污染及其防治8、初步了解氟氯烃、含磷洗衣粉即二氧化硅粉尘对环境及人类健康的影响9、了解环境污染的类型,认识环境保护的重要性10、初步了解生活用水的净化及污水处理的基本原理二、学习重点1、硫酸的化学性质2、硫及其化合物的转化关系考点与命题1.以硫元素为代表,了解氧族元素的单质、氢化物及其氧化物的重要性质;理解氧族元素的性质递变规律;2.以硫及其化合物为背景材料的实验评价问题;3.硫及其化合物的转化关系4.掌握工业上接触法制硫酸的反应原理及有关的多步反应的计算。
5.了解硫酸的性质、用途及硫酸根离子的检验;了解几种常见的硫酸盐6.掌握离子反应、离子反应发生的条件及离子方程式的书写。
7.探究性验证硫酸盐、亚硫酸盐的性质非金属知识主线:气态氢化物单质氧化物氧化物对应水化物相应含氧酸盐H2S S SO2 SO3 H2SO3 H2SO4 Na2SO3 Na2SO4硫及其化合物知识结构:1.氧族元素原子结构、单质性质一、硫1、游离态——自然界存在于火山喷口、地壳岩层。
人类在远古时代发现并使用硫。
存在化合态——存在形式有:FeS2(非盐)、CuFeS2(复盐)、石膏、芒硝、煤和石油中含少量硫——污染大气物主要来源。
2、物理性质:硫有多种同素异开体。
如单斜硫、斜方硫、弹性硫等。
不同温度硫分子含硫原子数不同、常温是S8、高温蒸气主要是S2。
常温为淡黄色晶体(淡黄色固体有:Na2O2、AgBr、黄铁矿、T、N、T等)。
--氧族元素

难溶 难溶
半导体 导体 升高
增大
小结:
氧族元素原子的电子层结构相似,它们 的最外层都有6个电子。氧族元素随核电荷数 的增加,电子层数增多,原子半径增大,原 子核对最外层电子的引力逐渐减弱,使原子 获得电子的能力也依次减弱,失电子的能力 依次增强。所以,氧、硫、硒、碲单质的化 学性质也随核电荷数的增加而发生变化,它 们的非金属性逐渐减弱,金属性逐渐增强, 单质的氧化性逐渐减弱,还原性逐渐增强。
混合气体,充分反应恢复到原状况,气体的体积
变为57ml,这57ml气体的成分可能是( A.C )
A. H2S
B. SO2 、
C.SO2、 O2
D. SO2 、H2S
(2)还原性:
2H2S + SO2 = 2H2O + 3S
H2S +2Fe3+ = 2Fe2+ + S↓+ 2H+
练习1:①在H2S水溶液中通入过量的O2 , ②在H2S水溶液中通入过量的SO2 ,PH怎样 变化,作出图像。
课堂练习:
1.碲元素及其化合物不可能具有的性质是
(
(A)碲的氧化物有TeO2和TeO3 (B)碲的化合物有-2、+4、+6价
C)
(C)碲能与氢气直接化合,且比较稳定
(D)单质碲为银白色、导电性比硒强的固体
课堂练习:
2.若已发现116号元素X,关于此元素,下列叙
述正确的是
(B)
(A)其钠盐为Na2X (B)最高价氧化物为XO3 (C)气态氢化物H2X很稳定 (D)X是非金属.
OH
CHO
催化剂
+ O2
CHO
O COOH
COOH
2、氧气的实验室制法
03 衡水中学高三化学一轮复习资料——金属及其化合物
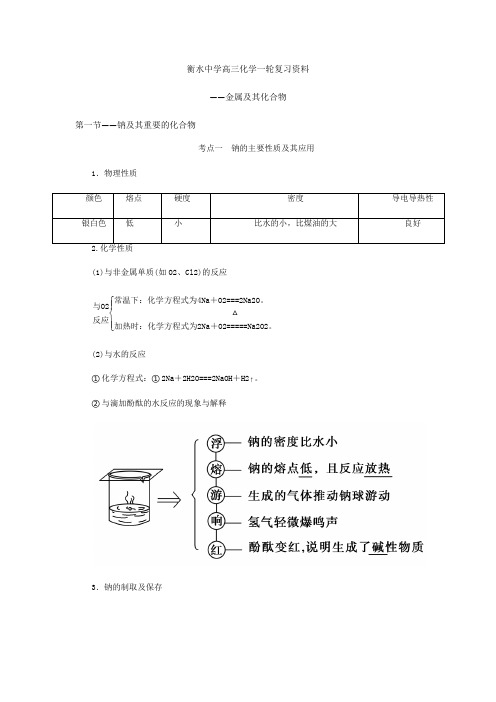
衡水中学高三化学一轮复习资料——金属及其化合物第一节——钠及其重要的化合物考点一 钠的主要性质及其应用1.物理性质(1)与非金属单质(如O2、Cl2)的反应与O2反应⎩⎪⎨⎪⎧常温下:化学方程式为4Na +O2===2Na2O 。
加热时:化学方程式为2Na +O2=====△Na2O2。
(2)与水的反应①化学方程式:①2Na +2H2O===2NaOH +H2↑。
②与滴加酚酞的水反应的现象与解释3.钠的制取及保存4.焰色反应(1)概念:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
属于物理变化,是元素的物理性质。
(2)常见元素焰色反应的颜色:钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃)。
5.钠的用途考点阐释:1.金属钠露置在空气中的变化过程银白色金属钠Na ――→O2表面变暗生成Na2O ――→H2O 出现白色固体生成NaOH――→H2O 表面变成溶液NaOH 潮解――→CO2白色块状物质―→生成Na2CO3·10H2O――→风化白色粉末状物质生成Na2CO32.钠与水、酸、盐溶液的反应(1)钠与水、酸的反应实质上均是和H +反应钠与稀硫酸、盐酸等非氧化性酸反应时,首先是钠直接跟酸反应,过量的钠再与水反应,而不能认为是钠先跟水反应,生成的NaOH 再跟酸中和。
钠投入足量盐酸中反应的化学方程式:2Na+2HCl===2NaCl+H2↑离子方程式:2Na+2H+===2Na++H2↑(2)钠与盐溶液的反应先考虑Na与水反应生成NaOH,再考虑NaOH是否与盐发生复分解反应①投入NaCl溶液中,只有H2放出。
2Na+2H2O===2NaOH+H2↑②投入饱和NaCl溶液中,有H2放出,还有NaCl晶体析出(温度不变)。
③投入NH4Cl溶液中,有H2和NH3逸出。
④投入CuSO4溶液中,有H2放出和蓝色沉淀生成。
2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑考点二氧化钠和过氧化钠1∶21∶2考点阐释:Na2O2与某些氧化物反应的规律1.过氧化钠的强氧化性2.Na2O2与CO2、H2O反应的重要关系(1)气体体积差的关系2Na2O2+2CO2===2Na2CO3+O2 气体体积差①2 1 ΔV=12Na2O2+2H2O(g)===4NaOH+O2↑气体体积差②2 1 ΔV=1由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的12,即为生成氧气的量。
【备战2020】高三化学一轮复习学案第八章氧族元素Word版含答案.pdf
6. 为了除去混在 CO2 中的 SO2和 O2,下列试剂使用的顺序正确的是①饱和 ②饱和 NaHC3O溶液;③浓硫酸;④灼热的铜网;⑤碱石灰 ( ) A. ①②③ B. ②③④ C. ②⑤④ D. ③④⑤
Na2CO3 溶液;
7. 将 11.2g 铁粉和 2.2g 硫粉均匀混合,在密闭容器中加热到红热,冷却后加入足 量的盐酸, 在标况下收集到的气体体积为 ( ) A.11.2L B.5.6L C.4.48L D.2.24L
第八章 氧族元素 硫酸工业
第一课时 氧族元素
【 考纲要求 】
1. 理解氧族元素的性质递变规律;
2. 以硫元素为代表,了解氧族元素的单质、氢化物及其氧化物的重要性质; 3. 了解硫的氧化物对环境的污染及环境保护的意义
【 自学反馈 】
教与学方案
1.氧族元素的原子结构及性质递变规律
元素名称和 氧( O) 硫( S) 符号 原 原子序 子数 结 结构示 构 意图
A.Fe(NO3) 2 溶液
过量盐酸通 SO2 , BaCl2溶液
白色沉淀
B.Ba(NO3) 2 溶液
过量盐酸 , Na2SO1溶液
白色沉淀
C. 无色溶液
稀 HNO 3 , BaCl 2溶液
白色沉淀
D. 无色溶液
过量盐酸
无色溶液
BaCl 2
白色沉淀
5. 关于酸雨的下列分析正确的是 ( ) A. 因空气中无催化剂, SO2 不能转化成 SO3,酸雨中只含 H2SO3 B.SO2 在空气中有条件形成 SO3,所以酸雨中含 H2SO4 C. 酸雨是无法避免的 D.H2SO4 形成的酸雨比 H2SO3 危害大
——其水溶液叫亚硫酸、 二元弱酸。 SO2 是重要的大气污染物 ( 其危害详见课本 ) ,防
04 衡水中学高三化学一轮复习资料——非金属及其化合物

衡水中学高三化学一轮复习资料——非金属及其化合物第一节——碳、硅及其化合物考点一碳、硅的性质及其应用1.单质的存在形态、物理性质和用途碳硅存在形态游离态和化合态化合态物理性质金刚石:熔点很高,硬度很大石墨:硬度较小,电的良导体灰黑色固体,有金属光泽、熔点高、硬度大,有脆性用途金刚石用作切割刀具,石墨用作电极、铅笔芯半导体材料、太阳能电池和合金材料(1)C的化学性质——还原性(2)Si的化学性质——还原性Si ⎩⎪⎪⎨⎪⎪⎧与非金属单质⎩⎪⎨⎪⎧ O 2:Si +O 2=====△SiO 2F 2:Si +2F 2===SiF 4Cl 2:Si +2Cl 2=====△SiCl 4与强碱溶液:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑与氢氟酸:Si +4HF===SiF 4↑+2H 2↑考点阐释:碳、硅单质的特殊性1.一般情况下,非金属元素单质熔、沸点低,硬度小,但晶体硅、金刚石熔、沸点高,硬度大,其中金刚石为自然界中硬度最大的物质。
2.一般情况下,非金属单质为绝缘体,但硅为半导体,石墨为电的良导体。
3.Si 的还原性大于C ,但C 在高温下能还原出Si :SiO 2+2C=====高温Si +2CO ↑。
4.非金属单质与碱反应一般既作氧化剂又作还原剂,且无氢气放出,但硅与强碱溶液反应只作还原剂,且放出氢气:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑。
5.非金属单质一般不与非氧化性酸反应,但硅能跟HF 作用:Si +4HF===SiF 4↑+2H 2↑。
6.一般情况下,金属(Na 、K)能置换出水中的氢,但C 在高温下也能置换出H 2O 中的氢:C +H 2O(g)=====高温H 2+CO 。
考点二 CO 2、SiO 2的性质与应用CO 2和SiO 2的比较二氧化碳二氧化硅结构 存在单个CO 2分子空间立体网状结构,不存在单个分子 主要物理性质熔、沸点低,常温下为气体,硬度大,熔、沸点高,常温下为固体,不溶能溶于水于水化学性质水CO2+H2O H2CO3不反应酸不反应SiO2+4HF===SiF4↑+2H2O(特例)碱CO2+2NaOH===Na2CO3+H2O或CO2+NaOH===NaHCO3SiO2+2NaOH===Na2SiO3+H2O(盛碱液的试剂瓶用橡胶塞)化学性质盐Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,CO2+Na2CO3+H2O===2NaHCO3SiO2+Na2CO3=====高温Na2SiO3+CO2↑(制玻璃)碱性氧化物CO2+Na2O=====△Na2CO3SiO2+CaO=====高温CaSiO3用途化工原料、灭火剂,干冰用于人工降雨光学镜片、石英坩埚、光导纤维考点阐释:二氧化硅性质的特殊性多数酸性氧化物的共性二氧化硅的特性非金属氧化物的熔沸点一般较低SiO2的熔点却很高酸性氧化物一般与水反应生成相应酸SiO2不溶于水,不与水反应酸性氧化物一般不与酸发生反应SiO2+4HF===SiF4↑+2H2O“较强酸制较弱酸”是复分解反应的一般规律,H2CO3酸性强于H2SiO3:Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓以下反应不能说明酸性的强弱Na2CO3+SiO2=====高温Na2SiO3+CO2↑CaCO3+SiO2=====高温CaSiO3+CO2↑考点三硅酸及无机非金属材料1.硅酸(1)溶解性:不溶于水。
