水分析化学5章共28页
水分析化学与实验

分析化学的课程性质和任务
分析化学是本科化学教育专业的一门 专业基础课,是为学生掌握分析化学的基 本原理、基本知识和基本操作技能;重视 化学反应条件,逐步树立准确的“量”的 概念;培养严谨的科学态度和良好的实验 习惯;初步具有分析问题和解决问题的能 力而开设的一门必须选修课程,是学生学 习其它化学课程的基础科目。
<0.1 <0.01
20
5. 待测组分含量 • 常量成分分析 • 微量成分分析 • 痕量成分分析
>1% 0.01~1 % <0.01%
另外还有:例行分析、仲裁分析、环境分析、食品分 析 、 药物分析 、 材料分析 、矿物分析等
例行分析:又称“常规分析”。指一般化验室日常生产中的分析。主
1
几种常见的饮用水
1.自来水
由江河湖泊的水引入水池加入明矾、氯气和碱再通过水管、水 塔送进千家万户。 功能:澄清水质,调节水之酸碱度(PH值在6.0-8.5间),杀菌 。 缺点:水中有机杂质、重金属无法除去,另外,水中有机杂质或 腐殖酸会与氯气反应生成致癌物质三氯甲烷,而且在输送过程中 会有第二次污染(铁锈、细菌、病毒等),所以几乎无人敢喝未 烧开的自来水。
14
● 课程性质与任务
水分析化学是研究水及水中污染物的 组成、性质、含量和分析方法的一门学 科。水分析化学是给水排水工程专业的 重要专业技术基础课、必修课,主要培 养学生的水质工程分析技能,为学习专 业课打下坚实的基础。 为我们专业的选修课。
15
● 基本要求
水分析化学是研究水中杂质及变化规律的重要学 科。掌握四大滴定方法(酸碱、配位、沉淀和氧化 还原滴定法)和主要的仪器分析方法(吸收光谱法、 电位分析法、原子吸收法及色谱法等)的基本原理 、基本知识、基本概念和基本技能,掌握水质分 析的基本操作,培养严谨的科学态度,树立准确 “量”的理念,初步具备数据评价能力、具备查 阅文献、选择分析方法、拟订实验方案的能力, 培养观察、分析和解决实际问题的能力。
黄君礼《水分析化学》课件讲义

12
n 残渣(Residue)…水中除溶解性气体外的杂质。
1.总残渣(Total Residue )(总固体Total Solid )
…水中固体物质总量。
2.总可滤残渣(Totalid)
…能通过0.45um滤器的固体物质。
3.总不可滤残渣(Total Unfilterable Residue) (悬浮固体 Suspended Solid )
…不能通过0.45um滤器的固体物质。
4.挥发性残渣(Volatile Residue)…600 ℃能挥发的物质。
5.固定性残渣(Fixed Residue)…600 ℃不能挥发的物质。
6.可沉降物(Settleable Matter)
13
1.总残渣(Total Residue ) 蒸发皿105℃烘干、称重—W1 蒸发皿装水样水浴蒸干 105℃烘干、称重—W2
紫外吸光度值 UVA —利用有机物在紫外光 区的吸收,间接反应水 中有机物的量。
氧化还原电位 ORP
—与水中氧化剂、还原 剂有关,是废水生物处 理过程重要控制参数 。
9
n 臭味(Odor)
1.文字描述 (20℃,摇荡) 无 微弱 弱 明显 强 很强 2.臭阈值(Odor Threshold Value)
v 物理指标 (Physical Index) 不涉及化学反应,测定后被测组分形态不发生 变化。
v 化学指标 (Chemical Index) 表示水中杂质及污染物的化学成分和特性。
水分析化学培训课件5point(5)

3 2
/Fe
O Fe 3 /Fe 2
0.059lg
cFe 3 cFe 2
O Fe
3
/Fe2
0.68 V
Ce4+ + e- = Ce3+
Ce
4
/Ce3
O Ce 4 /Ce3
0.059lg
cCe 4 cCe3
O Ce 4 /Ce3
lg k 2 (0.854 0) 28.6 0.059 K 3.981028
说明反应进行很完全,废水处理效果好。
3.外界条件对电极电位的影响
外界条件对电极电位的影响主要表现在: (1)温度; (2)离子强度; (3)有H+(或OH-)参与反应时,pH对条件电极电位有影响;
(4) 配位、沉淀等副反应使有效浓度降低. 电对的氧化态(cOX)生成沉淀(或配合物)时,电极电位
二、氧化还原滴定 1.氧化还原滴定曲线:
氧化还原滴定过程,随着滴定剂的加入,氧化 态和还原态的浓度逐渐改变,两个电对的电极电 位不断发生变化,化学计量点附近有一电位的 突跃。以滴定剂的体积为横坐标,电对的电极电 位为纵坐标绘制 ~V曲线即氧化还原滴定曲 线。
例题:在1.0 mol/L硫酸溶液中,0.1000mol/LCe(SO4)2 溶液滴定0.1000mol/L Fe2+溶液。 滴定反应: Ce4+ + Fe2+ = Ce3+ + Fe3+ 两点对: Fe2+ - e- = Fe3+
1.44V
(1)化学计量点前: Ce4+ + Fe2+ = Ce3+ + Fe3+ 由于Ce4+量很少,用被滴定物电对 Fe3+ / Fe2+进行计算。 当有99.9% Fe2+被滴定(-0.1%):
水分析化学第五章

K sp
当 CrO42-开始沉淀时所需Ag+浓度为:
1.1 10 12 [ Ag ] 3.3 10 6 mol / L 2 0.10 [CrO4 ]
K sp
10
5.2
分步沉淀
∴ Cl-离子先沉淀。 当Ag2CrO4开始沉淀时Cl-的剩余量为
1.8 10 10 [Cl ] 5.4 10 5 mol / L [ Ag ] 3.3 10 6 K 1 沉淀溶解平衡与影响溶解度的因素
5.1.2 影响沉淀溶解度的因素P165 (1) 同离子效应
CO32
2 3
CaCO3 Ca CO
2
CaCO3在水中的溶解度为S0 mol/L:
CaCO3 Ca CO
S0 Ksp = S2 S0
宜。这样终点观察到Ag2CrO4时,AgNO3肯定过量,怎样校正?
空白实验 以蒸馏水代替被测水样,加入相同量的K2CrO4指示剂,用 AgNO3标准溶液滴定至同样的终点颜色,记下读数,然后从原 滴定被测试液所消耗的AgNO3体积中扣除此此体积即可。
21
5.3 沉淀滴淀法的基本原理
测定条件2:
溶液的酸度
3 3
3
思考题:
1、络合滴定中返滴定用的标准金属离子和被测定的
金属离子与EDTA所形成的络合物的稳定性要适中。 为什么?举例说明。 2、简述金属指示剂的工作原理。 3、金属指示剂的封闭效应对则定结果有何影响?
4、络合滴定为什么需控制溶液的酸度?
4
第5章
5.1
沉淀滴定法
沉淀溶解平衡与影响溶解度的因素
18
5.3 沉淀滴淀法的基本原理
5.3.2 莫尔法
水分析化学课件详解演示文稿

解联立方程法多组分的测定
根据吸光度加合性原则
AX
Y
A1 Ax1 Ay1 x1bcx y1bcy
1 2
A 2
Ax2
Ay2
x
2bcx
y2bcy
A
x
1
为物质的特征参数,可通过配制标
准溶液测得。
解联立方程,可求得Cx, Cy
第十九页,共32页。
x
2
Cs(x)
8.5 应用实例
天然水中Fe2+的测定 废水中Cd2+测定:双硫腙比色法
紫红色 橙色 黄色
邻二氮菲-亚铁反应完全程度与pH的关系
lg [FeR3 ] [Fe]
NopH3~8为适宜 的酸度范围
Image
第九页,共32页。
固定CM、 CR,作 A ~ pH 曲线,寻找适 宜 pH 范围。
A
第十页,共32页。
pH1
pH2
pH
pH1<pH<pH2
3) 显色温度及显色时间
(CM、 CR 、 pH一定)作 A ~ T 曲线,确定适宜反应温度。
第十六页,共32页。
8.4 吸光光谱法的定量方法
1、绝对法:测定样品的吸光度,由A=εc L求出c,但须知吸光
系数ε、光程L
单 组
2、标准对照法:在同样条件下分别测定标准溶液(浓度为
分 已知c标 )和样品溶液的吸光度,然后求出被测样品的浓度
测 3、标准曲线法:校正 定 4、回归分析法:c=a A + b , a, b为回归系数
5、解联立方程组:利用吸光度的加和性,求多组分的浓度
多 组
6、双波长分光光度法:自学
分 7、示差分光光度法:透光率调零和100%的方法不同
《水分析化学》课后习题答案

水分析化学平时作业整理第一章1.简述水分析化学课程的性质及任务。
性质:水分析化学是研究水及其杂质、污染物的组成、性质、含量和它们的分析方法的一门学科。
任务:通过水分析化学学习,掌握水分析化学的四大滴定方法(酸碱滴定法、络和滴定法、沉淀滴定法和氧化还原滴定法)和主要仪器分析法(如吸收光谱法、色谱法和原子光谱法等)的基本原理、基本理论、基本知识、基本概念和基本技能,掌握水质分析的基本操作,注重培养学生严谨的科学态度,培养独立分析问题和解决实际问题的能力。
2.介绍水质指标分几类,具体包括哪些指标?(1) 物理指标 1) 水温 2) 臭味和臭阈值 3) 颜色和色度 4)浊度 5)残渣 6)电导率 7)紫外吸光度值 8)氧化还原电位(2)微生物指标 1) 细菌总数 2) 总大肠菌群 3) 游离性余氯 4) 二氧化氯(3) 化学指标 1) pH 值 2) 酸度和碱度 3) 硬度4) 总含盐量 5) 有机污染物综合指标 6) 放射性指标第二章1.简述水样分析前保存的要点是什么?水样保存希望做到:减慢化学反应速度,防止组分的分解和沉淀产生;减慢化合物或络合物的水解和氧化还原作用;减少组分的挥发溶解和物理吸附;减慢生物化学作用。
水样的保存方法主要有加入保存试剂,抑制氧化还原反应和生化作用;控制pH 值和冷藏冷冻等方法,降低化学反应速度和细菌活性。
2.测定某废水中的COD ,十次测定结果分别为50.0,49.2,51.2,48.9,50.5,49.7,51.2,48.8,49.7和49.5 mgO 2/L ,问测量结果的相对平均偏差和相对标准偏差(以CV 表示)各多少?第三章1.已知下列各物质的Ka或Kb,比较它们的相对强弱,计算它们的Kb或Ka,并写出它们的共轭酸(或碱)的化学式。
(1)HCN NH4+ H2C2O44.93×10-10(Ka)5.6×10-10(Ka) 5.9×10-2(Ka1)6.4×10-5(Ka2)(2)NH2OH CH3NH2 AC-9.1×10-9(Kb) 4.2×10-4(Kb) 5.90×10-10(Kb)解:(1)酸性强弱:H2C2O4 > NH4+ >HCN(2)碱性强度:CH3NH2 > NH2OH >AC-2.简述酸碱滴定中指示剂的选用原则。
哈尔滨工业大学《水分析化学》课件..

[4] EDTA的络合平衡
稳定常数
( 1 :1 ) (逆反应)
稳定常数用途:判断一个络合物的稳定性
EDTA的酸效应 条件稳定常数
[5]金属指示剂
影响金属指示 络合滴定曲线突跃范围 剂的主要因素 金属离子M的初始浓度 金属指示剂(有机络合剂)
金属指示剂的作用原理 解决办法:加掩蔽剂 种类 封闭现象:加入过量的EDTA也不能将MIn中的In置换 出来 的现象 僵化现象:由于生成的显色络合物为胶体或沉淀,使 终点延长或拖后的现象 解决办法 :加 有机溶剂或加热 慢滴,振摇
精确度高,则精密度一定高
准确度低,则精密度一定低
精密度高,而准确度不一定高
[6]标准溶液
基准物质:以直接准确称量,用于配制标准溶 液的一类物质
标准溶液:已知准确浓度的溶液
量浓度 :
滴定度: 1ml标准溶液相当于被测物质的质量( 用Ts/x表示,S-标准溶液,X-待测溶液)
例题与习题:
记住一些常用的摩尔质量 17g/mol 30g/mol 61g/mol
28g/mol
50g/mol
写出碱度计算的正确表达式
例题与习题:
例1:当P>0,M=0时
OH-碱度(mol/L)= ?
OH-碱度(mmol/L)= ?
OH-碱度 例2:已知某酸 =? ,求其共轭碱的PKb
第4章 络合滴定法
[4]碱度的测定
天然水中碱度的种类 :
可构成5种组合形式(假设水中
和
不
共存 ):
碱度和pH的关系:
连续滴定法测水中碱度
水分析化学课件ppt可修改全文

培养独立分析和解决分析化学 中实际问题的能力
注重培养严谨的科学态度
树立1个“量”概念 强化并树立准确“量”的观念
4
教学方式
➢ 课程讲授:核心的、最具价值的知识点,深讲;把握学 科的思维方式和研究方法。
➢ 内容总结、讨论、习题课、参观:围绕课程知识点归类 总结、大型仪器应用演示与认识参观等
➢ 课程作业:多做多练(强化科学训练);综合开放的题目 ➢ 课程材料:教材、多媒体教学课件
– 温度体积效应异常:冻结时膨胀、0~4℃时体积随 温度升高而降低、4 ℃是体积最小,密度最大
– 热容量最大:除液氨外,所有液体和固体物质中, 水的热容量最大—调节气温
– 具有强溶解性、强反应能力的溶剂:介电常数很 大(使溶质电离能力强),许多物质在水中溶解 度大,电离度大,可发生各种化学反应
– 强流动能力 – 较大的表面张力:液体中除汞以外,水的表面张
的依据
17
水分析化学与传统分析化学的关系
• 建立在传统分析化学基 础之上,
• 突出水质指标的工程应 用地位,
• 由水质分析技术引出相 关的分析化学理论内容
18
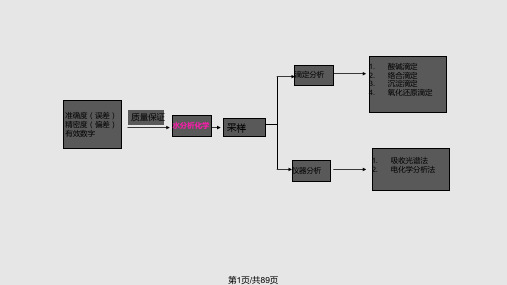
1.2 水分析方法分类
样品
➢按分析方法的原理和手段分:
➢1、★化学分析法 (常量组分):以化学反
应为基础的分析方法
➢定义:将水中被分析物质与已知成分、性质和含量
常量 半微量 微量
>100 10~100
<10
>10 1~10 <1
➢ ★按待测组分含量分
常量组分 (>1%) 微量组分 (0.01-1%)
21
痕量组分 (<0.01%)
分析化学组分含量单位
PPM ——parts per million (10-6) ( mg / kg )或( mg / L )
《工程化学基础》第5章PPT课件

–H+
酸1 + 碱2
酸2 + 碱1
+H+
.
5
第5章 水溶液中的化学反应和水体保护
弱酸弱碱溶液
在
H A c + H 2 O H 3 O + + A c -
和
H 2 O + A c - O H - + H A c
HAc–Ac–、H3O+–H2O、H2O–OH– 均互称为共轭酸 碱对。
.
6
第5章 水溶液中的化学反应和水体保护
1923年,化学家布朗斯特(Brφnsted J. N. 丹麦) 和化学家劳莱(Lowry T. M. 英国)
凡是能够提供质子的分子或离子都是酸 酸是质子的给予体
凡是能够接受质子的分子或离子都是碱 碱是质子的接受体
.
4
第5章 水溶液中的化学反应和水体保护
弱酸弱碱溶液
这种酸和碱的相互依存、相互转化关系被称为酸 碱共轭关系,酸(或碱)与它共轭的碱(或酸)一起被称为 共轭酸碱对。
N H 3 + H 2 ON H 4 + + O H -
这种在弱酸或弱碱等弱电解质溶液中,加入与弱酸 或弱碱解离后具有相同离子的易溶强电解质,能使弱电 解质解离度降低的现象称同离子效应
.
20
第5章 水溶液中的化学反应和水体保护
弱酸弱碱溶液
缓冲溶液
像 HAc–NaAc 这类能抵抗外加少量强酸、强碱或 适当稀释的影响,保持其 pH 基本不变的溶液叫缓冲 溶液。缓冲溶液对强酸强碱或适当稀释的抵抗作用叫 缓冲作用。
.
13
第5章 水溶液中的化学反应和水体保护
弱酸弱碱溶液
水分析化学 课件

2013-7-13
29
2-3 酸碱指示剂
2.两种最常见的酸碱指示剂: (1)酚酞:三苯甲烷类。 变色范围:8~10,无色变红色。 酚酞指示剂结构与颜色:
2013-7-13
30
2-3 酸碱指示剂
(2)甲基橙:偶氮类结构。 变色范围:3.1~4.4,黄色变橙红色。 甲基橙指示剂结构与颜色:
2013-7-13
31
2-3 酸碱指示剂
二、酸碱指示剂的变色范围 以HIn表示弱酸型指示剂,其在溶液中的 平衡移动过程,可以简单表示如下: HIn + H2O = H3+O + InKHIn = ([In-][H+] ) / [HIn] KHIn / [H+] = [In-] / [HIn] [In-]为碱色的浓度;[HIn]为酸色的浓度。 指示剂的颜色转变依赖于:[In-] / [HIn] 。
12
2.2 酸碱平衡中有关组分浓度的计算
H 2CO3 2
C
[H ] 2 [ H ] Ka1[ H ] Ka1K 2
2
[ HCO3 ] Ka1[ H ] 1 2 C [ H ] Ka1[ H ] Ka1K 2
[CO3 ] Ka1Ka 2 0 C [ H ]2 Ka1[ H ] Ka1K 2
HA HA C HA HA A A A C HA HA A
HA A 1
2013-7-13
9
2.2 酸碱平衡中有关组分浓度的计算
HAc溶液的分布曲线
2013-7-13
10
给排水基础水分析化学PPT课件
=K HAc
V n Ac-
V
pH=4.74-lg 0.1 0.02 =7.74 0 .1 1 9 .9 8
化学计量点: NaAc 〔OH-〕= K C Ac- Ac-
p OH=
1(p 2
K
Ac--lg
n Ac- V
) = 1(1 4 2
4.7 4-lg
0.1 20
2 0) =5.2 8 20
pH=14-pOH=14 - 5.28=8.72
100%
第3页/共89页
2. 精密度:偏差 绝对偏差d=测量值(X)-平均值( )
X Xi
n
相对偏差=d 100% X
平均偏差d= X-X ,相对平均偏差d(%)=d 100%
n
X
标准偏差:
(1)有限次测量s
(Xi X)2
n 1
(2)无限次测定:lim X=(总体平均值) n
= (X-)2
• 滴定曲线:pM(-lg[M])~V(EDTA) 1.滴定前 2.开始~化学计量点前 3.化学计量点 4.计量点之后
例 5 - 2 6 : 0 . 0 1 0 0 0 m o l / L E DTA 滴 定 2 0 m l C a 2+ 滴定突跃:pCa=5.3第~30页7/共.6899页,计量点6.49
由(V1
O
23
)
+
V2
)
算
总
➢算CO总32碱- +度
,H C2OV31-
(V1<V
算
C
O
23
2, pH 8.3~9.5 , (V2-V1)算
, H
由(V1+ CO3- )
V
水分析化学

z 物质的量(摩尔,mol):表示物质的指定的基 本单元是多少的物理量,1mol物质B所包含的 基本单元数为阿佛加德罗常数
z 基本单元
z 摩尔质量 (g/mol):用MB表示,也必须指出基 本单元,M(K2Cr2O7)=294, M(1/6K2Cr2O7)=49
施在进出水口 z 取样量:保证分析用量3倍以上,至少做2次平行
样 z 容器:玻璃或塑料瓶,容器清洁(化学指标)或
无菌(微生物指标) z 取样方法
保存
z 意义:采用一些措施终止或减缓各种反应速度 z 措施
¾ 冷藏 ¾控制pH值,加酸调pH <2,个别指标加NaOH ¾ 加保存试剂
[5]分析方法的评价体系
准分析方法,准备玻璃仪器和设备,取水样, 按照标准分析方法和流程进行测定,数据处理, 评价分析方法,结果报表 z 3、对同一水样连续测定至少8次 表2 ClO2光度法精密度实验结果
z 2(设计)表1 ClO2光度法加标回收实验结果
次数 1
加标前 (mg/L)
0.00
加时量 (mg/L)
0.20
加标后 (mg/L)
对于水以外的其他溶剂,Ka·Kb=Ks
z 拉平效应:使酸完全解离至溶剂化质子水平
HCl、HNO3在水中,拉平到H3O+(即H+),水 为拉平溶剂
HCl、HAc在氨水中拉平NH4+,氨水为拉平溶 剂。
z 区分效应:区分溶剂使酸碱表现出强弱。
例:以HAc为溶剂时,HClO4比HNO3酸性强
[2]酸碱滴定曲线
[3]酸碱指示剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
形成沉淀所需 [ A g ] 为:
[Ag]K [C sp, lA gC ]l 1.8109mol/L
[Ag]
Ksp,Ag2CrO4 [CrO4 ]
3.3106mol/L
结论
分布沉淀中, 先达到溶 度积Ksp的先沉淀(溶 解度小的先沉淀)。
此时 [C l]K [A sp ,g A g C ]l 1 3 ..8 3 1 1 0 0 1 6 05 .4 1 0 5m o l/L 沉淀平衡时剩余离子浓度与初始浓度相比 相差3个数量级以上,沉淀完全。
S 4 K SP 27
溶解度 和溶度积
AgCl 和 Ag2CrO4的溶度积分别为 1.8×10-10 和 1.1 ×10-12 ,则下面叙述中 正确的是:
(A) AgCl与Ag2CrO4的溶解度相等 (B) AgCl的溶解度大于Ag2CrO4 (C) 二者类型不同,不能由ksp大小直接判断溶解度大小
第五章 沉淀滴定法
知识点 ❖ 溶解度和溶度积 ❖ 影响沉淀平衡的因素 ❖ 分步沉淀
❖ 莫尔法测定水中Cl
5.1 沉淀溶解平衡与影响溶解度的因素
5.1.1 沉淀溶解平衡 (1)溶解度和溶度积
A gC l(S)ƒA g+ (L)+C l-(L)
活度积常数(活度积)KSP aAg acl
活度与浓度的关系: aAg Ag[Ag]
分子式
溶度积
溶解度/ mol /L
AgCl AgBr AgI Ag2CrO4
1.8×10 -10 5.0×10 -13 8.3×10 -17 1.1×10 -12
1.3×10 -5 7.1×10 -7 9.1×10 -9 6.5×10 -5
同一类型的电解质,可以用Ksp直接比较溶解度的大小, 不同类型的难溶电解质,不能用Ksp比较。
用酸效应系数αA(H)描述酸效应, αA(H) ≥1。
酸效应对强酸盐影响较小,使弱酸盐溶解度增大。
例5.1 计算CaC2O4在不同情况下的溶解度 在纯水中 Ksp(CaC2O4)=2.3×10-9 H2C2O4 pKa1=1.23 pKa2=4.19
CaC2O4
Ca2++C2O42-
S=[Ca2+]=[C2O42-]= K s p =4.8×10-5 mol·L-1
pH=1较pH=7时, CaC2O4s p = 3.1×10-3 (mol·L-1)
(4) 络合效应 —增大溶解度
能与构晶离子生成可溶性络合物,使沉淀溶解度增大, 甚至不产生沉淀的效应。
Ag 2 N C 3 H lA(N g3 )H 2 Cl
络合剂浓度越大,生成的络合物越稳定,则沉淀的溶解度越大。
5.3 沉淀滴定法的基本原理
5.3.1 沉淀滴定曲线
10
1mol/L
8 0.1mol/L
AgBr
6
pAg 4
6.44 4.87
应用:测定水样中Cl-的莫尔法
5.2.2 沉淀的转化 定义:将微溶化合物转化成更难溶的化合物 应用:1)测定水样中Cl-的佛尔哈德法。 2)工业水处理中,硬水的软化。
5.3 沉淀滴定法的基本原理
沉淀滴定法:以沉淀反应为基础的滴定分析法。
银量法——以生成微溶银盐沉淀的反应为基础的 滴定方法。 银量法:莫尔法、佛尔哈德法和法扬司法 应用:水中Cl-、Br-、CN-和Ag+等的测定。
5.1.2 影响沉淀溶解度的因素
(1) 同离子效应 —减小溶解度
沉淀溶解平衡时,向溶液中加入 构晶离子,沉淀的溶解度减小的现象。
应用:1)工程上用此种方法软化硬水——石灰-苏打软化法 2)沉淀分析法总要加过量沉淀剂. 可挥发性沉淀剂过量50%~100%; 非挥发性沉淀剂过量20%~30%。
(2) 盐效应 —增大溶解度
定义:利用溶度积Ksp 大小不同进行先后沉淀的作用 。
溶液中同时含有0.1mol/LCl-
和0.1mol/L
C rO
2 4
离子,
逐滴加入AgNO3溶液。 量少时为白色浑浊
AgClAgClKsp, AgCl 1.81010 S = 1.34×10-5
2A g C rO 2 4 A g 2C rO 4 K sp, A g2C rO 41.121012S = 1.04×10-4
在pH=1.0的酸性溶液中
CaC2O4
Ca2++C2O42-
K´sp= [Ca2+][C2O42-] =S2
H+ HC2O4-
c2o4 (H)
1
H Ka2
H
2
K K a1 a2
H2C2O4
1
101 104.19
(101)2 101.23 104.19
103.62
Ksp′= Ksp
C
2
O
2 4
-
(H=) 9.59×10-6
注意:沉淀剂本身就是络合剂,此时既存在同离子效应 ,又存在络合效应—
若沉淀剂适当过量,同离子效应起主导作用,沉淀的溶解度 降低,有利于沉淀反应;若沉淀剂过量太多,则络合效应起 主导作用,沉淀的溶解度增大,不利于沉淀反应;
(5)其他因素见教材P171 什么是陈化?
5.2 分步沉淀
5.2.1 分步沉淀
aCl
[Cl] Cl
溶溶度解积度常数(SK0溶sp度A [积A g)g ][C C ll]AgK spCl
K sp K s p [A g ]•[C l ] S 0 2 ( 1)
对MmAn型沉淀,溶度积计算公式为:
MmAn mM+nA
Ksp Mm An mm•nn•Smn
加入其他易溶强电解质使沉淀的溶解度增大的现象。
S/S0
1.6
BaSO4
Ksp
[M][A] Ksop
(M)(A)
1.4
1.2
AgCl
I ,(M )(A ) ,K S P ,S
1.0
0.001
0.005
0.01
c(KNO3)/(mol·L-1)
(3) 酸效应 —增大溶解度
溶液pH对沉淀溶解度的影响。
溶解度S:解离出的离子浓度,即平衡时每升溶液
中有S(mol)化合物溶解。
溶解度Smn Ksp mm•nn
(2)条件溶度积 Ks' pKspMA
M
为考虑pH值,络合剂等外界因素造成的副反应系数
A
溶解度的计算:
例1: AgAgCl Ksp[Ag ]C []lS2
1:1型沉淀 S Ksp
例2:F(O e )H 3F3 e3O H K sp [F 3 ]e O [ ]3 H S (3 S )3 2S 4 7
