Sr-Ca-La-Co
高考化学必背元素周期表64个-全文

高考化学必背元素周期表64个-全文化学是高考科学类的一门重要科目,其中元素周期表是化学研究的基础。
为了帮助学生掌握化学知识,以下是高考化学必须背诵的64个元素的周期表。
周期表的构成:1 1H HeL Li BeNa Mg 3 4 5 6 7 8 9 10K Ca Sc Ti V Cr Mn Fe Co NiRb Sr Y Zr Nb Mo Tc Ru Rh PdCs Ba *La Hf Ta W Re Os Ir PtFr Ra **Ac Rf Db Sg Bh Hs Mt Ds*Ce **Th Pr Nd Pm Sm Eu Gd Tb DyHo Er Tm Yb Lu化学元素:1. 氢 H2. 氦 He3. 锂 Li4. 铍 Be5. 硼 B6. 碳 C7. 氮 N8. 氧 O9. 氟 F10. 钠 Na11. 镁 Mg12. 铝 Al13. 硅 Si14. 磷 P15. 硫 S16. 氯 Cl17. 钾 K18. 钙 Ca19. 钪 Sc20. 钛 Ti21. 钒 V22. 铬 Cr23. 锰 Mn24. 铁 Fe25. 钴 Co26. 镍 Ni27. 铜 Cu28. 锌 Zn29. 镓 Ga30. 锗 Ge31. 砷 As32. 硒 Se33. 溴 Br34. 铷 Rb35. 铍 Sr36. 锶 Y37. 锆 Zr38. 铌 Nb39. 钼 Mo40. 锝 Tc41. 钌 Ru42. 铑 Rh43. 钯 Pd44. 银 Ag45. 镉 Cd46. 铟 In47. 锡 Sn48. 锑 Sb49. 碲 Te50. 碘 I51. 钡 Ba52. 铯 Cs53. 钡 Ba54. 铯 Cs55. 钡 Ba56. 锕 La78. 铌 Nb79. 钨 W80. 铼 Re81. 锇 Os82. 铱 Ir83. 铂 Pt84. 金 Au85. 汞 Hg86. 铊 Tl87. 铅 Pb88. 铋 Bi89. 钍 Th90. 镧 Pr91. 铈 Nd92. 镨 Pm93. 钕 Sm94. 铕 Eu95. 铽 Gd96. 镝 Tb97. 铒 Dy98. 铥 Ho99. 铪 Er 100. 钇 Tm 101. 铯 Yb 102. 铽 Lu以上是高考化学必背的64个元素及其位置。
同位素表

放射性同位素半衰期Radioative Isotopic Life Cycle同位素列表這張同位素列表顯示了所有已知的化學元素的同位素。
此表由左到右按照原子序數的增長而排列,由上到下依照中子數目由少到多排列。
表格中的颜色表示各個同位素的半衰期(参见圖例),表格邊缘的颜色表示最稳定的核異構體的半衰期。
以下為新編化學元素週期表 :1 H2 He3 Li4Be5B6C7N8O9F10Ne11 Na 12Mg13Al14Si15P16S17Cl18Ar19 K 20Ca21Sc22Ti23V24Cr25Mn26Fe27Co28Ni29Cu30Zn31Ga32Ge33Ae34Se35Br36Kr37 Rb 38Sr39Y40Zr41Nb42Mo43Tc44Ru45Rh46Pd47Ag48Cd49In50Sn51Sb52Te53I54Xe55 Cs 56Ba57La72Hf73Ta74W75Re76Os77Ir78Pt79Au80Hg81Tl82Pb83Bi84Po85At86Rn87 Fr 88Ra89Ac104Rf105Db106Sg107Bh108Hs109Mt110Uun111Uuu112Uub113Uut114Uuq115Uup116Uuh117Uus118Uuo 鑭系元素58Ce59Pr60Nd61Pm62Sm63Eu64Gd65Tb66Dy67Ho68Er69Tm70Yb71Lu錒系元素90Th91Pa92U93Np94Pu95Am96Cm97Bk98Cf99Es100Fm101Md102No103Lr同位素元素表 : 第一及第二週期同位素元素表 : 第三週期同位素元素表 : 第四週期同位素元素表 : 第五及第六週期同位素元素表 : 鑭系元素週期。
Sr_(1-x)La_xCo_(0.3)Ti_(0.3)Fe_(11.4)O_(19)铁氧体微波吸收特性的研究

.
.
Z HANG L i DI i —h S e , NG T e z u, HANG T o, a YAN Z e W ANG Xio b , IL , i h n, a — o L i HE Je
( col f hs a Si c n eh o g , nr noi U i ri , o ht 0 ,C ia Sh o o yi l c n ea dT c nl y I e Mo gl nv sy H h o 0 2 P c e o n a e t 1 1 hn ) 0
善吸 收性能 ;当 x= . 0 3时 , 大 吸收可达 4 . 7 B,0 B带宽达 2 9 G z2 d 最 2 3 d 1r i .0 H ,0 B带宽达 2 3 G z, .3 H
这 非 常有利 于作为高 频 吸波材料 。通 过对 snL。c 0T¨F 铁 氧体 烧结 温度 的分 析 , 现 r a o i e. O 发
. .
i n y a o t n a d t e a s r i g p ro ma c s b s . s o l b u 40 m n h b o b n e r n e i e t f K e o ds:o yw r s l—g l r — L 03 o3 l 4O 1; mir wa e a o b n o ris e ;S l a Co Ti Fe 1 9 c o v bs r i g prpete
s lsi d c t h td p n p r p it mo n frr at n h n m a n r a e a o b n a d wi t u t n i ae t a o i g a p o rae a u to a e e rh La t a u c n i c e s bs r i g b n d h
La—Co掺杂对锶铁氧体磁导率减落的影响

,A h i e aoaoyol om t nMaeil 1Dei sSho P yi ( . nu yL b rtr n r ai t as( v e, co lf hsc 1 K f f o r } c o s} MaeilSineA h i nvri, ee2 0 3, hn; t as cec, nu iest Hfi 3 09 C ia r U y 2Deat n oP yi 1Mahm tsA h intue f rht tr 1 n ut , fi3 02 C i ; . p r tf hs s( te ai . nu Isi to Ac icue(Id syHee 02, hn me c } c t e } r 2 a
Efe to - oSubs t io n heM a ne c f c fLa C i t ut n o t g t i Dia c m m o to n S r n i r ie s co da i n i t o tam Fe rt s
L U a .o g , XU a . i g HUAN G i, a l m  ̄ d z G6 z I Xin s n Xio b n , Ka P b o He i e . me n
维普资讯
L — o 杂对锶铁氧 体磁导率减 落的影响 aC 掺
刘先松 , 小兵 , 徐 黄 凯 a l H m ̄d z 6 e ,P bo e i e. m z n G
(. 1 安徽省信息材料与器件重点实验 室,安徽大学 物理与材料学院,安徽合肥 20 3 ; 30 9 2 安徽建筑工业学院 数理 系,安徽合肥 2 02 ; . 302
c r mi r c s .Th r s l s u n r s s d e y ea c p o e s e c y t 缸 c l wa t id b me n o r y d f a to .ma n t ia c mmo a i n a e u a s f X.a if c i n r g ei ds c o c dt o me s r me t r a r u t o u e i e y t m a e n a LCR rd e h e i fe c s o 3. 2 a u e ns we e c r o twi la c mp tr a d d s se b d o y l s b i g .T n u n e fLa C0 l s b t t n o h 缸 t r d p r e b l y o r — L F l 一 o O 1 we e y t ma c l i v s g t d n t e u si i n t e s ucu e a em a i t f S l x e 2 x 9 u t o n i r s se t a l n e t a e .I i y i h
标准电极电势表 (碱)

电对方程式E /VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02 Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99 La(III)-(0) La(OH)3+3e-=La+3OH--2.90 Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88 Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690 Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63 Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50 Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36 Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33 P(I)-(0) H2PO2-+e-=P+2OH--1.82 B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79 P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71 Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697 P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65 Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56 Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48 *Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26 Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249 Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219 Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215 Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2 Te(0)-(-I) Te+2e-=Te2--1.143 P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3-1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924 Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277 Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809 Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691 As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584 *S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627 Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46 *Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3-0.422 Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366 Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360 Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34 *Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31 Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222 Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3-0.12 O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076 Ag(I)-(0) AgCN+e-=Ag+CN--0.017 N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01 Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05 Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08 Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977 Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108 Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14 Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17 Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247 I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33 Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342 Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358 Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH30.373 O(0)-(-II) O2+2H2O+4e-=4OH-0.401 I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485 *Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490 Mn(VII)-(VI) MnO4-+e-=MnO42-0.558 Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595 Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60 Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607 Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH-0.61 Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH-0.62 Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH-0.66 I(VII)-(V) H3IO62-+2e-=IO3-+3OH-0.7 Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH-0.76 Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH-0.761 Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH-0.841 *Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95。
各个元素的读音

元素周期表中的元素1 H氢1.00792 He氦4.00263 Li锂6.9414 Be铍9.01225 B硼10.8116 C 碳12.0117 N氮14.0078 O氧15.999 9 F氟18.99810 Ne氖20.17 11 Na钠22.9898 12 Mg镁24.305 13 Al铝26.982 14 Si硅28.085 15 P磷30.974 16 S硫32.06 17 Cl氯35.45318 Ar氩39.94 19 K钾39.098 20 Ca钙40.08 21 Sc钪44.956 22 Ti钛47.9 23 V 钒50.94 24 Cr铬51.996 25 Mn锰54.93826 Fe铁55.84 27 Co钴58.9332 28 Ni镍58.69 29 Cu铜63.54 30 Zn锌65.38 31 Ga镓69.72 32 Ge锗72.5 33 As砷74.92234 Se硒78.9 35 Br溴79.904 36 Kr氪83.8 37 Rb铷85.467 38 Sr锶87.62 39 Y 钇88.906 40 Zr锆91.22 41 Nb铌92.906442 Mo钼95.94 43 Tc锝(99) 44 Ru钌161.0 45 Rh铑102.906 46 Pd钯106.42 47 Ag银107.868 48 Cd镉112.41 49 In铟114.8250 Sn锡118.6 51 Sb锑121.7 52 Te碲127.6 53 I碘126.905 54 Xe氙131.3 55 Cs铯132.905 56 Ba钡137.3357-71La-Lu镧系:57 La镧138.9 58 Ce铈140.1 59 Pr镨140.9 60 Nd钕144.2 61 Pm钷(147) 62 Sm钐150.3 63 Eu铕151.9664 Gd钆157.25 65 Tb铽158.9 66 Dy镝162.5 67 Ho钬164.9 68 Er铒167.2 69 Tm铥168.9 70 Yb镱173.04 71 Lu镥174.96772 Hf铪178.4 73 Ta钽180.947 74 W钨183.8 75 Re铼186.207 76 Os锇190.2 77 Ir铱192.2 78 Pt铂195.08 79 Au金196.96780 Hg汞200.5 81 Tl铊204.3 82 Pb铅207.2 83 Bi铋208.98 84 Po钋(209) 85 At砹(201) 86 Rn氡(222) 87 Fr钫(223)88 Ra镭226.03 89-103Ac-Lr锕系:89 Ac锕(227) 90 Th钍232.0 91 Pa镤231.0 92 U铀238.0 93 Np镎(237) 94 Pu钚(239,244)95 Am镅(243) 96 Cm锔(247) 97 Bk锫(247) 98 Cf锎(251) 99 Es锿(252) 100 Fm镄(257) 101 Md钔(258) 102 No锘(259)103 Lr铹(260) 104 Rf钅卢(257) 105 Db钅杜(261) 106 Sg钅喜(262) 107 Bh钅波(263) 108 Hs钅黑(262) 109 Mt钅麦(265)110 Ds钅达(266) 111 Rg钅仑(272) 112 Uub(285) 113 Uut(284) 114 Uuq(289) 115Uup(289) 116Uuh(292) 117 Uus(294)118 Uuo(293) ……氢(qīng) 氦(hài)锂(lǐ) 铍(pí) 硼(péng) 碳(tàn) 氮(dàn) 氧(yǎng) 氟(fú) 氖(nǎi)钠(nà) 镁(měi) 铝(lǚ) 硅(guī) 磷(lín) 硫(liú) 氯(lǜ) 氩(yà)钾(jiǎ) 钙(gài) 钪(kàng) 钛(tài) 钒(fán) 铬(gè) 锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xiù) 氪(kè) 铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(lǎo) 钯(bǎ) 银(yín) 镉(gé) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān)铯(sè) 钡(bèi) 镧(lán) 铈(shì) 镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铕(yǒu) 钆(gá) 铽(tè) 镝(dī) 钬(huǒ) 铒(ěr) 铥(diū) 镱(yì) 镥(lǔ) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái)锇(é) 铱(yī) 铂(bó) 金(jīn) 汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 钋(pō) 砹(ài) 氡(dōng)钫(fāng) 镭(léi) 锕(ā) 钍(tǔ) 镤(pú) 铀(yóu) 镎(ná) 钚(bù) 镅(méi) 锔(jú)锫(péi) 锎(kāi) 锿(āi) 镄(fèi) 钔(mén) 锘(nuò) 铹(láo) 钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(hēi) 钅麦(mài) 钅达(dá) 钅仑(lún)小结:其实大多数元素的读音比较好读,只要读半边就可以了。
金属活动性顺序表

金属活动性顺序表Cs、 Rb、 K、 Ra 、Ba 、Sr、 Ca、 Na 、Li、Ac、 La、 Ce、 Pr 、Nd 、Pm铯、铷、钾、镭、钡、锶、钙、钠、锂、锕、镧、铈、镨、钕、钷、Sm 、Eu、 Gd 、Tb 、Y 、Mg 、Dy、 Am 、Ho、 Er 、Tm 、Yb、 Lu 、(H)、 Sc、 Pu 、Th 、Np 、Be 钐、铕、钆、铽、钇、镁、镅、镝、钬、铒、铥、镱、镥、(氢)、钪、钚、钍、镎、铍、Uv、 Hf 、Al 、Ti 、Zr 、V 、Mn、 Nb、 Zn、 Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co 铀、铪、铝、钛、锆、钒、锰、铌、锌、铬、镓、铁、镉、铟、铊、钴、Ni、 Mo、 Sn 、Pb 、(D2)、 (H2)、 Cu、 Tc、 Po、 Hg 、Ag、 Rh 、Pd 、Pt 、Au 镍、钼、锡、铅、(氘分子)、(氢分子)、铜、锝、钋、汞、银、铑、钯、铂、金金属活动性顺序表的应用1.金属与氧气的反应铁铝铜反应现象剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体表面变暗,失去金属光泽[常温下在空气中],若把铝箔用火柴在氧气中引燃[和引燃铁丝的方法类同].则铝箔剧烈燃烧,发出和镁条燃烧一样耀眼的白光。
生成白色固体。
表面变黑,失去金属光泽化学方程式3Fe+2O2==(点燃)==Fe3O4 4Al+3O2==2Al2O3[常温]4Al+3O2==(点燃)==2Al2O32Cu+O2==(△)==2CuO反应特征都是氧化反应,生成金属氧化物,且都属于化合反应。
2. 金属与酸发生反应(1)金属应是在金属活动性顺序中排在(H)前面的金属;(2)酸应是不具有强氧化性的酸,例如盐酸、稀硫酸,不包括浓硫酸和硝酸;(3)单质铁与酸发生置换反应时生成亚铁盐;(4)K、Ca、Na除与酸反应外,还能与水在常温下发生置换反应,其余金属则不能。
化合价口诀一价钾钠氢与银,二价钙镁钡与锌。
三价金属元素铝,一五七价元素氯。
常见九种典型的晶体结构
TiSe2, TiTe2, SnS2, MnI2, NiTe2, PdTe2, PtS2,
CdI2, MgI2, CaI2, CoBr2, FeBr2, FeI2, ZrS2,
ZrSe2, MnBr2等。 具有反CaI2结构的物质有:
Ag2F,B2O, Ni2C
4 萤石结构
空间群:Fm3m,立方面心结构。 Ca分布于晶胞的角顶及面心;F分布在晶胞8等分 之后每个小立方体的中心。
BaTiO3 NaWO3 CaSnO3 CsPbO3 KZnF3
NaNbO3 LaVO3 BaZrO3 KFeF3 PbCsCl3
更有意义的是具有钙钛矿衍生结构的物质
如PbTiO3
(1) Pb-O键 长不相等。 中间的4个 为2.80A, 下面的4个 为2.51A, 上面的4个 为3.24A
物质名称 化学式 金刚石 C 0.3567 10 单晶硅 Si 0.5431 7 锗 Ge 0.5623 6 α锡 Sn 0.6489 5
a0/nm
H
D / g/cm3 颜色 熔点(‴)
主要用途
3.51 无色 3550
超硬材料
2.336 黑色 1410
半导体材料
5.47 淡灰色 958
半导体材料
5.77 白色 937
具有尖晶石型结构的部分物质
Fe3O4 γ -Fe2O3 VMn2O4 LiTi2O4 NiAl2O4 CoAl2O4 ZnAl2O4 Co3O4 GeCo2O4 NiGa2O4 Co3S4 TiZn2O4 VZn2O4
MgGa2O4 NiCo2S4
MnFe2O4 MnTi2O4 MgFe2O4 ZnCr2O4 Ti Fe2O4 CoCr2O4
阴离子配位立方体:全部共棱形成萤石结构。 [CaF8] 配位立方体沿3维方向相间排列而成。
化学元素周期表口诀
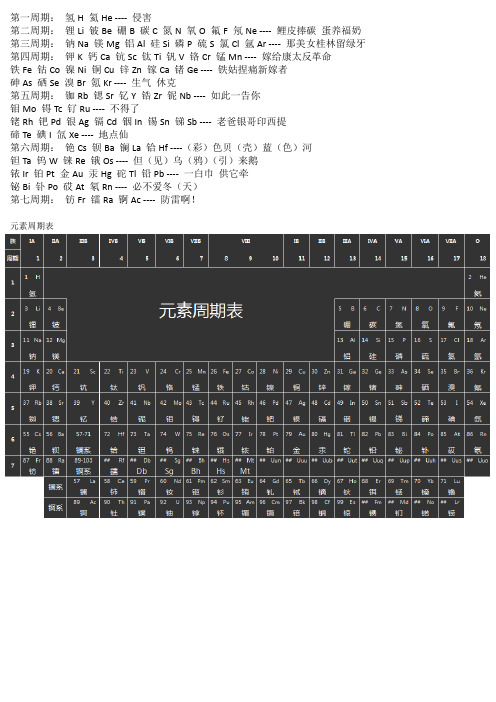
第一周期:氢H 氦He ---- 侵害
第二周期:锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne ---- 鲤皮捧碳蛋养福奶第三周期:钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar ---- 那美女桂林留绿牙第四周期:钾K 钙Ca 钪Sc 钛Ti 钒V 铬Cr 锰Mn ---- 嫁给康太反革命
铁Fe 钴Co 镍Ni 铜Cu 锌Zn 镓Ca 锗Ge ---- 铁姑捏痛新嫁者
砷As 硒Se 溴Br 氪Kr ---- 生气休克
第五周期:铷Rb 锶Sr 钇Y 锆Zr 铌Nb ---- 如此一告你
钼Mo 锝Tc 钌Ru ---- 不得了
铑Rh 钯Pd 银Ag 镉Cd 铟In 锡Sn 锑Sb ---- 老爸银哥印西提
碲Te 碘I 氙Xe ---- 地点仙
第六周期:铯Cs 钡Ba 镧La 铪Hf ----(彩)色贝(壳)蓝(色)河
钽Ta 钨W 铼Re 锇Os ---- 但(见)乌(鸦)(引)来鹅
铱Ir 铂Pt 金Au 汞Hg 砣Tl 铅Pb ---- 一白巾供它牵
铋Bi 钋Po 砹At 氡Rn ---- 必不爱冬(天)
第七周期:钫Fr 镭Ra 锕Ac ---- 防雷啊!
元素周期表
化合价口诀:
一价氢氯钾钠银
二价氧钙钡镁锌
三铝四硅五氮磷
二三铁,二四碳
二四六硫都齐全
铜汞二价最常见
单质为零要记清
负一氢氧硝酸根
负二碳酸硫酸根
正一价的是铵根
溶解性口诀:
钾钠铵销全可溶
硫酸根溶钾钠铵
盐酸不溶氯化银(AgCl)硫酸只有钡不溶
碱中只溶钾钠铵钡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
mi c r o w a v e c a l c i n a t i o n( MC ) a n d c o n v e n t i o n a l mu f f l e f u r n a c e c a l c i n a t i o n( C C ) , a n d t h e n s i n t e r e d ma t e r i a l s p r e p a r e d .
e n h a n c e d r e ma n e n c e( )a nd c o e r c i v i t y( J ) . F o r S r 0 . 2 2 L a o 3 8 C a o 4 F e l 1 . 6 C o 0 2 4 01 9 c a l c i n e d a t 1 2 5 0  ̄ C a n d s i n t e r e d a t
d i f r a c t i o n( X R D) , s c a n n i n g e l e c t r o n mi c r o s c o p y( S E M) , nd a v i b r a t i n g s a mp l e ma g n e t o me t r y( VS M) , r e s p e c t i v e l y  ̄
LI J i n — da o , ZHAN Zh e n . h ua , CHEN Zho n g— ya n , L V Zh a o . mi ng , FENG Ze . ku n i . J PM F Gu a n g do n g Co, Lt d Ji an gme n 5 2 9 00 0 ,Ch i n a,  ̄
T h e p h a s e c o mp o s i t i o n , mi c r o s t r u c t u r e , a n d ma g n e t i c p r o p e r t i e s o f t h e c a l c i n e d ma t e ia r l s we r e e x a mi n e d u s i n g X— r a y
4 Fe l 1 A bs t r a c t :M- t y p e h e x a g o n a l f e r r i t e S r o 2 2 La 0 3 8 Ca o 6 Co 02 4 01 9 p r e c a l c i n a e d p o wd e r s we r e p r e p a r e d b y
2 . S c h o o l o f O p t i c a l a n d E l e c t r o n i c I n f o r ma t i o n , Hu a z h o n g U n i v e r s i t y o f S c i e n c e a n dT e c h n o l o g y , Wu h a n 4 实验 室采用微波预烧 ( MC) 和传统马 弗炉预烧 ( C C)两种方法制备 了 M 型六角铁 氧体预烧料 ,
然后制备 出烧结磁体 。采用 XR D、S E M 和 VS M 分析样品的结构特征 、微观形貌及磁特性。研究表明 ,MC技 术能快速有效地生 成六角铁 氧体永磁材料 ,且 能提升材料 的 研 和 , c J 。 对于配方 S r 0 2 2 L a o 3 8 Ca o 4 F e 1 1 6 c o 0 - 2 4 O1 9 , 当预 烧温度和 烧结温度分别 为 1 2 5 0 ℃和 l 1 7 0 ℃时,对应 MC预烧料 的烧结样品 的 B , = 4 4 4 mT和 He j = 4 1 5 k A / m,
Re s e a r c h s h o ws t h a t t h e MC t e c h ni q u e h a s g r e a t p o t e n t i a l i n r a p i d a n d e ic f i e n t f a b r i c a t i o n o f h e x a f e r r i t e ma t e i r a l s wi t h
与相 同温度 下的 C C预烧料 的烧结样 品指 标相 比分别提 高 1 . 6 % 和5 %。 关键 词:六角铁氧体 ;微 波预烧 ;微观结构 ;磁性 能
中 图 分 类 号 :T M2 7 7 + . 2 文 献 标 识 码 :A 文章编号 :1 0 0 1 . 3 8 3 0 ( 2 0 1 5 ) 0 2 — 0 0 4 4 . 0 4
Co m pa r a t i v e s t udy o f mi c r o wa v e a n d t r a d i t i o na l c a l c i na t i o n t e c hno l o g y f o r Sr - Ca - La - Co t y pe h e xa f e r r i t e s
S r — C a . L a . C o型 六 角铁 氧 体 微 波 与传 统 预 烧 工 艺 比较研 究
李金道 ,詹振 华 ,陈 中艳 ,吕兆民 ,; - q ̄ U 坤
( 1 .广 东江粉 磁 材股份 有 限公 司 ,广 东江 门 5 2 9 0 0 0 ; 2 .华 中科 技 大学 光 学与 电子信 息 学院 ,湖北 武汉 4 3 0 0 7 4)
