盐类的水解盐类水解的应用人教版高中化学选修四教学课件
合集下载
人教版高中化学选修四课件---盐类的水解

TiO2·xH2O↓ +
四、盐类水解原理的应用
⒍泡沫灭火器工作原理
泡沫灭火器中的反应物分别是硫酸铝溶液和碳酸 氢钠溶液,它们是如何产生二氧化碳的?
Al3+ + 3H2O
Al(OH)3 + 3H+
HCO3- + H2O
H2CO3 + OH-
混合时, H+ + OH-
H2O
两个平衡相互促进, Al(OH)3形成沉淀, H2CO3 分解为CO2,总反应为:
c(Cl-)>c(NH4+)> c(H+)>c(OH-) 练习:已知等物质的量浓度醋酸与醋酸钠混合溶液
c呈(C酸H性3,CO写O出-)混>合c(溶N液a+中)>各c离(H子+浓)>度c大(O小H关-)系。
练习: 1、0.1mol/L下列溶液pH值由大到小的顺序是 ___⑨__>_③__>_②__>_⑥__>⑤__>_④>⑧>⑦>①
三、影响盐类水解的主要因素
⒈盐的组成: “越弱越水解”
盐类水解的实质是盐与水作用生成弱电解质(弱酸或弱 碱),生成弱电解质的倾向越大(生成的弱电解质越难 电离),对水电离平衡的影响越大,也就是水解程度越 大。 例:酸性:乙酸>碳酸>碳酸氢根离子 水解程度:乙酸钠<碳酸氢钠<碳酸钠
即pH : CH3COONa<NaHCO3<Na2CO3
B. c (Cl-)> c(NH4+)> c (H+) > c (OH-) C. c(NH4+) > c (Cl--)> c (OH-)> c (H+) (氨过量)
《盐类的水解》人教版高二化学选修4PPT课件

人教版高中化学选修4(高二)
第三章 水溶液中的离子平衡
感谢各位的仔细聆听
MENTAL HEALTH COUNSELING PPT
老师:
(3)能发生双水解的离子,在同一溶液中不能大量共存
练习:
D 1. 在溶液中,不能发生水解的离子是(
)
A、ClO –
B、CO3 2 –
C、Fe 3+
D、SO4 2 –
练习:
2、下列水解离子方程式正确的是 ( D )
A、Fe3++3H2O
Fe(OH)3↓+3H+
B、Br-+H2O
HBr+OH-
C、CO32-+H2O
盐类的分类
思考:
酸溶液显酸性,碱溶液显碱性,那么盐溶液显什么性?
盐类的分类
实验探究一:选择合适的方法测试下表所列盐溶液的酸碱性。
盐溶液 NaCl Na2CO NaHC NH4C Na2SO CH3COO
3
O3
l
4
Na
(NH4)2 SO4
盐类型
强酸强碱 盐
酸碱性
强碱弱 酸盐
强碱弱 酸盐
强酸弱碱 强酸强碱
盐类型 强酸强碱
盐
酸碱性 中性
强碱弱 酸盐
碱性
强碱弱 酸盐
碱性
强酸弱碱 强酸强碱
盐
盐
强碱弱酸盐
酸性 中性
碱性
强酸弱碱盐
酸性
归纳总结:
盐的类型 盐溶液酸碱性
强酸强碱盐 中性
强酸弱碱盐 酸性
强碱弱酸盐 碱性
探究二、分析盐溶液显酸碱性的原因:
讨论1:为什么强碱弱酸盐(例CH3COONa溶液)显碱性? 溶液显碱性,说明c(OH-)>c(H+)
人教版化学选修四盐类水解盐类水解应用教学课件
Kh2= c(H2Ac()H·Ac-()OH-)=
c(H2A)·c(OH-)·c(H+) c(HA-)·c(H+)
=
KW Ka1
Ka1>> Ka2
Kh1>> Kh2
比较多元弱酸对应盐的碱性强弱时,只需要考虑
第一步水解;
物质的量浓度相同时,多元弱酸正盐的碱性 比酸式盐碱性强。
HA-+H2O HA-+H2O
Ka>Kb:酸的电离程度大于碱的电离程度,溶液呈酸性; Ka≈Kb:酸碱的电离程度相近,溶液呈中性; Ka<Kb:酸的电离程度小于碱的电离程度,溶液呈碱性。
人教版化学选修四盐类水解盐类水解 应用
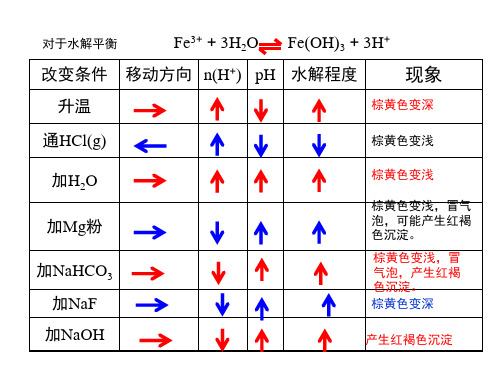
对于水解平衡
Fe3+ + 3H2O Fe(OH)3 + 3H+
改变条件 移动方向 n(H+) pH 水解程度
现象
升温
棕黄色变深
通HCl(g)
棕黄色变浅
加H2O
加Mg粉
加NaHCO3 加NaF 加NaOH
棕黄色变浅
棕黄色变浅,冒气 泡,可能产生红褐 色沉淀。 棕黄色变浅,冒 气泡,产生红褐 色沉淀。 棕黄色变深
人教版化学选修四盐类水解盐类水解 应用
(五)某些化肥的使用使土壤酸碱性变化 (NH4)2SO4(硫铵) Ca(OH)2、K2CO3(草木灰)
酸性 碱性
它们不能混合使用, 否则会因双水解而降低肥效。
(六)利用盐类水解除杂
如: MgCl2溶液中混有FeCl3杂质。 不引入新杂质!
(主)
Fe3+ + 3H2O Fe(OH)3 + 3H+
若Ka2>2-
Kh2= c(H2Ac()H·Ac-()OH-)=
人教版化学选修四第三节盐类水解的应用ppt

人教版化学选修四第三章第三节盐类 水解的 应用21p pt
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
3、净水原理
如:FeCl3、KAl(SO4)2·12H2O等可作净水剂
Al3+ + 3H2O Fe3+ + 3H2O
Al(OH)3 (胶体) + 3H+ Fe(OH)3 (胶体) + 3H+
配制 FeCl3溶液:加少量 稀盐酸 ; 配制 FeCl2溶液:加少量 稀盐酸和Fe粉 配制 FeSO4溶液:加少量 稀硫酸和Fe粉
; 加相应的酸或碱,
; 抑制水解。
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
1、某些盐溶液的配制与保存
判断可水解的盐溶液蒸发后的产物 (1)把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3。为什么?
FeCl3+3H2O
Fe(OH)3+3HCl
△
2Fe(OH)3 === Fe2O3 + 3H2O
判断可水解的盐溶液蒸发后的产物
(2)Al2(SO4)3溶液加热蒸发后得到固体是什么?
Al2(SO4)3+6H2O
Al(OH)3
难 Al2(SO4)3
规 弱碱易挥发性酸盐 律 弱碱难挥发性酸盐
蒸干 蒸干
氢氧化物固体 同溶质固体
判断加热蒸干盐溶液所得固体的成分
溶液蒸干
CuSO4 ·5H2O FeCl3
(NH4)2CO3或NH4HCO3 Ca(HCO3)2 Na2SO3 Na2CO3
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
3、净水原理
如:FeCl3、KAl(SO4)2·12H2O等可作净水剂
Al3+ + 3H2O Fe3+ + 3H2O
Al(OH)3 (胶体) + 3H+ Fe(OH)3 (胶体) + 3H+
配制 FeCl3溶液:加少量 稀盐酸 ; 配制 FeCl2溶液:加少量 稀盐酸和Fe粉 配制 FeSO4溶液:加少量 稀硫酸和Fe粉
; 加相应的酸或碱,
; 抑制水解。
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
人教版化学选修四第三章第三节盐类 水解的 应用21p pt
1、某些盐溶液的配制与保存
判断可水解的盐溶液蒸发后的产物 (1)把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3。为什么?
FeCl3+3H2O
Fe(OH)3+3HCl
△
2Fe(OH)3 === Fe2O3 + 3H2O
判断可水解的盐溶液蒸发后的产物
(2)Al2(SO4)3溶液加热蒸发后得到固体是什么?
Al2(SO4)3+6H2O
Al(OH)3
难 Al2(SO4)3
规 弱碱易挥发性酸盐 律 弱碱难挥发性酸盐
蒸干 蒸干
氢氧化物固体 同溶质固体
判断加热蒸干盐溶液所得固体的成分
溶液蒸干
CuSO4 ·5H2O FeCl3
(NH4)2CO3或NH4HCO3 Ca(HCO3)2 Na2SO3 Na2CO3
《盐类的水解》人教版高中化学选修4课件PPT23页

•
29、在一切能够接受法律支配的人类 的状态 中,哪 里没有 法律, 那里就 没有自 由。— —洛克
•
30、风俗可以造就法律,也可以废除 法律加强。 ——德 谟克利 特 67、今天应做的事没有做,明天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一桩大罪过。——卢梭
《盐类的水解》人教版高中化学选修
•
26、我们像鹰一样,生来就是自由的 ,但是 为了生 存,我 们不得 不为自 己编织 一个笼 子,然 后把自 己关在 里面。 ——博 莱索
•
27、法律如果不讲道理,即使延续时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
盐类的水解课件人教版选修4

当分别加入NaCl、NH4Cl、CH3COONa形成 溶液后,请思考:
(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质,
即生成弱酸或弱碱)?
(4)对水的电离平衡有何影响?
(5)相关的化学方程式?
分析后,填写书 P55 表格
【探究1】 往水中加NaCl形成溶液。
H2CO3 + OH – CO32– + H3O +
> 程度:① 水解 ② 电离 ∴溶液呈 碱 性
⑵ NaHSO3 ① HSO3– + H2O ② HSO3– + H2O
H2SO3 + OH – SO32– + H3O +
< 程度:① 水解 ② 电离 ∴溶液呈 酸 性
⑶ NaH2PO4 溶液呈弱酸性 ⑷ Na2HPO4 溶液呈弱碱性
H+
C+H3COOC–H3COOH
< ⑵ c(H+)和c(OH–)相对
大小
c(H+)
c(OH–)
⑶ 盐溶液的酸碱性
碱性
⑷ 盐溶液中的粒子 ⑸ 有无弱电解质生成
Na+、CH3COO–、OH–、H+、 H2O、CH3COOH
有(促进水的电离)
⑹ 水相解关离化学子方 程式方程式
盐类的水解课件人教版选修4
CH3COONa + H2O
(三)弱碱强酸盐水解 如:NH4Cl、CuSO4、AlCl3
水解的离子方程式:
NH4+ + H2O
NH3·H2O + H+
Cu2+ + 2H2O
人教版高中化学选修四盐类的水解课件PPT(38页)

Al(OH)3+
4.某些盐溶液在混合时,一种盐的阳离子和另 一种盐的阴离子在一起都发生水解,相互促进对 方的水解,水解趋于完全。可用“===”连接反应 物和生成物,水解生成的难溶物或挥发性物质可 加“↓”或“↑”等。 例如:将 Al2(SO4)3 溶液和 NaHCO3 溶液混合, 立即产生白色沉淀和大量气体,离子方程式为: Al3++3HCO- 3 ===Al(OH)3↓+3CO2↑。
变式训练1 常温下,一定浓度的某溶液,由
水电离出的c(OH-)=10-4 mol/L,则该溶液
中的溶质可能是( )
A.Al2(SO4)3 B.CH3COONa
C.NaOH
D.KHSO4
解析:选B。常温下,由纯水电离出的c(H+)
=c(OH-)=10-7mol/L,因为10-4>10-7,
因而该溶液中的溶液能促进水的电离,且使D.②④
解析:选
C。在
NH4Cl
溶液中存在
NH
+
4
+
H2O
NH3·H2O+H+,c(NH+ 4 )∶c(Cl-)<1,
要使 c(NH+ 4 )∶c(Cl-)=1∶1,其方法有:一是增
大 NH+ 4 的浓度(如①),二是使上述平衡向左移动
(如③)。
人教版高中化学选修四盐类的水解课 件PPT(3 8页)
归类:
AD pH>7⇒电离程度:AOH>HD
AD
pH=7⇒电离程度:AOH=HC
BC pH<7⇒电离程度:BOH<HC
BD
pH=7⇒电离程度:BOH=HD
综 上 可 知 , 电 离 程 度 : HC = AOH > HD =
BOH,即酸性:HC>HD,碱性 AOH>BOH。
人教版化学选修四《盐类的水解》课件PPT

人教版化学选修四《盐类的水解》课 件PPT
习
题
1:
向水中加入下列哪些物质,可使水的电 离平衡发生移动?怎样移动?
A、H2SO4 B、FeCl3
向左移动 向右移动
C、NaNO3
不移动
D、K2CO3 E、KOH
向右移动 向左移动
人教版化学选修四《盐类的水解》课 件PPT
人教版化学选修四《盐类的水解》课 件PPT
探究问题3:
从盐的组成以及其溶液的酸碱性分析归 纳,下列问题:
1、结合盐类水解的定义分析盐类水解 的条件、实质是什么?有什么规律?
2、盐类水解反应与中和反应的关系如 何?
人教版化学选修四《盐类的水解》课 件PPT
人教版化学选修四《盐类的水解》课 件PPT
1、盐类水解的条件、实质和规 律是什么?
分组讨论…
习
题
2:
1. 下列溶液PH小于7的是
A、 KBr B、 CuSO4 C、NaF D、Ba(NO3)2
2. 下列溶液能使酚酞指示剂显红色的是
A 、 K2CO3 B、 NaHSO4 C、 Na2S D、 FeCl3
3.下列离子在水溶液中不会发生水解的是
A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
人教版化学选修四《盐类的水解》课 件PPT
化学人教版选修4第三 章第三节《盐类的水解》
公开课精品课件
人教版化学选修四《盐类的水解》课 件PPT
欢迎各位领导、
同仁莅临指导!
第三章 水溶液中的离子平衡
第三节 盐类的水解
第一课时
NaCl溶液
Al2(SO4)3溶液
盐
KNO3溶液
溶
人教版化学选修四盐类的水解[]教学课件
![人教版化学选修四盐类的水解[]教学课件](https://img.taocdn.com/s3/m/fb0ce05a0912a216147929c9.png)
人教版化学选修四盐类的水解
C . Na2CO3溶Biblioteka 液:c(OH
-
)
-
c(H
+
)
=
c(HCO
-
3
)
+
2c(H2CO3) D.25 ℃时,pH=4.75,浓度均为 0.1 mol·L-1 的
CH3COOH、CH3COONa 混合溶液:c(CH3COO-) +c(OH-)<c(CH3COOH)+c(H+)
干并灼烧(<400 ℃)下列物质的溶液,可以得到该
物质的固体的是( )
A.AlCl3 C.MgSO4
B.NaHCO3 D.KMnO4
【思路点拨】
【 解析 】 AlCl3发生水解,AlCl3+3H2O Al(OH)3+3HCl,加热时生成的HCl不断挥发,使 上述平衡向右移动,致使不断生成Al(OH)3沉淀, 最终经灼烧得到Al2O3固体。NaHCO3、KMnO4溶 液蒸干后所得的NaHCO3、KMnO4固体受热分解 得到Na2CO3、K2MnO4、MnO2固体,只有MgSO4 溶液蒸干并灼烧后才能得到MgSO4固体。 【答案】 C
水
解
微
弱
,
c(Na
+
)
与
c(HCO- 3 )数值接近,所以 c(Na+)>c(HCO- 3 )>c(OH-)
【规律方法】 盐溶液蒸干后产物判断的思路 (1)首先分析选项中受热易分解的盐,如 NaHCO3、KMnO4溶液加热蒸干并灼烧时,得 不到该物质的固体,得到的是它们的分解产物。 (2)其次受热难分解的盐,加热其溶液,需分析
盐溶液水解生成的酸,如果是易挥发性酸,如 AlCl3、FeCl3等溶液,最终得到的是金属氧化 物。如果是难挥发性酸,如MgSO4、Fe2(SO4)3 等溶液,最终得到它们的固体溶质。
C . Na2CO3溶Biblioteka 液:c(OH
-
)
-
c(H
+
)
=
c(HCO
-
3
)
+
2c(H2CO3) D.25 ℃时,pH=4.75,浓度均为 0.1 mol·L-1 的
CH3COOH、CH3COONa 混合溶液:c(CH3COO-) +c(OH-)<c(CH3COOH)+c(H+)
干并灼烧(<400 ℃)下列物质的溶液,可以得到该
物质的固体的是( )
A.AlCl3 C.MgSO4
B.NaHCO3 D.KMnO4
【思路点拨】
【 解析 】 AlCl3发生水解,AlCl3+3H2O Al(OH)3+3HCl,加热时生成的HCl不断挥发,使 上述平衡向右移动,致使不断生成Al(OH)3沉淀, 最终经灼烧得到Al2O3固体。NaHCO3、KMnO4溶 液蒸干后所得的NaHCO3、KMnO4固体受热分解 得到Na2CO3、K2MnO4、MnO2固体,只有MgSO4 溶液蒸干并灼烧后才能得到MgSO4固体。 【答案】 C
水
解
微
弱
,
c(Na
+
)
与
c(HCO- 3 )数值接近,所以 c(Na+)>c(HCO- 3 )>c(OH-)
【规律方法】 盐溶液蒸干后产物判断的思路 (1)首先分析选项中受热易分解的盐,如 NaHCO3、KMnO4溶液加热蒸干并灼烧时,得 不到该物质的固体,得到的是它们的分解产物。 (2)其次受热难分解的盐,加热其溶液,需分析
盐溶液水解生成的酸,如果是易挥发性酸,如 AlCl3、FeCl3等溶液,最终得到的是金属氧化 物。如果是难挥发性酸,如MgSO4、Fe2(SO4)3 等溶液,最终得到它们的固体溶质。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A.a=b=c
B.c>a>b B
C.b>a>c
D.a>c>b
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
1.多元弱酸盐和多元弱酸溶液
CH3COONa溶液:
CH3COO-+ H2O
CH3COOH + OH-
[Na +] >[CHCOO -] >[OH -] >[H +]
热水:升温能够促进水解
配制CuCl2溶液,为防止出现浑浊,应加少量的_______
稀盐酸
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
Na 2S溶液 S2-+H2O
HS-+OH-
HS-+H2O OH- + H 2S
[Na +] > [S2- ] >[OH -] > [HS- ] >[H +]
H 2S: H 2S H + + HS- HS-
H + + S2-
[H +] > [HS- ] > [S2- ] >[OH -]
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
(二)比较盐溶液中各离子浓度的相对大小
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、 (NH4)2Fe(SO4)2三种溶液中,若测得其中c(NH4+)分别为a、b、 c(单位为moI/L),则下列判断正确的是( )
(四)解释某些实验现象及在生产、生活中的应用
1.配制易水解的盐溶液时,需考虑抑制盐的水解,如在 配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑 制盐的水解。
思考:热水配制CuCl2溶液, 会出现什么现象?
现象:溶液浑浊
原因:
CuCl2+2H2O
或Cu2++2H2O
Cu(OH)2+2HCl-Q Cu(OH)2+2H+ -Q
S2-+H2O
HS-+OH-
HS-+H2O OH- + H 2S
[Na+]=2[S2- ]+ 2[ HS-]+2[H2S]
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
Na2CO3 [Na+] = 2[CO3- ] +2[HCO3- ] +2 [H2CO3 ]
NaCI~ NH4Cl [Cl-]=[NaCl]+[NH4Cl]= [Na+] +[NH4+ ]+ [NH3·H2O]
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
NaHCO3: HCO3- +H20
H2CO3+ OH-
[Na+] >[HCO3- ] > [OH-] > [H+]
H3PO4: H3PO4
H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42-
H+ + PO43-
[H+] >[H2PO4- ] >[HPO42- ] >[PO43- ] > [OH-]
Na3PO4:: [OH - ]= [HPO42- ]+ 2[H2PO4- ]
+3[H3PO4 ] +[H+]
(三)判断溶液中离子能否大量共存。
如:Al3+、 Fe3+与HCO3-、CO32-、SiO32-等,不能在 溶液中大量共存。
Al2S3、CaC2、Mg3N2、 在水溶液中发生双水 解,只能用干法制取。
4.电荷守恒(原子守恒)
Na 2S溶液:[Na +] + [H +]=2[S2- ] +[OH -] +[HS- ]
NaHCO3:[Na+] + [H+]=[HCO3- ] + 2[CO32- ]+[OH-]
NH4Cl: [NH4+ ]+ [H+]= [OH-] + [Cl-]
5.水电离的H +和OH -守恒 Na 2S溶液:[OH - ]= [HS- ] +2[H 2S]+ [H + ] Na2CO3 [OH - ]= [HCO3- ] + 2 [H2CO3 ]+[H + ]
有弱才水解,越弱越水解 谁弱谁水解,谁强显谁性 都强不水解, 溶液显中性。
盐类水解的应用
思考判断下列水溶液的酸碱性 (1)NaHCO3 (2)KCl (3)Cu(NO3)2 (4)KClO (5)NaF
(一)判断盐溶液的酸碱性,比较盐溶液酸碱性的强弱
如:相同条件,相同物质的量浓度的下列八种溶液: Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、NaOH 、 (NH4)2SO4、NaHSO4等溶液,PH值由大到小的顺序为:
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
判断下列盐溶液的酸碱性 A:Na2HPO4 B: KHSO4 C: KH2PO4 D :NaHCO3 E: NaHS F:NaHSO4 显酸性的有:B C F 显碱性的有: A D E
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
NaOH>NaClO>Na2CO3>NaHCO3>NaAc >Naபைடு நூலகம்SO4>(NH4)2SO4>NaHSO4
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
1)弱酸根离子对应的弱酸越弱,水解程度越大, 碱性越强。 常见的弱酸比较:
H2SO3 > H3PO4 >HF >HCOOH > CH3COOH > H2CO3 > H2S > HCIO > HCN 2)弱碱离子对应的弱碱越弱,水解程度越大, 酸性越强。 3)酸式盐溶液酸碱性比较: 电离﹥水解: HSO3- 、 H2PO4- 、 HC2O4水解﹥电离:HCO3- 、 HPO42- 、 HS-
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
2.混合液:
NH4Cl~ NH3·H2O(1:1)
[NH4 +] >[CI -] >[OH -] >[H +]
HAC~NaAC(1:1)
3.物料守恒(原子守恒)
Na 2S溶液: Na2S = 2 Na+ + S2-
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
第三课时 盐类水解的应用
盐类的水解盐类水解的应用课件人教 版高中 化学选 修四
1、影响盐类水解的因素有哪些? 2、盐类水解的规律? 3、写出下列物质水解反应的离子方程式?
CH3COONa、NH4Cl、Na2CO3、AlCl3
