化学苏教版选修四试题:专题1 第一单元 化学反应中的热效应 第3课时课后达标检测 Word版含答案
高二化学 专题一 第一单元 化学反应中的热效应同步练习 苏教版选修4

高二化学专题一第一单元化学反应中的热效应同步练习苏教版选修4(答题时间:60分钟)一、选择题1. 下列说法中正确的是()A. 需要加热方能发生的反应一定是吸热反应B. 放热的反应在常温下一定很容易发生C. 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小D. 吸热反应在一定的条件下也能发生2. 有关氢能的利用,下列说法不正确的是()A. 氢能是最理想的洁净能源B. 应用氢能的一个首要问题是如何解决从水制氢的能耗C. 像液化气一样,可用钢瓶来贮存、运输氢气D. 解决从水制氢的能耗问题的一个方法是找出分解水的优良催化剂3. 2004年4月22日是第25个“世界地球日”,我国确定的主题是“善待地球——科学发展”。
下列行为中不符合这一主题的是()A. 大量开采地下水,以满足社会对水的需求B. 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质C.减少甚至不使用对大气臭氧层起破坏作用的氟氯烃D. 节约能源,提高能源的利用率4. 石墨和金刚石都是碳元素的单质,石墨在一定条件下可转化为金刚石。
已知12g石墨完全转化成金刚石时,要吸收E kJ的能量,下列说法不正确的是()A. 石墨不如金刚石稳定B. 金刚石不如石墨稳定C. 等质量的石墨和金刚石完全燃烧,金刚石放出的能量多D. 等质量的石墨和金刚石完全燃烧,石墨放出的能量多5. 在一定条件下,CO和CH4燃烧的热化学方程式分别为:()2CO(气)+ O2(气)= 2CO2(气);△H=-566kJ/molCH4(气)+ 2O2(气)= CO2(气)+ 2H2O(液);△H=-890kJ/mol现有1mol CO和3mol CH4组成的混合气,在上述条件下完全燃烧时,释放的热量为:A. 2912kJB. 2953kJC. 3236kJD. 3867kJ6. 1gH2在O2中燃烧生成液态水放出142.9kJ的热,则下列热化学方程式能表示氢气的标准燃烧热的是:()A. 2H2(气)+ O2(气)=== 2H2O(液);△H=-142.9kJ/molB. 2H2(气)+ O2(气)=== 2H2O(液);△H=-571.6kJ/molC. H 2(气) + 21O 2(气)=== H 2O (气);△H=-285.8kJ/molD. H 2(气) +21O 2(气)=== H 2O (液);△H=-285.8kJ/mol7. 在相同温度下,两个反应放出的热量分别用Q 1和Q 2表示, H 2(g )+O 2(g )== H 2O (g );ΔH =-Q1 kJ·mol -1; 2H 2(g )+21O 2(g )== 2H 2O (l );ΔH =-Q2 kJ·mol -1,则下列关系正确的是( ) A. Q 1>Q 2 B. Q 1=Q 2C. 2Q 1<Q 2D. Q 1=Q 28. 实验室用4 mol SO 2与2 mol O 2进行下列反应:2 SO 2(g )+ O 2(g )== 2 SO 3(g ) △H=-196.64 kJ/mol 当放出314.624 kJ 热量时,SO 2的转化率为: ( ) A. 40%B. 50%C. 80%D. 90%9. 已知充分燃烧a g 乙炔气体时生成1mol 二氧化碳气体和液态水,并放出热量bkJ ,则乙炔燃烧的热化学方程式正确的是( )A. 2C 2H 2(g )+ 5O 2(g )= 4CO 2(g )+ 2H 2O (l ) △H=-4b kJ/molB. C 2H 2(g )+ 5/2O 2(g )= 2CO 2(g )+ H 2O (l ) △H=+2b kJ/molC. 2C 2H 2(g )+ 5O 2(g )= 4CO 2(g )+ 2H 2O (l ) △H=-2b kJ/molD. 2C 2H 2(g )+ 5O 2(g )= 4CO 2(g )+ 2H 2O (l ) △H=+b kJ/mol10. 已知:H 2(g )+F 2(g ) = 2HF (g ),△H= -270kJ/mol ,下列说法正确的是( ) A. 2L 氟化氢气体分解成1L 的氢气和1L 的氟气吸收270kJ 热量B. 1mol 氢气与1mol 氟气反应生成2mol 液态氟化氢放出的热量小于270kJC. 在相同条件下,1mol 氢气与1mol 氟气的能量总和大于2mol 氟化氢气体的能量D. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ *11. 下列关于热化学反应的描述中正确的是( )A. HCl 和NaOH 反应的中和热△H =-57.3kJ/mol ,则H 2SO 4和Ca (OH )2反应的中和热 △H =2×(-57.3)kJ/molB. CO (g )的燃烧热是283.0kJ/mol ,则2CO 2(g )===2CO (g )+O 2(g )反应的△H =+ 2×283.0kJ/molC. 需要加热才能发生的反应一定是吸热反应D. 1mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 12. 已知强酸与强碱在稀溶液里反应的中和热可表示为: H +(aq )+OH -(aq )=H 2O (1);ΔH =-57.3kJ/molCH 3COOH (aq )+NaOH (aq )= CH 3COONa (aq )+ H 2O (1); ΔH=-Q 1 kJ/mol 1/2 H 2SO 4(浓) +NaOH (aq )=1/2Na 2SO 4(aq )+ H 2O (1); ΔH=-Q 2kJ/mol HNO 3(aq )+ NaOH (aq )= NaNO 3(aq )+ H 2O (1);ΔH=-Q 3J/mol 上述反应均在溶液中进行,Q 1、Q 2和Q 3的关系正确的是A. Q1= Q2= Q3B. Q2> Q1> Q3C. Q2> Q3.> Q1D. Q2= Q3 > Q1*13. 已知:CH3CH2CH2CH3(g)+6.5O2(g)4CO2(g)+5H2O(l);∆H =-2878 kJ/mol (CH3)2CHCH3(g)+6.5O2(g)4CO2(g)+5H2O(l);∆H =-2869 kJ/mol 下列说法正确的是()A. 正丁烷分子储存的能量大于异丁烷分子B. 正丁烷的稳定性大于异丁烷C. 异丁烷转化为正丁烷的过程是一个放热过程D. 异丁烷分子中的碳氢键比正丁烷的多14. 已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量下列叙述正确的是()A. 氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)= 2HCl(g)B. 氢气和氯气反应生成2 mol氯化氢气体,反应的∆H = 183 kJ/molC. 氢气和氯气反应生成2 mol氯化氢气体,反应的∆H =-183 kJ/molD. 氢气和氯气反应生成1 mol氯化氢气体,反应的∆H =-183 kJ/mol15. 氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。
苏教版高中化学选修四第一单元 化学反应中的热效应.docx

高中化学学习材料第一单元化学反应中的热效应2014.9一、选择题(每小题只有一个选项符合题意。
)1.能源可划分为一级能源和二级能源。
自然界中以现成形式提供的能源称为一级能源;需依靠其它能源的能量间接制取的能源称为二级能源。
下列叙述正确的是()A.电能是二级能源B.水力是二级能源C.天然气是二级能源 D.水煤气是一级能源1. 下列说法错误的是()A.需要加热方能发生的反应一定是吸热反应B.放热的反应在常温下不一定容易发生C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小D.吸热反应在一定的条件下也能发生2.下列反应属于吸热反应的是 ( )酶A. C6H12O6(葡萄糖aq)+ 6O 2 6CO2+6H2OB. CH3COOH+KOH CH3COOK+H2OC. A+B C+D;△H<0D.破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量3.已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ•mol-1,H—N键键能为391kJ•mol-1,根据热化学方程式:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ•mol-1。
则N≡N键的键能是 ( ) A.431 kJ•mol-1B.946 kJ•mol-1 C.649 kJ•mol-1D.896 kJ •mol-14.已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是 ( ) A.1∶1 B.1∶3C.1∶4 D.2∶35.在同温同压下,下列各组热化学方程式中,△H2>△H 1的是() A.2H2(g)+O2(g)=2H2O(g),△H 1;2H2(g)+O2(g)=2H2O(l),△H2B.S(g)+O2(g)=SO2(g),△H 1;S(s)+O2(g)=SO2(g),△H2C.C(s)+1/2O2(g)=CO(g),△H 1;C(s)+O2(g)=CO2(g),△H2D.1/2H2(g)+1/2Cl2(g)=HCl(g),△H 1 ;H2(g)+Cl2(g)=2HCl(g),△H26.已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ·mol-1B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2b kJ·mol-1C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4b kJ·mol-1D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=b kJ·mol-17.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨) + O2(g)=CO2(g);△H=-393.51kJ ·mol-1C(金刚石) + O2(g)= CO2(g);△H=-395.41kJ ·mol-1据此判断,下列说法中正确的是()A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高8.已知(1)H2(g)+1/2O2(g)=H2O(g),∆H1=akJ·mol-1 (2)2H2(g)+O2(g)=2H2O(g),∆H2=b kJ·mol-1 (3)H2(g)+1/2O2(g)=H2O(l),∆H3=c kJ·mol-1 (4)2H2(g)+O2(g)=2H2O(l),∆H4=d kJ·mol-1 下列关系式中正确的是() A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>09.(能力提高题)化学反应可视为旧键断裂和新键形成的过程。
第一单元化学反应中的热效应测试题_试题_试卷_选修4_苏教版

第一单元 化学反应中的热效应1.下列说法错误的是 ( )A .需要加热方能发生的反应一定是吸热反应B .放热的反应在常温下一定很容易发生C .反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小D .吸热反应在一定的条件下也能发生2.下列叙述中正确的是 ( )A.在稀溶液中1mol 酸和1mol 碱完全反应所放出的热量,叫做中和热B.在101kPa 时1mol 物质燃烧时的反应热叫做该物质的标准燃烧热C.热化学方程式中,各物质前的化学计量数不表示分子个数D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应。
3.下列反应属于吸热反应的是 ( )A. C 6H 12O 6(葡萄糖aq)+6O 2 6CO 2+6H 2OB. CH 3COOH+KOH CH 3COOK+H 2OC. A+B C+D ; △H<0D .破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量4.相同质量的氢气、一氧化碳、乙醇、甲烷完全燃烧时,放出热量最少的是(已知这些物质的标准燃烧热分别为-285.8 kJ·mol -1、-283.0 kJ·mol -1、-1366.8kJ·mol -1、-890.3 kJ·mol -1) ( )A. H 2(g)B. CO(g)C. C 2H 5OH(l)D. CH 4(g)5.在一定条件下,CO 和CH 4燃烧的热化学方程式分别为:2CO(g)+O 2(g)=2CO 2(g), △H= -566kJ·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l), △H= -890kJ·mol -1由1 mol CO 和3 mol CH 4组成的混和气在上述条件下完全燃烧时,释放的热量为 ( )A .2912 kJB .2953 kJC .3236 kJD .3867 kJ6.在同温同压下,下列各组热化学方程式中,△H 2>△H 1的是 ( )A .2H 2(g)+O 2(g)=2H 2O(g), △H 1;2H 2(g)+O 2(g)=2H 2O(l), △H 2B .S(g)+O 2(g)=SO 2(g), △H 1;S(s)+O 2(g)=SO 2(g), △H 2C .C(s)+21O 2(g)=CO(g), △H 1;C(s)+O 2(g)=CO 2(g), △H 2 D .H 2(g)+Cl 2(g)=2HCl(g), △H 1;21H 2(g)+21Cl 2(g)=HCl(g),△H 2 酶7.已知充分燃烧a g 乙炔气体时生成1mol 二氧化碳气体和液态水,并放出热量b kJ ,则乙炔燃烧的热化学方程式正确的是 ( )A. 2C 2H 2(g)+5O 2(g)=4CO 2(g)+2H 2O(l); ΔH =-2b kJ·mol -1B. C 2H 2(g)+5/2O 2(g)=2CO 2(g)+H 2O(l); ΔH =2b kJ·mol -1C. 2C 2H 2(g)+5O 2(g)=4CO 2(g)+2H 2O(l); ΔH =-4b kJ·mol -1D. 2C 2H 2(g)+5O 2(g)=4CO 2(g)+2H 2O(l); ΔH =b kJ·mol -18.分析右面的能量变化示意图,下列热化学方程式正确的是 A.2A (g )+ B(g)=2C (g );△H=a (a >0) B.2A (g )+ B(g)=2C (g );△H=a (a <0) C.2A + B=2 C ;△H=a (a <0) D.2C=2A +B ;△H=a (a >0) 9.已知25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式分别为: C(石墨) + O 2(g)=CO 2(g);△H=-393.51kJ ·mol-1C(金刚石) + O 2(g)= CO 2(g);△H=-395.41kJ ·mol-1据此判断,下列说法中正确的是 ( )A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高10. 天然气和液化石油气(主要成分为C 3~C 5的烷烃)燃烧的化学方程式分别为:CH 4+ 2O 2 CO 2+ 2H 2O ,C 3H 8+ 5O 2 CO 2+4H 2O现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是( )A.增大空气进入量或减小石油气进入量B.增大空气进入量或增大石油气进入量C.减小空气进入量或减小石油气进入量D.减小空气进入量或增大石油气进入量11.已知胆矾溶于水时溶液温度降低,室温下将1mol 无水硫酸铜制成溶液时放出热量为Q 1kJ,又知胆矾分解的热化学方程式为CuSO 4•5H 2O(s) CuSO 4(s)+5H 2O(l);△H=+Q 2kJ·mol -1则Q 1、Q 2的关系为 ( )A.Q 1<Q 2B.Q 1>Q 2C.Q 1=Q 2D.无法确定12.强酸和强碱在稀溶液中的中和热可表示为:H +(aq)+OH -(aq)=H 2O(l); △H= -57.3k kJ·mol -1,又知在溶液中反应有:CH 3COOH(aq)+NaOH(aq)=CH 3COONa(aq)+H 2O(l); △H=-Q 1kJ·mol -1,1H 2SO 4(浓)+NaOH(aq)=1Na 2SO 4(aq)+H 2O(l) ; △H= -Q 2kJ·mol -1 HNO 3(aq)+KOH(aq)KNO 3(aq )+H 2O(l) ; △H= -Q 3 kJ·mol -1,则Q 1、Q 2、Q 3的关系正确的是 ( )A. Q 1 = Q 2 = Q 3B.Q 2 > Q 1 > Q 3C. Q 2 > Q 3 > Q 1D. Q 2 = Q 3 > Q 1高低物质所具有2 A (g) + B(g) 2 C (g) 点燃 点燃13.已知(1) H 2(g )+21O 2(g )=H 2O (g ) ; ∆H 1=akJ·mol -1(2) 2H 2(g )+O 2(g )=2H 2O (g ) ; ∆H 2=b kJ·mol -1(3) H 2(g )+21O 2(g )=H 2O (l ) ; ∆H 3=c kJ·mol -1(4) 2H 2(g )+O 2(g )=2H 2O (l ) ; ∆H 4=d kJ·mol -1下列关系式中正确的是 ( )A . a <c <0B . b >d >0C . 2a =b <0D . 2c =d >014.化学反应可视为旧键断裂和新键形成的过程。
高中化学苏教选修四同步练习:专题第节化学反应中的热效应 含答案

专题一第1节 化学反应中的热效应(1)1、21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是( )A.电力B.核能C.太阳能D.氢能2、下列反应既属于氧化还原反应,又属于吸热反应的是( ) A.铝片与稀盐酸的反应B.Ba(OH)2·8H 2O 与NH 4Cl 的反应C.灼热的碳与CO 2的反应D.甲烷在氧气中的燃烧反应 3、下列说法正确的是( )①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下均很容易发生③判断反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 ④吸热反应也可能在常温下进行A.①②③④B.①②C.③④D.②③4、已知:HCN(aq)与NaOH(aq)反应的-112.1kJ mol H ∆=-⋅;HCl(aq)与NaOH(aq)反应的-155.6kJ mol H ∆=-⋅,则HCN 在水溶液中电离的ΔH 等于( )A.-67.7kJ/molB.-43.5kJ/molC.+43.5kJ/molD.+67.7kJ/mol 5、S(单斜)和S(正交)是硫的两种同素异形体。
已知: ①S(单斜,s)()2+O g =()2SO g 1297.16kJ/mol H ∆=- ②S(正交,s)()2+O g =()2SO g 2296.83kJ/mol H ∆=- ③S(单斜,s)=S(正交,s) 3H ∆ 下列说法正确的是( ) A.30.33kJ/mol H ∆=B.单斜硫转化为正交硫的反应是吸热反应C.S(单斜,s)=S(正交,s)30H ∆<,正交硫比单斜硫稳定D.S(单斜,s)=S(正交,s)30H ∆>,单斜硫比正交硫稳定6、室温下,将1mol 的()42CuSO 5H O s ⋅溶于水会使溶液温度降低,热效应为1H ∆,将1mol 的()4CuSO s 溶于水会使溶液温度升高,热效应为2H ∆;42CuSO 5H O ⋅受热分解的化学方程式为()42CuSO 5H O s ⋅()()42CuSO s +5H O l ,热效应为3H ∆。
2018-2019学年苏教版选修4 专题1第一单元 化学反应中的热效应 作业

第一单元化学反应中的热效应一、选择题1.化学反应中通常伴随着能量变化,下列说法中错误的是(B)A.煤燃烧时将部分化学能转化为热能B.电解水时将部分化学能转化为电能C.黑火药爆炸时将部分化学能转化为动能D.镁条燃烧时将部分化学能转化为光能2.下列反应既属于氧化还原反应,又是吸热反应的是(C)A.铝片与稀盐酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应C.灼热的炭与CO2的反应D.甲烷在氧气中的燃烧反应3.下列说法不正确的是(D)A.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能B.光—热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式C.氢气之所以被称为“绿色能源”是因为它燃烧的产物不会污染环境D.人类利用的能源都是通过化学反应获得的4.已知化学反应A2(g)+B2(g)2AB(g)的能量变化如图所示,判断下列叙述中正确的是(B)A.每生成2分子AB吸收b kJ热量B.该反应热ΔH=+(a-b)kJ/molC.加入催化剂,该化学反应的反应热变大D.断裂1mol A—A和1mol B—B键,放出a kJ能量5.下列热化学方程式书写正确的是(B)A.C(s)+O2(g)CO2(g)ΔH=393.5kJ/molB.H2(g)+O2(g)H2O(l)ΔH=-285.8kJ/molC.2SO2+O22SO3ΔH=-196.6kJ/molD.2H2(g)+O2(g)2H2O(l)ΔH=-571.6kJ6.反应Br+H2HBr+H的能量与反应历程的关系如图,则下列叙述中正确的是(C)A.正反应为放热反应B.加入催化剂,该化学反应的反应热变大C.反应物总能量低于生成物总能量D.升高温度可增大正反应速率,降低逆反应速率7.关于化学反应中的热效应,下列说法不正确的是(D)A.图Ⅰ表示:反应物的总能量高于生成物的总能量,则反应放热,ΔH<0B.图Ⅱ表示:反应物的总能量低于生成物的总能量,则反应吸热,ΔH>0C.H2与O2化合生成液态水的能量变化过程可用图Ⅰ来表示D.符合图Ⅱ所示能量变化的化学反应,必须要加热才能发生8.已知断裂1mol H2(g)中的H—H键需要吸收436.4kJ的能量,断裂1mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1molH—O键能放出462.8kJ的能量。
高中化学 专题一第一单元 化学反应中的热效应练习 苏教版选修4

《化学反应中的热效应》一、选择题1. 今有如下三个热化学方程式:H2(g)+1/2O2(g)=H2O(g);ΔH=aKJ·mol-1,H2(g)+1/2O2(g)=H2O(l);ΔH== bkJ·mol-1,2H2(g)+O2(g)=2H2O(l);ΔH== c kJ·mol-1,关于它们的下列表述正确的是A.它们都是吸热反应 B.a、b和c均为正值C.a== b D.2b== c2. 在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(g) + O2(g) = 2CO2(g);△H =-566kJ CH4(g) + 2O2(g) = CO2(g) + 2H2O(l);△H =-890kJ由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为A.2912kJ B.2953kJ C.3236kJD.3867kJ3. 关于热化学方程式:2H2(g)+02(g)=2H20(1), H=-571.6 kJ·mol-1,下列有关叙述不正确的是A.2mol H2完全燃烧生成液态水时放出571.6 kJ的热B.1mol H2完全燃烧生成液态水时放出285.8kJ的热C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热D.上述热化学方程式可表示为H2(g)+ O2(g)=H20(1), H=-285.8 kJ·mol-14. 同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是A.2A ( l ) + B ( l ) = 2C (g ) △H1B.2A ( g ) + B ( g ) = 2C (g ) △H2C.2A ( g ) + B ( g ) = 2C ( l ) △H3D.2A ( l ) + B ( l ) = 2C ( l ) △H45. 下列有关热化学方程式的叙述正确的是A. 已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJB. 已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定C. 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+1/2H2SO4(aq)= 1/2Na2SO4(aq)+H2O(l);△H=-57.4kJ/molD. 己知C(s)+ O2(g)= CO2(g);△H1 C(s)+1/2 O2(g)= CO(g);△H2则△H1>△H26. 下列属于热化学方程式的是 A .C + O 2 C O 2B .H 2 + CuOH 2O + Cu -QC .H 2(气) + Cl 2(气) === 2HCl + QD .C(固) + O 2(气) === CO 2(气) + 393.5kJ7. 已知一定条件下,CO(g) + H 2O (g) = CO 2(g) + H 2(g)反应过程能量变化如图所示,下列有关该反应的说法正确的是A. 该反应为吸热反应B. CO (g )与H 2O (g )所具有的总能量大于CO 2(g )与H 2(g )所具有的总能量C. 反应的热化学方程式是:CO(g) + H 2O (g) = CO 2(g) + H 2(g);△H=+41kJ/molD. 1mol CO 2(g)和1mol H 2(g)反应生成1molCO(g) 和1mol H 2O(g)要放出41kJ 热量 8. 下列反应属于吸热反应的是A.稀硫酸与氢氧化钾溶液反应B.氢气还原氧化铜的反应C.锌与稀硫酸的反应D.生石灰变成熟石灰的反应9. 科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的,已知在25℃、1.0×105Pa 时,1molC (石墨)完全燃烧生成CO 2气体,放热393.5KJ ,1molCO 完全燃烧生成CO 2气体,放热283.0KJ ,下列说法正确的是A.在25℃.1.0×105Pa 时,1molC (石墨)不完全燃烧,生成CO 气体的热化学方程式是2 C (石墨)(s)+O 2(g)==2CO(g); △H=-110.5kJB.1molC (石墨)不完全燃烧,生成CO 与CO 2混合气体时,放热283.3KJC.C (石墨)与CO 2(g)反应生成 CO(g)的反应是吸热反应能量反应物 生成物△H =—41kJ/mol反应物的总能量生成物的总能量D.如果金刚石燃烧生成CO 2的反应放热大于石墨燃烧生成 CO 2放出的热,则可以断定从石墨转变为金刚石的变化需要放热 10.下列说法正确的是A. 若反应X + Y = M 是放热反应,该反应一定不用加热。
2017-2018学年苏教版选修4 专题1第一单元 化学反应中的热效应(第3课时) 作业

第一单元 化学反应中的热效应第3课时 能源的充分利用1.下列说法不正确的是A .化石燃料在任何条件下都能充分燃烧B .化石燃料在燃烧过程中能产生污染环境的CO 、SO 2等有害气体C .直接燃烧煤不如将煤进行深加工后再燃烧的效果好D .固体煤变为气体燃料后,燃烧效率将提高2.下列有关能量转换的说法不正确的是A .煤燃烧是化学能转化为热能的过程B .化石燃料和植物燃料燃烧时放出的能量均来源于太阳能C .动物体内葡萄糖被氧化成CO 2是化学能转变成热能的过程D .植物通过光合作用将CO 2转化为葡萄糖是太阳能转变成热能的过程3. 25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是-393.5 kJ·mol -1、-285.8 kJ·mol -1、 -890.3 kJ·mol -1、-2800 kJ·mol -1,则下列热化学方程式正确的是 A .C(s)+21O 2(g)=CO(g);△H =-393.5 kJ·mol -1 B .2H 2(g)+O 2(g)=2H 2O(g);△H =+571.6 kJ·mol -1 C .CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(g);△H =-890.3 kJ·mol -1 D .21C 6H 12O 6(s )+3O 2(g)=3CO 2(g)+3H 2O(l);△H =-1 400 kJ·mol -1 4.下列关于2C 4H 10(g)+13O 2(g)===8CO 2(g)+10H 2O(l) ΔH =-5 800 kJ·mol -1 的叙述中错误的是A .该反应的反应热为ΔH =-5 800 kJ·mol -1,是放热反应 B .该反应的ΔH 与各物质的状态有关,与化学计量数也有关C .该式的含义为25 ℃、101 kPa 下,2 mol C 4H 10气体完全燃烧生成CO 2和液态水时放出热量5800 kJD .该反应为丁烷燃烧的热化学方程式,由此可知丁烷的标准燃烧热为- 5 800 kJ·mol -15.下列有关热化学方程式的书写及对应的表达均正确的是A .密闭容器中,9.6 g 硫粉与11.2 g 铁粉混合加热生成17.6 g 硫化亚铁时,放出19.12 kJ热量,则Fe(s)+S(s) =FeS(s) ΔH =-95.6 kJ·mol -1 B .稀醋酸与0.1 mol·L -1 NaOH 溶液反应:H +(aq)+OH -(aq) = H 2O(l) ΔH =-57.3 kJ·mol -1 C .已知1 mol 氢气完全燃烧生成液态水所放出的热量为285.5 kJ ,则水分解的热化学方程式为2H 2O(l)=2H 2(g)+O 2(g) ΔH =+285.5 kJ·mol -1 D .已知2C(s)+O 2(g)=2CO(g) ΔH =-221 kJ·mol -1,则可知C 的标准燃烧热ΔH =-110.5 kJ·mol -1 6.氢气(H 2)、一氧化碳(CO )、辛烷(C 8H 18)、甲烷(CH 4)的热化学方程式分别为:H 2(g) + 21O 2(g) = H 2O(l);△H =-285.8 kJ·mol -1 CO(g) + 21O 2(g) = CO 2(g);△H =-283.0 kJ·mol -1 C 8H 18(l) + 225O 2(g) = 8CO 2(g) + 9 H 2O(l);△H =-5518 kJ·mol -1 CH 4(g) + 2 O 2(g) = CO 2(g) + 2 H 2O(l);△H =-890.3 kJ·mol -1 相同质量的H 2、CO 、C 8H 18、CH 4完全燃烧时,放出热量最少的是A .H 2(g)B .CO(g)C .C 8H 18(l)D .CH 4(g)7.下列说法中正确的是A .物质燃烧放出的热量是标准燃烧热B .1 molC 燃烧生成CO 时放出的热量就是C 的标准燃烧热C .1 mol H 2燃烧生成水蒸气时放出的热量是H 2的标准燃烧热D .相同条件下,1 mol H 2O(l)完全分解吸收的热量与H 2、O 2化合生成1 mol H 2O(l)放出的热量值相等8.已知:2CO(g)+O 2(g)===2CO 2(g) ΔH =-566 kJ·mol -1Na 2O 2(s)+CO 2(g)===Na 2CO 3(s)+21O 2(g) ΔH =-226 kJ·mol -1 根据以上热化学方程式判断,下列说法正确的是A .CO 的标准燃烧热为- 283 kJB .右图可表示由CO 生成CO 2的反应过程和能量关系C .2Na 2O 2(s)+2CO 2(s)===2Na 2CO 3(s)+O 2(g) ΔH >-452 kJ·mol -1 D .CO(g)与Na 2O 2(s)反应放出509 kJ 热量时,电子转移数为6.02×10239.(1)已知酒精的热值为29.7 kJ·g -1,写出酒精在空气中完全燃烧的热化学方程式: 。
苏教版化学选修4 专题1 第一单元 化学反应中的热效应3 盖斯定律(学案)

苏教版化学选修4 专题1 第一单元化学反应中的热效应3 盖斯定律(学案)①由A直接变为生成物E,反应热为ΔH②由A经过B变成E,反应热分别为ΔH1、ΔH2③由A经过C变成D,再由D变成E,反应热分别为ΔH3、ΔH4、ΔH5则有ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。
(2)方程式加合法即运用所给热化学方程式通过加、减的方法得到所求热化学方程式。
【典例精析】例题1 物质A在一定条件下可发生一系列转化,由图判断下列关系错误..的是A. A→F,ΔH=-ΔH6B. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1C. C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|D. |ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|思路导航:盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。
从反应图像来看,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6表示从A又回到A,整个过程中没有能量变化,所以ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,B项错误,答案选B。
答案:B1O2(g)=例题2 对于反应:C(s)+2CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们根据盖斯定律设计一个方案求算反应的ΔH。
思路导航:我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热:C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol1O2(g)=CO2(g)ΔH=CO(g)+2-283.0 kJ/mol根据盖斯定律,可以很容易求算出C(s)1O2(g)=CO(g)的ΔH。
+2答案:∵ΔH1=ΔH2+ΔH3∴ΔH2=ΔH1-ΔH3=-393.5kJ/mol-(-283.0kJ/mol)=-110.5 kJ/mol1O2(g)=CO(g)的ΔH=即:C(s)+2-110.5 kJ/mol例题3 已知热化学方程式:2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ·mol-1和2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol -1,当1g液态水变为气态水时,其热量变化为:__________。
高中化学 专题一第一单元 化学反应中的热效应教案 苏教版选修4
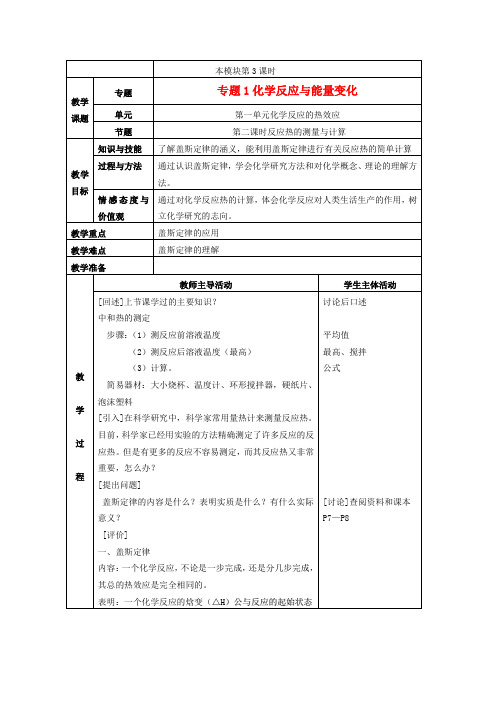
盖斯定律的内容是什么?表明实质是什么?有什么实际意义?
[评价]
一、盖斯定律
内容:一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。
表明:一个化学反应的焓变(△H)公与反应的起始状态
讨论后口述
平均值
最高、搅拌
公式
[讨论]查阅资料和课本
P7—P8
教
学
过
程
教师主导活动
学生主体活动
两式减得
C(石墨) == C(金刚石)ΔH= +1.7 kJ/mol
(4)C(石墨)稳定,能量低。
整理,记笔记。
有两种做法
从能量上看两种物质转化较为容易,但实际远不是这样的,所以化学反应还要考虑其它方面。
[练习]:
1、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g)△H=+67.2kJ/mol
(2)18克C(石墨)粉在氧气燃烧后生成CO(g)为0.5 mol
CO(g)+ O2(g) == CO2(g)ΔH=-283.0 kJ/mol
0.5 mol 141.5kJ
(3)
C(石墨) + O2(g) == CO2(g)ΔH=-393.51 kJ/mol
C(金刚石) + O2(气) == CO2(气)ΔH=-395.41 kJ/mol
教学重点
盖斯定律的应用
教学难点
盖斯定律的理解
教学准备
教
学
过
程
教师主导活动
学生主体活动
[回述]上节课学过的主要知识?
中和热的测定
步骤:(1)测反应前溶液温度
高二化学苏教版选修4成长训练:专题1第一单元化学反应中的热效应含解析

主动成长夯基达标1.下列变化,属于吸热过程的是( )A。
浓H2SO4溶于水 B.甲烷燃烧C.CaO与水反应D.Ba(OH)2晶体与NH4Cl 反应解析:变化既包括物理变化过程,又包括化学变化过程.答案:D规律总结:积累常见吸、放热物理过程,熟记常见吸、放热化学反应类型.2.下列说法不正确的是()A.物质发生化学反应的反应热仅指反应放出的热量B。
热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数C。
所有的燃烧都是放热反应D.热化学方程式中分子式前面的化学计量数可以是分数解析:反应热指化学反应过程中,所吸收或放出的热量,不仅仅指放出的热量。
答案:A3。
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和液态H2O时,放出445 kJ的热量,则下列热化学方程式正确的是()A。
2CH4(g)+4O2(g)====2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1 B。
CH4(g)+2O2(g)====CO2(g)+2H2O(l)ΔH=+890 kJ·mol-1C 。
CH 4(g )+2O 2(g ) ====CO 2(g )+2H 2O(l ) ΔH=—890 kJ·mol -1 D.21CH 4(g)+2O 2(g )====21CO 2(g)+2H 2O(l ) ΔH=—890 kJ·mol —1 解析:0。
5 mol CH 4完全燃烧生成二氧化碳和液态水时,放出445 kJ 热量,即1 mol CH 4完全燃烧生成二氧化碳和液态水时,放出890 kJ 热量,根据热化学方程式的有关规定,要注明聚集状态,要标出热效应,故选C 。
答案:C4。
在25 ℃、101 kPa 下,1 g 甲醇燃烧生成CO 2和液态水时放热22。
68 kJ,下列热化学方程式正确的是( )A.CH 3OH (l )+23O 2(g)====CO 2(g )+2H 2O(l ) ΔH=+725.8 kJ·mol -1 B.2CH 3OH (l )+3O 2(g )====2CO 2(g )+4H 2O(l ) ΔH=—1 452 kJ·mol —1C.2CH 3OH (l )+3O 2(g )====2CO 2(g )+4H 2O (l ) ΔH=-725。
化学苏教版选修四试题:专题1第一单元化学反应中的热效应第3课时课后达标检测含答案

课后达标检测[基础巩固]1.(2018·XX 高二检测)含有11.2 g KOH 的稀溶液与1 L 0.1 mol/L 的H 2SO 4溶液反应,放出11.46 kJ 的热量,表示该反应中和热的热化学方程式为( )A .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-11.46 kJ/mol B .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-11.46 kJ/molC .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-114.6 kJ/molD .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-57.3 kJ/mol 解析:选D 。
中和热是以生成1 mol H 2O(l)所放出的热量来定义的,故书写中和热的热化学方程式时,应以生成1 mol H 2O(l)为标准来配平其余物质的化学计量数,故D 正确。
2.下列关于热化学反应的描述中正确的是( )A .稀HCl 和NaOH 溶液反应的中和热ΔH =-57.3 kJ·mol -1,则稀H 2SO 4和稀Ba(OH)2溶液反应的热化学方程式为12H 2SO 4(aq)+12Ba(OH)2(aq)===12BaSO 4(s)+H 2O(l) ΔH =-57.3 kJ·mol -1B .1 mol CO(g)完全燃烧时放出的热量为283.0 kJ ,则2CO 2(g)===2CO(g)+O 2(g)反应的ΔH =556.0 kJ·mol -1C .葡萄糖在人体内转化为CO 2和H 2O 为吸热反应D .NaOH 溶液与稀H 2SO 4反应,表示其中和热的热化学方程式为2NaOH(aq)+H 2SO 4(aq)===Na 2SO 4(aq)+2H 2O(l) ΔH =-114.6 kJ ·mol -1解析:选B 。
苏教版高中化学选修四专题1第一单元第3课时课堂达标即时巩固

1.已知:①4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2834.9 kJ·mol-1②4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3119.1 kJ·mol-1由此得出的正确结论是()A.等质量的O2比O3能量低,由O2变O3为吸热反应B.等质量的O2比O3能量低,由O2变O3为放热反应C.O3比O2稳定,由O2变O3为吸热反应D.O2比O3稳定,由O2变O3为放热反应解析:选A。
据盖斯定律,①式-②式得:3O2(g)===2O3(g)ΔH=284.2 kJ·mol-1即等质量的O2比O3能量低,O2比O3稳定,O2变O3为吸热反应。
2.盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是()A.A→FΔH=-ΔH6B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1C.C→F|ΔH|=|ΔH1+ΔH2+ΔH6|D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|解析:选B。
F→A,ΔH=ΔH6,则A→F,ΔH=-ΔH6;6个ΔH全部相加,是A→A的ΔH,应等于零;F→C的ΔH=ΔH6+ΔH1+ΔH2,则C→F的ΔH=-(ΔH6+ΔH1+ΔH2);A→D的ΔH=ΔH1+ΔH2+ΔH3,D→A的ΔH=ΔH4+ΔH5+ΔH6,二者的绝对值相等,符号相反。
3.在298 K、101 kPa时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1Cl2(g)+H2(g)===2HCl(g)ΔH22Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3则ΔH3与ΔH1和ΔH2间的关系正确的是()A.ΔH3=ΔH1+2ΔH2B.ΔH3=ΔH1+ΔH2C.ΔH3=ΔH1-2ΔH2D.ΔH3=ΔH1-ΔH2解析:选A。
高中化学4第1章第1节 化学反应的热效应第3课时反应焓变的计算测试题1

选修4第1章第1节化学反应的热效应第3课时反应焓变的计算测试题1一、选择题1。
已知下列反应的热化学方程式为()(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJ•mol﹣1(2)C(s)+O2(g)═CO2(g)△H2=﹣393。
5kJ•mol﹣1 (3)H2(g)+O2(g)═H2O(l)△H3=﹣285。
8kJ•mol ﹣1则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H 为()A. ﹣488。
3 kJ•mol﹣1B。
﹣191 kJ•mol﹣1C. ﹣476。
8 kJ•mol﹣1D。
﹣1 549.6 kJ•mol﹣1 2.通过以下反应均可获取H2。
下列有关说法正确的是()①太阳光催化分解水制氢:2H2O(l)===2H2(g)+ O2(g)ΔH1=571.6kJ·mol-1②焦炭与水反应制氢:C(s)+ H2O(g) ="==CO(g)+” H2(g) ΔH2=131.3kJ·mol-1③甲烷与水反应制氢:CH4(g)+ H2O(g)===CO(g)+3H2(g)ΔH3=206.1kJ·mol-1A。
反应①中电能转化为化学能B. 反应②为放热反应C. 反应③使用催化剂,ΔH3减小D。
反应CH4(g)===C(s)+2H2(g)的ΔH3=74。
8kJ·mol-13.下列关于反应焓变及测定说法正确的是()A. 甲烷的燃烧热为890kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g)△H=—890kJ/molB. 已知S(s)+O2(g)=SO2(g) △H1和S(g)+O2(g)=SO2(g) △H2△H1 >△H2C. 0。
1mol的N2 和0。
3molH2在密闭容器中充分反应放热3。
8kJ,其热化学方程式可以表示为3H2(g)+N2(g)=2NH3(g)△H=-38kJ/molD。
高二化学苏教版选修4课后训练:专题1第一单元化学反应中的热效应含解析

化学反应中的热效应练习基础巩固1.下列反应中生成物总能量高于反应物总能量的是()。
A.碳酸钙受热分解B.乙醇燃烧C.铝粉与氧化铁粉末反应D.氧化钙溶于水2.下列说法中,正确的是( )。
A.在化学反应中,发生物质变化的同时不一定发生能量变化B.ΔH>0表示放热反应,ΔH<0表示吸热反应C.ΔH的大小与热化学方程式中的化学计量数无关D.反应产物的总焓大于反应物的总焓时,ΔH>03.已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()。
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1B.C2H2(g)+52O2(g)===2CO2(g)+H2O(l)ΔH=2b kJ·mol-1C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=b kJ·mol-14.已知25℃、101kPa下,石墨、金刚石燃烧后都生成二氧化碳,同时其能量的变化为:1mol石墨完全燃烧生成CO2(g)能量变化为393.51 kJ;1mol金刚石完全燃烧生成CO2(g)能量变化为395.41kJ。
据此判断,下列说法中正确的是()。
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高5.下列关于反应能量的说法正确的是( )。
A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,反应物总能量<生成物总能量B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子的能量为E2,则2E1>E2C.101kPa时,2H2(g)+O2(g)===2H2O(l) ΔH=-571。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课后达标检测 [基础巩固]1.(2018·沈阳高二检测)含有11.2 g KOH 的稀溶液与1 L 0.1 mol/L 的H 2SO 4溶液反应,放出11.46 kJ 的热量,表示该反应中和热的热化学方程式为( )A .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-11.46 kJ/molB .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-11.46 kJ/molC .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-114.6 kJ/molD .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-57.3 kJ/mol解析:选D 。
中和热是以生成1 mol H 2O(l)所放出的热量来定义的,故书写中和热的热化学方程式时,应以生成1 mol H 2O(l)为标准来配平其余物质的化学计量数,故D 正确。
2.下列关于热化学反应的描述中正确的是( )A .稀HCl 和NaOH 溶液反应的中和热ΔH =-57.3 kJ·mol -1,则稀H 2SO 4和稀Ba(OH)2溶液反应的热化学方程式为12H 2SO 4(aq)+12Ba(OH)2(aq)===12BaSO 4(s)+H 2O(l) ΔH =-57.3kJ·mol -1B .1 mol CO(g)完全燃烧时放出的热量为283.0 kJ ,则2CO 2(g)===2CO(g)+O 2(g)反应的ΔH =556.0 kJ·mol -1C .葡萄糖在人体内转化为CO 2和H 2O 为吸热反应D .NaOH 溶液与稀H 2SO 4反应,表示其中和热的热化学方程式为2NaOH(aq)+H 2SO 4(aq)===Na 2SO 4(aq)+2H 2O(l) ΔH =-114.6 kJ ·mol -1解析:选B 。
中和热不包括生成沉淀所产生的热效应,Ba 2+与SO 2-4反应生成BaSO 4沉淀会放出热量,故稀H 2SO 4与稀Ba(OH)2溶液反应生成1 mol H 2O 时放出的热量大于57.3 kJ ,故A 项错误;当反应逆向进行时,其反应的ΔH 数值相等,符号相反,同时应注意ΔH 必须和化学计量数相对应,故B 项正确;葡萄糖在人体内转化为CO 2和H 2O ,是一个放热反应,故C 项错误;中和热是以生成1 mol H 2O 所放出的热量来定义的,因此书写表示中和热的热化学方程式时,应以生成1 mol H 2O 为标准配平其余物质的化学计量数,故应为NaOH(aq)+12H 2SO 4(aq)===12Na 2SO 4(aq)+H 2O(l) ΔH =-57.3 kJ ·mol -1, 故D 项错误。
3.(2018·烟台高二质检)已知HCl 和NaOH 的稀溶液反应的中和热ΔH =-57.3 kJ·mol-1,则下列物质间发生反应时放出的热量与57.3 kJ 最接近的是( ) A .含0.5 mol Ca(OH)2的稀溶液与足量稀H 2SO 4 B .含1 mol H 2SO 4的稀溶液与足量稀NaOH 溶液 C .含1 mol CH 3COOH 的稀溶液与足量稀KOH 溶液 D .含1 mol Ba(OH)2的稀溶液与含1 mol HCl 的稀盐酸解析:选D。
HCl和NaOH的稀溶液反应的中和热是可溶性强酸与可溶性强碱生成可溶性盐和1 mol H2O所放出的热量。
A.生成物CaSO4是微溶物,故A错误;B.含1 mol H2SO4的稀溶液与足量稀NaOH溶液生成2 mol H2O,故B错误;C.CH3COOH是弱酸,电离要吸热,故C错误;D.1 mol HCl和1 mol Ba(OH)2的稀溶液反应的中和热是可溶性强酸与可溶性强碱生成可溶性盐和1 mol H2O所放出的热量,故D正确。
4.已知25 ℃、101 kPa条件下:(1)4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2 834.9 kJ·mol-1(2)4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3 119.1 kJ·mol-1由此得出的正确结论是()A.等质量的O2比O3能量低,由O2变为O3为吸热反应B.等质量的O2比O3能量高,由O2变为O3为放热反应C.O3比O2稳定,由O2变为O3为吸热反应D.O2比O3稳定,由O2变为O3为放热反应解析:选A。
依据盖斯定律,第一个热化学方程式减去第二个热化学方程式可得:3O2(g)===2O3(g)ΔH=284.2 kJ·mol-1,说明等质量的臭氧比氧气能量高,不如氧气分子稳定。
对比四个选项,只有A正确。
5.下列依据热化学方程式得出的结论正确的是()A.已知2SO2(g)+O2(g)2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量B.已知C(石墨,s)===C(金刚石,s)ΔH>0,则金刚石比石墨稳定C.已知H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为-57.3 kJSn(白,s)ΔH=2.1 kJ·mol-1,则白锡制品在寒冷的冬D.已知Sn(灰,s)>13.2 ℃<13.2 ℃天因易转化为灰锡而损坏解析:选D。
A项中2 mol SO2(g)与1 mol O2(g)的总能量比2 mol SO3(g)的能量高,不能判断SO2和SO3能量的相对高低,错误;B中金刚石比石墨能量高,不如石墨稳定,错误;从离子方程式的意义可知,只有强酸与强碱的稀溶液反应生成可溶性盐和1 mol液态水的热效应为-57.3 kJ, C项错误。
6.(2016·高考江苏卷)通过以下反应均可获取H2。
下列有关说法正确的是()①太阳光催化分解水制氢:2H2O(l)===2H2(g)+O2(g)ΔH1=571.6 kJ·mol-1②焦炭与水反应制氢:C(s)+H2O(g)===CO(g)+H2(g)ΔH2=131.3 kJ·mol-1③甲烷与水反应制氢:CH4(g)+H2O(g)===CO(g)+3H2(g)ΔH3=206.1 kJ·mol-1A.反应①中电能转化为化学能B .反应②为放热反应C .反应③使用催化剂,ΔH 3减小D .反应CH 4(g)===C(s)+2H 2(g)的ΔH =74.8 kJ·mol -1解析:选D 。
A 项,反应①是光能转化为化学能,错误;B 项,反应②的焓变为正值,属于吸热反应,错误;C 项,催化剂不会改变反应的焓变,错误;D 项,根据盖斯定律,③-②得所求反应,其焓变为206.1 kJ·mol -1-131.3 kJ ·mol -1=74.8 kJ·mol -1,正确。
7.将V 1 mL 1.0 mol/L HCl 溶液和V 2 mL 未知浓度的NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V 1+V 2=50 mL)。
下列叙述正确的是( )A .做该实验时环境温度为22 ℃B .该实验表明化学能可以转化为热能C .NaOH 溶液的浓度约是1.0 mol/LD .该实验表明有水生成的反应都是放热反应解析:选B 。
中和反应为放热反应,B 正确;从表中分析当加入HCl 溶液5 mL 、NaOH 溶液45 mL 时,反应后溶液温度为22 ℃,故实验时环境温度小于22 ℃,A 错;当加入HCl 溶液30 mL 反应放热最多,应是酸碱恰好完全中和,故c (NaOH)=1.0 mol/L ×30 mL 20 mL =1.5mol/L ,C 错;中和反应有水生成,但有水生成的反应不一定是放热反应,如H 2+CuO=====△H 2O +Cu 是吸热反应,D 错。
8.单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是( )A .S(单斜,s)===S(正交,s) ΔH =0.33 kJ·mol -1 B .正交硫比单斜硫稳定C .相同物质的量的正交硫比单斜硫所含有的能量高D.①表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ解析:选B。
根据盖斯定律,得:S(单斜,s)===S(正交,s)ΔH=-0.33 kJ·mol-1,可知单斜硫转化为正交硫时要放出热量,正交硫的能量要低,较稳定,A项错误、B项正确;相同物质的量的正交硫应该比单斜硫所含有的能量低,C项错误;①表示断裂1 mol S(单斜,s)和1 mol O2(g)中的共价键所吸收的能量比形成1 mol SO2(g)中的共价键所放出的能量少297.16 kJ,D项错误。
9.已知H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出________kJ的热量。
(2)用含 2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热ΔH为____________。
解析:(1)20 g40 g·mol-1=0.5 mol,所以0.5 mol NaOH与足量稀盐酸反应放出的热量为0.5 mol×57.3 kJ·mol-1=28.65 kJ。
(2)据中和热的定义可知,强酸与强碱反应的中和热与强酸、强碱的物质的量的多少无关,中和热ΔH为-57.3 kJ·mol-1。
答案:(1)28.65(2)-57.3 kJ·mol-110.把煤作为燃料可通过下列两种途径:途径ⅠC(s)+O2(g)===CO2(g)ΔH1<0 ①途径Ⅱ先制水煤气:C(s)+H2O(g)===CO(g)+H2(g)ΔH2>0 ②再燃烧水煤气:2CO(g)+O2(g)===2CO2(g)ΔH3<0 ③2H2(g)+O2(g)===2H2O(g)ΔH4<0 ④(1)途径Ⅰ放出的热量理论上________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是_______________________________。
(3)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)ΔH1=-25 kJ·mol-1①3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g)ΔH2=-47 kJ·mol-1②Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH3=19 kJ·mol-1③请写出CO还原FeO的热化学方程式:____________________________________________________________________________________________________________。
