高考化学一轮复习 排查落实练十四课件 苏教版
高考化大一轮复习江苏专用配套课件-章末再提升-化家眼中的物质世界

【点评】 1.导管插入液面以下是为了防止吸入气体造成误 差。 2.要利用题中数据进行计算,不能直接利用教材中的数据 。 3.解题的切入点是从实验目的、原理、仪器思考,同时注 意测定条件;减少测定气体体积的误差主要从三方面思考: 由于外界温度、压强对气体体积的影响较大,因此在实验前 后应尽量保持装置内外的温度、压强相等,这样测得的气体 的体积才准确。其次要考虑气体的溶解性,选择气体难溶的 液体试剂来封闭产生的气体,最后要看选择量气的方法及加 入试剂的顺序能否给测定的结果带来影响,并力争把这些不 利的影响降低到最低。
高考化大一轮复习江苏 专用配套课件 章末再提 升 化家眼中的物质世界
2024年2月1日星期四
一、微知识细排查 正误判断(2012~2014高考题精选) 1.化学概念
(1)明矾能水解生成Al(OH)3胶体,可用作净水剂 ()
(2)石油分馏是化学变化,可得到汽油、煤油 ()
(3)煤制煤气是物理变化,是高效、清洁地利用煤的重要 途径
(19)标准状况下,22.4 L氨水含有nA个NH3分子 ()
(20)56 g铁片投入足量浓H2SO4中生成nA个SO2分子 ()
自我核对 (1)× (2)√ (3)× (4)× (5)√ (6)×,(7)× (8)× (9)× (10)× (11)√ (12)× (13)√ (14)× (15)× (16)× (17) (18)× (19)× (20)×
9NA ()
(5)常温常压下,8 g O2含有4nA个电子 ()
(6)1 L 0.1 mol·L-1的氨水中有nA个NH ()
(7)标准状况下,22.4 L盐酸含有nA个HCl分子 ()
(8)1 mol Na被完全氧化生成Na2O2,失去2nA个电子 ()
高考化学一轮复习 第十四单元 元素周期律课件 苏教版
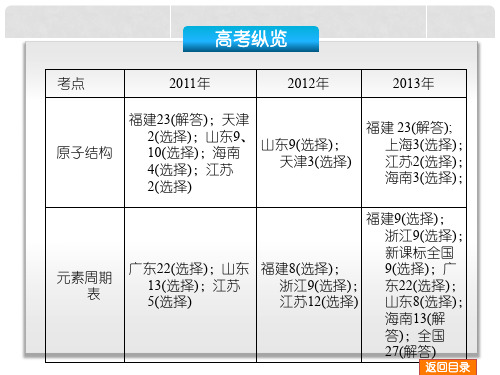
广东22(选择);山东 福建8(选择);
9(选择);广
13(选择);江苏
浙江9(选择); 东22(选择);
5(选择)
江苏12(选择) 山东8(选择);
海南13(解
答);全国
27(解答)
返回目录
高考纵览
考点
2011年
2012年
2013年
元素 周 期 律
福建7(选择);浙江8(选 择新安7择北标东2(5选课)徽)京全2(;;解2择标国12(浙天选答15)(全(1;选江津择解)1;(国天选择97答 );四((1津选 解)择)3;; 安 川(2择 答)选重 ;新 徽(选))择; ;庆 广课);新课1北 四 天 重 答 237标京 川 津((庆)选 ; 解全9872择 全 答(((6国选 选 解()解 国 );择 择 答))); ; ; 26(解答)
浙江7、9(选择);天津 7(解答);北京25(解答)
天津3(选择); 四川8(选择); 全国6(选择)
海4(选择);山 东8(选择);海 南13(解答);
天津7(解答)
返回目录
使用建议
【教学建议】 本单元包括原子结构、元素周期律和元素周期表、化 学键等内容,概念多,内容深,难度大。本单元的重点知 识主要是:元素周期律的实质和元素周期表的结构;元素 的性质、原子结构和该元素在周期表中的位置三者之间的 关系;离子键和共价键的知识;同周期、同主族元素元素 性质的递变规律。难点是“位、构、性”三者之间的关系; 对离子键和共价键本质的理解。 学习的过程中,在精读教材的基础上,以物质结构为 中心,以元素周期律(表)为纲,充分利用类比、归纳、分 析、推理的方法按由先到后,由浅入深的顺序,形成知识 网络,总结知识规律,达到能灵活运用知识的目的。
步步高高考化学大一轮复习(苏教版通用)配套课件:专题四排查落实练八硫、氮及其化合物PPT

⑬浓硝酸见光分解(化学方程式) 4HNO3(浓)=光==照==4NO2↑+O2↑+2H2O
;
; 。
返回
排查落实练八 硫、氮及其化合物
二、值得强化记忆的实验现象
1.硫在纯 O2 中燃烧的现象 产生明亮的蓝紫色火焰,放出热量, 有刺激性气味的气体生成 。
排查落实练八 硫、氮及其化合物
(3)NH4+的检验 试剂及用品:__N__a_O_H__溶__液__、__湿__润 ___的__红__色__石__蕊__试__纸________ 操作及现象:___向__所__取__试__液__中__加__入__浓__N__aO__H__溶__液__,__加__热__,___ _把__湿__润__的__红__色__石__蕊__试__纸__放__在__试__管__口__,_若__试__纸__变__蓝__,__说__明__有____ _N_H_3_生__成__, __证 ___明__原__溶__液__含__有__N__H_4+__
⑥NO2 溶于水 3NO2+H2O===2H++2NO- 3 +NO ;
⑦NO2 被烧碱溶液吸收生成两种钠盐 2NO2+2OH-===NO- 3 +NO- 2 +H2O ;
⑧物质的量之比为 1∶1 的 NO 和 NO2 混合气体恰好被烧碱
溶液吸收生成一种钠盐
NO+NO2+2OH-===2NO- 2 +H2O
排查落实练八 硫、氮及其化合物
排查落实练八 硫、氮及其化合物
2.氮及其化合物 (1)知识网络构建
排查落实练八 硫、氮及其化合物
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
高考化学(苏教版)一轮复习《专题讲座共七讲》课件

三、电荷守恒 指阳离子所带的电荷总数(各种阳离子所带电荷数与阳离子物质的 量的乘积的代数和)与阴离子所带的电荷总数(各种阴离子所带电荷数与 阴离子物质的量的乘积的代数和)在数值上相等,主要在以下两个方面 应用。 1.离子方程式中,常用于离子方程式正误判断及书写 【例4】 在一定条件下,ROn3-与I-发生反应的离子方程式如下: ROn3-+6I-+6H+===R-+3I2+3H2O,ROn3-中的n为________。
[特别提示] (1)注意特殊物质中元素的化合价,如 Na2O2中氧元素、FeS2中硫元素的化合价均为-1价。
(2)配平化学方程式时,化学计量数“1”也必须填写在 空格里。
(3)依据电子得失守恒列等式时容易忽略变价原子个数。
【例3】 1.92 g铜投入到一定量的浓硝酸中,铜完全 溶解,用试管收集生成的气体,颜色越来越浅,共收集到 672 mL气体(标准状况下),将盛有此气体的试管倒扣在水 中,通入氧气恰好使气体完全溶解在水中,则需要标准状 况下的氧气的体积为( )
二、电子守恒 氧化还原反应中,氧化剂得电子(化合价降低)总数等 于还原剂失电子(化合价升高)总数,得失电子守恒(化合价 升降相等)。在解题中找到有元素化合价升高的和降低的物 质,列等式求解。 应用电子守恒解题的一般步骤为: (1)找出氧化剂、还原剂及相应的还原产物和氧化产物。 (2)找准一个原子或离子得失电子数(注意化学式中粒 子的个数)。 (3)根据题中物质的物质的量和得失电子守恒列出关系 式。
所以 c(H2SO4)=00..315mLol=2 mol·L-1。 [答案] B
2.金属溶于酸,再加碱生成沉淀质量的求法
M―-―ne→- Mn+―nO―H→-M(OH)n。
所以金属失去n mol电子,就结合n mol OH-,沉淀质 量=原金属质量+结合的OH-质量。
步步高高考化学大一轮复习(苏教版通用)配套课件:专题四 排查落实练七 碳、硅、氯

写出下列反应的方程式,是离子反应的写离子方程式。
①Si 和 NaOH 溶液的反应 Si+2OH-+H2O===SiO32-+2H2↑ ;
②SiO2 和 NaOH 溶液的反应 SiO2+2OH-===SiO23-+H2O ;
③SiO2 和 C 的反应
SiO2+2C=高==温==Si+2CO↑
;
④SiO2 和氢氟酸的反应 SiO2+4HF===SiF4↑+2H2O ;
层为橙红色的溴水,下层为深红棕色的液溴 。
返回
排查落实练七 碳、硅、氯
三、简答类语言规范再落实
1.纯碱中通常含有 NaCl,检验其中 Cl-的操作及现象是 取少量纯 碱样品于试管中,加入过量稀 HNO3,产生大量气泡,再加入 AgNO3 溶液,产生白色沉淀 。
2.闻 Cl2 的操作方法 用手在瓶口轻轻扇动,仅使极少量的 Cl2 飘进 鼻孔 。
返回
排查落实练七 碳、硅、氯
二、值得强化记忆的实验现象
1.向澄清石灰水中通入 CO2 气体至过量,其现象是 先有白色沉 淀生成,继续通入 CO2 时,白色沉淀溶解 。
2.将点燃的 Mg 条伸入盛有 CO2 的集气瓶中,有什么现象? 答案 剧烈燃烧,有黑色物质附着在集气瓶内壁上,瓶底还 有白色物质生成。
的烟
,加水后, 生成蓝色溶液 。
7.将 Cl2 通入 KI 溶液中,再加入 CCl4,现象为 溶 液 分层,上层无色,下层呈紫红色 。
8.Fe 在 Cl2 中的现象是 剧烈燃烧,有大量棕红色的烟 。
9.实验室中保存液溴,通常加入少量水液封,试剂瓶中呈现
三种颜色,从上到下分别是上层为红棕色的溴蒸气,中
3.向 Na2SiO3溶液中加入稀盐酸,其现象是有白色胶状沉淀生成 。 4.H2 在 Cl2 中燃烧现象是 H2 在 Cl2 中安静地燃烧,产生苍白色
2019届苏教版高考一轮化学总复习课件:专题三+第14讲 专题提升

非金属元素及其化合物
专题提升
第14讲
专题网络
栏 目 导 航
专题整合
专题整合
微小专题 微小专题1 常见物质的制备 一、 合金 概念 性能
两种或两种以上 合金是指______________ 的 合金具有不同于各成分金属的物理、化学性
非金属 金属(或金属与_______) 熔合 能或机械性能 金属特性 而成的具有________ 的物 低。 (1)熔点:一般比它的各成分金属_____ 大。 (2)硬度和强度:一般比它的各成分金属___
铝合金 铜合 青铜、黄 金 铜、白铜等
密度小、强度高、可塑性好、易于 建筑业、容器、包装业、 成型、制造工艺简单 良好的导电、导热性 交通运输、电子行业 电器、电子工业
三、 金属冶炼方法 金属的活动性顺序 金属原子失电子能力 金属离子得电子能力 主要冶炼方法 电解法 K Ca Na Mg Al Zn Fe Sn Pb (H)Cu 强→弱 弱→强 热还原法 热分解法 物理方法 Hg Ag Pt Au
活泼金属还原法
热分解法
微小专题2 部分金属离子的测定 一、 常见的两种氧化还原滴定
高锰酸钾法 原理 还原剂和高锰酸钾发生氧化 还原反应 氧化剂:O2、 Cu2+、 ClO
-
碘量法
可以测定的物 还原剂:Fe2+、H2C2O4、 质 指示剂 终点颜色变化
- C2O2 4 、H2O2
2
、
- CH3COOOH、NaNO2、Cr2O2 7 等
Ⅲ . 取 25.00 mL 溶液 A 于锥形瓶中,加入稍过量的 KI 溶液 (2Cu2 + + 5I -
- - - - 2- ===2CuI↓+I3 ),用 0.100 0 mol· L-1Na2S2O3 溶液滴定(2S2O2 + I ===S O + 3I )到 3 3 4 6
2021版高考化学一轮复习 课时提升作业十四 元素周期表 元素周期律(含解析)苏教版

元素周期表元素周期律1.如图中横坐标均表示11~17号元素顺序排列的原子序数。
根据图象变化趋势判断,纵坐标表示其最高化合价的是()【解析】选C。
11~17号元素,随原子序数的递增,最高化合价从+1→+7。
【加固训练】核反应不仅能发电也能制造元素.2016年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117和118四种新元素,填补了目前元素周期表的空白,其中113号元素与Al元素处于同一主族。
下列说法中正确的是()A.核反应发电实现了化学能到电能的转化B。
115号元素一定是处于ⅤA族的非金属元素C.117号元素与F、Cl、Br、I均处于ⅦA族D。
四种新元素位于元素周期表中的不同周期【解析】选C。
A项,核反应发电是将核能转化为电能。
B项,115号元素是位于ⅤA族的金属元素。
D项,四种新元素均位于第7周期。
2.物理学家根据原子核结构理论计算,人工合成的元素将会完成元素周期表的第七周期(零族元素的原子序数应为118),并进入第八周期,甚至第九周期。
若第八周期元素种类是第五、六周期元素种类之和,依照已有的规律,可以推知第九周期将有元素种类的数目是( )A.32 B。
50 C。
64 D.82【解析】选B。
人工合成的元素完成元素周期表的第七周期(零族元素的原子序数应为118)后,1至7周期的元素种类分别为2、8、8、18、18、32、32,依照已有的规律,第八周期和第九周期元素种类相同,第八周期元素种类是第五、六周期元素种类之和,可以推知第九周期将有元素种类的数目是50。
3。
(2018·浙江11月选考真题)元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17,下列说法不正确的是( )XY ZQA.原子半径(r):r(Q)>r(Y)〉r(Z)B。
元素X有-4、+2、+4等多种价态C.Y、Z的氧化物对应的水化物均为强酸D.可以推测H3QO4是Q的最高价氧化物的水化物【解析】选C。
高三化学第一轮复习第十四单元

无 机 物 卤素、氢气、水等 氢气等
C=O
丙酮 氢气等
-CHO
乙醛 氢气等
整理课件
6.发生氧化反应的官能团(不含燃烧)
CC C=C
C-OH -CHO C6H5-R CH3CH2CH2CH3
代表物 乙烯 乙炔 乙醇 乙醛 甲苯 丁烷
KMnO4 褪色
催化氧 化
与O2 生成 乙醛
褪色
--------
褪色
-X
溴乙 烷 与碱 溶液 共热
-COO-
C6H5
RCOO- O-
乙酸乙 醋酸钠 苯酚
酯
钠
与碱 或酸
常温
溶液
共热
二糖 多糖
蔗糖 淀粉 纤维 素
与硫 酸溶 液共 热
与硫 酸溶 液共 热
与硫 酸溶 液共 热
整理课件
5.发生加成反应的基/官能团
C=C C C 基/官能 团
C6H5-
代 表 物 乙烯 乙炔
甲苯
环已烷
条件均需 催化剂、 加热。
醛(或酮)+H2 不饱和酸+H2
醇 饱和酸
卤代烃
消 去
醇
反 应 卤代烃
加热、浓 硫酸
氢氧化钠 醇溶液
醇 烯+水 卤代烃 烯+卤化氢
整理课件
水
卤代烃
氢氧化钠水溶
液
卤代烃+水
醇+卤化氢
解 反
酯
酸或碱、加热 酯+水
醇+酸
应糖
加热、硫酸 多糖+n水 葡萄糖
蛋白质
酶
蛋白质+n水 氨基酸
(1)a、CH3CH2CH2COOH b、CH3CH2COOCH3 (2)羟基、醛基 CH3COCH2COOH (3)a; b、c (4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O (5) nCH3CH=CHCH2OH → [-CH-CH]n (6)CH3CH2CH
高三化学第一轮复习第十四单元课件

4C3H5(ONO2)3
12CO2+10H2O+O2+6N2
整理课件
氨基酸的结构:
氨基酸是一种含氮有机物,其分子结构中
含有 氨基 和 羧基 天然氨基酸都是 氨基酸. 氨基酸的性质:(1)两性: 请写出谷氨酸分别与NaOH 和HCl反应的化学方程式
整理课件
(2)缩合反应: 请分别写出甘氨酸缩合为二肽和缩聚为高分子化 合物的化学方程式
(标准状况)。
(5)A在浓硫酸作用下加热可得到B(B的结构简式为HO─ ─ COOH
),其反应类型基又含有酯基的共有 种,写
出其中一种同分异构体的结构简整式理课件
。
整理课件
2(03测试22)、下面是一个四肽,它可以看作是4 个氨基酸缩合
掉3 个水分子而得。
H2N-CH-C-NH-CH-C-NH-CH-C-NH-CH-C-OH
•颜色反应:具有苯环结构的蛋白质遇浓硝酸会变性, 生成黄色物质,此反应可用于蛋白质的鉴别; (5)灼烧:灼烧蛋白质产生烧焦羽毛的气味,此现象也可用 于鉴别蛋白质.
整理课件
整理课件
A、B两种有机化合物,分子式都是C9H11O2N 化合物A是天然蛋白蛋的水解产物,光谱测定显
示,分子结构中不存在甲基(-CH3)化合物A的
C2H6和浓硫酸、浓硝酸在一定条件下反应(类似苯的硝化) 生成。
(1)A和B的结构简式可能是
A
,B
;
(2)一定条件下C2H6与浓硫酸,浓硝酸反应的化学方
程式为
整理课件
。
作业:
(06上海29)已知 (注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去 反应,可能得到两种互为同分异构体的产物, 其中的一种B可用于制取合成树脂、染料等多 种化工产品。A能发生如下图所示的变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8.苯是一种密度比水小的有机溶剂,分子式为 C6H6,结构简式 为 ,呈平面正六边形结构。苯分子中 6 个碳原子之间的
键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键。
所以苯具有易取代(C6H6+Br2―F―e―B―r→3 C6H5Br+HBr,C6H6+
HO—NO2 ―浓―H―△―2S―O→4 C6H5—NO2 + H2O) , 能 加 成 (
CH4,结构式为
,是一种对称的正四面体结构,
四个C—H键的长度和强度相同,夹角相等( √ ) 3.通常情况下,甲烷等烷烃的化学性质比较稳定,与高锰酸钾 等强氧化剂不反应,与强酸、强碱也不反应;但在一定条件下, 能在氧气中燃烧,能与溴水、氯水发生取代反应( × )
4.甲烷与氯气的第一步取代反应为CH4+Cl2 光CH3Cl+HCl,生 成的一氯甲烷可与氯气进一步发生取代反应,依次生成二氯 甲烷、三氯甲烷、四氯甲烷等氯代物。这四种氯代物都 不 溶于水;常温下,一氯甲烷是气体,其他三种都是油状 液 体( √) 5.乙烯主要从石油中获得,其产量可以用来衡量一个国家的石 油化工发展水平;苯可从石油或煤焦油中获得,是一种重要 的有机溶剂,也是一种重要的化工原料(√ )
二、扫除盲点
1. 乙烯 可用于植物生长调节剂和水果的催熟剂。 2.乙烯使溴水褪色是因为发生 加成 反应,使酸性KMnO4溶液 褪色是因为发生 氧化 反应。 3.聚乙烯塑料 无 毒,可用于食品包装,聚氯乙烯 有 毒, 不能 用于食品包装。
4.乙酸又叫 醋酸 ,低于熔点时是 无色冰状 晶体,所以又 称 冰醋酸 。
12.酸与醇反应生成酯和水的反应叫酯化反应。乙酸与乙醇发
生酯化反应的化学方程式为CH3COOH+CH3CH2OH
浓硫酸 △
CH3COOCH2CH3+H2O( √ )
13.二糖、多糖在酸的催化下水解,最终得到葡萄糖或果糖。 它们的化学方程式为
C12H22O11+H2O―催――化――剂→C6H12O6+C6H12O6
6.棉花、羊毛、蚕丝、天然橡胶属于 天然 有机高分子材料, 塑料、合成纤维、合成橡胶属于 合成 有机高分子材料,高分 子分离膜属于 新型 有机高分子材料。 7.纤维分为天然纤维和化学纤维,棉、麻、丝、毛属于 天然 纤维 ,人造棉、人造丝、锦纶、腈纶属于化学纤维,其中人 造棉、人造丝又属于人造纤维,而锦纶、腈纶属于 合成纤维 。 8.石油的分馏属于物理变化,其各种馏分仍然是 混合物 ,它 分为常压分馏 和减压分馏。石油的裂化和裂解属于化学变化。
蔗糖
葡萄糖 果糖
C12H22O11+H2O―催――化――剂→2C6H12O6
麦芽糖
葡萄糖
(C6H10O5)n+nH2O―催―― 化△―剂→nC6H12O6
淀粉(或纤维素)
葡萄糖
(√ )
14.油脂水解生成甘油、高级脂肪酸盐,此反应称为皂化反应, 工业上利用此反应来制取肥皂( × ) 15.蛋白质在酶等催化剂作用下水解,生成氨基酸( √ )
排查落实练十四 有机化合物
一、正误判断 二、扫除盲点 三、现象归纳 四、实验比较
一、正误判断
1.仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃; 烃分子中的碳原子之间只以单键互相结合,剩余价键均与氢 原子结合,使每个碳原子的化合价都达到“饱和”,这样的 饱和链烃最简单的烷烃。其分子式为
5.淀粉、纤维素水解实验应注意 (1)淀粉、纤维素水解都用H2SO4作催化剂,但淀粉用 20% H2SO4,纤维素用 90% H2SO4,均需微热。 (2)检验产物时,必须用 NaOH溶液中和过量的酸 ,才能用
银氨溶液 或新制 Cu(OH)2悬浊液 进行检验。
(3)淀粉是否发生水解的判断:利用淀粉遇碘变蓝的反应和其 水解最终产物葡萄糖能发生银镜反应或与新制Cu(OH)2悬浊 液生成砖红色沉淀来判断淀粉是否发生水解和水解进行程度。 如淀粉没有水解,则 不能 发生银镜反应;如淀粉已完全水 解,则遇碘 变不蓝能色;如既能发生与新制氢氧化铜悬浊液加 热反应生成砖红色沉淀或银镜反应,又能遇碘变蓝色,则说 明淀粉仅 水部解分。
6.乙烯分子中含有碳碳双键,属于不饱和烃,分子呈平面形 结构。乙烯是最简单的烯烃,其结构简式为CH2==CH2,乙 烯燃烧火焰明亮且伴有黑烟( √ ) 7.加成反应是指有机物分子中的不饱和碳原子跟其他原子或 原子团直接结合生成新化合物的反应。乙烯与溴水可发生加 成反应:CH2CH2+Br2―→CH3CHBr2(× )
+
3H2―△―N→i (√ )
),难氧化(不能使酸性高锰酸钾溶液褪色)的性质
9.决定有机化合物的化学特性的原子或原子团叫作官能团。卤 素原子(—X)、羟基(—OH)、硝基(—NO2)、碳碳双键等都是官 能团( √) 10.将一小块钠加入乙醇中,钠沉于乙醇底部,不熔化,最终 慢慢消失。说明钠的密度比乙醇的大,钠与乙醇缓慢反应生 成氢气,乙醇中羟基上的氢原子相对于水不活泼(√ ) 11.乙酸是具有强烈刺激性气味的无色液体,易溶于水和乙醇。 乙酸的结构简式为CH3COOH,官能团为羧基(—COOH)(√ )
三、现象归纳
1. 在 空 气 中 点 燃 甲 烷 , 并 在 火 焰 上 放 干 冷 烧 杯 : 火 焰 呈 淡蓝 色,烧杯内壁有 液滴产生。 2.光照甲烷与氯气的混合气体:黄绿色逐渐 变浅,容器内壁 有 油状液滴 生成。
3.加热(170 ℃)乙醇与浓硫酸的混合物,并使产生的气体依次 通入溴水、酸性高锰酸钾溶液:溴水 褪色 ,酸性高锰酸钾溶 液紫色逐渐 变浅 。 4.在空气中点燃乙烯:火焰 明亮 ,有 黑烟 产生。 5.苯在空气中燃烧:火焰 明亮 ,并带有 黑烟 。 6.乙醇在空气中燃烧:火焰呈现 淡蓝 色。 7.苯与液溴在有铁粉作催化剂的条件下反应:有 白雾 产生, 生成褐色的油状液体。
8.将少量甲苯倒入适量的高锰酸钾溶液中,振荡:紫色 褪去 。 9.将金属钠投入到盛有乙醇的试管中:钠在 底部 缓 慢 反 应 , 生成 气泡。 10.在适宜条件下乙醇和乙酸反应:有透明的带 香味 的
