江苏省南通市第二中学高中化学 化学反应与能量变化课件 新人教版选修4
合集下载
化学选修4(化学反应原理)第一章第一节化学反应与能量的变化 .ppt

二、热化学方程式 热化学方程式∶能表示参加 反应 物质的量 和反应热 的关系的化学方程式。
【练习】
1、1molC与1molH2O(g)反应生成1molCO(g) 和1molH2(g),需吸收131.5kJ的热量,该反 应的反应热为△H= +131.5 kJ/mol。 2、拆开1molH—H键、1molN—H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ, -92kJ/mol 则1molN2生成NH3的反应为: ,1mol H2 -30.67kJ/mol 生成NH3的反应热为: 。
30.5克
4、已知: S(s) + O2(g) = SO2(g) ΔH =-290.6KJ, 求 1.6克硫燃烧成为SO2气体放出多少热量?
14.53KJ
思考与交流
热化学方程式与普通 化学方程式有什么区别?正确书写其应当 注意哪几点?
小结∶热化学方程式不单表示了反应物和生 成物的关系,而且表示了反应的热效应。
D、1/2CH4 (g)+O2 (g) =1/2CO2 (g) +H2O (l) ΔH = -890 kJ/mol
3、已知
(1)H2(g)+1/2O2 (g) =H2O (g) ΔH1 = a kJ/mol
(2)2H2(g)+O2 (g) =2H2O (g) ΔH2 = b kJ/mol
(3) H2(g)+1/2O2 (g) = H2O (l) ΔH3 = c kJ/mol (4) 2H2(g)+O2 (g) =2H2O (l) 则a、b、c、d的关系正确的是 C ΔH4 = d kJ/mol 。
A、 2CH4 (g)+4O2 (g)=2CO2 (g)+ 4H2O (l) ΔH = +890 kJ/mol B、 CH4 +2 O2 = CO2 + H2O C、CH4 (g)+2 O2 (g) =CO2 (g) +2H2O (l) ΔH = -890 kJ/mol ΔH = -890 kJ/mol
人教版高中化学选修四化学反应与能量的变化PPT课件

人教版高中化学选修四第一章 第1节化学反应与能量的变化(共52 张PPT)
思考2、在同温、同压下,比较下列反应 放出热量Q1、Q2的大小
B: S(g)+O2(g)=SO2(g)+Q1 S(S)+O2(g)=SO2(g)+Q2
两式数量相同,S由固态吸收热量转化为 气态,在氧化燃烧生成SO2。其放出热量 的总和小于由气态S直接燃烧所放出的热 量,Q1<Q2。
❖H△2H(=g一)28+51./82OK2J(/mgo)l=H2O(l) ❖请同学们分析为什么二者的产物同
样是水,而释出的能量却不同? ❖热化学方程式∶能表示参加反应物
质的量和反应热的关系的化学方程 式。
❖
人教版高中化学选修四第一章 第1节化学反应与能量的变化(共52 张PPT)
人教版高中化学选修四第一章 第1节化学反应与能量的变化(共52 张PPT)
D: H2(g)+Cl2(g)=2HCl(g)+Q1 1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2
状态相同,但数量后式仅是前式的一半,释 放的热量也应是前式的一半,Q2<Q1
人教版高中化学选修四第一章 第1节化学反应与能量的变化(共52 张PPT)
综上所述∶
❖ 当△H为“一”或△H<O时,为放热反应; ❖ 当△H为“+”或△H>O时,为吸热反应。 ❖ 请同学们分析p3的能量变化图。 ❖ 二、热化学方程式 ❖ 能够表示化学反应热效应的化学方程式应怎
样书写?下面我们来讨论和研究∶
人教版高中化学选修四第一章 第1节化学反应与能量的变化(共52 张PPT)
反应物的总能量高
生成物的总能量高
《化学反应与能量的变化》人教版高二化学选修4PPT课件(第一课时)

因此C项错误;一个化学反应是吸热反应还是放热反应,取决于生成物和反应物的焓的差值, 也可以根据断键时吸收的能量与成键时放出的能量大小判断,D项正确。
典例精析
例4下列说法正确的是( D )
A.焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.在加热条件下发生的反应均为吸热反应
ΔH = – m kJ/mol
注:单位中的每mol是与整个反应对应的,即反应热表示每mol反应放出或吸收的热量。
一、反应热 焓变
从能量角度看:
能 量
反应物
能 量
放热
△H<0
生成物
吸热
△H>0
生成物 反应过程
反应物 反应过程
ΔH=生成物能量-反应物能量(宏观)
一、反应热 焓变
从键能角度看:化学键断裂——吸热 化学键形成——放热 1mol H2与1mol Cl2反应生成2mol HCl时的反应热
人教版高中化学选修4(高二)
第一章 化学反应与能量
第1节 化学反应与能量的变化
MENTAL HEALTH COUNSELING PPT
第一课时 焓变反应热
焓变 反应热
焓变 反应热
这是一幅幅多么撩人的自然美景,然而,如今的地球正在遭受着前所未有的灾难:大 气污染加剧、水污染严重,固体废弃物与日俱增、臭氧空洞、酸雨、赤潮、温室效应、 水土流失、土地沙漠化等。归根结底,都和化学反应有着密切的关系,我们这一章研究 的主要是物质的能量变化,这种能量变化常以热能、电能、光能等形式表现出来。让我 们共同学习、研究化学反应与能量,做好保护地球,保护环境的工作。
人教版高中化学选修4(高二)
第一章 化学反应与能量
典例精析
例4下列说法正确的是( D )
A.焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.在加热条件下发生的反应均为吸热反应
ΔH = – m kJ/mol
注:单位中的每mol是与整个反应对应的,即反应热表示每mol反应放出或吸收的热量。
一、反应热 焓变
从能量角度看:
能 量
反应物
能 量
放热
△H<0
生成物
吸热
△H>0
生成物 反应过程
反应物 反应过程
ΔH=生成物能量-反应物能量(宏观)
一、反应热 焓变
从键能角度看:化学键断裂——吸热 化学键形成——放热 1mol H2与1mol Cl2反应生成2mol HCl时的反应热
人教版高中化学选修4(高二)
第一章 化学反应与能量
第1节 化学反应与能量的变化
MENTAL HEALTH COUNSELING PPT
第一课时 焓变反应热
焓变 反应热
焓变 反应热
这是一幅幅多么撩人的自然美景,然而,如今的地球正在遭受着前所未有的灾难:大 气污染加剧、水污染严重,固体废弃物与日俱增、臭氧空洞、酸雨、赤潮、温室效应、 水土流失、土地沙漠化等。归根结底,都和化学反应有着密切的关系,我们这一章研究 的主要是物质的能量变化,这种能量变化常以热能、电能、光能等形式表现出来。让我 们共同学习、研究化学反应与能量,做好保护地球,保护环境的工作。
人教版高中化学选修4(高二)
第一章 化学反应与能量
高中化学选修4-1.1 化学反应与能量变化 课件 (共14张PPT)

3.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续
进行,直至反应完全生成新物质硫化亚铁。该现象说明了( B ) A、该反应是吸热反应 B、该反应是放热反应 C、铁粉和硫粉在常温下可以发生反应 D、生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量 4.由图分析,有关叙述正确的是( D ) A.A―→B+C和B+C―→A两个反应吸收或放出的能 量不等 B.A―→B+C是放热反应 C.A具有的能量高于B和C具有的能量总和 D.A―→B+C是吸热反应,则B+C―→A必然是 放热 反应
焓变与反应热关系: 恒压条件下,反应的热效应等于焓变。
思考:化学反应过程中为什么会有能量的变化?
放热吸热的决定因素:反应物和生成物所具有的总能量的相对大小
ΔH=生成物总能量-反应物总能量(宏观)
能 量 反应物 放热 △H<0 能 量 吸热
生成物
△H>0
生成物 反应过程
反应物 反应过程
反应热的表示方法:
课后作业
课时训练1
结论: ΔH决定于反应物的总能量与生成物的总能量的相对大小, ΔH决定于反应物的总键能与生成物的总键能的相对大小。
物质的稳定性:键能越大,物质越稳定;能量越低,物质越稳定。
小试牛刀
1.下列过程中,需要吸收能量的是( C ) A.H+H=H2 B.H+Cl=HCl C.I2→I+I D.S+O2=SO2 2.下列变化中, 属于放热反应的是 ( B ) A.Ba(OH)2·8H2O与NH4Cl的反应 B.点燃的镁条在二氧化碳中继续燃烧 C.灼热的碳与二氧化碳的反应 D.水凝结成冰
3.在一定条件下,A和B反应可生成C和D,其能量变化如下:
吸热 填“吸热”或“放热”) 若E1﹤ E2,则该反应为____( 反应,该反应的反应热为 ΔH=(E2-E1) kJ· mol-1
人教版高中化学选修四化学反应与能量的变化教学课件 (共41张PPT)

反应物、生成物的状态不同,反应热也不 相同,在完全的相同条件下完全燃烧2 mol氢 气是完全燃烧1 mol氢气放出的热量的两倍, 在热化学方程式里怎么表达出来呢?
例:在25℃、101kPa时,有两个由H2和O2化合 成1molH2O的反应,一个生成气态水,一个生 成液态水,其化学方程式克表示为:
H2(g)+ 12O2(g)=H2O(g) △H=-241.8 kJ/mol H2(g)+ 12O2(g)=H2O( l ) △H=-285.8 kJ/mol
两个反应的产物都是1molH2O,但释 放出来的能量却不同,这是由于液态水蒸 发为气态水时需要吸收能量。
H2O(g)=H2O( l ) △H=+44.0 kJ/mol
导入新课
蜡烛燃烧
在化学反应过程中能量以热能、电 能和光能等形式表现出来,当能量以热 的形式表现时,可以把化学反应分为放 热反应和吸热反应。
铝箔燃烧
铝箔燃烧 产生光能和 热能,该反 应是放热反 应。
氢氧化钡晶体[Ba(OH)2•8H2O]与氯化铵晶体 (NH4Cl)的反应,玻璃片上的水由于结冰使玻
(2)当生成物释放的总 能量小于反应物吸收的总 能量时,反应是吸热反应, 通过加热、光照等方法吸 收能量,使反应本身能量 升高,△H为“+”,所以 △H为“+”或△H>0时为 吸热反应。
氧气的实验室制法:吸热反应
二、热化学方程式
1.表明反应所放出或吸收的热量的化学方 程式,叫做热化学方程式。
H2(g)+I2(g)=2HI(g);△H=-14.9 kJ/mol
3.书写热化学方程式的注意事项
(1)需注明反应的温度和压强。因为反应 的温度和压强不同时,其△H不同。 (反应在 25℃、101 kPa下进行时,可不注明温度和压 强条件。)
新人教版化学选修4第1章《化学反应与能量变化》章复习课件

△H=-57.3kJ/mol
中和 反应
三、书写热化学方程式应注意下列几点: ⒈需注明反应时的温度和压强。对于25℃ 、101kPa 时进行的反应可不注明。 ⒉需注明反应物和生成物的聚集状态或晶型,常用s、 l、g、aq分别表示固态、液态、气态、水溶液。 ⒊化学计量数只表示各物质的物质的量,可为整数或分 数。对于分数一般是以某一反应物或生成物为“1mol” 时的物质相对应。不能随便写分数。
6.已知反应:① 2C(s)+O2(g)=2CO(g) Δ H=-221 kJ/mol ② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) Δ H=-57.3 kJ/mol 下列结论不正确的是 A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
4.红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4 ( s ) + 5O2 ( g ) = P4O10 ( s ) △H = -2983.2 kJ/mol P ( s ) + 5/4O2 ( g ) = 1/4P4O10 ( s ) △H = -738.5 kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 或“不稳定”)
⒋△H写在化学方程式的右边,以“+”表示吸热,以 “-”表示放热。△H的数值与反应式中的系数有关,单 位总是kJ· mol-1 。
四、中和热的测定 五、盖斯定律及其应用 ⒈盖斯定律的内容 化学反应的反应热只与反应体系的始态和终态有 关,而与反应的途径无关。也就是说,一个反应可 以分几步进行,则各分步反应的反应热之和与该反 应一步完成时的反应热是相同的。 ⒉盖斯定律的应用 进行很慢,或不易直接发生,或产品不纯的化学 反应,很难直接测得反应的反应热,可通过盖斯定律 获得它们的反应热数据。 利用盖斯定律求反应热时,应注意热化学方程 式在同乘(或除)一个数时,△H也要作相应变化; 物质的分子式可以相加减,△H同样也可以相加减。
中和 反应
三、书写热化学方程式应注意下列几点: ⒈需注明反应时的温度和压强。对于25℃ 、101kPa 时进行的反应可不注明。 ⒉需注明反应物和生成物的聚集状态或晶型,常用s、 l、g、aq分别表示固态、液态、气态、水溶液。 ⒊化学计量数只表示各物质的物质的量,可为整数或分 数。对于分数一般是以某一反应物或生成物为“1mol” 时的物质相对应。不能随便写分数。
6.已知反应:① 2C(s)+O2(g)=2CO(g) Δ H=-221 kJ/mol ② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) Δ H=-57.3 kJ/mol 下列结论不正确的是 A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
4.红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4 ( s ) + 5O2 ( g ) = P4O10 ( s ) △H = -2983.2 kJ/mol P ( s ) + 5/4O2 ( g ) = 1/4P4O10 ( s ) △H = -738.5 kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 或“不稳定”)
⒋△H写在化学方程式的右边,以“+”表示吸热,以 “-”表示放热。△H的数值与反应式中的系数有关,单 位总是kJ· mol-1 。
四、中和热的测定 五、盖斯定律及其应用 ⒈盖斯定律的内容 化学反应的反应热只与反应体系的始态和终态有 关,而与反应的途径无关。也就是说,一个反应可 以分几步进行,则各分步反应的反应热之和与该反 应一步完成时的反应热是相同的。 ⒉盖斯定律的应用 进行很慢,或不易直接发生,或产品不纯的化学 反应,很难直接测得反应的反应热,可通过盖斯定律 获得它们的反应热数据。 利用盖斯定律求反应热时,应注意热化学方程 式在同乘(或除)一个数时,△H也要作相应变化; 物质的分子式可以相加减,△H同样也可以相加减。
1.1.1化学反应与能量变化(第一课时)课件(人教版选修4)

答案: A
共 64 页
35
3.下列说法不正确的是 (
)
A.化学反应过程是原子的重新组合过程 B.化学反应可分为吸热反应和放热反应 C.化学反应中的能量变化与其反应物的量有关 D.化学变化中的能量变化都是以热能的形式表现出来 的
答案: D
共 64 页
36
4. 我们把拆开 1 mol 共价键所吸收的能量或形成 1 mol 共价键所放出的能量叫键能,已知 Cl- Cl 键的键能为 247 kJ/mol,下列有关键能的叙述正确的是 ( )
共 64 页
9
ห้องสมุดไป่ตู้一节
化学反应与能量的变化
第1课时 反应热 焓变
课标定位:①知道化学反应中能量转化的原因,能说出常见的能 量转化形式。②了解反应热的概念,知道化学反应热效应与反应
的焓变之间的关系。
共 64 页
10
预习设计
自主探究
课前预习打基础 · 自学能力步步升
共 64 页
11
填一填· 知识清单
40
共 64 页
5
3.热点 (1)吸热反应和放热反应的本质。 (2)热化学方程式的书写方法。 (3)燃烧热的含义。 (4)盖斯定律的意义和有关反应热的计算。
共 64 页
6
链接情景
中国迈向太空的“第一步”
共 64 页
7
“十、九、八、七、六、五、四、三、二、一!” “点火!” “起飞!” 刹那间烈焰升腾,大漠震颤。宛如巨龙的橘红色火焰 划破秋日的戈壁长空,托举着“ 神舟七号 ”飞船的火箭, 在地动山摇般的轰鸣声中腾空而起,直指苍穹。
答案:A
共 64 页
31
【活学活用 2】 不正确的是( )
高中化学选修四 1.1《化学反应与能量的变化》 课件

①
H2 (g) +
1 2
O2(g) = H2O(g); △H= – 241.8 kJ/mol
②
H2 (g) +
1 2
O2(g) = H2O(l); △H= – 285.8 kJ/mol
③ 2H2 (g) + O2(g) = 2H2O(l); △H= – 571.6 kJ/mol
④ 2H2O(l) = 2H2 (g) + O2(g) ; △H= + 571.6 kJ/mol
1.了解焓变化学含义 2.掌握热化学方程式书写的要求 3.了解中和热测定的方法
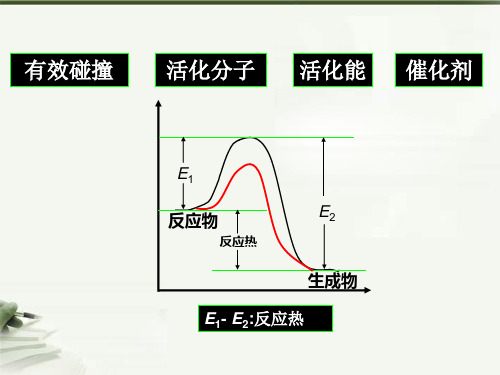
1、化学反应一般要经历的过程Fra bibliotek普通 分子
活化 能
活化 分子
合理 取向的
碰撞
加催化剂
新物质
有效 碰撞
能量
3、焓变、反应热
(1)、焓(H):是与反应物、生成物能量有关的物理量 (2)、焓变(△H):△H= E生成物总- E反应物总 (3)、 △H单位: KJ/mol
放热反应:E反应物总>E生成物总 ∆H为“-”( ∆H<0)
吸热反应:E反应物总<E生成物总; ∆H为“+”( ∆H>0)
反应体系的能量降低
反应体系的能量升高
二.热化学方程式 1、定义: 表明反应所吸收或放出热量的化学方程式 2、观察与分析
H2O(l) H2O(g) △H= + 44 kJ/mol
1.热化学方程式中计量数的化学含义? 2.化学计量数与反应热数值的关系? 3.为什么要标明反应物、生成物状态?
1.化学计量数表示反应物消耗或生成物生成的物质 的量,可以整数或小数。
2.反应热数值和计量数对应比例。
3.物质状态变化同时也有能量变化
高中化学 1.1《化学反应与能量的变化》课件2 新人教版选修4

实验步骤
1.保温。在大烧杯底部垫泡沫塑 料,使放入的小烧杯杯口与大烧 杯杯口相平。然后再在大、小烧 杯之间填满碎泡沫塑料,大烧杯 上用泡沫塑料板(或硬纸板)作 盖板,在板中间开两个小孔,正 好使温度计和环形玻璃搅拌棒通 过,如图所示。
思考1:大、小烧杯放置时,为何要使两杯口相平?填 碎泡沫塑料(或碎纸条)的作用是什么?对此装置, 你有何更好的建议?
思维导图& 超级记忆法& 费曼学习法
1
外脑- 体系优化
知识体系& 笔记体系
内外脑高效学习模型
超级记忆法
超级记忆法-记忆 规律
记忆前
选择记忆的黄金时段
前摄抑制:可以理解为先进入大脑的信息抑制了后进 入大脑的信息
后摄抑制:可以理解为因为接受了新的内容,而把前 面看过的忘记了
超级记忆法-记忆 规律
TIP1:我们可以选择记忆的黄金时段——睡前和醒后! TIP2:可以在每天睡觉之前复习今天或之前学过的知识,由于不受后摄抑制的 影 响,更容易储存记忆信息,由短时记忆转变为长时记忆。
思考5:酸、碱混合时,为何要把量筒中的 NaOH溶液一次倒入小烧杯而不能缓缓倒入?
答:因为本实验的关键是测反应的反应热,若 动作迟缓,将会使热量损失而使误差增大。
5.重复实验两到三次,取测量所得数据的 平均值作为计算依据。
温度 实验次数
1 2 3
起始温度t1/℃ HCl NaOH 平均值
终止温度 t2/℃
第一章 化学反应与能量
第一节 化学反应与能量的变化
物质变化 1、化学反应的特征 能量变化
质量守恒 能量守恒
2、化学反应中能量的变化(吸收和放出),可
以 热能 、 光能 、 电能 及其它形式的能量
高中化学选修四人教版化学反应与能量的变化2课时PPT(53页)

20
跟踪练习2 对于放热反应:2H2(g)+O2(g)=2H2O(l), 下列说法中正确的是( )
A.产物H2O所具有的总能量高于反应物H2和O2所具有 的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有 的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有 的总能量
D.反应物H2和O2比产物H2O稳定 答案 B
23
二、热化学方程式
1.概念 表示参加反应物质的量和反应热的关系的化学方程式, 叫做热化学方程式。 2.表示的意义 (1)反应物和生成物的种类、聚集状态 (2)反应中各物质的物质的量比和质量比 (3)反应中放出或吸收的热量。
24
下面热化方程式表示的意义
2H2(g)+ O2(g)====2H2O(g) △H=-
3
思考题 下列说法中不正确的是( ) A.化学变化过程是原子的重新组合过程 B.化学反应可分为吸热反应和放热反应 C.化学反应中能量变化的多少与其反应物的质量有关 D.化学变化中的能量变化都是以热能形式表现出来的 答案 D
4
阅读思考
1.什么是焓、焓变? 2.焓变与反应热有什么关系?
5
高中化学 选修四 人教版 化学反 应与能 量的变 化2课时 PPT(53 页)
(3)单位: kJ/mol 或kJ·mol-
1
说明: (1)在一定条件下,某一化学反应是吸热反应还
是放热反应,由焓变(△H)决定。
(2)恒压条件下进行的反应,反应的热效应等于焓变。 (3)许多化学反应的反应热可以由实验直接测定。
高中化学 选修四 人教版 化学反 应与能 量的变 化2课时 PPT(53 页)
思考题 下列说法中正确的是( ) A.焓变是指1 mol物质参加反应时的能量变化
跟踪练习2 对于放热反应:2H2(g)+O2(g)=2H2O(l), 下列说法中正确的是( )
A.产物H2O所具有的总能量高于反应物H2和O2所具有 的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有 的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有 的总能量
D.反应物H2和O2比产物H2O稳定 答案 B
23
二、热化学方程式
1.概念 表示参加反应物质的量和反应热的关系的化学方程式, 叫做热化学方程式。 2.表示的意义 (1)反应物和生成物的种类、聚集状态 (2)反应中各物质的物质的量比和质量比 (3)反应中放出或吸收的热量。
24
下面热化方程式表示的意义
2H2(g)+ O2(g)====2H2O(g) △H=-
3
思考题 下列说法中不正确的是( ) A.化学变化过程是原子的重新组合过程 B.化学反应可分为吸热反应和放热反应 C.化学反应中能量变化的多少与其反应物的质量有关 D.化学变化中的能量变化都是以热能形式表现出来的 答案 D
4
阅读思考
1.什么是焓、焓变? 2.焓变与反应热有什么关系?
5
高中化学 选修四 人教版 化学反 应与能 量的变 化2课时 PPT(53 页)
(3)单位: kJ/mol 或kJ·mol-
1
说明: (1)在一定条件下,某一化学反应是吸热反应还
是放热反应,由焓变(△H)决定。
(2)恒压条件下进行的反应,反应的热效应等于焓变。 (3)许多化学反应的反应热可以由实验直接测定。
高中化学 选修四 人教版 化学反 应与能 量的变 化2课时 PPT(53 页)
思考题 下列说法中正确的是( ) A.焓变是指1 mol物质参加反应时的能量变化
江苏省南通市高中化学《化学反应与能量变化》课件 新人教版选修4
ΔH = – 890 kJ/mol
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol ΔH = – 445 kJ/mol
例4、已知在1×105Pa,298K条件下2mol氢 气燃烧生成水蒸气放出484kJ热量,下列热 化学方程式正确是( )
反应热与键能的关系(微观) ΔH=反应物总键能-生成物总键能
H2+Cl2=2HCl
ΔH=[436kJ/mol+243kJ/mol]- 431kJ/mol×2=-183kJ/mol
小结:
E E ∆H= (生成物的总能量)- (反应物的总能量)
= E ∆H
(反应物分子化学键断裂时所吸收的总能量)-
E(生成物分子化学键形成时所释放的总能量)
思考1、在同温、同压下,比较下列反应 放出热量Q1、Q2的大小 A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2
数量的分析:反应物的状态,数量和生成物 的数量都相同,但由于气态水转化为液态要 放出一定热量
∴Q2>Q1
思考2、在同温、同压下,比较下列反应 放出热量Q1、Q2的大小
课堂练习
1.已知充分燃烧a g 乙炔气体时生成1mol二氧化碳 气体和液态水,并放出热量bkJ,则乙炔燃烧的热
化学方程式正确的是( A )
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=+2b kJ/mol C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+b kJ/mol
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol ΔH = – 445 kJ/mol
例4、已知在1×105Pa,298K条件下2mol氢 气燃烧生成水蒸气放出484kJ热量,下列热 化学方程式正确是( )
反应热与键能的关系(微观) ΔH=反应物总键能-生成物总键能
H2+Cl2=2HCl
ΔH=[436kJ/mol+243kJ/mol]- 431kJ/mol×2=-183kJ/mol
小结:
E E ∆H= (生成物的总能量)- (反应物的总能量)
= E ∆H
(反应物分子化学键断裂时所吸收的总能量)-
E(生成物分子化学键形成时所释放的总能量)
思考1、在同温、同压下,比较下列反应 放出热量Q1、Q2的大小 A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2
数量的分析:反应物的状态,数量和生成物 的数量都相同,但由于气态水转化为液态要 放出一定热量
∴Q2>Q1
思考2、在同温、同压下,比较下列反应 放出热量Q1、Q2的大小
课堂练习
1.已知充分燃烧a g 乙炔气体时生成1mol二氧化碳 气体和液态水,并放出热量bkJ,则乙炔燃烧的热
化学方程式正确的是( A )
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=+2b kJ/mol C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+b kJ/mol
人教版高中化学选修四化学反应与能量的变化PPT(46页)

人教版高中化学选修四化学反应与能 量的变 化PPT(4 6页)
三、放热反应与吸热反应 1.生成物_释__放__的总能量与反应物_吸__收__的总 能量的相对大小,决定化学反应是吸热反应 还是放热反应。 (1)当ΔH为“_-_降_”低或ΔH_<_0时,为放热反应, 反应体系能量+_____。 > (2)当ΔH为“__升_”高或ΔH__0时,为吸热反应, 反应体系能量_____。
第一节 化学反应与能量的变化
学习目标 1.了解化学反应中能量转化的原因,能说出 常见的能量转化形式。 2.了解化学能与热能的相互转化;了解吸热 反应、放热反应、反应热等概念。
3.了解热化学方程式的含义并能正确书写热 化学方程式。 4.通过中和反应反应热的测定,初步学习测 定化学反应反应热的实验方法。 5.能正确分析测定反应热时误差产生的原因, 并能采取适当措施减小误差。
人教版高中化学选修四化学反应与能 量的变 化PPT(4 6页)
人教版高中化学选修四化学反应与能 量的变 化PPT(4 6页)
③燃烧反应。如:
2CO+O2==点=燃==2CO2 CH3CH2OH+3O2―点―燃→2CO2+3H2O
④多数化合反应。如: Na2O+H2O===2NaOH CaO+H2O===Ca(OH)2
解析:选BD。化学反应是反应物的原子重新 组合而生成其他物质的过程,这必然包含有 物质拆散成原子而吸收能量和原子相互结合 而释放能量的过程。任何化学反应都一定伴 随着能量变化,但是,这种能量变化是可以 通过多种形式表现出来的,如热量、光、电 能等。
2.下列反应中,生成物的总能量大于反应物 总能量的是( ) A.氢气在氧气中燃烧 B.铁丝在氧气中燃烧 C.硫在氧气中燃烧 D.焦炭在高温下与水蒸气反应
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.在反应H2 (g)+ Cl2 (g) =2HCl(g)中,已 知H-H 键能为436kJ,Cl-Cl键能为247kJ,H-Cl 键能为431kJ,判断该反应是( ) BD A. 吸热反应 B. 放热反应 C. 吸收179kJ热量 D.放出179kJ热量Leabharlann 3.已知:H + H
═
H2 ;
△H = -436KJ/mol,则下列叙述正 确的是( A D ) A. 2个H 原子的能量高于 H2 的能量 B. H 原子的能量低于 H2 的能量 C. H 原子比 H2分子稳定 D. H2分子比 H 原子稳定
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+b kJ/mol
课堂练习
2、氢气在氧气中燃烧产生蓝色火焰,已知 破坏1 mol H-H键消耗的能量为Q1kJ, 破坏1 mol O = O键消耗的能量为Q2kJ, 形成1 mol H-O键释放的能量为Q3kJ。 下列关系式中正确的是( B ) A 2Q1 + Q2 >4Q3 B.2Q1 + Q2 < 4Q3 C. Q1 + Q2 < Q3 D.Q1 + Q 2 = Q3
课堂练习
4、已知 (1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol (2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l )
则a、b、c、d的关系正确的是
ΔH4 = d kJ/mol C
。
A、a<c<0
B、b>d>0
C、2a=b< 0 D、2c=d>0
实践活动 中和反应 反应热的测定
×××中和热
• 1. 定义:在稀溶液中,酸和碱发生中和反应生 成1molH2O(l),这时的反应热叫做中和热。 2. 单位: KJ/mol
S(S)+O2(g)=SO2(g)+Q2 两式数量相同,S由固态吸收热量转化为 气态,在氧化燃烧生成SO2。其放出热量 的总和小于由气态S直接燃烧所放出的热 量,Q1<Q2。
思考3、在同温、同压下,比较下列 反应放出热量Q1、Q2的大小
C: C(S)+1/2O2(g)=CO(g)+Q1 C(S)+O2(g)=CO2(g)+Q2 固态C氧化为CO,释放出热量Q1,CO是气 体燃料,和O2反应生成CO2,又释放热量Q3, 两次释放热量的总和Q1+Q3,等于固态C氧化 为气态CO2释放的热量Q2,∴Q2>Q1
4.已知键能: N≡N: 946KJ/mol, H-H :436KJ/mol, H-N :391KJ/mol N2(g) + 3H2(g) 2NH3(g), 从理论上计算△H为( C ) A.+1800KJ/mol C. – 92KJ/mol B. + 92KJ/mol D. – 46KJ/mol
●学习重点 中和反应反应热的测定 原理和方法。 ●实验用品
大烧杯(500 mL)、小烧杯(100 mL) 温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个 小孔)、环形玻璃搅拌棒。 0.50 mol/L 盐酸、0.55 mol/L NaOH溶液
A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ· -1 mol B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ· -1 mol C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ· -1 mol D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ· -1 mol
④热化学方程式中各物质化学式前面的计量数可以用整数表示, 也可以用分数表示。 ⑤ΔH的数值与反应的计量数成比例; 计量数加倍, ΔH加倍。
相同状况下 H2(g)+Cl2(g)=2HCl(g)+Q1
⑥不需要注明反应的条件。不用↑或↓符号。 ⑦可逆反应向逆向进行时,反应热与正反应 数值相等,符号相反。
C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol ΔH = – 445 kJ/mol
例4、已知在1×105Pa,298K条件下2mol氢 气燃烧生成水蒸气放出484kJ热量,下列热 化学方程式正确是( )
ΔH=[436kJ/mol+243kJ/mol]- 431kJ/mol×2=-183kJ/mol
小结:
E ∆H= E E
∆H=
(生成物的总能量)-
E
(反应物的总能量)
(反应物分子化学键断裂时所吸收的总能量)-
(生成物分子化学键形成时所释放的总能量)
练习
1.已知反应A+B=C+D为放热反应,对该反应 的下列说法中正确的是( ) C A. A的能量一定高于C B. B的能量一定高于D C. A和B的总能量一定高于C和D的总能量 D. 该反应为放热反应,故不必加热就一定能发生
3.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧 生成二氧化碳和液态水时放出48.40kJ 热量。表 示上述反应的热化学方程式正确的是 ( B ) A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g) △H= - 48.40kJ· -1 mol B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l) △H= - 5518kJ· -1 mol C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l) △H= + 5518kJ· -1 mol D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l) △H= - 48.40kJ· -1 mol
∆H = + 68 kJ/mol
例3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧 生成CO2和H2O时,放出445 kJ的热量。则下列热化 学方程式中正确的是( )
C
A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol ΔH = – 890 kJ/mol
5.下列过程中,需要吸收能量的是( C ) A.H+H=H2 B.H+Cl=HCl C.I2→I+I D.S+O2=SO2
二、热化学方程式
能够表示化学反应热效应的化学方程式
1、定义:能表示参加反应物质的量和反应热的 关系的化学方程式。
H2(g) + I2 (g) ==== 2HI(g)
101kPa 200℃
反应过程中能量变化曲线图:
能 量 生成物 能 量 反应物
吸收 热量
放出 热量
反应物
生成物 图2
图1
问题探究二
化学反应的本质是什么?
化学键的断裂和形成
旧键断裂需要 吸 收 能量, 新键形成会 放 出 能量。
所以:一个化学反应是放热还是吸热 取决于 取决于所有断键吸收的总能量与所有 形成新键放出的总能量的相对大小
课堂练习
1.已知充分燃烧a g 乙炔气体时生成1mol二氧化碳 气体和液态水,并放出热量bkJ,则乙炔燃烧的热 化学方程式正确的是( A )
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=+2b kJ/mol C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol
1 2 1 H2(g) + 2
∆H =-184.6 kJ/mol ∆H =-369.2 kJ/mol ∆H =-92.3 kJ/mol
Cl2(g) = HCl(g)
例2:1mol N2(g) 与适量O2(g) 反应生成NO2 (g), 需吸收68kJ的热量;写出热化学方程式。
N2(g) + 2O2(g) = 2NO2 (g)
4.(1)强酸、强碱的稀溶液: +(aq)+OH- (aq)=H2O(l); H
△H=-57.3 kJ/mol
(2)有弱酸(或弱碱)参加中和反应,中和热一 般低于57.3 kJ/mol,因为电离吸热。
(3)若反应过程中有其他物质生成(沉淀、难电 离物质等),这部分反应热不属于中和热
●实验目的
测定强酸与强碱反应的反应热
1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2
热化学方程式的书写步骤: 1、写出化学反应方程式 2、注明反应物和生成物的状态 3、标明反应热△H(注意单位和+、-) 4、注明反应的温度和压强(不注明指 常温常压) 5、检查
例1:当1mol气态H2与1mol气态Cl2反应生成2 mol气态HCl,放出184.6 kJ的热量,请写出该 反应的热化学方程式。 H2(g) + Cl2(g) = 2HCl(g) 2H2(g) + 2Cl2(g) = 4HCl(g)
【练习】
在相同温度下,4gH2完全燃烧生成液态水释
放571.6kJ热量,如果4gH2完全燃烧生成气态 水,释放热量要比571.6kJ( B )
