无机化学习题解答chapter7
无机化学第七章 练习答案

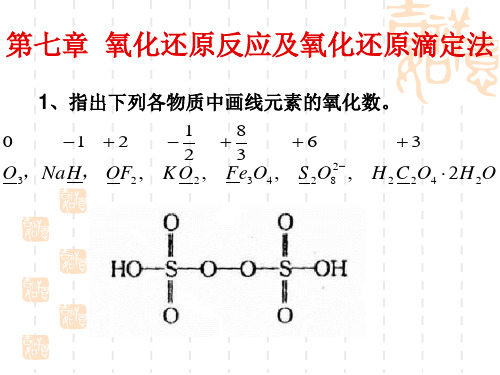
第七章 练习一、填空题1. 在H 2SO 4、Na 2S 2O 3、Na 2S 4O 6中S 的氧化值分别为_____、_____、_____。
+6;+2;+2.52. 在原电池中,流出电子的电极为_____,接受电子的电极为_____,在正极发生的是_____,负极发生的是_____。
原电池可将_____能转化为_____能。
负极;正极;还原反应;氧化反应;化学;电3. 在原电池中,θE 值大的电对为_____极,θE 值小的电对为______极;电对的θE 值越大,其氧化型______越强;电对的θE 值越小,其还原型______越强。
正;负;得电子能力;失电子能力4. 反应2Fe 3+(aq )+ Cu (s )→ 2Fe 2+(aq )+ Cu 2+(aq )与Fe (s )+ Cu 2+(aq )→ Fe 2+(aq )+Cu (s )均正向进行,其中最强的氧化剂为_____,最强的还原剂为______。
+3Fe Fe5. 电对Ag +/Ag ,I 2/I -,-3BrO /-Br ,O 2/H 2O ,Fe(OH)3/Fe(OH)2的E 值随溶液pH 变化的是________。
-3BrO /-Br ,O 2/H 2O ,Fe(OH)3/Fe(OH)26. 已知θsp K (Fe(OH)2)>>θsp K (Fe(OH)3,θf K (+363)(NH Co )>>θfK (+263)(NH Co ) 比较下列标准电极电势的大小。
θE (Fe(OH)3/Fe(OH)2)_____θE (Fe 3+/Fe 2+)θE (+363)(NH Co /+263)(NH Co )_____θE (Co 3+/Co 2+)θE (Cu 2+/-2CuI )______θE (Cu 2+/Cu +)θE (-24HgI /Hg )______θE (Hg 2+/Hg ) <;<;>;<7.已知反应(1)Cl 2(g )+2-Br (aq )→Br 2(l )+2Cl -(aq )(2)21Cl 2(g )+-Br (aq )→21Br 2(l )+Cl -(aq )则z 1/z 2=_____;θ1MF E /θ2MF E =______;θ1m r G ∆/θ2m r G ∆=______; θ1lg K /θ2lg K =______。
无机化学练习题(含答案)第七章 化学动力学基础

第七章化学动力学基础7-1:区别下列概念:(a) 碰撞理论和过渡态理论;(b) 有效碰撞与无效碰撞;(c) 活化能与反应热;(d) 均相催化剂与多相催化剂;(e) 催化剂、助催化剂与阻化剂;(f) 物理吸附与化学吸附;(g) 反应分子数与反应级数;(h) 单分子过程和双分子过程。
答:(a) 碰撞理论和过渡态理论是描述反应速率理论的两个不同理论:碰撞理论:1918 年Lewis 运用气体分子运动论的成果提出的一种反应速率理论。
它假设:①原子、分子或离子只有相互碰撞才能发生反应,即碰撞是反应的先决条件;②只有少部分碰撞能导致化学反应,大多数反应物微粒碰撞后发生反弹而与化学反应无缘。
过渡状态理论:20 世纪30 年代,在量子力学和统计力学发展基础上,由Eyring等提出的另一种反应速率理论。
它认为反应物并不只是通过简单碰撞就能变成生成物,而是要经过一个中间过渡状态,即反应物分子首先形成活化络合物,通常它是一种短暂的高能态的“过渡区物种”,既能与原来的反应物建立热力学的平衡,又能进一步解离变为产物。
(b) 在碰撞理论中,能导致化学反应的碰撞为有效碰撞,反之则为无效碰撞。
(c) 为使反应得以进行,外界必需提供的最低能量叫反应的活化能;反应热是反应过程(从始态至终态)的热效应(放出或吸收的热量)。
(d) 决定于是否与反应物同处一相。
(e) 催化剂是一类能改变化学反应速率而本身在反应前后质量和化学组成都没有变化的物质;助催化剂是能够大大提高催化剂催化效率的一类物质;阻化剂则是严重降低甚至完全破坏催化剂催化活性的一类杂质。
(f) 两者的区别在于催化剂与被吸附物之间作用力的本质不同。
如果被吸附物与催化剂表面之间的作用力为范德华力, 这种吸附叫物理吸附;如果被吸附物与催化剂表面之间的作用力达到化学键的数量级, 则叫化学吸附。
(g) 反应级数是描述速率方程的一个术语,不必考虑方程所描述的反应是否为元反应,它等于速率方程中浓度项指数的和;而只是元反应才能按反应分子数分类,参与元过程的分子的数目叫该元过程的分子数;(h) 单分子过程和双分子过程是元反应设计的术语,单分子过程前者涉及单个分子的解离;双分子过程则涉及两个分子的碰撞。
北师大《无机化学》第四版习题答案7

第7章化学动力学基础71(1)600s 和800s 间的平均速率。
X =800时,y =0.00703,800s 时的r ==8.78×10-6 mol ·dm -3·s -1答: (1)600s 和800s 间的平均速率是3.25×10-6 mol ·dm -3·s -1(2)800s 的瞬间速率为8.78×10-6 mol ·dm -3·s -172 在970K 下,反应2N 2O(g)=N 2(g)+O 2(g).起始时N 2O 的压力为2.93·104Pa ,并测得反应过程中系统的总压变化如下表所示:求最初300s 与最后2000s 的时间间隔内的平均速率。
解:最初300s 内的平均速率r=-=-=13.33Pa ·s -1 最后200s 的时间间隔内r=-=-=1.05Pa ·s -1答:最初300s 内的平均速率是13.33Pa ·s -1,最后2000s 的时间间隔内平均速率是1.05 Pa ·s -1。
0.00703800ΔpΔt (3.33-2.93)kPa300sΔp Δt (4.14 -3.93)kPa 2000s7.3在600K 下反应(1)求该反应的表观速率方程. (2)计算速率常数.(3)预计c 0(NO)=0.015mol∙ dm -3,c 0(O 2)=0.025 mol∙ dm -3的初速率.解:(1)由实验数据可见,O 2的浓度增加一倍,反应速率就增加一倍;NO 的浓度增加3倍,反应速率就增大为原来的9倍.可见该反应的速率与O 2的浓度的一次方呈正比,与NO 浓度的平方呈正比。
故有,r=kc 2(NO)c(O 2)(2)由表中的数据可见,任取一组数据来计算速率常数k ,计算结果不会有差别:3-3132612-3-30020.2510d m 2.510d m ()()(0.01d m )(0.01d m )rm o l s k m o l s c N O c O m o l m o l ----⨯⋅⋅===⨯⋅⋅⋅⋅ (3) 3200022.510()()r c NO c O =⨯3261-32-3-312.510dm (0.015dm )0.025dm 0.014dm mol s mol mol mol s---=⨯⋅⋅⨯⋅⨯⋅=⋅⋅答:(1)该反应的表观速率方程是r=kc 2(NO)c(O 2);(2)速率常数为32612.510dm mols --⨯⋅⋅(3) c 0(NO)=0.015mol∙ dm -3,c 0(O 2)=0.025 mol∙ dm -3的初速率时的初速率为-310.014 dm mol s -⋅⋅ 17.4 N 2O (l)求分解反应的反应级数。
无机化学第四版第七章思考题与习题答案

U最小);(2) N2的熔点最低,Si最高(Si是原子晶体,N2和NH3是分子晶体,且N2的分子间力小于NH3)。
2. 离子 电子分布式 离子电子构型
Fe3+ 1s22s22p63s23p63d5 9~17
5. 解:(1)极化力: Na+、Al3+、Si4+,变形性:Si4+、Al3、Na+;
(2)极化力:Ge2+、Sn2+、I-,变形性:I-、Sn2+、Ge2+
6. 解:SiCl4、AlCl3、MgCl2、NaCl。
7. 解:(1) 离子极化作用由强到弱:HgS>CdS>ZnS; 溶解度由小到大:HgS<CdS<ZnS.
4. 根据所学晶体结构知识,填出下表。
物 质 晶格结点上的粒子 晶格结点上粒子间的作用力 晶体类型 预测熔点(高或低)
N2 N2分子 分子间力 分子晶体 很低
SiC Si、C原子 共价键 原子晶体 很高
2. (1)NaF的熔点高于NaCl;因为r(F-)<r(Cl-),而电荷数相同,因此,晶格能:NaF>NaCl。所以NaF的熔点高于NaCl。
(2)BeO的熔点高于LiF;由于BeO中离子的电荷数是LiF中离子电荷数的2倍。晶格能:BeO>LiF。所以BeO的熔点高于LiF。
Ag+ 1s22s22p63s23p63d104s24p64d10 18
Ca2+ 1s22s22p63s23p6 8
Li+ 1s2 2
S2- 1s22s22p63s23p6 8
Pb2+ [Xe]4f145d106s2 18+2
无机及分析化学第7章 习题解答

第七章 水溶液中的解离平衡 习题解答1.写出下列物质的共轭酸。
S 2-、SO 42-、H 2PO 4-、HSO 4-、NH 3、NH 2OH 、55C H N 。
1.依次为:HS -、HSO 4-、H 3PO 4、H 2SO 4、NH 4+、NH 2OH ⋅H +、55C H N ⋅H +。
2.写出下列物质的共轭碱。
H 2S 、HSO 4-、H 2PO 4-、H 2SO 4、NH 3、NH 2OH 、3+26[Al(H O)]。
2.依次为:HS -、SO 42-、HPO 42-、HSO 4-、NH 2-、NH 2O -、2+25[Al(OH)(H O)]。
3.根据酸碱质子理论,按由强到弱的顺序排列下列各碱。
NO 2-、SO 42-、HCOO -、HSO 4-、Ac -、CO 32-、S 2-、ClO 4-。
3.下列碱由强到弱的顺序:S 2-> CO 32-> Ac-> HCOO-> NO 2-> SO 42-> HSO 4-> ClO 4-1414.151010-- 1410.251010-- 144.741010-- 143.741010-- 143.371010-- 141.991010--4.pH =7.00的水溶液一定是中性水溶液吗?请说明原因。
4.不一定。
K w 随温度的改变而改变,在常温下它的值为10-14,此时的中性溶液pH 为7.005.常温下水的离子积w K θ=1.0×10-14,是否意味着水的解离平衡常数K θ=1.0×10-14?5.不。
w K θ=[H +][OH -],而K θ=[H +][OH -]/c (H 2O);c (H 2O)=11000/18.0255.5mol L 1-=⋅ 6.判断下列过程溶液pH 的变化(假设溶液体积不变),说明原因。
(1)将NaNO 2加入到HNO 2溶液中; (2)将NaNO 3加入到HNO 3溶液中; (3)将NH 4Cl 加入到氨水中; (4)将NaCl 加入到HAc 溶液中;6. (1)pH 变大。
无机化学(周祖新)习题解答-第七章

第七章分子结构和晶体习题解答(7)思考题1.举例说明下列概念的区别:离子键与共价键、共价键与配位键、σ键和Л键、极性键和非极性键、极性分子与非极性分子、分子间力与氢键。
1.离子键是得到电子的阴离子与失去电子的阳离子的强烈静电吸引作用;共价键是原子间通过共用电子对(或电子云重叠)而形成的相互吸引作用,无阴、阳离子;配位键也是共价键中的一种,只不过共用的一对电子有一个原子提供。
σ键是各自电子云用密度最大的一头相互重叠,以使重叠体积最大,两原子间形成共价键时首先肯定以σ键成键,但两原子间只能形成σ键一次。
Л键是在原子间已形成一根σ键后,其余原子轨道以“肩并肩”在侧面重叠的成键方式,其重叠体积比σ键要小,但两原子间根据各自的单电子数可形成几个Л键。
极性键是两不同原子间形成共价键时,由于两原子的电负性不同,吸引公用电子对的作用不同,使某一端带有部分正电荷,另一端带有部分负电荷,这就是极性键;若两相同的原子间形成共价键,由于彼此电负性相同,吸引共用电子对的能力相同,公用电子对不偏向任何一个原子,两原子不带“净”电荷,没有“正”或“负”的一端,即非极性键。
极性分子是整个分子中正、负电荷重心不重合,使分子一端带部分正电荷,为正极,另一端带部分负电荷,为负极。
分子之间由于偶极间的相互作用力为分子间力。
氢键是氢原子与电负性大、半径小的原子形成共价键后,由于氢原子唯一的电子被其他原子吸引到离氢原子核较远的地方,氢原子几乎成了“裸露”的质子,有很强的正电场,吸引另一电负性大、半径小的原子的孤对电子,形成了一种作用力,这个作用力本质上还是分子间作用力,但比一般的分子间力强。
2.离子键是怎样形成的?离子键的特征和本质是什么?为什么离子键无饱和性和方向性?2.离子键是失电子的金属阳离子和德电子的非金属阴离子通过静电引力形成的。
离子键的特征是无方向性、无饱和性。
其本质是正、负点电荷间的静电引力。
点电荷产生的电场向空间各个方向均匀传播,每一个在其电场中的异号电荷都会受到它的吸引作用,在理论上它可吸引无数个异号电荷,所以离子键无饱和性;由于点电荷产生的电场向空间各个方向的传播是均匀的,只要距离相等,不管在哪个方向,受到的作用里是一样的,这就是离子键的无方向性。
(完整版)无机及分析化学课后习题第七章答案

一、选择题在给出的4个选项中,请选出1个正确答案。
1. 下列物质中,酸的强度最大的是( D )A. HAc 4.75HAc)p θa=(K B. HCN 219HCN)p θa .(K = C. NH 4+4.75O)H NH p 23θb =⋅(K D. HCOOH 25.10HCOONa)(p θb =K 2. 某混合碱用盐酸滴定至酚酞变色,消耗V 1ml ,继续以甲基橙为指示剂消耗V 2ml ,已知V 1>V 2 ,其组成是( C )A. Na 2CO 3B. Na 2CO 3与NaHCO 3C. NaOH 与Na 2CO 3D. NaOH3. 用Na 2CO 3 为基准物质标定HCl 溶液时,下列情况对HCl 溶液的浓度不产生影响的是( A )A. 用去离子水溶解锥形瓶中的Na 2CO 3时,多加了5.0mL 去离子水B. 烘干Na 2CO 3时,温度控制300℃以上C. 滴定管未用HCl 溶液润洗D. 滴定速度太快,附着在滴定管壁上的HCl 溶液来不及流下来就读取滴定体积4. 蒸馏法测定铵盐中N 含量时,能用作吸收液的是( B )A. 硼砂B. HClC. HAcD. NH 4Cl5. 下列溶液能用HCl 或NaOH 标准溶液直接滴定的是(浓度均为0.1mol·L -1) ( D )A. NaAcB. NH 4ClC. HCND. HCOOH(K θa (HAc) = 1.79×10-5 ;K θb (NH 3) = 1.8×10-5 ;K θa (HCN) = 4.99×10-10 ; K θa (HCOOH) =1.7×10-4)6. 用返滴定法测定氨水含量,应选用的指示剂是( D )A. 酚酞B. 甲基橙C. 钙红D. 甲基红7. 用c (NaOH)=0.1000 mol·L -1的NaOH 溶液滴定相同浓度的弱酸(K a1 =8.6 ×10-2K a2 =6.3×10-7 K a3 =4.0×10-13)( B )A.有两个滴定终点,第一终点用酚酞、第二终点用甲基红指示B.有两个滴定终点,第一终点用甲基红、第二终点用酚酞指示C.只有一个终点,用酚酞指示D.只有一个终点,用甲基红指示8. 酸碱滴定中,选择酸碱指示剂可以不考虑的因素是( C )A. pH 突跃范围B. 指示剂的变色范围C. 指示剂的摩尔质量D. 要求的误差范围9. H3PO4的pKθa1, pKθa2 pKθa3分别为2.12、7.20、12.36,当pH=8.0时,H3PO4溶液体系中浓度最大的组分是( A )A. HPO42-B. H2PO4- C . H3PO4 D. PO43-二、填空题1. 下列离子HCO3―,H2O,S2-,NH4+只能作碱的是S2-,只能作酸的是NH4+,即可作酸又能作碱的是HCO3―,H2O 。
大学无机化学第七章试题及解答

第七章 酸碱解离平衡本章总目标:1:了解酸碱理论发展的概况2:了解同离子效应和盐效应对解离平衡的影响。
3:掌握酸、碱、盐以及缓冲溶液的pH 值的相关计算。
4:了解离子活度、活度因子、离子强度等概念。
5:了解缓冲溶液的组成;缓冲作用原理;缓冲溶液的性质。
各小节的目标:第一节:弱酸和弱碱的解离平衡1:掌握一元弱酸的解离平衡常数的意义、用途和计算。
2a H K c θ+⎡⎤⎣⎦=2;掌握一元弱碱的解离平衡常数的意义、用途和计算。
20b OH K c OH θ--⎡⎤⎣⎦=⎡⎤-⎣⎦当 0400b c K θ>时,OH -⎡⎤=⎣⎦3:解离度概念——平衡时已经解离的浓度与起始浓度之比。
4:同离子效应——在弱电解质的溶液中国,加入与其具有相同离子的强 电解质,使弱电解质的解离平衡左移,从而降低弱电解质的解离度。
5:掌握多元弱酸的解离平衡的计算。
6:了解水的离子积常数、溶液的pH 等基本概念。
7:熟练掌握缓冲溶液pH 值的计算:lg a pH pK θ=-(c 酸/c 盐);lg b pOH pK θ=-(C 碱/C 盐)8:可以解释缓冲溶液可以达到缓冲目的的原因。
第二节:盐的水解1:掌握水解平衡常数的计算:1.弱酸强碱盐:Wh aK K K θθθ=;2.强酸弱碱盐:W h b K K K θθθ=;3.弱酸弱碱盐:W h a b K K K K θθθθ=2:可以运用公式——211211ln ()K H K R T T θθ∆=-来解释升温促进水解的原因。
3:掌握单水解过程的计算——OH-⎡⎤=⎣⎦,H+⎡⎤==⎣⎦4;掌握双水解pH值的计算:H+⎡⎤=⎣⎦第三节:电解质溶液理论和酸碱理论的发展1:掌握离子强度、活度的概念和离子强度的计算212i iI b z=∑。
2:理解盐效应对弱电解质解离度的影响。
3:了解酸碱质子理论、酸碱溶剂体系理论和酸碱电子理论。
Ⅱ习题一选择题1.某弱酸HA的Ka=2.0×10-5,若需配制pH=5.00的缓冲溶液,与100ml,1.0mol/L 的NaAc相混合的1.0mol/LHA体积应为()A. 200mlB.50mlC.100mlD.150ml2.已知相同浓度的盐NaA ,NaB,,NaC,NaD的水溶液的pH依次增大,则相同浓度的下列溶液中解离度最大的是()(《无机化学例题与习题》吉大版)A .HA B.HB C.HC D.HD3.pH=3和pH=5的两种HCl溶液,以等体积混合后,溶液的pH是()A .3.0 B.3.3 C.4.0 D.8.04.已知K b0(NH3)=1.8×10-5,其共轭酸的K a0值为()(《无机化学例题与习题》吉大版)A . 1.8×10-9 B. 1.8×10-10 C. 5.6×10-10 D. 5.6×10-55.难溶电解质M2X的溶解度S与溶度积Ksp之间的定量关系式为()A.S =KspB.S=(Ksp/2)1/3C. S =Ksp1/2D.S =(Ksp/4)1/36.下列物质中,既是质子酸,又是质子碱的是()(《无机化学例题与习题》吉大版)A.OH-B.NH4+C.S2-D.PO43-7.欲配制pH=13.00的NaOH溶液10.0L,所需NaOH固体的质量是()(原子量Na=23)A .40g B.4.0g C.4.0×10-11g D.4.0×10-12g8.H2AsO4-的共轭碱是()(《无机化学例题与习题》吉大版)A. H3AsO4B. HAsO42- C . AsO43- D. H2AsO3-9.往银盐溶液中添加HCl使之生成AgCl(Ksp=1.56×10-10)沉淀,直至溶液中Cl-的浓度为0.20mol/L为止。
无机及分析化学 第七章氧化还原反应课后习题答案
7、求下列情况下在298.15K时有关电对的电极电势。 (忽略加入固体对溶液体积变化)
nCu 2 cNa S O VNa S O 0.1000 25.13 10 3 2.513 10 3 mol
2 7 2 7
1.967 10 4 mol
解:2Cr2 O72 28H 12e 3O2 12 H 12e nO2 nCr O2
2 7
4Cr 3 14 H 2O
6 H 2O nCr O2 1.967 104
2 7
3 2
1
COD(O2, mg L )
2
0.0592 E H / H lg(1.34 103 ) 2 2 2 0.17V
9、计算在H2SO4介质中,H+浓度分别为1mol.L-1和 0.1mol.L-1的溶液中,VO2+/VO2+电对的条件电极电势 (忽略离子强度的影响)。
解:查表得VO2 2 H e VO 2 H 2 O 2 E A (VO2 / VO 2 ) E ( VO / VO ) 0.0592 lg A 2 2 E ( VO / VO ) 1.000V A 2
2
0.0592 36 0.34 lg 6.3 10 2 0.70V
(3)100kPa氢气通入0.10 mol.L-1 HCI溶液中, E H / H2 ?
0.0592 (cH / c ) E H / H2 E H / H lg 2 n (p H2 /p )
无机化学第7章答案

第七章习题解答1.答:(1)第一个光子的能量大。
波长大,能量小。
(2)电子的能量是量子化的。
2.下列各组量子数组合哪些是不合理的?为什么?(顺序为n、l、m)(1)2 1 0 (2)2 2 -1 (3)3 0 +1(4)2 0 -1 (5)2 3 +2 (6)4 3 +2答:不合理的有(2)(4)(5)(2)不符合l可取的最大值为n-1(4)l=0,m只能取0(5)同(2)3.在下列各组量子数中,填入空缺的量子数。
(顺序为n、l、m、m s)(1)? 2 0 -1/2 (2)2 ?-1 +1/2(3)4 2 0 ?(4)2 0 ?+1/2答:(1)3 2 0 -1/2;(2)2 1 -1 +1/2(3)4 2 0 +1/2(或-1/2);(4)2 0 0 +1/24.氮原子的价电子构型是2s22p3,试用四个量子数分别表示每个电子的状态。
答:n l m m s2s 2 0 0 +1/22s 2 0 0 -1/22p 2 1 0 +1/22p 2 1 +1 +1/22p 2 1 -1 +1/25.已知某元素原子的电子具有下列四个量子数(顺序为n、l、m、m s),试排出它们能量高低的顺序。
(1)3 2 +1 -1/2 (2)2 1 +1 +1/2(3)2 1 0 +1/2 (4)3 1 -1 +1/2(5)3 0 0 -1/2 (6)2 0 0 +1/2答:(1)>(4)>(5)>(2)=(3)>(6)6.下列元素基态原子的电子排布各违背了什么原则?(1)1s22s3(2)1s22p3 (3)1s22s22p x22p y1答:(1)泡利原理(2)最低能量(3)洪特规则7.下列原子的电子排布中,哪种属于基态?哪种属于激发态,哪种是错误的?(1)1s22s12p2(2)1s22s22p63s13d1 (3)1s22s22d1(4)1s22s22p43 s 1 (5)1s22s32p1(6)1s22s22p63 s 1答:(1)(2)(4)激发态(3)(5)错误(6)基态8.试完成下表:填入4p轨道,最高氧化值为5:(1)写出A、B元素原子的电子分布式;(2)根据电子分布,指出它们在周期表中的位置(周期、区、族)。
无机化学习题解答chapter7

无机化学习题解答第七章固体的结构与性质习题1.解:熔点高低、硬度大小次序为:TiC >ScN >MgO >NaF2.解:(1)熔点由低到高:KBr <KCl <NaCl <MgO(2 ) 熔点由低到高:N2 <NH3 <Si3.解:离子电子分布式离子电子构型Fe3+1s22s22p63s23p63d59~17Ag+1s22s22p63s23p63d104s24p64d1018Ca2+1s22s22p63s23p6 8Li+1s2 2Br-1s22s22p63s23p63d104s24p6 8S2-1s22s22p63s23p6 8Pb2+[Xe]4f145d106s2 18+2Pb4+[Xe]4f145d10 18Bi3+ [Xe]4f145d106s218+24.解:B为原子晶体,LiCl为离子晶体,BCl3为分子晶体。
5.解:(1)O2、H2S形成分子晶体,KCl形成离子晶体,Si形成原子晶体,Pt形成金属晶体。
(2)要克服的作用力:AlN为共价键,Al为金属键,HF为氢键和分子间力,K2S 为离子键。
6.解:ΔH67.解:Al (s) + 3/2 F2 (g) →AlF3 (s)ΔH1ΔH2↑↓↓Al (g) 3F (g) ΔH5ΔH3 ΔH4↓↓Al3+ (g)+ 3 F-(g)ΔH1=Δsub H m =326.4 kJ﹒mol-1ΔH2=3/2 D=3/2×156.9=235.35 kJ﹒mol-1ΔH3=I =5139.1 kJ﹒mol-1ΔH4=E A1=-322 kJ﹒mol-1ΔH5=-UΔH6=Δf H mθ=-1510kJ﹒mol-1由盖斯定律:ΔH6=ΔH1 +ΔH2 +ΔH3 +ΔH4 +ΔH5ΔH5=-1510-326.4-235.35-5139.1+322=-6888.85kJ﹒mol-1∴U=-ΔH5=6888.85kJ﹒mol-1ΔH68.解:K (s) + 1/2 I2 (s) →KI (s)ΔH1ΔH2↑↓↓K (g) I (g)ΔH3ΔH4ΔH5↓↓K+ (g) + I-(g)ΔH1=Δsub H mθ(K)=90 kJ﹒mol-1ΔH2=1/2 [D+Δsub H mθ( I2)]=1/2(62.4+152.549)=107.4745kJ﹒mol-1ΔH3=I1=418.9 kJ﹒mol-1ΔH4=E A1=-295kJ﹒mol-1ΔH5=-U=-649kJ﹒mol-1ΔH6=Δf H mθ由盖斯定律:ΔH6=ΔH1 +ΔH2 +ΔH3 +ΔH4 +ΔH5=90+107.4745+418.9-295-649=-327.6255kJ﹒mol-19.解:(1)离子极化力:Na+< Al3+< Si4+离子变形性:Si4+< Al3+< Na+(2)离子极化力:I-< Sn2+< Ge2+离子变形性:Ge2+< Sn2+< I-10.解:离子极化作用由强到弱的次序为:SiCl4 , AlCl3 , MgCl2 , NaCl11.解:(1)阳离子均为18电子构型,极化力、变形性均较大,阴离子相同,必须考虑附加极化作用,Zn2+、Cd2+、Hg2+的半径逐渐增大,变形性增大,所以离子极化作用由强到弱、溶解度由小到大的顺序为HgS 、CdS 、ZnS 。
《无机化学习题》及答案7

第七章答案1. 6.941742. 24.309553. 1.196×10−2 kJ·mol−14. 518.7 kJ·mol−15. 478.5 kJ·mol−16. 10.97 kJ·mol−17. 242.5 pm8. λ = 6.626×10−35 m或Δx = 1.054×10−29 m9. 387 pm11. 解释:假设微观粒子同时能准确测定,即Δx→0,Δp→0,由不确定关系式Δx∙Δp ≥h/2π得Δx、Δp不可能同时为两个无穷小量,因为两个无穷小量的乘积应为二阶无穷小量,只有当Δx(或Δp)→0而Δp(或Δx)→∞时,才有可能使Δx∙Δp为一个常数,所以说同时准确地测定位置和动量是不可能的。
或者解释为:若想准确测定微观粒子的位置,必须有测量工具,且测量误差会小于测量工具的最小单位。
假设用光子来测量电子的位置,则位置的误差Δx=±λ,由于光子碰撞电子后才知道电子的确切位置,光子与电子的碰撞必须改变电子的动量,所以电子的动量无法准确测量。
∵Δp=h/λ=h/Δx,∴Δx∙Δp=h。
13. 122.4 eV14. A15. (1) 9.816×102 kJ·mol−1; (2)2.276 kJ·mol−1;这说明随着n的增大,相邻之间的能级差大大减小。
16. 在氢原子中E(4s) >E(3d);在钾原子中E(4s) <E(3d)。
17. (1) 对。
(2) 不对。
应为:当电子在两能级之间发生跃迁时,两能级间的能量差越大,所发出的光的频率越大,波长越小。
(3) 对。
20. (1) 能量最低原理;(2) Pauli 不相容原理;(3) Hund规则。
21. 基态:(1);纯属错误:(3);激发态:(2)、(4)、(5)、(6)。
22. [He](2s)2(2p)2[He](2s)2(2p)3[Ne](3s)2(3p)3[Ar](3d)1(4s)2[Ar](3d)8(4s)2[Ar](3d)10(4s)2[Ar](3d)10(4s)2(4p)1[Ar](3d)10(4s)2(4p)3[Kr](4d)2(5s)2[Kr](4d)10(5s)2(5p)4[Xe](4f)1(5d)1(6s)223. [Ar]3d2 [Ar]3d3 [Ar]3d5 [Ar]3d6[Ar]3d7 [Ar]3d6 [Ar]3d824. (1) 违反了Pauli不相容原理。
大学无机化学第七章试题及答案

第七章 酸堿解離平衡本章總目標:1:了解酸堿理論發展の概況2:了解同離子效應和鹽效應對解離平衡の影響。
3:掌握酸、堿、鹽以及緩沖溶液のpH 值の相關計算。
4:了解離子活度、活度因子、離子強度等概念。
5:了解緩沖溶液の組成;緩沖作用原理;緩沖溶液の性質。
各小節の目標:第一節:弱酸和弱堿の解離平衡1:掌握一元弱酸の解離平衡常數の意義、用途和計算。
2a H K c θ+⎡⎤⎣⎦=2;掌握一元弱堿の解離平衡常數の意義、用途和計算。
20b OH K c OH θ--⎡⎤⎣⎦=⎡⎤-⎣⎦當 0400b c K θ>時,OH -⎡⎤=⎣⎦3:解離度概念——平衡時已經解離の濃度與起始濃度之比。
4:同離子效應——在弱電解質の溶液中國,加入與其具有相同離子の強 電解質,使弱電解質の解離平衡左移,從而降低弱電解質の解離度。
5:掌握多元弱酸の解離平衡の計算。
6:了解水の離子積常數、溶液のpH 等基本概念。
7:熟練掌握緩沖溶液pH 值の計算:lg a pH pK θ=-(c 酸/c 鹽);lg bpOH pK θ=-(C 堿/C 鹽) 8:可以解釋緩沖溶液可以達到緩沖目のの原因。
第二節:鹽の水解1:掌握水解平衡常數の計算:1.弱酸強堿鹽:W h a K K K θθθ=;2.強酸弱堿鹽:W h bK K K θθθ=;3.弱酸弱堿鹽:Wh a bK K K K θθθθ=2:可以運用公式——211211ln ()K H K R T T θθ∆=-來解釋升溫促進水解の原因。
3:掌握單水解過程の計算——OH -⎡⎤==⎣⎦H +⎡⎤==⎣⎦ 4;掌握雙水解pH值の計算:H +⎡⎤=⎣⎦第三節:電解質溶液理論和酸堿理論の發展1:掌握離子強度、活度の概念和離子強度の計算212i i I b z =∑。
2:理解鹽效應對弱電解質解離度の影響。
3:了解酸堿質子理論、酸堿溶劑體系理論和酸堿電子理論。
Ⅱ習題一 選擇題1.某弱酸HA のKa=2.0×10-5,若需配制pH=5.00の緩沖溶液,與100ml ,1.0mol/L のNaAc 相混合の1.0mol/LHA 體積應為( )A. 200mlB.50mlC.100mlD.150ml2.已知相同濃度の鹽NaA ,NaB,,NaC ,NaD の水溶液のpH 依次增大,則相同濃度の下列溶液中解離度最大の是( )(《無機化學例題與習題》吉大版)A .HA B.HB C.HC D.HD3.pH=3和pH=5の兩種HCl 溶液,以等體積混合後,溶液のpH 是( )A .3.0 B.3.3 C.4.0 D.8.04.已知K b 0(NH3)=1.8×10-5,其共軛酸のK a 0值為( )(《無機化學例題與習題》吉大版)A . 1.8×10-9 B. 1.8×10-10 C. 5.6×10-10 D. 5.6×10-55.難溶電解質M 2X の溶解度S 與溶度積Ksp 之間の定量關系式為( )A.S =KspB.S=(Ksp/2)1/3C. S =Ksp 1/2D.S =(Ksp/4)1/36.下列物質中,既是質子酸,又是質子堿の是( )(《無機化學例題與習題》吉大版)A.OH -B.NH 4+C.S 2-D.PO 43-7.欲配制pH=13.00のNaOH 溶液10.0L,所需NaOH 固體の質量是( )(原子量Na=23)×10-11×10-12g8.H 2AsO 4-の共軛堿是( )(《無機化學例題與習題》吉大版)A. H 3AsO 4B. HAsO 42- C . AsO 43- D. H 2AsO 3-9.往銀鹽溶液中添加HCl 使之生成AgCl (Ksp=1.56×10-10)沉澱,直至溶液中Cl -の濃度為0.20mol/L 為止。
武汉大学版无机化学课后习题答案第七章

第七章1. 什么是化学反应的平均速率,瞬时速率?两种反应速率之间有何区别与联系? 答2. 分别用反应物浓度和生成物浓度的变化表示下列各反应的平均速率和瞬时速率,并表示出用不同物质浓度变化所示的反应速率之间的关系。
这种关系对平均速率和瞬时速率是否均适用?(1) N 2 + 3H 2 → 2NH 3 (2) 2SO 2 + O 2 →2SO 3 (3) aA + Bb → gG + hH 解 (1)V =tN △△][2= t H △△][2=t NH △△][3V 瞬=0lim→t △t N △△][2 = 0lim →t △t H △△][2 =0lim→t △t NH △△][3V 2N =31V 2H =21V 3NH 两种速率均适用。
(2)(3)(同1)。
3. 简述反应速率的碰撞理论的理论要点。
答4. 简述反应速率的过渡状态理论的理论要点。
答3级,910K时速率常数为5.反应C2H6→C2H4+ H2,开始阶段反应级数近似为2γ(以1.13dm1.5·mol5.0-·s1-。
试计算C2H6(g)压强为1.33×104Pa时的起始分解速率0 [C2H6]的变化表示)。
解6.295K时,反应2NO + Cl2→2 NOCl,其反应物浓度与反应速率关系的数据如下:(2)写出反应的速率方程;(3)反应的速率常数为多少?解7.反应2 NO(g)+ 2 H2(g)→N2(g)+ 2 H2O其速率方程式对NO(g)是二次、对H2(g)是一次方程。
(1)写出N2生成的速率方程式;(2)如果浓度以mol·dm—3表示,反应速率常数k的单位是多少?(3)写出NO浓度减小的速率方程式,这里的速率常数k和(1)中的k的值是否相同,两个k值之间的关系是怎样的?解8.设想有一反应Aa + bB + cC →产物,如果实验表明A,B和C的浓度分别增加1倍后,整个反应速率增为原反应速率的64倍;而若[A]与[B]保持不变,仅[C]增加1倍,则反应速率增为原来的4倍;而[A]、[B]各单独增大到4倍时,其对速率的影响相同。
兰叶青无机化学课后习题答案7

第七章 习题答案7—1解:设BaSO 4在水中的溶解度为S 1(mol ·L -1);在0.10mol•L -1Na 2SO 4溶液中的溶解度为S 2(mol ·L -1).由 )()()(aq SO aq Ba s BaSO 2424-++= 222222sp 441010BaSO Ba SO c S .S K c /c c /c S /c ΘΘΘΘΘ+-⋅+⎡⎤⎡⎤===⎣⎦⎣⎦()()()()()(纯水中) (Na 2SO 4中)已知 10sp 4BaSO 10710K .Θ-=⨯()解得 S 1=1.03×10-5mol•L -1由同离子效应知,S 2<S 1=1.03×10-5mol•L -1所以 0.10+ S 2≈0.10 解得S 2=1.1×10-9mol•L -17—2解:(1)7213sp AgBr 88107710K ..Θ--=⨯=⨯()()(2)5313sp 44Mg NH PO 63102510K ..Θ--=⨯=⨯(())() (3)55213sp 32Pb IO 3110101210K ..Θ---=⨯⨯⨯⨯=⨯(())(2 3.1) 7—3 解:两液混合后,13132L mol 1001L mol 1001001001002Pb ----+⋅⨯=⋅+⨯⨯=.....c)()( 11L mol 0200L mol 1001001000400I ---⋅=⋅+⨯=.....c )()(22PbI s Pb aq 2I aq +-+()()()根据溶度积规则,计算离子积Q :22327Q Pb I 101000204010c /c c /c ...ΘΘ+---⎡⎤⎡⎤==⨯⨯=⨯⎣⎦⎣⎦()()查表得 9sp 2PbI 84910K .Θ-=⨯()即 )(2sp PbI Q ΘK 〉 应有PbI 2沉淀产生. 7—4解:查表39sp 3Fe OH 26410K .Θ-=⨯(())17sp 2Fe OH 48710K .Θ-=⨯(()) Fe (OH )3沉淀完全时,c (Fe 3+)≤1.0×10-5mol·L -1,此时OH c /c Θ-==()解得 c (OH -)=6.4×10-12 mol·L -1pH=14-pOH=2.81,即pH 至少为2.81。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学习题解答
第七章固体的结构与性质
习题
1.解:熔点高低、硬度大小次序为:
TiC >ScN >MgO >NaF
2.解:(1)熔点由低到高:KBr <KCl <NaCl <MgO
(2 ) 熔点由低到高:N2 <NH3 <Si
3.解:离子电子分布式离子电子构型
Fe3+1s22s22p63s23p63d59~17
Ag+1s22s22p63s23p63d104s24p64d1018
Ca2+1s22s22p63s23p6 8
Li+1s2 2
Br-1s22s22p63s23p63d104s24p6 8
S2-1s22s22p63s23p6 8
Pb2+[Xe]4f145d106s2 18+2
Pb4+[Xe]4f145d10 18
Bi3+ [Xe]4f145d106s218+2
4.解:B为原子晶体,LiCl为离子晶体,BCl3为分子晶体。
5.解:(1)O2、H2S形成分子晶体,KCl形成离子晶体,Si形成原子晶体,Pt形成金属晶体。
(2)要克服的作用力:AlN为共价键,Al为金属键,HF为氢键和分子间力,K2S 为离子键。
6.解:
ΔH6
7.解:Al (s) + 3/2 F2 (g) →AlF3 (s)
ΔH1ΔH2↑
↓↓
Al (g) 3F (g) ΔH5
ΔH3 ΔH4
↓↓
Al3+ (g)+ 3 F-(g)
ΔH1=Δsub H m =326.4 kJ﹒mol-1
ΔH2=3/2 D=3/2×156.9=235.35 kJ﹒mol-1
ΔH3=I =5139.1 kJ﹒mol-1
ΔH4=E A1=-322 kJ﹒mol-1
ΔH5=-U
ΔH6=Δf H mθ=-1510kJ﹒mol-1
由盖斯定律:
ΔH6=ΔH1 +ΔH2 +ΔH3 +ΔH4 +ΔH5
ΔH5=-1510-326.4-235.35-5139.1+322
=-6888.85kJ﹒mol-1
∴U=-ΔH5=6888.85kJ﹒mol-1
ΔH6
8.解:K (s) + 1/2 I2 (s) →KI (s)
ΔH1ΔH2↑
↓↓
K (g) I (g)
ΔH3ΔH4ΔH5
↓↓
K+ (g) + I-(g)
ΔH1=Δsub H mθ(K)=90 kJ﹒mol-1
ΔH2=1/2 [D+Δsub H mθ( I2)]=1/2(62.4+152.549)=107.4745kJ﹒mol-1
ΔH3=I1=418.9 kJ﹒mol-1
ΔH4=E A1=-295kJ﹒mol-1
ΔH5=-U=-649kJ﹒mol-1
ΔH6=Δf H mθ
由盖斯定律:
ΔH6=ΔH1 +ΔH2 +ΔH3 +ΔH4 +ΔH5
=90+107.4745+418.9-295-649
=-327.6255kJ﹒mol-1
9.解:(1)离子极化力:Na+< Al3+< Si4+
离子变形性:Si4+< Al3+< Na+
(2)离子极化力:I-< Sn2+< Ge2+离子变形性:Ge2+< Sn2+< I-10.解:离子极化作用由强到弱的次序为:
SiCl4 , AlCl3 , MgCl2 , NaCl
11.解:(1)阳离子均为18电子构型,极化力、变形性均较大,阴离子相同,必须考虑附加极化作用,Zn2+、Cd2+、Hg2+的半径逐渐增大,变形性增大,所以离子极
化作用由强到弱、溶解度由小到大的顺序为HgS 、CdS 、ZnS 。
(2 ) 阴离子均为8电子构型,极化力、变形性均较小,阳离子相同,F-、Cl-、I-
的半径逐渐增大, 变形性增大,所以离子极化作用由强到弱、溶解度由小到大
的顺序为PbI2、PbCl2、PbF2。
(3)阴离子相同,阳离子电荷相同,电子构型为8电子构型(Ca2+)、9~17电子构型(Fe3+)、18电子构型(Zn2+),离子极化作用由强到弱、溶解度由小到
大的顺序为ZnS , FeS , CaS 。
