(完整版)第二章缩聚和逐步聚合
高分子化学-第二章 缩聚和逐步聚合
N0
N0
反应程度与转化率的区别
转化率:参加反应的单体量占起始单体量的分数,是指已 经参加反应的单体的数目
反应程度:则是指已经反应的官能团的数目
例如: 一种缩聚反应,单体间双双反应很快全部变成二聚体,就 单体转化率而言,转化率达100%;而官能团的反应程度 仅50%
反应程度与平均聚合度的关系
聚合度是指高分子中含有的结构单元的数目
聚加成:形式上是加成反应,但反应机理是逐步反应。 如聚氨酯的合成(p17)。
开环反应:部分开环反应为逐步反应,如水、酸引发的己内 酰胺的开环反应。
氧化-偶合:单体与氧气的缩合反应, 如 2,6-二甲基苯酚和氧 气形成聚苯撑氧,也称聚苯醚。
2 逐步聚合反应的特点
官能团间的反应,无特定的活性中心;无所谓的引发、 增长、终止等基元反应;反应逐步进行,每一步的反 应速率和活化能大致相同;
[ H + ][ A- ] KHA =
[ HA ]
[ HA ] [ H + ] [ A- ] = KHA
代入式
-d [ COOH ] = k1k3[ COOH ][OH ][ H+]
dt
k 2KHA
催化用酸HA:可以是二元酸本身,但反应较慢,也可以是 外加酸,如H2SO4,大大加速
自催化缩聚反应
无外加酸,二元酸单体催化剂,[HA] = [COOH]
Flory对此进行了解释:
官能团等活性理论是近似的,不是绝对的,这一理论大大简化了研 究处理,可用同一平衡常数表示,整个缩聚过程可以用两种官 能团之间的反应来表征
COOH + HO
k1
OCO
k1
2. 线型缩聚动力学
不可逆条件下的缩聚动力学
高分子化学第二章-缩聚及逐步聚合

l 按反应热力学的特征分类 平衡缩聚反应 指平衡常数小于 103 的缩聚反应 不平衡缩聚反应 平衡常数大于 103
l按生成聚合物的结构分类 线型缩聚 体型缩聚
2.2.3 特点
缩聚反应是缩合聚合反应的简称,是缩合反应多 次重复结果形成缩聚物的过程。 1、典型缩合反应——形成低分子化合物
3 、反应程度与数均聚合度的关系
数均聚合度是指高分子中含有的结构单元的数目。
Xn
起始单体数目
=
达到平衡时同系物数目(大分子数)
N0 N
代入反应程度关系式
P = N0-N = 1- N
N0
N0
P = 1- 1 Xn
1 Xn = 1-P
一般 Xn 100~200 P提高到
0.99~0.995
300 250 200
a. 密闭体系中,nw=P
Xn
1 P
K=
1 nw
K
当M n 104 , P 1, X n
K nw
平衡缩聚中数均聚合度与平衡常数
及小分子副产物浓度三者关系
Xn只与温度有关,与其他无关。(因为nw平衡时为定值)
b. 敞开体系,水排出,则 nw为体系中剩余的。
说明:X
的影响因素
n
密闭体系,只与T有关 敞开体系,与排出的水有关
3、缩聚中的副反应 副反应
消去反应 化学降解 链交换反应
消去反应
HOOC(CH2)nCOOH
HOOC(CH2)nH + CO2
二元酸脱羧温度(℃)
己二酸 300~320 庚二酸 290~310 辛二酸 340~360 壬二酸 320~340 癸二酸 350~370
《材化高分子化学》第2章 缩聚和逐步聚合

6
第二章 缩聚和逐步聚合
Diels-Alder加成聚合:单体含一对共轭双键,如:
+
与缩聚反应不同,逐步加成聚合反应没有小分 子副产物生成。
7
第二章 缩聚和逐步聚合
逐步聚合还可以按以下方式分类:
逐步聚合
线形逐步聚合 非线形逐步聚合
(1)线形逐步聚合反应 参与反应的每种单体只含两个功能基,聚合产物分子链
19
第二章 缩聚和逐步聚合
★ 浓度很低时,A功能基旁同一分子链上的B功能基浓度较 高,相互反应生成环状高分子。
环化反应经常被用来合成环状低聚物与环状高分子。 环化低聚物可用做开环聚合的单体,具有以下的优点: (1)没有小分子副产物生成; (2)聚合反应速率高; (3)所得聚合物的分子量分布窄。
环状高分子则由于不含未反应的末端功能基,其分子量 和性能不会因末端功能基间的反应而不稳定。
n 聚体 + m 聚体
(n + m) 聚体 + 水
缩聚反应无特定活性种,各步反应速率和活化能基本相等。
23
第二章 缩聚和逐步聚合
在缩聚反应早期,单体之间两两反应,转化率很高,但
分子量很低,因此转化率无实际意义。用基团的反应程度P
来表示聚合深度。
反应程度P定义为参与反应的基团数(N0-N)占起始
基团数的分数,
13
第二章 缩聚和逐步聚合
HOOC-R-COOH + HO-R'-OH
HOOC-R-COO-R'-OH + H2O 二聚体
HOOC-R-COO-R'-OH +
HOOC-R-COOH HO-R'-OH
(完整版)第二章缩聚和逐步聚合

第二章缩聚和逐步聚合思考题2.1简述逐步聚合和缩聚、缩合和缩聚、线形缩聚和体形缩聚、自缩聚和共缩聚的关系和区别。
解(1)逐步聚合和缩聚逐步聚合反应中无活性中心,通过单体中不同官能团之间相互反应而逐步增长,每步反应的速率和活化能大致相同。
缩聚是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,缩聚物为主产物,同时还有低分子副产物产生,缩聚物和单体的元素组成并不相同。
逐步聚合和缩聚归属于不同的分类。
按单体—聚合物组成结构变化来看,聚合反应可以分为缩聚、加聚和开环三大类。
按聚合机理,聚合反应可以分成逐步聚合和连锁聚合两类。
大部分缩聚属于逐步聚合机理,但两者不是同义词。
(2)缩合和缩聚缩合反应是指两个或两个以上有机分子相互作用后以共价键结合成一个分子,并常伴有失去小分子(如水、氯化氢、醇等)的反应。
缩聚反应是缩合聚合的简称,是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,主产物为大分子,同时还有低分子副产物产生。
l-1、1-2、1-3等体系都有一种原料是单官能度,只能进行缩合反应,不能进行缩聚反应,缩合的结果,只能形成低分子化合物。
醋酸与乙醇的酯化是典型的缩合反应,2-2、2-3等体系能进行缩聚反应,生成高分子。
(3)线形缩聚和体形缩聚根据生成的聚合物的结构进行分类,可以将缩聚反应分为线形缩聚和体形缩聚。
线形缩聚是指参加反应的单体含有两个官能团,形成的大分子向两个方向增长,得到线形缩聚物的反应,如涤纶聚酯、尼龙等。
线形缩聚的首要条件是需要2-2或2官能度体系作原料。
体形缩聚是指参加反应的单体至少有一种含两个以上官能团,并且体系的平均官能度大于2,在一定条件下能够生成三维交联结构聚合物的缩聚反应。
如采用2-3官能度体系(邻苯二甲酸酐和甘油)或2-4官能度体系(邻苯二甲酸酐和季戊四醇)聚合,除了按线形方向缩聚外,侧基也能缩聚,先形成支链,进一步形成体形结构。
(4)自缩聚和共缩聚根据参加反应的单体种类进行分类,可以将缩聚反应分为自缩聚、混缩聚和共缩聚。
高分子化学第二章 缩聚和逐步聚合

O=
C
H2C─C O H2C─CH2
H2C O
H2C CH2 CH2
20
• HO–(CH2)n–COOH缩聚
n=1,2HOCH2COOH HOCH2COOCH2COOH O=C-CH2O-C=O + H2O OCH2
21
• n=2
HO(CH2)2COOH
CH2=CH-COOH+H2O
• n=3 HO(CH2)3COOH
CH2-C=O CH2-CH2-O + H2O
22
• n=4 HO(CH2)4COOH
CH2-CH2-C=O CH2-CH2-O + H2O
• n>=5,成链,形成线形聚合物。
23
• 成环倾向大小,主要取决于单体的结构, 受反应条件的影响较小。
• 环上取代基或环上元素改变时,环的稳定 性也相应变化。
• 在工业上:锦纶大量用来制造轮胎帘子 布、工业用布、缆绳、传送带、帐篷、 鱼网等,还可用作降落伞。
64
• 还可用于制造轴承、齿轮、滚子、 滑轮、辊轴、风扇叶片、涡轮、垫 片等。
65
全芳聚酰胺
• 是20世纪60年代由美国的杜邦公司首先开 发成功的。
13
自由基聚合
线型缩聚
③只有链增长才使聚 ③任何物种间都能反应, 合度增加,从一聚体 使分子量逐步增加。反应 增长到高聚物,时间 可以停留在中等聚合度阶 极短,中途不能暂停。段,只在聚合后期,才能 聚合一开始,就有高 获得高分子量产物。 聚物存在。
④在聚合过程中,单 ④聚合初期,单体几乎全
体逐渐减少,转化率 部缩聚成低聚物,以后再
(2—23式)
• 水部分排出时:
-dC/d t =k1 [ (1-P)2-P•nW/ K]
第二章 缩聚和逐步聚合

§2-3 缩聚反应的机理和动力学
§2.3.1 缩聚反应的基本过程 (1 ) 大分子的生长反应
a ABb + a A B + ab a A B + ab
aAa + b B b a A B m
n
m +n
特点:大分子之间可以互相反应产生更大的分子。
17
(2)大分子生长过程的停止
a. 热力学平衡的限制---缩聚反应的逆反应解缩聚
+ HO
O C R' COOH H OROCOR' CO m OH
( ( )
(
HCOORR' CO
OROCOR' CO n OH
)
)
2 H 2N CH 2 n NH2
( )
2 C CH 2 n1
)
NH
+ 2NH 3 + NH 3
H 2N CH 2 n NH CH 2 n NH2
+
21
§2.3.1
线性缩聚反应动力学
13
●单体中官能团的空间分布对产物结构与性能的影响
nH2N- -NH2 + nClOC- -COCl
H-NH-
-NHOC-
-CO-Cl + (2n-1)HCl
n
聚对苯二甲酰对苯二胺
结晶性高聚物,能溶于浓硫酸中,不溶解于有机溶剂
nH2N NH2 H-NH NHOC
聚间苯二酰间苯二胺
+ nClOC COCl + (2n-1)HCl CO- Cl n
脲醛缩聚反应 聚烷基化反应 聚硅醚化反应
脲醛树脂 聚烷烃 有பைடு நூலகம்硅树脂
6
n [CH2]
-Si-O-
第2章缩聚和逐步聚合反应

大部分缩聚属于逐步聚合,缩聚也占了逐步聚 合的大部分。有时候换用,但不是一个概念。 逐步聚合的概念: 逐步聚合反应指随着反应时间的延长,相对分 子质量逐步增大的聚合反应。 聚合初期,单体通过官能团反应变为低聚物, 然后由低聚物转化为高聚物。 单体、低聚物和高聚物之间任何两个分子都可 以反应,相对分子质量逐步增大,聚合物链逐 渐增长。 反应的中间物可以分离出来,并能再进一步反 应。
也称A-A型缩聚,如:
② 混缩聚(或称为杂缩聚) mixing polycondensation 由两种具有不同官能 团(功能基)的单体参加的缩聚反应,这两 种单体自身都不能进行均缩聚。通式为:
如二元酸和二元胺,二元酸和二元醇的缩 聚反应(2-2官能度体系)。
③ 共缩聚 (co-condensation polymerization) 在均缩聚中加入第二种单体进行缩聚, 或在混缩聚中加入第三种甚至第四种单 体进行的缩聚反应。通式分别为:
线形缩聚产物相对分子质量或聚合度与反 应程度之间有怎样的关系?
聚合度:进入大分子链中的平均总单体数 (或结构单元数)。
式(2-3)同样适用于“a-A-a + b-B-b”型(2/2官能度 体系) 缩聚反应。如等量的二元酸和二元醇之间的 反应。
如果设 为平均相对结构单元质量,则 线型缩聚产物的数均相对分子质量为:
如果羧基数和羟基数相等,令其起始浓 度C0=1,时间t的浓度为C,
C= C0*(1-P)=1-P。则酯的浓度为 1-C=P,水全未排除时,水的浓度也是P 。 如果一部分水排出,残留水的浓度为nw
上式表明:总反应速率与反应程度P、低分子副产物含 量nw、平衡常数K有关
2.5 线型缩聚物的聚合度
逐步聚合反应的分类: 缩聚反应、逐步加成聚合反应
02 缩聚和逐步聚合

HO CH2 CH2 OH
+
HOOC
COOH
O H2N R N H2
O R' C OH
+
HO
C
CH3 HO
O OH
C
CH3
+
Cl
C Cl
OH
H
OH
H
+
H C H2O
OH
+
OH
H
C H2
CH2
H
CH3
O OH
n HO
C
CH3
+ (n+2) ClCH2
C CH2 H
3、氧化偶联聚合反应 通过氧化偶联反应生成聚合物的反应。 例如:苯的氧化偶联聚合生成聚苯;酚的氧化偶联 聚合生成聚苯醚。 4、逐步加成聚合反应 通过加成反应逐步生成聚合物的反应。 例如:聚氨酯的合成、D-A聚合等,反应式见p17 表2-1。
一、线形缩聚与成环倾向 1、反应倾向 一般来说,5、6元环比较稳定,因此如果形成的是5、6元 环,则易发生成环反应; 否则,主要发生线形缩聚反应。
2、影响因素 单体浓度,影响着成环反应与线形缩聚的竞争。 成环反应是单分子反应,缩聚则是双分子反应, 因此,低浓度有利于成环反应,高浓度有利于缩聚反应。
有特殊官能团单体 有特殊的活性中心
线形缩聚
烯烃 无特殊的活性中心
有基元反应,各步Ea 无基元反应,各步Ea 不同 相同 分子量随时间不变, 转化率随时间增加 单体 +大分子+微量引 发剂 C% 分子量随时间增加, 转化率随时间不变 聚合度不等的同系物 P
单体及引发剂浓度、 平衡常数、单体比例、 温度、阻聚剂、分子 温度、…… 量调节剂、……
第2章缩聚及其他逐步聚合反应

高分子化学
第2章 缩聚及其他逐步聚合反应
2.1-2.3
2.2.1.2 缩聚反应的类型 按参加反应的单体种类分类 (1)均缩聚:只有一种单体参加的缩聚反应,其重复单元 只含有一种结构单元。单体本身含有能发生缩合反应的两种 官能团。 如由氨基酸单体合成聚酰胺:
(2)混缩聚:由两种单体参与、但所得聚合物只有一种重 复结构单元的缩聚反应,其起始单体通常为对称性双功能基 单体,如aRa和bR ′ b,聚合反应通过X和Y功能基的相互反 应进行。
2.1-2.3
(1)实验依据d: (2)理论分析: 官能团的活性取决于官能团的碰撞频率,而不是大分子的扩散 速率。 碰撞频率:单位时间内一个官能团与其他官能团碰撞的次数。 大分子的整体扩散速率很低,大分子链末端的官能团的活动性 要比整个大分子大很多。
(3)“等活性”理论需满足的条件
缩聚反应体系必须是真溶液、均相体系。 官能团所处的环境——邻近基团效应和空间阻碍在反应过程中 不变。 聚合物的相对分子质量不能太高,反应速率不能太大,体系粘 度不能太高。 第2章 缩聚及其他逐步聚合反应 2.1-2.3 高分子化学
第2章 缩聚及其他逐步聚合反应
2.1 聚合反应类型及特点
在高分子工业中具有重要地位:
1.大多数杂链聚合物都是由逐步聚合而成:聚酯、聚酰胺、聚 氨酯、酚醛树脂、环氧树脂等。
2.许多带芳环的耐高温聚合物如聚酰亚胺由逐步聚合而成。
3.逐步聚合可以合成很多功能高分子,如离子交换树脂。
4.许多天然生物高分子通过逐步聚合而得:蛋白质,多糖等。
n HOOC-R-COOH + n HO-R'-OH
高分子化学
O O HO ( C R C OR'O ) H + (2n-1) H2O n
第二章 缩聚和逐步聚合

自催化作用下的聚酯化反应,1/(1-p)2 与t 成线性关系
22
引入聚合度与反应程度的关系式
23
♣ 外加酸催化缩聚 则:
一般地,
二级反应 积分并引入p,得:
24
2)平衡条件下的缩聚动力学
聚酯化反应平衡常数K值较小,小分子副产物若不 及时排除,逆反应不能忽视 令羧基的起始浓度为C0 ,t 时刻的浓度为C;分别考虑 水不排除和部分排除(残留水的浓度为nw)两种情况
♣ K中等:如聚酰胺反应(K≈300~500),低分子 副产物对分子量有所影响。
♣ K很大:可看作不可逆反应。如聚砜、聚碳酸酯等 反应(K>1000)。
16
2.4 线形缩聚动力学
1. 官能团等活性概念
“官能团等活性”假定:任何反应阶段,不论单 体、低聚体、多聚体或高聚物,其两端官能团的 反应能力不随分子链的增长而变化,每一步反应 的平衡常数相同。
q+2 ( Na+Nb ) / 2 1 +r Xn = = = ( Na+Nb-2 NaP ) / 2 1 +r-2rP q+2( 1 -P )
36
q+2 ( Na+Nb ) / 2 1 +r Xn = = = ( Na+Nb-2 NaP ) / 2 1 +r-2rP q+2( 1 -P )
若q很小
10
2. 线形缩聚机理
机理特征:逐步、可逆
是官能团间的逐步反应,且每一步都是可逆的。 ∴逐步的可逆平衡反应
11
….
3. 聚合度与反应程度p的关系
单体转化率C%——已反应单体量与起始单体量
的比值
反应程度p——已反应官能团量与起始官能团量
的比值p=(N0-N)/N0 注意区别!
12
以等摩尔的二元酸和二元醇的缩聚为例
高分子化学第02章 缩合和逐步聚合反应

2020/2/2
16
3). 反应程度
在缩聚反应中,常用反应程度来描述反应的深度。
反应程度:是参加反应的官能团数占起始官能团数的分 数,用P表示。 反应程度可以对任何一种参加反应的官能团而言,以等 物质量的二元酸和二元醇的缩聚反应为例:
2020/2/2
17
假定:
体系中起始二元酸和二元醇的分子总数为N0 t 时的聚酯分子数为N
反应程度和平衡常数对缩聚物聚合度有影响,但通常不 利用它们调控聚合度。
2020/2/2
47
例:对苯二甲酸(NAmol)和乙二醇(NBmol)反应得到聚酯,试求: (1)NA=NB=1mol,数均聚合度为100时的反应程度p (2)当平衡常数K=4时,要求生成的数均聚合度为100,体系中的水量(mol)
即对于聚酯合成,若反应体系封闭,因K≈4,则
在密闭 体系
聚酯化反应,K = 4, p = 0.67,X n 只能达到 3 聚酰胺反应,K = 400, p = 0.95,X n 只能达到21 不可逆反应 K = 104, p = 0.99,X n 只能达到101
2020/2/2
43
非密闭体系 在实际操作中,要采取措施排出小分子
解:(1)当NA=NB=1mol时,
n
1 1-p
100, p
0.99
(2)当平衡常数K=4,X n 100 ,体系中生成的水nw为:
X n K 100 pnw
nw K 2 4 104 mol Xn
2020/2/2
48
2.5.3 基团数比对聚合度的影响
HOCH2
CH2OH C CH2OH CH2OH
季戊四醇
高分子化学2 缩聚和逐步聚合

第二章 缩聚和逐步聚合
2.2 缩聚反应
若参与反应的物质均为二官能度的,则缩合反应转化 为缩聚反应。
以二元羧酸与二元醇的聚合反应为例。当一分子二元 酸与一分子二元醇反应时,形成一端为羟基,一端为羧基 的二聚物;二聚物可再与二元酸或二元醇反应,得到两端 均为羟基或均为羧基的三聚体,也可与二聚体反应,得到 四聚体;三聚体既可与单体反应,也可与二聚体或另一种 三聚体反应,如此不断进行,得到高分子量的聚酯。
CH2 O CO
CH2 CH2
HO(CH2)4COOH
CH2
CH2 CH2
O CO
CH2
22
第二章 缩聚和逐步聚合
3.2 线形缩聚机理
线形缩聚反应有两个显著的特征:逐步与可逆平衡。 1)聚合过程的逐步性
以二元酸和二元醇的缩聚为例。在缩聚反应中,含羟 基的任何聚体与含羧基的任何聚体之间都可以相互缩合。 随着反应的进行,分子量逐步增大,达到高分子量聚酯。 通式如下:
13
第二章 缩聚和逐步聚合
HOOC-R-COOH + HO-R'-OH
HOOC-R-COO-R'-OH + H2O 二聚体
HOOC-R-COO-R'-OH +
HOOC-R-COOH HO-R'-OH
HOOC-R-COO-R'-OOC-R-COOH + H2O 三聚体
HO-R'-OOC-R-COO-R'-OH + H2O
如光气法制备聚碳酸酯,合成聚砜等。
逐步特性是所有缩聚反应共有的,可逆平衡的 程度则各类缩聚反应有明显差别。
28
第二章 缩聚和逐步聚合
3.3 缩聚过程中的副反应
高分子化学导论第2章线性缩聚和逐步聚合

2.7 体形缩聚和凝胶化作用
一. 体形缩聚 1. 定义
在缩聚反应中,参加反应的单体只要有一种单体具有 两个以上官能团( f >2),缩聚反应将向三个方向发展, 生成支化或交联结构的体形大分子,称为体形缩聚。 体形缩聚的最终产物称为体形缩聚物。
r
=
Na
Na+2Nc
2表示1个分子Cb中的1个基 团b相当于一个过量的bBb 分子双官能团的作用
q=
Nc Na
=
2Nc Na
2
推导过程同上
r
=
1
q+1
1+r
q+2
Xn = 1+r-2rP = q+2( 1-P )
和前一种情况相同,只是 r 和 q 表达式不同
3)aRb 加少量单官能团物质Cb(分子数为Nc) 基团数比和分子过量分率如下:
Polymer Chemistry
高分子化学
缩聚和逐步聚合
2.1 发展历史
按聚合机理或动力学分类:
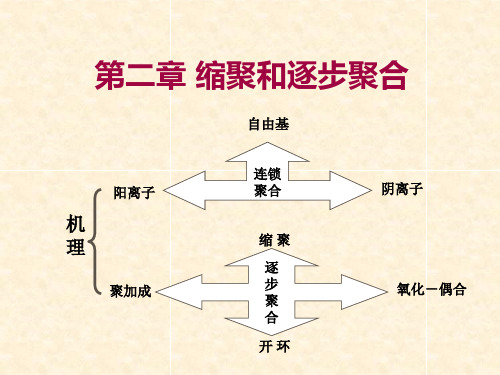
• 逐步聚合(stepwise polymerization) 无活性中心,单体官能团间相互反应而逐步增长
• 连锁聚合(chain polymerization) 活性中心(active center)引发单体,迅速连锁增长
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
若q很小
高分子化学第二章 缩聚和逐步聚合(复习内容)

第二章缩聚与逐步聚合名词解释连锁聚合(Chain Polymerization):活性中心引发单体,迅速连锁增长的聚合。
烯类单体的加聚反应大部分属于连锁聚合。
连锁聚合需活性中心,根据活性中心的不同可分为自由基聚合、阳离子聚合和阴离子聚合。
逐步聚合(Step Polymerization):无活性中心,单体官能团之间相互反应而逐步增长。
绝大多数缩聚反应都属于逐步聚合。
加聚反应(Addition Polymerization):即加成聚合反应,烯类单体经加成而聚合起来的反应。
加聚反应无副产物。
缩聚反应(Condensation Polymerization):即缩合聚合反应,单体经多次缩合而聚合成大分子的反应。
该反应常伴随着小分子的生成。
线形缩聚(Linear Poly-codensation):在聚合反应过程中,如用2-2 或 2 官能度体系的单体作原料,随着聚合度逐步增加,最后形成高分子的聚合反应。
线型缩聚形成的聚合物为线形缩聚物,如涤纶、尼龙等。
体形缩聚(Tri-dimensional Poly-condensation):参加反应的单体,至少有一种单体含有两个以上的官能团,反应中形成的大分子向三个方向增长,得到体型结构的聚合物的这类反应。
官能度(Functionality):一分子聚合反应原料中能参与反应的官能团数称为官能度。
平均官能度(Aver-Functionality) :单体混合物中每一个分子平均带有的官能团数。
即单体所带有的全部官能团数除以单体总数反应程度(Extent of Reaction):参加反应的官能团数占起始官能团数的分率。
转化率(Conversion)参加反应的反应物(单体)与起始反应物(单体)的物质的量的比值即为转化率。
凝胶化现象(Gelation Phenomena) 凝胶点(Gel Point):体型缩聚反应进行到一定程度时,体系粘度将急剧增大,迅速转变成不溶、不熔、具有交联网状结构的弹性凝胶的过程,即出现凝胶化现象。
高分子化学第二章-缩聚及逐步聚合

水排出多,则nw ,K / nw ,则X n
K小时,可通过排水提高X n
2.4.4 影响缩聚平衡的因素 1、温度的影响
ln
K2 K1
H R
1 T1
1 T2
对于吸热反应,△H>0,若T2>T1,则K2>K1,即 温度升高,平衡常数增大。
对于放热反应,△H<0,若T2>T1,则K2<K1,即 温度升高,平衡常数减小。
HOROCOR`COOROH HOOCR`COOROCOR`COOH
三聚体
三聚体
四聚体
三聚体和四聚体可以相互反应,也可自身反应, 也可与单体、二聚体反应。
含羟基的任何聚体和含羧基的任何聚体都可以 进行反应,形成如下通式:
n-聚体 + m-聚体
(n + m)-聚体 + 水
如此进行下去,分子质量随时间延长而增加, 显示出逐步的特征。
2.2.2 缩聚反应分类
l 按反应热力学的特征分类 平衡缩聚反应 指平衡常数小于 103 的缩聚反应 不平衡缩聚反应 平衡常数大于 103
l按生成聚合物的结构分类 线型缩聚 体型缩聚
2.2.3 特点
缩聚反应是缩合聚合反应的简称,是缩合反应多 次重复结果形成缩聚物的过程。 1、典型缩合反应——形成低分子化合物
第二章 缩聚和逐步反应
2.1 引言
2
(*) 2.2 缩聚反应
主要内容
2.3 逐步聚合反应单体 (△) 2.4 线型缩聚的机理
(△) 2.5 线型平衡缩聚反应的相对 分子质量控制、分布及影响因素
2.6 线型缩聚反应的分子量分布 (△) 2.7 体型缩聚和凝胶化作用
2.8 缩聚反应方法
第二章缩聚和逐步聚合反应

O C OH + HA k1
k2
OH
-
C OH + A
+
K,= k1 = [ C +( OH )2 ][ A- ] k 2 [ COOH ][ HA ]
[ C+( OH
)2 ]
=
k1[ COOH ][ k 2[ A- ]
HA ]
代入式
-d [ COOH dt
k2
OH
C
+
OH
+
HO
O
k5
CO
OH
-
C OH + A
质+子化羧基
k3 慢
OH
k4
C OH
OH
+
+ H2O + H+
聚酯反应速率可以用羧基消失速率来表示:
Rp =-d [ COOH ] = k3[ C+( OH )2 ][OH ] dt
32
Rp =-d [ COOH ] = k3[ C+( OH )2 ][OH ] dt
缩聚特点: 缩聚物有特征结构官能团; 有低分子副产物(byproduct); 缩聚物和单体分子量不成整数倍。
官能度(f):一分子中能参加反应的官能团数。
1-1、1-2、1-3体系;低分子缩合反应; 2-2或2体系:线形缩聚; 2-3、2-4等多官能度体系:体形缩聚。
23
复习回顾:
线形缩聚单体
条件:1)必须是2-2、2官能度体系; 2)反应单体要不易成环; 3)少副反应,保证一定的分子量 ;
A.羧酸不电离Rpd[COOH ] dt
k[COOH ][OH ][H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章缩聚和逐步聚合思考题2.1 简述逐步聚合和缩聚、缩合和缩聚、线形缩聚和体形缩聚、自缩聚和共缩聚的关系和区别。
解(1) 逐步聚合和缩聚逐步聚合反应中无活性中心,通过单体中不同官能团之间相互反应而逐步增长,每步反应的速率和活化能大致相同。
缩聚是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,缩聚物为主产物,同时还有低分子副产物产生,缩聚物和单体的元素组成并不相同。
逐步聚合和缩聚归属于不同的分类。
按单体—聚合物组成结构变化来看,聚合反应可以分为缩聚、加聚和开环三大类。
按聚合机理,聚合反应可以分成逐步聚合和连锁聚合两类。
大部分缩聚属于逐步聚合机理,但两者不是同义词。
(2) 缩合和缩聚缩合反应是指两个或两个以上有机分子相互作用后以共价键结合成一个分子,并常伴有失去小分子(如水、氯化氢、醇等)的反应。
缩聚反应是缩合聚合的简称,是指带有两个或两个以上官能团的单体间连续、重复进行的缩合反应,主产物为大分子,同时还有低分子副产物产生。
l-1 、1-2、1-3 等体系都有一种原料是单官能度,只能进行缩合反应,不能进行缩聚反应,缩合的结果,只能形成低分子化合物。
醋酸与乙醇的酯化是典型的缩合反应,2-2、2-3等体系能进行缩聚反应,生成高分子。
(3) 线形缩聚和体形缩聚根据生成的聚合物的结构进行分类,可以将缩聚反应分为线形缩聚和体形缩聚。
线形缩聚是指参加反应的单体含有两个官能团,形成的大分子向两个方向增长,得到线形缩聚物的反应,如涤纶聚酯、尼龙等。
线形缩聚的首要条件是需要2-2 或2 官能度体系作原料。
体形缩聚是指参加反应的单体至少有一种含两个以上官能团,并且体系的平均官能度大于2,在一定条件下能够生成三维交联结构聚合物的缩聚反应。
如采用2-3 官能度体系(邻苯二甲酸酐和甘油)或2-4 官能度体系(邻苯二甲酸酐和季戊四醇)聚合,除了按线形方向缩聚外,侧基也能缩聚,先形成支链,进一步形成体形结构。
(4) 自缩聚和共缩聚根据参加反应的单体种类进行分类,可以将缩聚反应分为自缩聚、混缩聚和共缩聚。
自缩聚(均缩聚):通常为aAb型的单体进行的缩聚反应,其中a和b是可以反应的官能团。
如羟基酸或氨基酸的缩聚。
混缩聚:通常为aaa和bbb的单体之间进行的缩聚反应,其中a和b是可以反应的官能团。
如己二酸和己二胺合成尼龙-66 的反应。
共缩聚:通常将aAc型的单体(a和c是不能反应的官能团,a和c可以相同)加入到其他单体所进行的自缩聚或混缩聚反应中进行的聚合反应。
共缩聚反应通常用于聚合物的改性。
例如以少量丁二醇、乙二醇与对苯二甲酸共缩聚,可以降低涤纶树脂的结晶度和熔点,增加柔性,改善熔纺性能。
思考题2.3 己二酸与乙醇、乙二醇、甘油、苯胺、己二胺这几种化合物反应,哪些能形成聚合物?解:己二酸(f = 2)为2官能度单体,因此能与己二酸形成聚合物的化合物有:乙二醇(f = 2)、甘油(f = 3)、己二胺(f = 2)。
其中与乙二醇(f = 2)、己二胺(f = 2)形成线形缩聚物,与甘油(f = 3)形成体形缩聚物。
思考题2.7简述线形缩聚的逐步机理,以及转化率和反应程度的关系。
解以二元酸和二元醇的缩聚为例,两者第一步缩聚,形成二聚体羟基酸。
二聚体羟基酸的端羟基或端羧基可以与二元酸或二元醇反应,形成三聚体。
二聚体也可以自缩聚,形成四聚体。
含羟基的任何聚体和含羧基的任何聚体都可以相互缩聚,如此逐步进行下去,分子量逐渐增加,最后得到高分子量聚酯,通式如下:n聚体+m聚体=(n+m)聚体+水。
聚合反应进行的程度可用转化率C来表示。
转化率定义为反应掉的单体量占单体初始量的百分比。
反应程度p的定义为参加了反应的基团数与起始基团数的比值。
从线形缩聚的机理可看出,在缩聚早期,单体的转化率就很高,在整个聚合过程中实际参加反应的是官能团而不是整个分子,因此转化率并无实际意义,改用基团的反应程度来表述反应的深度更确切。
思考题2.9简单评述官能团的等活性概念(分子大小对反应活性的影响)的适用性和局限性。
答官能团等活性概念是Flory在20世纪30年代提出的,其要点包括:单官能团化合物的分子链达到一定长度后,其官能团的反应活性与分子链的长度无关。
适用条件为:①聚合体系为真溶液;②官能团的邻近基团及空间环境相同;③体系黏度不妨碍缩聚反应生成的小分子的排除;④在低转化率下适用。
思考题2.11在平衡缩聚条件下,聚合度与平衡常数、副产物残留量之间有何关系?答在线性平衡缩聚条件下,聚合度与平衡常数、副产物残留量之间有下列关系:X n . K /(pn w),式中,n w为生成小分子副产物的残留量;K为平衡常数;p为反应程度。
因此,对于不同平衡常数的反应,对副产物残留量的要求不同。
平衡常数小,如聚酯化反应,K=4,低分子副产物水的存在限制了分子量的提高,要得到分子量高的聚合物,须在高度减压条件下脱除小分子,减少小分子的残留量。
平衡常数中等,如聚酰胺化反应,K=300〜400,水对分子量有所影响。
聚合早期,可在水介质中进行;聚合后期,须在一定的减压条件下脱水,提高反应程度。
平衡常数很大,K>1000 ,允许小分子的残留量较大,如合成酚醛树脂。
思考题2.12影响线形缩聚物聚合度的因素有哪些?两单体非等化学计量,如何控制聚合度?答(1)影响线形缩聚物聚合度的因素有:①反应程度p 缩聚物的聚合度随反应程度的增加而增加;②平衡常数K 对于可逆缩聚反应,平衡常数对反应程度产生影响,进一步影响聚合度,密闭体系中聚合度与平衡常数有下列定量关系:Xn = l/(1 一p) = ■ K +l,敞开体系中聚合度、残留小分子及平衡常数之间有下列定量关系:X? .. K /(pn w) J K/n w③基团的摩尔比反应基团的摩尔比影响反应程度,进一步影响聚合度;④反应条件如反应温度、反应器内压力、催化剂、单体纯度和浓度、搅拌、惰性气体等。
(2) 两单体非等化学计量,通过控制原料单体的摩尔比来控制聚合度,可按下式进行计算:试计算:⑴羧基已经酯化的百分数;⑵数均聚合度M n ; (3)结构单元数。
式中,Na 、Nb 为a 、b 的起始基团数;Xn 为数均聚合度;r 为基团数比;p 为反应程度。
思考题2.15体形缩聚时有哪些基本条件?平均官能度如何计算?答体形缩聚的基本条件是至少有一单体含两个以上官能团, 并且体系的平均官能度大于2。
平均官能度的计算分两种情况:(1) 反应的官能团物质的量相等,单体混合物的平均官能度定义为每一分子平均带有的 基团数。
- Nifi f,官能度Ni 为fi 的单体的分子数。
Ni(2) 反应的官能团物质的量不等,平均官能度应以非过量基团数的2倍除以分子总数来求取。
f = (2不过量的官能团总数 ”参加反应的总物质量 思考题2.16聚酯化和聚酰胺化的平衡常数有何差别,对缩聚条件有何影响 ?答(1)聚酯化反应 平衡常数小,K=4,低分子副产物水的存在限制了聚合物分子量的提高, 对聚合反应的条件要求较高,反应须在高温和高真空条件下进行, 体系中水的残留量应尽量低,这样才能得到高聚合度的聚合物。
(2)聚酰胺化反应 平衡常数中等,K=300〜400,水对分子量有所影响,对聚合反应的 条件要求相对温和。
聚合早期,可在水介质中进行;聚合后期,须在一定的减压条件下脱水, 提高反应程度。
思考题2.24简述聚芳砜的合成原理。
答 聚砜是主链上含有砜基团(-SO 2-)的杂链聚合物,比较重要的聚砜是芳族聚砜, 多称 作聚芳醚砜,简称聚芳砜。
商业上最常用的聚砜由双酚 A 钠盐和4,4'-二氯二苯砜经亲核取代反应而成。
CH 3NaO i 厂 C —:. :-ONa+ClCH 3聚砜的制备过程大致如下:将双酚 A 和氢氧化钠浓溶液就地配制双酚A 钠盐,所产生的水分经二甲苯蒸馏带走,温度约160~C ,除净水分,防止水解,这是获得高分子量聚砜的 关键。
以二甲基亚砜为溶剂,用惰性气体保护,使双酚钠与二氯二苯砜进行亲核取代反应, 即成聚砜。
商品聚砜的分子量为20000〜40000。
计算题2.2 羟基酸HO-(CH 2)4-COOH 进行线形缩聚,测得产物的质均分子量为18400g/mol ,解 ⑴已知 M w = 18400, M o = 100。
Xn -1 1 r r 2rpN a N bCMw则Xw 184M01 p Xw -1 PXw 1p = 0.989Xw 1因此,已酯化羟基百分数等于98.9%。
⑵根据Mw/M n 1 p 1.989M n 18400/1.989=9251.Xn Mn/M 0=92.51⑶本题中结构单元数= Xn = 92.51计算题2.4等物质的量二元醇和二元酸经外加酸催化缩聚,试证明从开始到p = 0.98所需的时间与p从0.98到0.99的时间相近。
计算自催化和外加酸催化聚酯化反应时不同程度p下Xn、C/C。
与时间t值的关系,用列表作图来说明。
解外加酸催化时二元酸和二元醇反应得:Xn k'c0t 1当p= 0.98 时,Xn 1/(1 p) = 50,所需反应时间=49/k、C0。
当p= 0.99 时,Xn 1/(1 p) = 100,所需反应时间=99/k'c。
所以t2~ 2t,故p由0.98到0.99所需时间与从开始至p = 0.98所需得时间相近。
自催化和外加酸催化聚酯化反应时不同程度p下Xn、C/C0与时间的关系见下表:计算题2.5 由Imol 丁二醇和Imol己二酸合成Mn = 5000聚酯,试作下列计算:(1)两基团数完全相等,忽略端基对Mm的影响,求终止缩聚的反应程度p ;(2)在缩聚过程中,如果有0.5% (摩尔分数)丁二醇脱水成乙烯而损失,求到达同一反应程度时的Mn ;⑶如何补偿丁二醇脱水损失,才能获得同一M n的缩聚物?(4)假定原始混合物中羧基为2mol,其中1.0 %为醋酸,无其他因素影响两基团数比,求获得同一数均聚合度所需的反应程度p。
解(1)由丁二醇和己二酸反应得到的聚合物的结构式,其重复单元的分子量为200,因此Xn= (5000/200) 2=50两基团数完全相等时:Xn 1/(1 p)p=0.98终止缩聚时的反应程度为0.98。
(2)如果有0.5%丁二醇脱水,则:r (1 0.5%)/1 0.995Xn = (1-r)/(1+r-2rp)=44.53所以得到的聚合物的分子量为:M n=(Xn /2)=4453M n的缩聚物。
(3) 可以通过提高反应程度、补偿丁二醇脱水损失,从而获得同一根据Xn = (1-r)/(1+r-2rp)=50得p= 0.982当反应程度增加到0.982时,可以补偿丁二醇脱水损失,从而获得同一M n的缩聚物。
(4) 若混合物中羧基为2mol,其中1.0%为醋酸,要获得M n = 5000时,所需的反应程度可以根据下述方法进行计算。
