相图1
汽车材料-项目二任务二合金的相图(1)

对质量不再变化所达到的一种状态。合金在极其缓慢的冷却条件下的结晶过程,
一般可以认为是平衡的结晶过程。 利用相图,可知各种成分的合金在不同温度的组织状态及一定温度下发生的 结晶和相变,了解不同成分的合金在不同温度下的相组成及相对含量,了解合金 在加热和冷却过程中可能发生的转变。 碳钢和铸铁是现代工农业生产中使用最广泛的金属材料,组成碳钢和铸铁的 主要元素是铁和碳,所以钢铁又可称为铁碳合金。不同成分的铁碳合金具有不同 的组织和性能。为了研究铁碳合金成分、组织和性能之间的关系,必须要了解铁 碳合金相图。
任务二 ·合金的相结构与相图
合金的结构 二元合金的结晶 铁碳合金相图
引入 不锈钢的出现
不锈钢是指耐空气、蒸汽、水等弱腐蚀介质或具有不锈性的金属材料, 在工业和生活用具上有着广泛的应用,如建筑屋顶、刀叉餐具等。不锈钢 的发明可追溯到第一次世界大战,英国政府兵部军工厂希望研发出一种不 易磨损的合金材料,用来制造步枪枪膛。英国科学家亨利·布雷尔利在研究 过程中制造出一种含Cr量较高的材料,这种材料并不耐磨,不能用来制造
碳溶于 α -Fe 中形成的间隙固溶体称为铁素 1.铁素体 体,用符号F或α 表示。铁素体仍保持α -Fe的体心
立方晶格。铁素体中碳的溶解度极小,室温时约
为0.000 8%,在727碳合金的基本相。 铁素体的力学性能与工业纯铁相似,即塑性、韧 性较好,强度、硬度较低。
变就越严重。晶格畸变会增大位错运动的阻力,提高合金的强度和硬度。这种通
过形成固溶体使金属强度、硬度提高的现象称为固溶强化。固溶强化是提高合金 力学性能的重要途径之一。
图2-17 固溶体中的晶格畸变
2.金属化 合物
金属化合物是指合金组元相互作用形成的晶格结构和特性 完全不同于任一组元的新相,一般可用分子式表示。金属化合 物一般具有复杂的晶格结构,熔点高,硬而脆。合金中含有金 属化合物时,合金的强度、硬度会提高,而塑性、韧性会降低。 根据其形成条件及结构特点,金属化合物可分为正常价化合物、 电子化合物和间隙化合物。
大学材料科学基础 第五章材料的相结构和相图(1)

弗兰克尔空位
肖脱基空位
2) 为了保持电中性,离子间数量不等的置换会 在晶体内部形成点缺陷。 如:2Ca2+→Zr4+ ,形成氧离子空缺。 3) 陶瓷化合物中存在变价离子,当其电价改变 时,也会在晶体中产生空位。 如:方铁矿中,部分Fe2+被氧化为Fe3+时, 2FeO+O → Fe2O3中,产生阳离子空缺。 同理,TiO2中,部分Ti4+被还原为Ti3+时,产 生阴离子空缺。 这种由于维持电中性而出现的空位,可以 当作电子空穴。欠缺或多出的电子具有一定的 自由活动性,因而降低了化合物的电阻。这种 现象在材料的电性能方面有重要意义。
3.陶瓷材料中的固溶方式
陶瓷材料——一般不具备金属特性,属无机非金属。 无机非金属化合物可以置换或间隙固溶的方式溶入其 它元素而形成固溶体,甚至无限固溶体,但是一般形 成有限固溶体。 如:Mg[CO3] → (Mg,Fe)[CO3] →(Fe,Mg)[CO3] →Fe[CO3] 菱镁矿 含铁菱镁矿 含镁菱铁矿 菱铁矿 不改变原来的晶格类型,晶格常数略有改变。
(3) 多为金属间或金属与类金属间的化合物, 以金属键为主,具有金属性,所以也称金属 间化合物。 (4) 晶体结构复杂。 (5) 在材料中是少数相,分布在固溶体基体 上,起到改善材料性能、强化基体的作用。 中间相可分为以下几类: 正常价化合物;电子化合物;间隙相;间隙 化合物;拓扑密堆相。
1. 正常价化合物 • 通常是由金属元素与周期表中第Ⅳ、Ⅴ、 Ⅵ族元素形成,它们具有严格的化合比, 成分固定不变,符合化合价规律,常具有 AB、AB2、A2B3分子式。 • 它的结构与相应分子式的离子化合物晶体 结构相同,如分子式具有AB型的正常价化 合物其晶体结构为NaCl型。正常价化合物 常见于陶瓷材料,多为离子化合物。如 Mg2Si、Mg2Pb、MgS、AuAl2等。 • 在合金材料中,起弥散强化的作用。
材料的相结构及相图第一、二节2014

3. 尺寸因素化合物
作业与工程作业
本节作业: P229:1,3 工程作业
1、文献调研铜合金、高温合金或不锈钢中的相组成,指出其中的固溶体及 各种化合物相。 2、纯金属原子间以金属键结合,密堆积结构常见有fcc、bcc和hcp。以面心 立方结构的纯铜为例,铜原子的半径为0.128nm,原子重量为63.5g/mol, 计算纯铜的理论密度,并于实际密度比较,分析Zn置换后形成的黄铜其 密度随Zn含量变化规律。 3、GaAs和GaP都具有闪锌矿结构,它们在整个浓度范围相互固溶。若要获 得一个边长为0.5570nm的固溶体需要在GaAs中加入多少GaP?已知GaAs 和GaP的密度分别为5.307和4.130g/cm3.
《材料科学基础》讲义
材料的相结构及相图
P HASE STR UCTUR E AN D P HASE DI AGR AM OF M ATER I ALS
关于《材料科学基础(II)》 2014秋季教学说明
内容分工:席、王 课堂教学:讲课、讨论 作业 考试
席生岐 2014年秋
工程作业:做题、讲评
教学学习参考书目
电子浓度 —各组成元素价电子总数 e 与原子总数a之比
式中, —溶质元素的摩尔分数 —溶剂的原子价 —溶质的原子价 溶质元素在一价溶剂元素中的最大溶解 度对应于
电子浓度( ) 1.38
进一步学习内容:金属及合金的电子理论(金属物理)
陶瓷材料中的固溶方式第二大类Βιβλιοθήκη 程材料陶瓷材料中的固溶方式
例如,Cu-51wt%Au 合金,390℃以上为无序 固溶体, 缓冷到390℃以下时形成有 序固溶体
固溶体中溶质原子的偏聚与有序
固溶体中溶质原子的偏聚与有序
材料科学基础第四张相平衡与相图(1)

化学位: 当温度、压力不变因组元增加一个摩尔, 引起吉布斯自由能的变化,就是组元的化 学位或偏摩尔自由能。它代表了系统内物 质传递的驱动力。
组元2在β相 中化学位等于其 在α相中的化学位 推演如下:
多元系统的吉布斯自由能是温度、压力及各组元摩尔 数n1、n2…….函数,即可写成 G=f(T、P、n1、n2……….)
二元系中,三相平衡的热力学条件是每个组元在各相中的化学位相等,即 μα1=μβ1=μγ1 μα2=μβ2=μγ2 多元复相平衡的普遍条件是每个组元在各相中的化学势都必须彼此相等,即 μαi=μβi=μγ i =…=μPi
其中,α、β、γ…P表示合金中存在的相,i代表合金中的第i个组元 。 μPi则表示P相中i组元的化学位,即上标表示平衡相,下标表示组元。
温度与压力都能变动的情况
二、 SiO2系统相图 •也有晶型变化:
(<573℃)低温型α-SiO2 (α-石英) (573℃-870℃) 高温型β-SiO2 (β-石英) (870℃-1470℃) 磷石英β2-SiO2 (β2-磷石英) (1470℃-1713℃) 方石英β-方SiO2 这四种不同晶体结构的SiO2存在 的温度、压力范围不同
•确定两平衡相的相对量: •将成分坐标当作杠杆,以合金的成分点为 •支点,Wα和WL看成作用于a、b两点的力, •则与力学上的杠杆定律一样,即 • WL/Wα=0b/a0 •上式表明合金在两相区内,两平衡相的相 •对量之比与合金成分点两边的线段长度呈 •反比关系。
•合金中两平衡相的含量也可用下式表达: Wα%=(C-CL)/(Cα-CL) =a0 /abχ100% WL%=(Cα-C)/(Cα-CL) = 0b /ab χ100% 在两相区内,温度一定时,两相的质量比 是一定的。
二元合金相图(1)

第二章二元合金相图纯金属在工业上有一定的应用,通常强度不高,难以满足许多机器零件和工程结构件对力学性能提出的各种要求;尤其是在特殊环境中服役的零件,有许多特殊的性能要求,例如要求耐热、耐蚀、导磁、低膨胀等,纯金属更无法胜任,因此工业生产中广泛应用的金属材料是合金。
合金的组织要比纯金属复杂,为了研究合金组织与性能之间的关系,就必须了解合金中各种组织的形成及变化规律。
合金相图正是研究这些规律的有效工具。
一种金属元素同另一种或几种其它元素,通过熔化或其它方法结合在一起所形成的具有金属特性的物质叫做合金。
其中组成合金的独立的、最基本的单元叫做组元。
组元可以是金属、非金属元素或稳定化合物。
由两个组元组成的合金称为二元合金,例如工程上常用的铁碳合金、铜镍合金、铝铜合金等。
二元以上的合金称多元合金。
合金的强度、硬度、耐磨性等机械性能比纯金属高许多,这正是合金的应用比纯金属广泛得多的原因。
合金相图是用图解的方法表示合金系中合金状态、温度和成分之间的关系。
利用相图可以知道各种成分的合金在不同温度下有哪些相,各相的相对含量、成分以及温度变化时所可能发生的变化。
掌握相图的分析和使用方法,有助于了解合金的组织状态和预测合金的性能,也可按要求来研究新的合金。
在生产中,合金相图可作为制订铸造、锻造、焊接及热处理工艺的重要依据。
本章先介绍二元相图的一般知识,然后结合匀晶、共晶和包晶三种基本相图,讨论合金的凝固过程及得到的组织,使我们对合金的成分、组织与性能之间的关系有较系统的认识。
2.1 合金中的相及相图的建立在金属或合金中,凡化学成分相同、晶体结构相同并有界面与其它部分分开的均匀组成部分叫做相。
液态物质为液相,固态物质为固相。
相与相之间的转变称为相变。
在固态下,物质可以是单相的,也可以是由多相组成的。
由数量、形态、大小和分布方式不同的各种相组成合金的组织。
组织是指用肉眼或显微镜所观察到的材料的微观形貌。
由不同组织构成的材料具有不同的性能。
铁碳相图(1)讲解

1 基本组元: Fe、C 2 基本相: (1)铁素体(α或 F ) :
良好塑韧性→钢 中基体相
定义: C在体心立方α-Fe中的间隙固溶体
但C在α-Fe中的溶解度极小:
0.0008% (20℃) ~0.0218% (727℃)
性能: 强硬度低(50HBS~80HBS),
γ +Fe3C
A1 727℃
K 6.69
0.0008 Q
Fe
α+Fe3C 常温下的组织构成:
C%
F+Fe3CⅢ
Fe3C
合金②:共析钢
L+δ
A δ
1495℃
B
J
N
Tγ
G
α+γ
α
0.77
P
S
0.0218
Q
Fe
铁碳相图
L+γ
2.11 E
L L +Fe3C D
4.3 1148℃ F C
727γ℃SA1时γ 发+7F生(2eα73℃P共C+析F转e3C变6).6:=9KP
Fe3C
包晶线HJB
L+δ
A 1495℃
δ
B
HN J
T
γ
LB+δH γJ
共晶线ECF
L
LC γE+Fe3C
L +Fe3C D
L+γ 2.11
E
4.3 C
1148℃
F 共析线PSK
G α+γ 0.77 PS
α 0.0218
γ +Fe3C A1 727℃
α+Fe3C
γS αP+Fe3C
第三章 水盐相图1
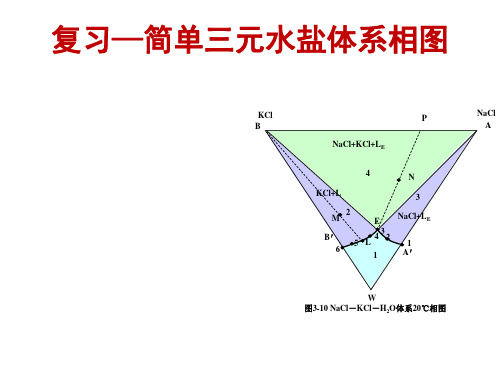
E1
B' M7
1 A' E2 E1 2 3
B'
H
NiCl2· 2 H2 O a' b'
4 5 c d
e B ( NH4Cl )
A(Na2SO4) (a)
B ( MgSO4 )
A(NiCl2) ( b)
图3-25 复杂相图两例
二、共饱点性质的判断 共饱点的相应三角形: 在三元等温图中,与共饱点所代表的 液相平衡的两个固相点及水点所构成 的三角形。 共饱点分类: 相称共饱点—在相应三角形内 不相称共饱点—在相应三角形外/边上
水合物转溶, 绝不是干点
除右边的两情况
异成分复盐
水合物Ⅱ型
三、变温过程分析
t(℃) 100 E100
B ( NaNO3 )
80 60
E75
N100 N75 N25 E25 E75 E100
Ex 40 E25 20
M
A(KNO3) E100 E75
W
Ex
E25
W(H2O) K25
K75
K100
A ( K NO3 )
S10脱水转溶 Na2SO4 Na2SO4+NaCl 为Na2SO4析出 析出 共析 3→4 4→5 5→6
W(H2O) 1 Q 2 B' A' 3 E 4 S10
1→2
2→Q Q(不是干点) Q→E
E(干点)
5
——
S10
S10→B
B
B→6
A(NaCl) 图3-21 水合物Ⅱ型 6
B(Na2SO4)
二、各类相图的等温蒸发过程
2.复杂三元水盐体系蒸发过程分析 (3)同成分复盐
阶段
过程情况
一
浓缩阶段
热处理基础1-相图

返回 实线:Fe-Fe3C系;虚线:Fe-C(石墨)系
铁碳相图中各种相及成分
• 纯铁有液态结晶为固态后冷却到1394℃及912摄氏度时先 后发生两次晶格类型转变。
δ—Fe
体心立方
1394℃
γ—Fe
面心立方
912℃
α—Fe
体心立方
碳在铁中的固溶体
碳在α—Fe中形成的间隙固溶体成为铁素体。用符号F表示,最大溶解度为 0.0218wt%C(727℃) 碳在γ—Fe中形成的间隙固溶体成为奥氏体,用符号A表示,最大溶解度为 2.11wt%C(148℃)
当冷却到t2温度时,由联结 线EF与液.固相线相交点 可知,液相线成分为E,w (Ni)约为24%,而固相 线成分为F, w(Ni)约为 36%.
匀晶合金的非平衡结晶
匀晶合 金平衡 组织示 意图
匀晶合金在平衡条件下结晶,冷却速度极其缓慢,先后结晶的固相 虽然成分不同,但是有足够的时间进行均匀化扩散。所以,室温下的 组织是均匀的固溶体,在光学显微镜下观察,与纯金属十分相似。 但是,在实际生产中合金的冷却速度很快,远远达不到平衡的条件。 因此,固、液二相中的扩散来不及充分进行,先后结晶出来的固相中 较大的成分差别被保留下来。这种成分差别的存在,还造成结晶时固 相以树枝状形态生长。因此,这种成分上的不均匀性被称为“树枝状 偏析”或枝晶偏析。 采用均匀化热处理(扩散退火、正火等)可以消除枝晶偏析。
b、锻造、轧制:确定锻造、轧制温度,钢处于奥氏 体状态时强度低、塑性高,因此锻造或轧制必须选择 在奥氏体单相区
c、焊接:由焊缝盗墓在在焊接过程中处于不同温度条件, 因而整个焊缝区出现不同组织,引起性能不均,可根据相 图来分析碳钢的焊接组织,并用适当的热处理方法来消除 组织不均匀性和焊接应力
第四章 二元相图(1)

图 表明k0的示意图 (a) k0<0 ; (b) k0>1
(1)平衡冷却时固相的溶质分布
图 固溶体长大机制的模型
形核→相界平衡→扩散破坏平衡→长大→相界平衡
(2)三种混合状态下的溶质分布
液相完全 不混合 液相完全 混合
液相部分 混合
图 三种混合状态下溶质分布
图 定向凝固后得到的溶质分布曲线 a-平衡凝固,b-液相完全混合 c-液相完全不混合,d-液相部分混合
4.2.1 匀晶相图
1.相图分析 由液相结晶出单相固溶体的 过程称为匀晶转变。
L
两组元在液态无限溶解,在 固态无限固溶,并且发生匀 晶反应的相图,称为匀晶相 图。
匀晶转变动画
图 Cu-Ni相图
2.固溶体合金的平衡凝固及组织
当合金缓慢冷却至l1点以前时,均为单一的液相; 冷却到l1点时,开始从液相中析出α固溶体,冷却到α4点 时,合金全部转变为α固溶体; 若继续从α4点冷却到室温,为单一的α固溶体。
温度 成分
L
质量分数
α
变化趋势 成分 质量分数 变化趋势
t1
t2 t3
l1
l2 l3
100%
2 X 0 2 l2 3 X 0 3 l3
α
α α
1
0%
X 0 l2 2 l2 X 0 l3 3 l3
2
3
α 4 t4 l4 0% 100% 在液固两相共存区,随着温度的降低,液相的量不断减少, 固相的量不断增多,同时液相的成分沿液相线变化,固相 成分沿固相线变化。
2.Pb-Sn合金的平衡凝固 (1)端部固溶体合金(10%Sn-Pb合金)
图 10%Sn-Pb 合金凝固过程示意图
6讲铁碳合金相图(1)

5)PQ线:碳在铁素体中 L+A 的溶解度曲线。铁素体冷 C 1148℃ E 却到此线,将以Fe3C形 A ( A+Fe C ) G 式析出过饱和的碳,称为 Ld A+ 三次渗碳体(Fe3CⅢ), Fe CⅡ A+Ld+Fe CⅡ A+F S F P 数量极少。 ( F+ Fe C ) P+Ld’+Fe CⅡ Ld’ 一、二、三次渗碳体, P ( P+Fe C ) 对钢铁性能的影响是一样 Q P+F P+Fe CⅡ 0.0218%C 0.77%C 2.11%C 4.3%C 的。
•
3
• 3、奥氏体 碳溶入γ -Fe中形成的间隙固溶体称为奥氏 体,呈面心立方晶格,用A表示。 • γ -Fe的溶碳能力较α -Fe高许多。在 1148 ℃时,最大溶碳量为2.11%;温度 降低时,溶碳能力也随之下降,到727 ℃ 时,溶碳量为0.77%。由于γ -Fe仅存在 于高温,因此,稳定的奥氏体通常存在 727 ℃以上,故在铁碳合金中奥氏体属于 高温组织。 • 奥氏体的力学性能与其溶碳量有关。一 般来说,其强度、硬度不高;但塑性优 良(δ=40%~50%)。在钢的轧制或锻造 时,为使钢易于进行塑性变形,通常将 钢加热到高温,使之呈奥氏体状态。 • 在显微镜下,奥氏体也是呈多边形晶粒, 但晶界较铁素体平直,并存有双晶带。
5
5、珠光体: 铁素体和渗碳体组成的机械混合物称为珠光体,用符号P或 (F+ Fe3C)表示。珠光体的含碳量为0.77 %。由于渗碳体在混合 物中起强化作用,因此,珠光体有着良好的力学性能,如其抗 拉强度高σb≈750Mpa)、硬度较高(180HBS)且仍有一定的 塑性和韧性δ=20%~25%、ak=30~40J/cm2珠光体在显微镜下 呈层片状。其中白色基体为铁素体,黑色层片为渗碳体。
相图1

2.
互溶系统:指其中一个组元溶解于另外一 个组元晶格中形成的固相。
A + B A(B) A + B B(A)
VI、二元系相图—三相平衡转变类型
3.
偏晶转变:液相L1在恒定温度T下同时 转变为另一个成分不同的液相L2和一个 固相的转变。 L1 L2 +
4.
包晶转变:指一个液相L与一个固相在 恒定温度T下转变为另一个成分不同的 固相的转变。 L+
溶解 度线
溶解 度线
原生固溶体在共晶系统内的表示
一般而言,共晶等温线以上,当温度沿固线下降时,固溶度增加。 共晶等温线以下,随温度下降固溶度减小。
假定总体成分为x,在平衡情况下,
这一合金在T1进入固液二相区,在
T2进入固溶区。在T1和T2温度范围
由于核化现象的存在,在 内,固相与液相平衡,成分按照共
它们相互间形成无限互溶固溶体。 形成互溶系统的条件: 组元的晶体结构必须相同,即同形。
②、二元互溶系统相图
液相区:自由度为2,温度与成分均可自由变化 T( ℃ ) 固线 L
温度改变,两相的各 自成分就随之而改变。
液线
L+
固相区:自由度为2,温度与成分均可自由变化 A B(%) B
最典型的二元互溶相图
1. 2. 3.
均晶转变:从液相中结晶出一个固相的转变。 同素异构转变:两种同素异构体之间的转变。 二次析出转变:由于超过固相的固溶度极限而
从固相中析出另一个固相的转变。脱溶转变。
4.
磁性转变:相的磁性随温度变化而改变称为磁
性转变,磁性转变线常用虚线表示。
5.
有序无序转变:一定成分的固溶体,在某一临 界温度下,由短程有序转变为长程有序结构。
《无机材料》 第6章 相平衡与相图(1)-相平衡及其研究方法(2学时)

五、应用相图时需注意的几个问题
1. 实际生产过程与相图表示的平衡过程有差别; 2. 相图是根据实验结果绘制,多采用将系统升至高温
再平衡冷却的方法,而实际生产则是由低温到高温 的动态过程; 3. 相图是用纯组分做实验,而实际生产中所用的原料 都含有杂质。
1. 宏观上相间无任何物质传递; 2. 系统中每一相的数量不随时间变化; 3. 为动态平衡。
(三)相平衡条件 各组分在各相中的化学位相等, 即 等温等压条件下:
dG idni 0
(四)相平衡研究内容 单或多组分多相系统中相的平衡问题,即多相系
统的平衡状态——相数目、相组成、各相相对含量 等如何随影响平衡的因素——温度、压力、组分的 浓度等变化而改变的规律。
① 形成机械混合物:有几种物质就有几个相; ② 生成化合物:产生新相; ③ 形成固溶体:为一个相; ④ 同质多晶现象:有几种变体,即有几个相 。
2.相数
一个系统中所含相的数目称为相数,以P表示—— 单相系统(P=1) 二相系统(P=2) 三相系统(P=3)
含有两个相以上的系统,统称为多相系统。
(四)独立组元(独立组分) 物种(组元):系统中每一个能单独分离出来并 能独立存在的化学纯物质。 独立组元:足以表示形成平衡系统中各相组成所需 要的最少数目的物种(组元)。 独立组元数:独立组元的数目,以C表示。 n元系统:具有n个独立组元系统—— 单元系统(C=1) 二元系统(C=2) 三元系统(C=3)
(六)外界影响因素
:指温度、压力、电场、磁场、重
力场等影响系统平衡状态的外界因素。
:用n表示。在不同情况下,影响系统
平衡状态的因素数目不同,则n值视具体情况定。
一般情况:只考虑
的影响,即n=2
相平衡与相图一元系

水泥生产要求:在水泥熟料中希望C2S 是以 β晶型存在的,而且要防止介稳的β-C2S 向稳定的γ-C2S 转化。
原因:
β-C2S具有胶凝性质,而γ-C2S 没有胶 凝性。 β-C2S向γ-C2S转化时,发生体积膨胀 (约增大9%)使C2S 晶体粉碎,水泥熟料 粉化,水泥质量下降。
措施:急冷工艺,使β-C2S来不及转变为 γ-C2S ,以β-C2S 型过冷的介稳状态存 在下来. 也可以采用加人少量稳定剂(如:P205、 Cr203、V2O5、BaO、Mn2O3等)的方法。稳定 剂能溶入β-C2S 的晶格内,与β-C2S形 成固溶体,使其晶格稳定,防止β-C2S 转 变成γ-C2S ,并在常温下长期存在。
dp fus H m dT T fusV
vap H m 0
fus H m 0
斜率为正。 斜率为正。
fus H 0, fusV 0
斜率为负。
1、一般分析
2、亚稳态分析 单组分体系相图的共同特征点: 点:三相共存;f=0 线:二相共存;f=1 面:一相;f=2
三、SiO2系统相图
七种晶相
冷却速度影响晶相
1、SiO2相图的一般内容
①一级变体间的转变:指变体间结构转变较 大,转变时形成新的结构。
特点:转变速度非常缓慢,转变常常是 从外部向内部转变的。因此,只有长时 间的恒定温度下,才能实现这种转变。
-石英→ - 鳞石灰 -石英→ -方石英 -石英→ - 石英玻璃 石英玻璃→ -方石英
Si02多晶转变时的体积变化可知,在各 SiO2 变体的高低温型的转变中,方石英之间 的体积变化最为剧烈,石英次之,而鳞石英之 间的体积变化最微弱。 因此,为了获得稳定的致密硅砖制品,就 希望硅砖中含有尽可能多的鳞石英,而方石英 晶体越少越好。这也就是硅砖烧成过程的实质 所在。
铁碳合金相图1

2015-3-3
奥氏体(A或γ)(Austenite) 奥氏体是碳溶于γ-Fe中所形成的间隙固溶体,面心 立方晶格。碳在γ-Fe中的溶碳量较高,1148℃时 2.11%;1148℃时为0.77%。其强度和硬度比铁素体高, 塑性、韧性也好。其晶粒呈多边形,晶界较铁素体平 直。
2015-3-3
渗碳体(Fe3C)(Cementite) 渗碳体是铁与碳形成的金属化合物,碳含量是6.69%, 具有复杂的晶体结构。其力学性能特点是硬度高,脆性 大,塑性几乎为零。渗碳体是钢中的强化相,根据生成 条件不同渗碳体有条状、网状、片状、粒状等形态,它 们的大小、数量、分布对铁碳合金性能有很大影响。
铜镍二元合金相图
2015-3-3
2015-3-3
2、匀晶结晶特点 (1)形核与长大 (2)变温结晶
2015-3-3
(3)两相的成分确定 (4)两相的质量比一定
2015-3-3
2015-3-3
提示: 杠杆的两个端点为给定温度时两相的成分点,支点 为合金的成分点。 杠杆定律只适用于相图中的两相区。 杠杆定律只能在平衡状态下使用。
2015-3-3
2015-3-3
2015-3-3
2015-3-3
2015-3-3
2015-3-3
2015-3-3
2015-3-3
2015-3-3
三、 发生共析反应的合金的结晶
2015-3-3
四、 含有稳定化合物的合金的结晶
2015-3-3
§2.5.1 铁碳合金相图
一、 铁碳相图 是研究钢和铸铁的基础,对于钢铁材料的应用以及 热加工和热处理工艺的制订也具有重要的指导意义。 铁和碳可以形成一系列化合物,如Fe3C、Fe2C、 FeC等。 有实用意义的是Fe—Fe3C部分,称为Fe—Fe3C 相图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P + F = C+1 Pressure is fixed Max. 3 phases in a binary system Max. 2 phases in a one-component system
Equilibrium – lowest free energy
Fig. 6.2 Schematic diagram showing stable, unstable and metastable conditions
Fig. 6.1 Binary join CaO-SiO2 in the ternary system Ca-Si-O
MgO is an one-component system
’FeO’ is a two-component system Fe-O ’FeO’ is Fe1-xO + Fe
The condensed phase rule:
The distinction between different crystalline crystalline phases is usually clear e.g. CaCO3 and SiO2 MgSiO3 and Mg2SiO4 are also different phases What about solid solutions? Al2O3 + Cr2O3 One phase The liquid state: Lower number of homogeneous phases Gasses: 1 phase only same crystal structure mix from 0 to 100% Cr2O3
P+F=C+2=3
Fig.6.3 Schematic pressure versus temperature phase diagram of a one-component system.
Fig. 6.4 The system H2O
The SiO2 system
α-quartz
573 ◦C
It is the minimum number of constituents needed in order to describe completely compositions of the phases present
CaO-SiO2 is a two component system
Binary join in the ternary system Ca-Si-O
β-quartz
870 ◦C
β -tridymite
1470 ◦C
β -cristobalite
1710 ◦C
liquid
Polymorphs at ambient pressure
Fig. 6.5 The system SiO2
Diamond anvil cell
3500 kbar = 350 GPa pressure at the centre of the earth
The monotectic reaction
l2
l1
l 1 ⇔ l2 + B
also an invariant reaction
Fig. 6.21 Phase diagram MgO-SiO2
Technologically important phase diagrams
Fig. 6.22 The Fe-C diagram
The system Li2O-SiO2: metastable phase separation and synthetic opals
Spinodal decomposition Two liquids with a very fine texture
Fig. 6.26 Phase diagram Li2SiO3-SiO2. Metastable immiscibility dome
Fig. 6.27 Purification of Si by zone refining: impurities contrate in melt
Yttria-stabilized zirconia, a solid electrolyte
Fig. 6.28 Phase diagram ZrO2-Y2O3 Zr1-2xY2xO2-x oxygen vacancies
Two-component condensed systems
P + F = C +1 = 3
Fig. 6.6 Simple eutectic binary system
Mechanical mixtures
Lever rule
m1*(dist xy) = m2*(dist yz)
Fig. 6.7 Principle of moments
Glass production
Na2O-SiO2 glasses are water soluble!
CaO, MgO, Al2O3 and B2O3 solves this problem
SiO2 glass is also used e.g. in the laboratory
Fig. 6.25 Phase diagram Na2O-SiO2
Syntectic reaction: V ⇔ L1 + L2
Eutectoid reaction:
α ⇔ β + γ
Peritectoid reaction: α ⇔ β + γ
Ca3SiO5 has a lower limit of stability Eutectoid reaction Fast cooling so Ca3SiO5 does not decompose
Ca3SiO5 is the key ingredient in rapid-hardening Portland cement
Number of components?
The number of components of a system is the number of constituents that can undergo independent variation in different phases Alternatively
Coring
Concentration gradients in grains
Fig. 6.11 The plagioclase feldspar system, anorthite-albite
indifferent points
Fig. 6.12 Binary colid solution systems with (a) thermal minima and (b) thermal maxima in liquidus and solidus curves
Fig. 6.16 Binary system with incongruently melting compound and partial solid solution formation
Polymorphs αA αA βB βB
Fig. 6.17 Simple eutectic system with solid-solid phase transitions
Fig. 6.23 Partial diagram for the lime-rich composition in the system CaO-SiO2
Na-S battery
Fig. 6.24 Na-S phase diagram and open circuit cell voltage as a function of degree of discharge/cathode composition for the Na/S cell
AB melts congruently (solid and melt have the same chemical composition)
AB melts incongruently (solid and melt have different chemical compositions) The peritectic reaction also an invariant reaction
Chapter 6 Interpretation of Phase Diagrams
Gibb’s phase rule:
P + F = C+2
What do we mean by phase? A phase is homogeneous The number of phases in a sample is number of physically distinct and mechanically separable (in principle) portions
Fig. 6.18 Binary solid solutions systems with polymorphic phase transitions
Fig. 6.19 Binary eutectic system with polymorphic transitions and partial solid solution formation
Fig. 6.13 Simple eutectic system showing partial solid solubility of the end members
Fig. 6.14 The system Mg2SiO4 – Zn2SiO4
Fig. 6.15 Binary system with partial solid solution formation
Example 1
Example 2
