受试者原始资料追踪表 - 上海第一人民医院——首页
306PLA JG R 001 02受试者入选筛选登记表

临床试验申请表306PLA-JG-T-001-01研究者履历表306PLA-JG-T-002-01项目名称: CFDA批件号:研究中心名称:研究中心代号:方案编号:参加负责项目分工:研究者声明临床试验协调会签到表306PLA-JG-T-003-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:临床试验协调会记录表306PLA-JG-T-004-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:日期:__________________ _ 主要研究者:临床试验提交伦理审议申请表306PLA-JG-T-005-01中国人民解放军第306医院国家药物临床试验机构管理文件临床试验启动会签到表306PLA-JG-T-006-01项目名称:方案编号:申办单位:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:中国人民解放军第306医院国家药物临床试验机构管理文件临床试验启动会记录表306PLA-JG-T-007-01项目名称:方案编号:申办单位:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:_________日期:主要研究者:_________ _中国人民解放军第306医院国家药物临床试验机构管理文件研究人员分工表306PLA-JG-T-008-01项目名称:方案编号:申办单位:专业科室:主要研究者:主要研究者签字:日期:中国人民解放军第306医院国家药物临床试验机构管理文件受试者筛选/入选表306PLA-JG-T-009-01页第页___共___中国人民解放军第306医院国家药物临床试验机构管理文件受试者签认代码表306PLA-JG-T-010-01 项目名称:方案编号:___第共页___页中国人民解放军第306医院国家药物临床试验机构管理文件严重不良事件报告表306PLA-JG-T-011-01项目名称:CFDA批件号:方案编号:中国人民解放军第306医院国家药物临床试验机构管理文件/ 报告者(研究医生)/报告日期:确认者(主要研究者/日期: /时间:/ / 发送者/日期者送是CFDA注册司否发伦理委员会申办至:□是□否□是□否□是□否中国人民解放军第306医院国家药物临床试验机构管理文件完成试验受试者编码目录306PLA-JG-T-012-01项目名称:方案编号:___第共页___页中国人民解放军第306医院国家药物临床试验机构管理文件临床试验总结会签到表306PLA-JG-T-013-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:中国人民解放军第306医院国家药物临床试验机构管理文件临床试验总结会记录表306PLA-JG-T-014-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:________日期:主要研究者:_________ _中国人民解放军第306医院国家药物临床试验机构管理文件临床试验用药物(物资)签收记录单306PLA-JG-T-015-01 项目名称: CFDA批件号:方案编号:研究中心名称:研究中心代号:发送单位名称:___第页___共页中国人民解放军第306医院国家药物临床试验机构管理文件试验用药物保存记录表306PLA-JG-T-016-01方案编号:项目名称:药物编号:药物名称:药物批号:药物规格:中国人民解放军第306医院国家药物临床试验机构管理文件试验用药物分发回收记录表306PLA-JG-T-017-01中国人民解放军第306医院国家药物临床试验机构管理文件临床试验剩余药物(物资)退回/销毁记录单306PLA-JG-T-018-01中国人民解放军第306医院国家药物临床试验机构管理文件文件接收、保管记录表306PLA-JG-T-019-01项目名称:方案编号:发送方:接收方:送交人:_________________ 日期:_________________注:本记录一式两份,本份由_____________(研究中心名称)保存。
临床试验结题核查表(专业组用)
第4版
附件 4
临床试验结题核查表(专业组用)
项目名称
项目科室 方案号
批件号
项目负责人 注册分类
申办方/CRO/SMO
分期组长单位Fra bibliotek协议例数 筛选数 筛选失败号
入组数
实际完成数 脱落号
脱落数
退出数
ICF 份数 退出号
CRF 份数
发生 AE 号
项目启动会时间
第 1 例知情同意时间
注: 1. 此表请双面打印于一张纸上
2.项目研究结束,专业组必须进行此结题质控
3.如不适用表中内容,请在备注中标明 NA;如果勾选"否",请写明原因
上海市第一人民医院国家药物临床试验机构
第4版
有生物样本采集、保存、运输记录(含温度记录)
知情、入组、用药、不良事件均完整记录
是否漏记合并用药或住院等
文件记录 和修改
最后 1 例研究结束时间
检查要点
问题
是
否
试验方案
申办者、研究者已签名或盖章 是否最新版且有伦理批准
研 究 者 履 历 研究者均 GCP 培训 及相关文件 研究者均有执业医师资格且被正确授权(关注签名样张一致性)
研究者均参加启动会或补充培训
是否所有入组受试者都签名+日期
是否为受试者本人签署(关注:1.多份签字均类似 2.与研究者签字类似
合并用药记录完整(有明显伴随疾病却没有合并用药) 未合并使用禁用药物
必要时查看 His 是否漏记
实施
方案规定的随访及检查无遗漏或者超窗 检验、检查单均及时打印并且完整
检查单都已签名+日期 有无脱落?说明原因
AF10初审申请表-上海第一人民医院
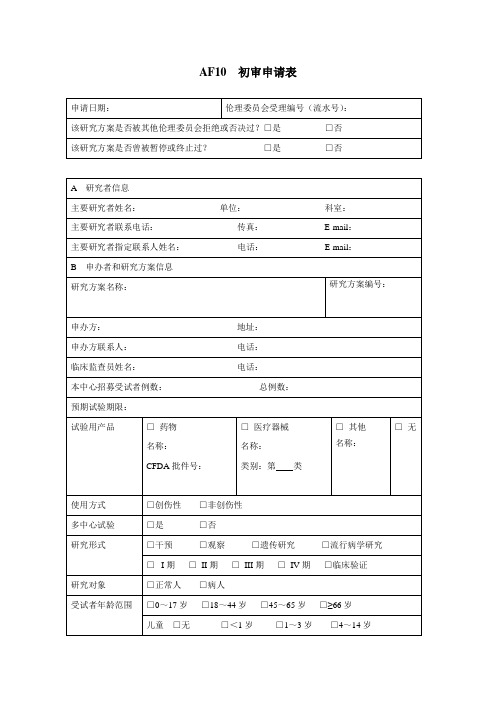
AF10 初审申请表填表须知:1、请将本申请表各栏(除流水号)填写完整,如没有相关内容,请填写“无”;2、请以电子版形式填写本申请表,打印后签字(一般不接受手写版申请表);3、请如实填写本申请表;4、本申请表的“申请日期”即为方案递交日期,须在申请当日递交方案,如有特殊情况,一般方案递交日期不超过申请日期两个工作日;5、请根据本申请表所附的“研究方案目录”填写所递交方案的目录,目录所列内容须与递交材料一致,目录将作为批件所附“伦理审查文件”的参考依据。
附1:研究方案目录(药物)□ 1、临床试验方案中文版本号:日期:;英文版本号:日期:□ 2、知情同意书中文版本号:日期:;英文版本号:日期:□ 3、病例报告表中文版本号:日期:;英文版本号:日期:□ 4、研究者手册中文版本号:日期:;英文版本号:日期:□ 5、主要研究者履历□ 6、药物临床试验批件□ 7、药物检测报告□ 8、申办者资质□ 9、其他:附2:研究方案目录(医疗器械)□ 1、临床试验方案中文版本号:日期:;英文版本号:日期:□ 2、知情同意书中文版本号:日期:;英文版本号:日期:□ 3、病例报告表中文版本号:日期:;英文版本号:日期:□ 4、研究者手册中文版本号:日期:;英文版本号:日期:□ 5、主要研究者履历□ 6、医疗器械注册产品标准□ 7、医疗器械自检报告□ 8、申办者资质□ 9、其他:豁免知情同意申请表填表须知:1、请以电子版形式填写本申请表,打印后签字(不接受手写版申请表);2、请如实填写本申请表。
临床试验生物样本外送承诺书项目名称:发起方:研究者:上海市第一人民医院是参加该临床试验的医院之一,依据《赫尔辛基宣言》、我国《药物临床试验质量管理规范》、我国《人类遗传资源管理条例》以及其他相关法规,在受试者签署知情同意书后,结合上海市第一人民医院有关生物样本的管理规范,研究者/发起方对该试验中有关生物样本(包括但不限于组织切片、血样、尿样、临床分离菌、生物标记物等)的保存、运输、使用、销毁等环节进行如下承诺:1、研究者承诺在该试验中,标本必须首先满足上海市第一人民医院临床正常的医疗用途,再由医院根据科研及临床需求情况后决定是否选送。
试验用药物接收、保存、发放、回收、退还的SOP

上海市第一人民医院上海交通大学附属第一人民医院国家药物临床试验机构 30 版程序类 SOP CX-JG-3-22 试验用药物接收保存发放回收退还的SOPI 目的规范药物临床试验中试验用药物的接收保存发放回收退还确保试验药物质量保证药物正确使用II 范围适用于本机构所有临床试验III 规程试验药物是指临床试验中用作试验或对照的药物或安慰剂机构指定药物管理专员负责试验用药物的管理专业组的试验用药物日常管理由专人负责1 试验用药物的接收11申办者按储存要求运送试验用药物机构药物管理员在接收时应核对如下项目111 试验用药物的药检报告试验用药物名称剂型规格数量生产日期批号有效期生产厂家112 运输过程中的条件是否与贮存条件相符113 阳性对照药必须为国内已批准上市的药品并附药品说明书114 药物编号凡双盲试验用药物双盲药物每盒均有药物编号接收时要检查药物编号是否与运送单上号码一致如果出现不一致时与即时与该项目的申办方联系试验用药物与阳性对照药或安慰剂在外形形状色泽质感气味包装标签和其他特征一致115 应急信封接收双盲药物时如附有应急信封要注意应急信封上的编号与该批药物的药物编号是否一致检查信封是否密封如有破损要及时向项目监察员联系接收应急信封后应交予使用该试验用药物的临床科室并应由专人专柜保管116 药物包装检查药物的外包装是否完好包装的标识是否清楚117 标签药袋小盒大盒均需贴标签内容为试验编号×××临床试验用药物药名药物编号规格用法用量注意事项贮藏条件有效期批号生产日期生产厂家等118 低温运送药物首先要核对温度计的编号与送货单上登记的编号是否一致再记录温度核对无误后要求快递员在温度记录单签上姓名日期把温度版本日期 2012-11-10 1上海市第一人民医院上海交通大学附属第一人民医院国家药物临床试验机构 30 版程序类 SOP CX-JG-3-22 记录表传真到指定的地址或交快递员寄回12 信息核对无误后签收在接收记录上附件 1 与申办方共同登记并签名13 机构药物管理员将验收合格的试验药物发至专业组药物管理员双方共同清点交接2 试验用药物的保存21 试验用药物保存于专业组的加锁专用储藏柜或冰箱中严格按照其保存条件要求进行储藏22 试验用药品由专人保管建立专门的帐册登记发放情况并规定接触人员的名单23 不得把试验用药物转交给任何非临床试验参加者24 定期检查试验药品的质量失效期如有试验用药物破损变质失效则将药物集中单独存放统一退还申办者25 试验用药物存放期间每日需记录温湿度节假日除外药物管理员填写《试验用药物贮藏记录表》附件 2 常温存放药物贮藏温度不超过 30 ℃阴凉存放药物贮藏温度不超过 20 ℃凉暗处保存药物避光保存并不超过 20 ℃冷处保存药物贮藏温度 210 ℃试验用药物储存环境相对湿度应保持在 5 75 之间26 超出规定温湿度条件范围时及时采取调控措施确保储存条件符合要求并把该批药物按保存条件单独放置等待该项目的临床监察员判断物是否可以继续使用27 当试验用药物不足一个月的药量时药物管理员要通知研究者和申办者3 试验用药物的分发回收31药物管理员根据授权医生开出的处方或医嘱进行试验用药物的分发并详细记录于《试验用药物分发回收登记表》附件 3311 接收药物受试者的姓名缩写及代码312 分发的数量包装编号及日期313 用药开始及停止时间314 用法与用量315 从受试者收回的用药后空包装及未用包装数量版本日期 2012-11-10 2上海市第一人民医院上海交通大学附属第一人民医院国家药物临床试验机构 30 版程序类 SOP CX-JG-3-22316 分发药物时的其他情况记录和解释如药物的误用损失等32试验用药物的分发应严格执行研究方案所制定的分发要求4试验用药物的使用试验用药物的使用由研究者负责必须保证所有试验用药物仅用于该临床试验的受试者不得挪做它用5 试验用药物的退还试验结束时剩余药物及用药后空包装退回机构药物管理员清点核实后退还申办者或 CRO 监察员并共同签署《试验用剩余药物退回登记件 46 机构药物管理人员在试验进行过程中将不定期抽查专业组试验用药物的保管和发放情况专业组应随时接受监查员对试验用药物的接收分发使用储藏及剩余药物的处理过程的检查7 所有项目结题必须提供《试验用剩余药物退回登记表》机构方在分中心小结或者总结报告上盖章IV参考依据现行版 GCP 第十章试验用药品的管理《药品管理法》V附件1试验用药物接收登记表2试验用药物贮藏记录表3试验用药物分发回收登记表4试验用剩余药物退还登记表版本日期 2012-11-10 3上海市第一人民医院上海交通大学附属第一人民医院国家药物临床试验机构 30 版程序类SOP CX-JG-3-22附件1试验用药物接收登记表临床试验名称临床试验方案编号研究者申办者CRO 试验类别单盲双盲开放试验药物名称规格数量批号有效期生产日期生产单位保存条件是否有相应批次的药检报告包装与标签是否恰当是否标明为临床试验专用相关检查试验药物与对照药物安慰剂是否在外形气味标签包装和其它特征上一致送样人签名送样日期接收人签名接收日期版本日期 2012-11-10 4上海市第一人民医院上海交通大学附属第一人民医院国家药物临床试验机构30 版程序类SOP CX-JG-3-22附件2试验用药物贮藏记录表医院名称研究科室存放地点负责人姓名温度计型号要求温度Required Temperature °C 请每日记录please record everyday 温度最低温度最低最最高湿度最低湿度最低日期签名缩写日期高签名缩写Temperat 最高最高Date Initials Date Temperature Initialsure Humidity Humidityminmin注本表一式两份研究单位和申办者各保存一份版本日期2012-11-10 5上海市第一人民医院上海交通大学附属第一人民医院国家药物临床试验机构 30 版程序类SOP CX-JG-3-22附件3试验用药物分发回收登记表研究项目试验中心申办者方案编号研究者受试者编号受试者姓名缩写发药日期药物名称药物批号规格发药数量发药人签名退还日期退还数量回收人签名备注注本表一式两份研究单位和申办者各保存一份版本日期 2012-11-10 6。
临床试验观察表(CRF)(word文档良心出品)

病例报告表(Case Report Form)受试者姓名:家庭地址:联系电话:试验中心名称:申办单位:延吉喜来健医疗器械有限公司在正式填表前请认真阅读下列填表说明病例报告表填写说明:1.筛选合格者填写病例报告表。
2.病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。
3.填写记录一律用钢笔或碳素签字笔。
4.患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。
5.表中凡有“□”的项,请在符合的条目上划“√”。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.所有检验项目因故未查或漏查,请填写ND;具体合并用药剂量和时间不明,请先写NK。
7.试验期间应如实填写合并用药记录表、不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。
8.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目,请对照临床流程图执行。
受试者知情同意书敬爱的患者:我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。
温热磁疗仪是XXX医疗器械有限公司根据韩国专利技术研制生产的医疗器械,本治疗仪是通过XXXXXXXXXXXXXXXXXXXXXXXXXXXXXX机理,主要用于XXXXXXXXXXXXX治疗。
具有平衡机体阴阳,增强脏腑机能,促进新陈代谢,调节植物神经,改善心脑血管血液供应,促进血液循环,调节血管张力,降低血液粘稠度,防治动脉粥样硬化,促进组织的再生修复功能,增强机体免疫功能及消炎止痛等作用。
临床试验—病例表

甘露聚糖肽注射液辅助治疗恶性肿瘤的安全性和有效性的随机、双盲、与安慰剂平行对照、多中心临床再评价试验病例报告表(Case Report Form)受试者姓名缩写□□□□药物编号:□□□试验中心编号:□□试验开始日期年月日填表说明1.请用签字笔填写,字迹应清晰,易于辨认。
2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。
3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。
4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。
不要用任何方式(橡皮、涂改液等)涂抹原记录。
5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。
6.知情同意书一般为患者签名。
如患者有特殊情况,可由患者法定代理人签名。
试验观察流程图入组筛选表1.受试者应为:♦年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽)♦性别不限♦预计生存期2个月以上的住院患者♦疼痛强度为中到重度,评分≥4♦并符合一下条件之一(请在符合的项目上画圈)1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2;2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2♦非放疗期或疼痛部位为非照射部位♦间歇期的化疗者,应由主管医生确认化疗后无止痛作用♦该患者是否同意参加本试验,并已签署知情同意书如以上任何一个答案为“否”,此受试者不能参加2.受试者排除标准:♦本研究开始前4周内曾参加过其他临床试验♦正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等)♦24小时内用过XX类镇痛药,或5日内用过XXX♦癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗♦呼吸抑制、(肺)气道阻塞或组织缺氧♦胆道疾病♦心脏疾患(即Ⅱ级和Ⅱ级以上心功能)♦血压高于正常值♦血液系统疾病♦肝、肾功能明显异常(即指标高于正常值一倍以上)♦脑部疾病,判定能力异常♦XX药耐受、过敏,或曾在使用时因不良反应停药♦药物及∕或酒精滥用♦孕妇或哺乳期妇女如以上任何一个答案为“是”,此受试者不能参加结论:该患者是否符合上述要求,同意入组是□□□□□□□□是□□□□□□□□□□□□□□□否□□□□□□□□否□□□□□□□□□□□□□□□医生签名:______日期____年___月___日病历简况1.1检查日期:年月日.2受试者病历号:2.1出生日期:年月.2性别:□1.男□2.女.3临床诊断:分期1. T□ 2. N□ 3. M□.4现接受的抗癌治疗:□1.放疗间歇期□2.化疗间歇期□3.中医药□4.手术□5.无□6.其他(请注明).50疼痛强度 : □1.轻(评分 ) □2.中(评分 ) □3.重(评分 ) .51疼痛性质: □1.急性疼痛□2.慢性持续性疼痛□3.间歇性(规律或无规律) □4.持续性痛伴一过性加剧□5.其他.52疼痛主要部位:□1.头面部□2.颈部□3.四肢□4.胸背部□5.腹部□6.骨关节□7.会阴□8.其他(请注明).53疼痛能否自行缓解:□1.能□2.有时能□3.不能.60入选前接受的镇痛治疗:□1.无□2. 吗啡、度冷丁、二氢埃托啡、美散痛、芬太尼等普通制剂□3. 缓控释吗啡、多瑞吉□4. 自控泵□5. 可待因及其复方制剂□6. 曲马多□7. 解热镇痛药□8. 其他如有,请回答:.61药品名称用药剂量:.62用药方式:□1.口服□2.静注□3.肌注□4.其他.63用药时间:□1.近四周内□2.近三天□3.其他3.0既往史.1药物过敏史□1.无□2.有 .2脑部疾患□1.无□2.有.3心脏疾患□1.无□2.有 .4哮喘□1.无□2.有.5胆道疾患□1.无□2.有 .6习惯性便秘□1.无□2.有.7肾脏疾患□1.无□2.有 .8糖尿病□1.无□2.有如有,请描述:1.2.4.0体格检查.1 1.T ._℃ 2.P 次/分 3.R 次/分4.SBP mmHg5.DBP mmHg6.身高 cm7.体重 Kg .2皮肤粘膜□ 1.无□2.苍白□3.黄染□4.紫绀□5.皮疹.3浅表淋巴结□ 1. 无肿大□2.有肿大.4双侧瞳孔□ 1.等大等圆□2.不等大□3.不等圆.50呼吸节律 .51肺部罗音□1.规则□2.不规则□1.无□2.有.60心律 .61心脏各瓣膜区杂音□1.齐□2.不齐□1.无□2.有.70腹部 .71腹部压痛□1.软□2.硬□1.无□2.有.72腹部包块 .73 移动性浊音□1.无□2.有. □1.无□2.有.74肝区叩痛 .75肝脏肿大□1.无□2.有□1.无□2.有.76脾脏肿大 .77肾区叩痛□1.无□2.有□1.无□2.有.80生理反射□1.存在□2.部分存在□3.不存在.81病理反射□1.未引出□2.有引出5.入组前可能与镇痛药物有关的基础症状(如果患者出现没有标识的症状,请自行填写文字)给药前生活质量记录表入组时实验室检查心电图检查医生签名:______日期____年___月___日入组时检验报告粘贴单用药情况记录表镇痛效果记录表说明1.0度:未缓解(疼痛未减轻);1度:轻度缓解(疼痛减轻约1/4);2度:中度缓解(疼痛减轻约1/2);3度:明显缓解(疼痛减轻约3/4以上);4度:完全缓解(疼痛消失)。
上海市第一人民医院HIS系统临床试验模块使用指南

上海市第一人民医院HIS系统临床试验模块使用指南简介:本临床试验模块的建立,基于我院HIS平台,以实现项目的免费检验、检查及伴随用药。
一、试验开展前需了解事宜1.研究者是否有“154药物试验门诊权限”,如没有,请先填写“研究者授权申请”(附件1),科室负责人、机构办主任签字后,交至信息科项醇处(分机4545)开通。
2.协议中是否涉及免费检验、检查及免费药物。
3.试验需进行的具体免费检验、检查项及免费药物,如有特殊检查如无痛胃肠镜、MRI、CT、CTA等,需包含必要的配套药物或者操作。
4.根据拟入病例数,预估需要充入的检查费/药费(可根据项目进度分次充入系统)。
二、研究者操作部分1.项目信息维护(需在机构办公室完成):(1)在《药物临床试验代码表》中按顺序进行编号,北院为Y开头(例Y2018001),南院为S开头(例S2018001)。
(2)登录门诊HIS系统,点击“其他设置”,点击“临床药物试验方案”,填写项目基本信息(每个内容均需填写,不可缺项),点击“新增”。
(方案名称:例Y2018001+项目简称)(3)项目基本信息维护完成后,在“方案名称包括中”输入“Y2018001”,点击“查询”,显示项目后双击。
(4)点击“项目相关药物信息”进行项目相关药物信息、相关非药物信息、相关医师信息维护。
a)相关非药物信息维护:例:血常规(血细胞分析)——输入每字首字母“xxbfx”——回车——选择相应检查——添加,按》键;如需移除,按《键b)相关医师信息维护:输入医师姓名——回车——选择相应工号——添加,按》键;如需移除,按《键注意事项:南北两院系统完全独立,北院项目在北院门诊HIS系统中维护,南院项目在南院门诊HIS系统中维护。
若同一项目南北院同时开展,两院系统均需维护。
2.免费检查/药物资金充值(1)项目经费到账后至机构办提交免费项目经费充值申请(免费药物和免费检查需分别充值)。
(2)充值完成,登录门诊HIS系统——其他设置——临床试验病人入组选择——在“入组组号”中选择相应方案——查看检查/药物金额。
出院后的肿瘤病人追踪表

出院后的肿瘤病人追踪表
目的
该追踪表旨在帮助医院对出院后的肿瘤病人进行有效的管理和
跟踪,确保他们能够按时接受治疗和检查,提高治疗效果和生存率。
表格内容
该追踪表包括以下内容:
1. 患者基本信息:姓名、性别、年龄、联系方式等;
2. 肿瘤类型和分期:记录患者的肿瘤类型、分期和病理类型等
重要信息;
3. 出院医嘱和治疗计划:记录患者出院时的医嘱和治疗计划,
包括手术、放疗、化疗等;
4. 随访记录:记录患者的随访日期、随访方式、身体状况、治
疗情况等;
5. 不良反应和并发症记录:记录患者在治疗过程中出现的不良
反应和并发症等;
6. 其他注意事项:记录患者的其他需要注意的事项,比如注意事项、营养指导、心理支持等。
填写方式
每次患者来院随访时,医生应根据表格内容进行记录,并及时更新患者的治疗计划和随访计划。
在患者治疗过程中,医生还应及时记录患者的不良反应和并发症等,并采取相应的措施进行处理。
注意事项
1. 该追踪表仅供参考,医生应根据实际情况进行调整;
2. 医生应保证填写内容的真实性和准确性;
3. 医生应注意保护患者的隐私权,避免泄露个人信息。
结束语
该追踪表是肿瘤病人管理工作中的重要组成部分,医生应认真填写和使用,以确保患者能够得到及时、有效的治疗和管理。
人体生物样本采集-上海第一人民医院

药物临床研究协议书项目名称甲方单位********公司乙方单位上海市第一人民医院签定日期:年月日一、协作方式、目的、内容甲方(********公司)委托乙方(上海市第一人民医院)为参研单位,对甲方研制的**类新药“****治疗****期”临床研究项目(国家食品药品监督管理局批件号:**#)按GCP要求进行临床研究。
二、研究目的、内容:研究目的:**。
研究内容:由甲方研制开发的****(以下简称临床试验药物),在获得国家食品药品监督管理局《药物临床研究批件》(批件号:#)的基础上,甲方委托乙方为参研单位负责****治疗****期临床研究(以下简称“本试验”)。
乙方同意接受甲方委托,双方将协作进行本项临床研究。
为明确双方的权利、责任及义务,经友好协商,订立以下条款。
双方共同遵守。
三、各方承担的责任和义务甲方:1.向乙方提供 *** (新药名称)临床研究方案、知情同意书、CRF、研究者手册、国内外临床研究资料综述等资料、国家食品药品监督管理局(CFDA)的临床批件,对所提供资料的真实性负责。
2.按试验方案规定,免费提供符合GCP要求足量的试验用药品和基础用药(写出名称、数量、规格等明细及保存要求,根据要求将收取药物管理费或者提供保存设备)及其质检报告。
(器械临床试验,需列明是否提供相关设备及型号,并写明免费提供还是结束后需回收)3.按协议要求的时间和金额,向乙方支付临床研究费用。
4.向乙方所在地派遣合格的监查员,协助乙方按GCP标准开展临床试验工作,负责临床试验全过程的监查与协调。
监查员有权对受试者的相关实验数据进行溯源,核对病例报告表(本研究使用eCRF)是否填写正确。
5.在项目启动至入组第三例受试者后,组织对项目进行第三方的稽查,向乙方提供稽查报告并将问题整改合格经乙方同意后,方可进行后续受试者的入组。
6.组织研究者和机构办参加各期临床研究会议,承担参加会议人员的食宿、交通费用。
7.甲方对本临床试验相关的资料、数据和统计分析结果有拥有权。
原始资料记录SOP

审查日期编号:HX-DS-001-2016/01 机密XXXX 的 SOP版本号:2012/01页数:页(包括封面)颁布日期:2016-12-01起效日期:2016-12-01起草人:2016 年 11 月 16 日审核人:2016 年 11 月 16 日批准人:李梅华2016 年 11 月 16 日版本更新记录版本号2012/01 起效日期2016-012-01 失效日期制(修)订理由简报原始版审查日期1 2 34审查记录签名 签名56 78昆明市第一人民医院药物临床试验机构文件编号:HX-DS-001-2016/01文件类别:标准操作规程版次:2016/01文件名称:药物临床试验方案设计规范页码:第1页共6页1目的:为了规范呼吸专业组药物临床试验方案的设计,按照药物管理法、药物注册管理办法、GCP及其相关规定的要求,特制订本规程。
2范围:本规程适用于呼吸专业组各类临床试验方案设计。
3职责:呼吸专业组研究人员对本规程实施负责。
4修订(制订)理由:原始版。
5依据:《GCP》。
6定义:7程序内容:原始资料记录SOP目的:保证原始资料记录真实、可靠、提高药品研究的质量。
定义:原始资料是指研究者在临床试验过程中形成的文字、符号、图表、声像等资料的总和,包括住院病历、门诊病历和辅助检查结果报告等。
原始资料记录是指研究者通过询问、查体、辅助检查、临床观察等活动获得的有关资料,并进行归纳、分析和整理而形成相关文件的过程。
范围:适用于所有药物临床试验。
内容:对临床试验中原始资料记录进行统一规定,保证数据真实可靠。
一、药物临床研究的各种原始资料是证明新药评价科学、客观、真实的重要文件,是用于证明临床试验数据真实、准确、可靠的证据。
应严格按照GCP 和医院管理的有关规定完整、妥善保存,并随时备查。
二、原始资料的记录包括病历记录和实验室记录。
病历、实验室记录、自动仪器记录、X线片、心电图等均属于原始资料。
三、在临床试验开始以前,主要研究者应与研究人员讨论如何在原始文件中记录有关临床试验的信息,并建立对原始记录的要求和提供原始文件中临床试验信息的格式。
临床研究填写指南

开始时间 结束时间 目前持续 (年/月/日) (年/月/日) (请划“×” ) UN 22004/1/10 2004/4/15 × □
如 果受试者 所患疾病 目 □ 前仍未治愈,则“结束时 □ 间”可以不填,并在后面 的空格中选择目前持续 □ □ □ □
第5页
N-乙酰氨基葡萄糖 II 期临床试验临床研究资料填写指南 N-乙酰氨基葡萄糖 II 期临床试验病例报告表 申办者: 江苏江山制药有限公司
×无 ×否 是 病程:1 0月
如果是女性,则生育次数是1次 ,是否已经绝经 身高 1 7 5cm
体重0 6 5.5kg
生命体征 体温 血压 3 6.5摄氏度 1 1 0/0 8 5mmHg 呼吸速率 静息心率 1 5次/分 0 6 5次/分
体格检查 系统 耳、鼻、喉 、眼 呼吸系统 消化系统 泌尿系统 中枢神经系统 血液及淋巴系统 内分泌系统 皮肤 其他 × × × × × × × 请研究者在此签 字 □ 此处填写研究者签 字的日期 日期:____________________ 如果体检时发现异常请 在画横线处详细描述 正常 × × 左下肺湿罗音 异常 如果异常请说明
合同研究组织: 合同研究组织: 上海艾而达生物科技有限公司
第3页
N-乙酰氨基葡萄糖 II 期临床试验临床研究资料填写指南 N-乙酰氨基葡萄糖 II 期临床试验病例报告表 申办者:江苏江山制药有限公司
批准文号 2003L03905
试验中心 0
药物编号 0 1 8
受试者姓名缩写 W X W E
就诊日期 2004年1 1月0 8日
N-乙酰氨基葡萄糖 II 期临床试验临床研究资料填写指南
I.
总则
1、 2、 所有的临床研究资料应使用黑色水笔及时填写。 填写务必准确,字迹应清晰可辨,不得随意涂改,错误之处纠正时需用横线居中划出,并在错 误处右上方签署修改者姓名或姓名缩写及修改时间,原改处内容应能清晰可见,修改后的内容 填写在原内容上方。 36.4 举例:: 57.6 3、
药物临床试验数据核查表

2.2.2已签署的知情同意书数量与总结报告中的筛选病例数一致。
请如实记录
2.2.3所有知情同意书签署的内容完整、规范(含研究者电话号码,签署日期等)。
请如实记录
2.2.4知情同意签署时间不得早于伦理批准时间,记录违规例数;修订的知情同意书应要求处在试验阶段的受试者再次签署。
记录临床试验批件批准时间、伦理批准时间、合同签署时间、本中心启动会时间
1.2
伦理审查批件及记录的原始性及完整性:
1.2.1试验过程的所有伦理审查活动,包括初始审查、加快审查、持续审查等。
请列出清单
1.2.2核对伦理审查时相应提交资料的完整性。
资料是否完整?包括伦理提交函和伦理签收函
1.3
临床试验合同经费必须覆盖临床试验所有开支(含检测、受试者营养/交通费补贴、研究者观察费等)。
数据核查人员签名:核查日期:
项目负责人声明
本项目已经按照《药物临床试验数据现场核查要点》逐项进行了检查,上述核查情况表的填写真实可靠。
项目负责人签名:日期:
逐例逐项检查,有违反入排标准的要详细记录
2.1.3*受试者代码鉴认表或筛选、体检等原始记录涵盖受试者身份鉴别信息(如姓名、住院号/门诊就诊号、身份证号、联系地址和联系方式等),由此核查参加临床试验受试者的真实性。
核对受试者鉴认代码表有研究者或受试者的签名,以确认信息的准确性。
2.1.4对受试者的相关医学判断和处理必须由本机构具有执业资格的医护人员执行并记录,核查医护人员执业许可证及其参与临床试验的实际情况。
请如实记录
2.4
CRF中违背方案和严重不良事件(SAE)例数等关键数据:
2.4.1核查CRF中合并用药记录与门诊/住院病历记载是否一致,核实并记录漏填的合并用药例数;若一致则核实其与总结报告是否一致。
病案追踪记录表

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载病案追踪记录表地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容12(宋丹丹)保持病案的可获得性。
【C】1.保持病案的可获得性。
(1)有方法(如病案示踪系统)控制每份病案的去向,(2)病案如果没有其他替代品,如:影像、缩影,病案则不能打包存放或远距离存放(委托存放)。
2.有3年病案存放的发展空间。
3.对未归的病案有催还的实际记录。
4.对病案使用期限和使用范围有明确的规定。
5.患者出院后,住院病历在7 个工作日之内回归病案科达≥90%。
【B】符合“C”,并1.患者出院后,住院病历在3 个工作日之内回归病案科达≥90%。
2.病案科与职能部门对患者出院后病历未能及时回归病案科的科室进行追踪、分析、改进管理,保障回归率。
【A】符合“B”,并1.患者出院后,住院病历在 2 个工作日之内回归病案科达≥95%,在 7 个工作日内回归病案科 100%。
2.病案管理有序,去向明确,保持病案的可获得性。
病案室工作:1、对病案使用期限和使用范围有明确的规定。
对病案使用期限和使用范围有明确的规定一、时间:三天之内归还。
二、使用范围:1.再次住院病人的病案调用。
2.临床病历讨论会、病理讨论会、死亡讨论会、尸体病理检查等调用。
3.医院领导对医疗事故、差错检查、及其他有关问题的处理调用病案。
4.科学研究、临床教学的调用。
5.医疗单位以外的因公临时性调阅,如:公检法部门、患者工作单位、社会福利、医疗保险等部门,经病人同意方可提供。
2、对患者出院后病历未能及时回归病案科的科室进行追踪、分析、改进管理,保障回归率。
钟山县人民医院钟山县人民医院保证病案回收率的措施:做好临床科主任、医生及护士长的思想工作,在院周会上要明确出院病案三日回收的重要性,必须按照规定执行。
