《化学平衡常数》PPT课件
合集下载
大学化学《无机化学-化学平衡常数》课件

❖
在可逆反应中,为了尽可能利用某一反应物,
经常用过量的另一种物质和它作用。
❖ 不断将生成物从反应体系中分离出来,则平衡 将不断向生成产物的方向移动。
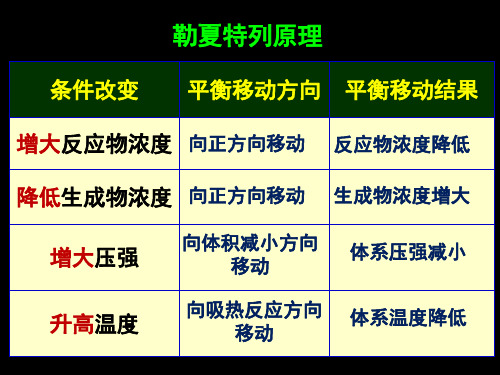
6.4压力对化学平衡的影响
❖ 等温下,增大总压强,平衡向气体分子数减少的方
向移动;减压,则平衡向气体分子数增加的方向移 动。如:
❖
673K时反应:N2(g)+3H2(g)2NH3(g)
这就是化学反应等温式。用该式可以求出 rGm , 以做为 非标准态下化学反应进行方向的判据。
<0
自发反应
rGm
=0
可逆途径,平衡态
当体系处于平衡时 > 0
非自发
有
rGm = 0 , 同时 Q = K
故化学反应等温式 rGm = rGm + RTlnQ 变为
0 = rGm + RTln K
即 rGm = - RTln K
第6章 化学平衡常数
主要内容:本章应该掌握化学平衡常数的概念和平 衡常数表达式;理解和区分标准平衡常数和经验平 衡常数;掌握有关化学平衡的计算;掌握化学平衡 移动原理。
重难点:化学平衡常数的概念的理解和计算
教学方法:讲授法
6.1化学平衡状态
6.1.1化学平衡 正逆反应速度相等时体系所处的状态称为化学平
T2 T1 T1T2
体系放热时rH为负值,吸热时为正值。K1、K2分别 为温度T1、T2时的平衡常数,R是气体常数。
这一公式极为重要,它将两个重要的热力学数据 rGm 和 K 联系起来。
将 rGm = - RTlnK 代入化学等温式,得
rGm = - RTlnK + RTlnQ即Βιβλιοθήκη Q rGm RT ln K
化学平衡常数 (ppt.x)

可逆反应
平衡常数 K (25℃)
H 2 F2 H 2 Cl 2 H 2 Br2 H2 I2
2 HF
6.5 1095 5.5 1033
2 HCl
2 HBr 2 HI
2.2 1018
8.7 102
卤素单质与氢气的反应现象
反应 反应条件及产物的稳定性
在暗处能剧烈化合并发生爆炸,生 成的氟化氢很稳定 光照或点燃发生反应,生成的氯化 氢较稳定 加热至一定温度才能反应,生成的 溴化氢不如氯化氢稳定 持续加热才能缓慢反应,碘化氢不
Cl 2 ( g ) H 2 O(l )
HCl (aq) HClO(aq)
Kc
注意事项:
(1)对于同一个可逆反应, K正 K 逆 1 ;
(2)固体或纯液体的浓度视为常数,平衡常数表达式和浓度熵表达式中不出现固 体或纯液体; (3)化学平衡常数是指某一具体反应的平衡常数,化学方程式的书写形式不同, 则 K、Qc的表达式不同;
(2)同理,可得
1.7m ol L1 (CO) 100% 85% 1 2m ol L
H 2 F2 H 2 Cl 2
2 HF
光照或点燃
2 HCl
H 2 Br2 H2 I2
2 HBr
2 HI
稳定,在同一条件下,同时分解为 氢气和碘蒸气
练习3:298K时,各反应的平衡常数如下:
① N 2 ( g ) O2 ( g ) ② 2H 2 ( g ) O2 ( g ) ③ 2CO2 ( g )
起始 (mol L ) 转化 (mol L ) 平衡 (mol L )
1 1 1
2
2
0
0
x
化学平衡与化学平衡常数-PPT

29
11
[解析] (1)在恒温、恒压条件下向平衡体系中通入氩气,相 当于给反应体系减压,则平衡向着物质的量增大的方向移 动(向左移动);ΔH是一个状态函数,与反应的速率和反应的 程度无关,而使用催化剂只能改变反应速率,ΔH不变. (2)由盖斯定律可得:ΔH=ΔH1+ΔH2-ΔH3=1175.7 kJ·mol-1 +(-771.1 kJ·mol-1)-482.2 kJ·mol-1=-77.6 kJ·mol-1.
以该曲线上任一点的Ksp都相等,D项错误. 答案:C
27
5.(2009·重庆高考)各可逆反应达平衡后,改变反应条件,
其变化趋势正确的是
()
28
解析:A项,加入CH3COONa,使CH3COOH的电离平衡逆向移 动,c(H+)减小,pH增大;B项,加入KCl,对平衡没有影响, c(Fe3+)不变;C项,加入Ar气,原平衡分压减小(因平衡为恒 压过程),平衡左移,H2转化率减小. 答案:D
条件下向平衡体系中通入氩气,平衡________移动(填“向左
”“向右”或“不”);使用催化剂________反应的ΔH(填“
增大”“减小”或“不改变”).
8
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
9
(2)已知:O2(g)===O+2 (g)+e- ΔH1=1175.7 kJ·mol-1 PtF6(g)+e-===PtF-6 (g) ΔH2=-771.1 kJ·mol-1 O+2 PtF6-(s)===O+2 (g)+PtF-6 (g) ΔH3=482.2 kJ·mol-1 则反应 O2(g)+PtF6(g)===O+2 PtF6-(s)的 ΔH= ________kJ·mol-1.
13
[答案] (1)向左 不改变 (2)-77.6
11
[解析] (1)在恒温、恒压条件下向平衡体系中通入氩气,相 当于给反应体系减压,则平衡向着物质的量增大的方向移 动(向左移动);ΔH是一个状态函数,与反应的速率和反应的 程度无关,而使用催化剂只能改变反应速率,ΔH不变. (2)由盖斯定律可得:ΔH=ΔH1+ΔH2-ΔH3=1175.7 kJ·mol-1 +(-771.1 kJ·mol-1)-482.2 kJ·mol-1=-77.6 kJ·mol-1.
以该曲线上任一点的Ksp都相等,D项错误. 答案:C
27
5.(2009·重庆高考)各可逆反应达平衡后,改变反应条件,
其变化趋势正确的是
()
28
解析:A项,加入CH3COONa,使CH3COOH的电离平衡逆向移 动,c(H+)减小,pH增大;B项,加入KCl,对平衡没有影响, c(Fe3+)不变;C项,加入Ar气,原平衡分压减小(因平衡为恒 压过程),平衡左移,H2转化率减小. 答案:D
条件下向平衡体系中通入氩气,平衡________移动(填“向左
”“向右”或“不”);使用催化剂________反应的ΔH(填“
增大”“减小”或“不改变”).
8
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
9
(2)已知:O2(g)===O+2 (g)+e- ΔH1=1175.7 kJ·mol-1 PtF6(g)+e-===PtF-6 (g) ΔH2=-771.1 kJ·mol-1 O+2 PtF6-(s)===O+2 (g)+PtF-6 (g) ΔH3=482.2 kJ·mol-1 则反应 O2(g)+PtF6(g)===O+2 PtF6-(s)的 ΔH= ________kJ·mol-1.
13
[答案] (1)向左 不改变 (2)-77.6
化学平衡常数计算 PPT课件

2、已知在800K时,反应:
CO(g) + H2O(g)
H2(g) + CO2(g)
若起始浓度c(CO) = 2mol•L-1,c(H2O) = 3mol•L-1,
则反应达平衡时,CO的转化率为60%,如果将H2O的起始浓度加大为
6 mol•L-1,
1)求此时CO的转化率。
2)分别求改变H2O的浓度前H2O的转化率和浓度改变后H2O的转化率? 3)通过以上数据发现,增加一种反应物的浓度后,另外一种反应
第二节 化学反应的限度
化学平衡常数
顾燕蓉
1、平衡常数K:
一定温度下,密闭容器中:
对于反应: aA(g) + bB(g)
cC(g) + dD(g)
K=
巩固练习
1、 请写出下列反应的平衡常数表达式
3、已知:某温度下,H2(g)+I2(g) 2HI(g)
的平衡常数为K1 ;1/2H2(g)+ 1/2I2(g) HI(g)
发生反应:CO(g)+H2O(g)
CO2(g)+H2(g)
800℃时反应达平衡,若k=1.求:
(1)CO的平衡浓度和转化率。
(2)若温度不变,上容器中充入 的是1mol CO和 2mol H2O(g), CO和H2O(g),的平衡浓度和转化率是 多少。
(3)若温度不变,上容器中充入 的是1mol CO和 4mol H2O(g), CO和H2O(g),的平衡浓度和转化率是 多少。
(2)已知平衡转化率和初始浓度求平衡常数
例2:反应SO2(g)+ NO2(g)
SO3(g)+NO(g) ,若
在一定温度下,将物质的量浓度均为2mol/L的
高三化学化学平衡常数(课件)
,△H 0
(填“<”“ >”“ =”);
(4)1200℃时反应C(g)+D(g)
A(g)+B(g)的平衡常
数的值为
。
【答案】(1) <
(4)2.5
三、化学平衡常数
1. 概念 在一定温度下,一个可逆反应达到__平__衡____
时,生成物_浓__度__幂__之__积__与反应物 _浓__度__幂__之__积__的比值,用符号_K__表示。
0.2
0
平衡浓平度衡/m常o数l·的L-计1 算:0.05 0.05
0.1
下列说法错误的是K:=——c—2 (—Z)———
A. 反应达到平衡时,Xc的3 (Y转) 化·c(率X)为50%
B. 反应可表示为X+3Y 2Z,其平衡常数为
1600
C. 增大压强使平衡向生成Z的方向移动,平衡
常数增大
D. 改变温度可以改变此反应的平衡常数
(3) 保持温度和压强不变加入稀有气体,则C的物 质的量 减小 。
(4) 保持温度和体积不变加入稀有气体,则A的转
化率
不变
。
(5) 若温度和体积不变,反应从A、B开始至平衡, 在这个变化过程中,容器内气体的密度 不变 ,混 合气体的平均相对分子质量 增大 。
高考化学第一轮复习之 第七章 化学反应速率和化学平衡
高考面对面
例1. (09年海南)在25℃时,密闭容器中X、
Y、Z 三种气体的初始浓度和平衡浓度如下表:
物质
本答案X考查了平Y衡
Z
初始浓度/mol·L-1 常数0的.1外界影响0.因2
0
平衡浓度/mol·L-1素:0只.0与5温度有0关.05, 0.1
《化学平衡常数》PPT人教

《化学平衡常数》PPT人教
《化学平衡常数》PPT人教
[特别提醒](1)关于 H2O 的浓度问题: ①稀水溶液中进行的反应,虽然 H2O 参与反应,但是 H2O 只作为溶剂,不能带入平衡常数表达式。
如 NH4Cl+H2O
NH3·H2O+HCl 的平衡常数表达式为 K
=cHCl·cNH3·H2O。 cNH4Cl
• 1.在某温度下,可逆反应:
• mA(g)+nB(g)
pC(g) + qD(g)的平衡常数为K,
AD 下列说法正确的是(
)
• A.K越大,达到平衡时,反应进行的程度越大.
• B.K越小,达到平衡时,反应物的转化率越大.
• C.K随反应物浓度改变而改变.
• D.K随温度改变而改变.
《化学平衡常数》PPT人教
提示:(1)× (2)√ (3)√ (4)√ (5)×
2.在一定温度下,三个反应: H2(g)+I2(g) 2HI(g) K1 12H2(g)+12I2(g) HI(g) K2 2HI(g) H2(g)+I2(g) K3, K1 与 K2、K3 有何关系?
提示:K1=K22;K1·K3=1
《化学平衡常数》PPT人教
《化学平衡常数》PPT人教
《化学平衡常数》PPT人教
【思路点拨】
(1)根据K随温度的变化可判断正反应为吸热反应还是放热 反应。 (2)计算平衡常数,然后与表中所给数据对比可判断反应的 温度。 (3)根据Qc与K的关系可以确定平衡移动的方向。
《化学平衡常数》PPT人教
《化学平衡常数》PPT人教
已知 A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol 的A和0.80 mol 的 B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s 时c(A)=0_.0_2_2_____ mol·L-1,C的物质的量为_0_.0_9_____mol;若反应经一 段时间后,达到平衡时A的转化率为__8_0%_____,如果这时向该密闭容器 中再充入1 mol 氩气,平衡时A的转化率为8_0_%______;
《化学平衡常数》PPT人教
[特别提醒](1)关于 H2O 的浓度问题: ①稀水溶液中进行的反应,虽然 H2O 参与反应,但是 H2O 只作为溶剂,不能带入平衡常数表达式。
如 NH4Cl+H2O
NH3·H2O+HCl 的平衡常数表达式为 K
=cHCl·cNH3·H2O。 cNH4Cl
• 1.在某温度下,可逆反应:
• mA(g)+nB(g)
pC(g) + qD(g)的平衡常数为K,
AD 下列说法正确的是(
)
• A.K越大,达到平衡时,反应进行的程度越大.
• B.K越小,达到平衡时,反应物的转化率越大.
• C.K随反应物浓度改变而改变.
• D.K随温度改变而改变.
《化学平衡常数》PPT人教
提示:(1)× (2)√ (3)√ (4)√ (5)×
2.在一定温度下,三个反应: H2(g)+I2(g) 2HI(g) K1 12H2(g)+12I2(g) HI(g) K2 2HI(g) H2(g)+I2(g) K3, K1 与 K2、K3 有何关系?
提示:K1=K22;K1·K3=1
《化学平衡常数》PPT人教
《化学平衡常数》PPT人教
《化学平衡常数》PPT人教
【思路点拨】
(1)根据K随温度的变化可判断正反应为吸热反应还是放热 反应。 (2)计算平衡常数,然后与表中所给数据对比可判断反应的 温度。 (3)根据Qc与K的关系可以确定平衡移动的方向。
《化学平衡常数》PPT人教
《化学平衡常数》PPT人教
已知 A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol 的A和0.80 mol 的 B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s 时c(A)=0_.0_2_2_____ mol·L-1,C的物质的量为_0_.0_9_____mol;若反应经一 段时间后,达到平衡时A的转化率为__8_0%_____,如果这时向该密闭容器 中再充入1 mol 氩气,平衡时A的转化率为8_0_%______;
课件《化学平衡常数》优秀课件完美版_人教版1

化学平衡常数 K12=K2=1/K32
Q<K时,平衡在向正反应方向移动
若升高温度,K值增大,则正反应为吸热反应
【思考与交流】在25℃时:
H2+I2
2HI, K=49;
若升高温度,K值增大,则正反应为吸热反应
一个反应的K值越大,平衡时生成物的浓度越大,反应物的浓度越小,反应物转化率也越大。
当一个可逆反应达到化学平衡状态时,反 1、定义:达到平衡,这时各种生成物浓度幂之积除以各反应物浓度幂之积所得的比值,常用K表示
答案:K=0.5625;氮气、氢气在反应开始 时的浓度分别为3.5mol/L和6.5mol/L
【问题探究】
反应:N2O4(g)
2NO2(g) K1
2N2O4(g) 4NO2(g) K2
2NO2(g)
N2O4(g) K3
它们的平衡常数是否相同?
K1=
c(NO2)2 c(N2O4)
K3=
c(N2O4) c(NO2)2
请结合以前的知识推测平衡常数跟反应的难易程度有何关系?
判断正在进行的可逆反应是否平 ⑶利用K可判断反应的热效应:
①由于固体、纯液体(水)浓度为一常数,
3×1033 ;
衡及不平衡时向何方进行建立平 ①由于固体、纯液体(水)浓度为一常数,
书写平衡常数应注意的几个问题:
c m(A) • c n (B)
衡: H2(g)+I2(g)
2HI △H<0
Байду номын сангаас
H2+I2
2HI, K=49;
Q<K时,平衡在向正反应方向移动 【思考与交流】在25℃时:
【思考与交流】对于反应: 一个反应的K值越大,平衡时生成物的浓度越大,反应物的浓度越小,反应物转化率也越大。
Q<K时,平衡在向正反应方向移动
若升高温度,K值增大,则正反应为吸热反应
【思考与交流】在25℃时:
H2+I2
2HI, K=49;
若升高温度,K值增大,则正反应为吸热反应
一个反应的K值越大,平衡时生成物的浓度越大,反应物的浓度越小,反应物转化率也越大。
当一个可逆反应达到化学平衡状态时,反 1、定义:达到平衡,这时各种生成物浓度幂之积除以各反应物浓度幂之积所得的比值,常用K表示
答案:K=0.5625;氮气、氢气在反应开始 时的浓度分别为3.5mol/L和6.5mol/L
【问题探究】
反应:N2O4(g)
2NO2(g) K1
2N2O4(g) 4NO2(g) K2
2NO2(g)
N2O4(g) K3
它们的平衡常数是否相同?
K1=
c(NO2)2 c(N2O4)
K3=
c(N2O4) c(NO2)2
请结合以前的知识推测平衡常数跟反应的难易程度有何关系?
判断正在进行的可逆反应是否平 ⑶利用K可判断反应的热效应:
①由于固体、纯液体(水)浓度为一常数,
3×1033 ;
衡及不平衡时向何方进行建立平 ①由于固体、纯液体(水)浓度为一常数,
书写平衡常数应注意的几个问题:
c m(A) • c n (B)
衡: H2(g)+I2(g)
2HI △H<0
Байду номын сангаас
H2+I2
2HI, K=49;
Q<K时,平衡在向正反应方向移动 【思考与交流】在25℃时:
【思考与交流】对于反应: 一个反应的K值越大,平衡时生成物的浓度越大,反应物的浓度越小,反应物转化率也越大。
化学平衡常数及计算-PPT

(2) Kc=[NO2]2/[N2O4]
(3)
Kc= [CO2]
13
4、平衡常数只表现反应进行的程度,即 可能性问题,而不表现到达平衡所需的 时间,即现实性问题.
5、平衡常数K与温度有关,与浓度无关,由K随温度 的变化可推断正反应是吸热反应还是放热。 若正反应 是吸热反应,升高温度,K 增大;若正反应是放热反应,升 高温度,K 减少;
3
二、数学表达式: 对于一般的可逆反应mA+nB pC+qD
{c(C)}p{c(D)}q
K = {c(A)} m{c(B)} n
三、平衡常数的单位 浓度的单位为mol·L-1
∴K的单位为(mol·L-1)n; 4
练习:试写出下列反应的浓度平衡常数的数学表达式:
2SO2(g)+O2(g) 催化剂 2SO3
反应物A: [A]=c0(A) - △c(A) (2)生成物:平衡浓度=初始浓度+转化浓度
生成物D: [D] = c0(D) +△c(D) (3)各物质的转化浓度之比等于它们在化学方程式中 相应的化学计量数之比。△c(A):△c(D)=a:d
20
例度1平:合衡成是氨:[N的2]反=3应mNol2·+L3-1H,[H22]2=N9mH3o在l·L某-1,温[N度H3下] =各4m物o质l·L的-1浓求 该反应的平衡常数和N2、H2的初始浓度。
3、反应的平衡常数与反应可能进行的程度。一般来 说,反应的平衡常数KC≥105,认为正反应进行得较完 全;KC ≤10-5则认为这个反应的正反应很难进行(逆反 应较完全)。
17
例如:不同温度时,反应:H2(g)+I2(g) △ 的平衡常数与温度的关系如下:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K
c4(
H2O
)
c4( H2 )
Cr2O72- + H2O
2CrO42- + 2H+
Kc2(C 编c辑(rC pp4O 2t2rO )7c22()H)
9
二、平衡转化率( )
1、定义:P49
2、表达式:
该反应物的起始浓度-该反应物的平衡浓度
=
×100%
该反应物的起始浓度
3、理解注意:
(1)、转化率是对反应物而言的;
应的平衡常数表达式。
N2+3H2
2NH3
K1 c(Nc22()N c3H(3H ) 2 )
2NH3
N2+ 3H2
1 2
N2
+
3 2
H2
NH3
高温
K2 c(Nc22()N c3H(3H ) 2 ) K3c1/2(N c(2N )c3H 3/2)(H2)
Fe3O4(s) + 4H2(g)
3Fe(s)
+
4H2O(g)
第二单元 化学反应的方向和限度
化学平衡常数
编辑ppt
1
复习:在一定温度下,下列叙述不是可逆反应
A(气)+3B(气)
2C(气)+2D(固)达到
平衡的标志的是 ( A)
①C的生成速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
2、K的表达式
对于下列可逆反应:aA + bB cC + dD,则有:
K
cc(C)cd(D) ca(A)cb(B)
其中c为各组分的平衡浓度
编辑ppt
5
思考:学习化学平衡常数有什么重要意义?对我们研究 化学反应进行的程度有什么帮助? 请大家阅读书本P48 页及表2-7,并得出结论。
3、化学平衡常数的意义
⑵基本关系
00 px qx px qx
①反应物:平衡浓度=起始浓度-转化浓度
②生成物:平衡浓度=起始浓度+转化浓度
编辑ppt
12
例1:某温度下,向10L真空容器中注入1.00 mol H2(g) 和
1.00 mol I2(g),反应平衡后I2(g)的浓度为0.0200 mol·L-1试
求该温度下 H2(g)+I2(g)
(2)、在一定温度下可逆反应中,K值越大,反应物的 转化率就越高;
(3)、对于一给定可逆反应,K值只与温度有关,而a不
仅与温度有关也与反应物起始浓度有关。
编辑ppt
10
练习2、在某温度下,可逆反应:
mA(g)+nB(g)
pC(g) + qD(g)的平衡常数为K,下列
说法正确的是
( AD )
A.K越大,达到平衡时,反应进行的程度越大.
(3)看能否通过P总、n总、ρ、M的变化情况得出结论: 若反应往正方向或逆方向进行时P总 或 n总 或ρ或M会发生改
变的,则不变时说明达到平衡编;辑若pp始t 终不变的,则不能判断。 3
“交流与讨论”
请大家完成 P48页的“交流与讨论”,并根据所得 结果总结归纳平衡时反应物、生成物浓度之间的关系。
B.K越小,达到平衡时,反应物的转化率越大.
C.K随反应物浓度改变而改变.
D.K随温度改变而改变.
编辑ppt
11
三、化学平衡的相关计算
⑴基本模式——“三部曲解法”
例: mA + nB
pC + qD
起始浓度:a b
(mol/L)
转化浓度:mx nx
(mol/L)
平衡浓度:a-mx b-nx
(mol/L)
② 不同种物质:一物质的正反应速率与另一物质的逆反 应速率之比等于方程式中的计量数之比;
即 mA(g) + n B(g)
p C(g) +q D(g) ひ(A) ׃ひ(B逆) == m ׃n
③ 键的角度分析:单位时间某物质断裂与形成的化学键的 物质的量相等
(2) 看能否得出反应混合物中各组成成分的含量保持不变的结论 ① 各组成成分的含量(浓度、物质的量、体积分数等)保持不变 ② 容器体积一定时,有色气体的 颜色不再变化;如I2、Br2、NO2
2HI(g)的平衡常数。
解:据题意可知,起始时c(H2)=c(I2)=0.100mol·L-1, 平衡时c(H2)=c(I2)=0.0200mol·L-1,生成的c(HI) =
0.160mol·L-1
H2(g) + I2(g)
2HI(g)
起始时各物质的浓度/mol·L-1 0.100
0.100
0
变化的各物质的浓度/mol·L-1 0.0800 0.0800 0.160
aA + bB
cC + dD
K
cc(C)cd(D) ca(A)cb(B)
K值的大小,表示在该温度下达到平衡时,反应 进行的程度(反应的限度),K值越大,表明反应进 行的程度越大;反之则越小。
编辑ppt
6
“交流与讨论”
阅读分析表2-8和表2-9,总结可逆反应平衡常数 的使用条件和书写平衡常数表达式的注意事项
c(N2O4) c(NO2) 1.08
1.38
c(N2O4) c2(NO2)
171.2
171.9
1.61
169.9
3.89
170.4
结论:在一定的温度下,无论反应物的起始浓度,
反应达到平衡状态后,反应物与生成物的系数次方
的比是一常数。
编辑ppt
4
一、化学平衡常数
1、 概念
对某一可逆反应,在一定温度下,无论反应物的起 始浓度如何,反应达到平衡状态后,反应物与生成物浓 度系数次方的比是一个常数,称为化学平衡常数,用K 表示。
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①编③辑p④pt ⑦ D.②⑤⑥⑧
2
化学平衡状态的标志
(1) 看能否得出v正 = v逆 的结论 ① 同一种物质:该物质的生成速率等于它的消耗速率;
编辑ppt
7
4.使用平衡常数的注意事项
aA + bB
cC + dD
K
cc(C)cd(D) ca(A)cb(B)
(1)K只与温度有关,所以使用时应注明温度;
(2)K值表达式中,固体、液态水不写;
(3)平衡常数的表达式与方程式的书写方式有关;
(4)平衡常数表示反应进行的程度,不表示反应的 快慢,即速率大,K值不一定大;
(5)利用K 值可判断某状态是否处于平衡状态
K′= K : 反应处于平衡状态, v正= v逆 K′< K : 反应向正方向进行, v正> v逆
K,
cc (C). cd(D) ca ( A).cb (B)
v v K′>K : 反应向逆方向进行,编辑正ppt< 逆家写出下列可逆反
c4(
H2O
)
c4( H2 )
Cr2O72- + H2O
2CrO42- + 2H+
Kc2(C 编c辑(rC pp4O 2t2rO )7c22()H)
9
二、平衡转化率( )
1、定义:P49
2、表达式:
该反应物的起始浓度-该反应物的平衡浓度
=
×100%
该反应物的起始浓度
3、理解注意:
(1)、转化率是对反应物而言的;
应的平衡常数表达式。
N2+3H2
2NH3
K1 c(Nc22()N c3H(3H ) 2 )
2NH3
N2+ 3H2
1 2
N2
+
3 2
H2
NH3
高温
K2 c(Nc22()N c3H(3H ) 2 ) K3c1/2(N c(2N )c3H 3/2)(H2)
Fe3O4(s) + 4H2(g)
3Fe(s)
+
4H2O(g)
第二单元 化学反应的方向和限度
化学平衡常数
编辑ppt
1
复习:在一定温度下,下列叙述不是可逆反应
A(气)+3B(气)
2C(气)+2D(固)达到
平衡的标志的是 ( A)
①C的生成速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
2、K的表达式
对于下列可逆反应:aA + bB cC + dD,则有:
K
cc(C)cd(D) ca(A)cb(B)
其中c为各组分的平衡浓度
编辑ppt
5
思考:学习化学平衡常数有什么重要意义?对我们研究 化学反应进行的程度有什么帮助? 请大家阅读书本P48 页及表2-7,并得出结论。
3、化学平衡常数的意义
⑵基本关系
00 px qx px qx
①反应物:平衡浓度=起始浓度-转化浓度
②生成物:平衡浓度=起始浓度+转化浓度
编辑ppt
12
例1:某温度下,向10L真空容器中注入1.00 mol H2(g) 和
1.00 mol I2(g),反应平衡后I2(g)的浓度为0.0200 mol·L-1试
求该温度下 H2(g)+I2(g)
(2)、在一定温度下可逆反应中,K值越大,反应物的 转化率就越高;
(3)、对于一给定可逆反应,K值只与温度有关,而a不
仅与温度有关也与反应物起始浓度有关。
编辑ppt
10
练习2、在某温度下,可逆反应:
mA(g)+nB(g)
pC(g) + qD(g)的平衡常数为K,下列
说法正确的是
( AD )
A.K越大,达到平衡时,反应进行的程度越大.
(3)看能否通过P总、n总、ρ、M的变化情况得出结论: 若反应往正方向或逆方向进行时P总 或 n总 或ρ或M会发生改
变的,则不变时说明达到平衡编;辑若pp始t 终不变的,则不能判断。 3
“交流与讨论”
请大家完成 P48页的“交流与讨论”,并根据所得 结果总结归纳平衡时反应物、生成物浓度之间的关系。
B.K越小,达到平衡时,反应物的转化率越大.
C.K随反应物浓度改变而改变.
D.K随温度改变而改变.
编辑ppt
11
三、化学平衡的相关计算
⑴基本模式——“三部曲解法”
例: mA + nB
pC + qD
起始浓度:a b
(mol/L)
转化浓度:mx nx
(mol/L)
平衡浓度:a-mx b-nx
(mol/L)
② 不同种物质:一物质的正反应速率与另一物质的逆反 应速率之比等于方程式中的计量数之比;
即 mA(g) + n B(g)
p C(g) +q D(g) ひ(A) ׃ひ(B逆) == m ׃n
③ 键的角度分析:单位时间某物质断裂与形成的化学键的 物质的量相等
(2) 看能否得出反应混合物中各组成成分的含量保持不变的结论 ① 各组成成分的含量(浓度、物质的量、体积分数等)保持不变 ② 容器体积一定时,有色气体的 颜色不再变化;如I2、Br2、NO2
2HI(g)的平衡常数。
解:据题意可知,起始时c(H2)=c(I2)=0.100mol·L-1, 平衡时c(H2)=c(I2)=0.0200mol·L-1,生成的c(HI) =
0.160mol·L-1
H2(g) + I2(g)
2HI(g)
起始时各物质的浓度/mol·L-1 0.100
0.100
0
变化的各物质的浓度/mol·L-1 0.0800 0.0800 0.160
aA + bB
cC + dD
K
cc(C)cd(D) ca(A)cb(B)
K值的大小,表示在该温度下达到平衡时,反应 进行的程度(反应的限度),K值越大,表明反应进 行的程度越大;反之则越小。
编辑ppt
6
“交流与讨论”
阅读分析表2-8和表2-9,总结可逆反应平衡常数 的使用条件和书写平衡常数表达式的注意事项
c(N2O4) c(NO2) 1.08
1.38
c(N2O4) c2(NO2)
171.2
171.9
1.61
169.9
3.89
170.4
结论:在一定的温度下,无论反应物的起始浓度,
反应达到平衡状态后,反应物与生成物的系数次方
的比是一常数。
编辑ppt
4
一、化学平衡常数
1、 概念
对某一可逆反应,在一定温度下,无论反应物的起 始浓度如何,反应达到平衡状态后,反应物与生成物浓 度系数次方的比是一个常数,称为化学平衡常数,用K 表示。
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①编③辑p④pt ⑦ D.②⑤⑥⑧
2
化学平衡状态的标志
(1) 看能否得出v正 = v逆 的结论 ① 同一种物质:该物质的生成速率等于它的消耗速率;
编辑ppt
7
4.使用平衡常数的注意事项
aA + bB
cC + dD
K
cc(C)cd(D) ca(A)cb(B)
(1)K只与温度有关,所以使用时应注明温度;
(2)K值表达式中,固体、液态水不写;
(3)平衡常数的表达式与方程式的书写方式有关;
(4)平衡常数表示反应进行的程度,不表示反应的 快慢,即速率大,K值不一定大;
(5)利用K 值可判断某状态是否处于平衡状态
K′= K : 反应处于平衡状态, v正= v逆 K′< K : 反应向正方向进行, v正> v逆
K,
cc (C). cd(D) ca ( A).cb (B)
v v K′>K : 反应向逆方向进行,编辑正ppt< 逆家写出下列可逆反
