广西大学2020年《物理化学(二)(859)》考试大纲与参考书目
广西大学2020年《普通化学(848)》考试大纲与参考书目

广西大学2020年《普通化学(848)》考试大纲与参考书目考试性质普通化学是广西大学海洋科学(一级学科)专业硕士研究生入学考试专业基础课程考试方式和考试时间本考试为闭卷考试,满分为150分,考试时间为180分钟试卷结构试卷结构:选择30%左右,名词解释15%左右,填空15%左右,判断15%左右,问答25%左右。
考试内容1. 元素、原子和分子了解元素基本的周期性变化规律,重点掌握卤族元素、氧族元素、过渡金属元素的一些重要化合物及其性质;掌握原子核外电子排布规律,理解共价键的本质、原理和特点,理解分子间作用力的分类及特点。
2. 水溶液化学掌握水溶液浓度及溶解度的概念;理解水溶液中质子理论和电离平衡理论,掌握一元弱酸(碱)、多元弱酸(碱)水溶液中pH值的计算;理解缓冲溶液相关理论及计算方法;理解沉淀溶解平衡中溶度积和溶解度的关系,掌握溶度积规则并熟练运用于沉淀溶解平衡中的相关计算;理解水溶液中配合物离子的逐级形成过程,熟练运用配位化合物的结构理论(价键理论)解释常见配合物的形成、空间构型和稳定性等性质。
3. 化学热力学和动力学基础了解化学热力学基本概念及重要的状态函数,掌握运用生成焓、标准熵、生成能计算反应的焓变、熵变、自由能变;了解化学平衡的影响因素有哪些;理解并掌握过渡态理论。
4. 电化学基础掌握氧化还原反应的基本概念,氧化还原反应方程式的配平,原电池及其符号书写,标准电极电势的意义及应用,熟练运用能斯特方程及元素电势图进行相关计算,理解原电池和电解池的区别。
5. 有机化学基础掌握有机化合物的分类、命名规则;熟悉简单有机化合物的分离、提纯步骤;了解常规的有机反应并能准确判断反应的主产物和副产物;了解常用的鉴别有机物的方法和仪器。
6. 波谱分析基础了解紫外光谱的基本原理,掌握朗伯-比尔定律,熟悉紫外光谱仪的操作,熟练分析简单有机化合物的紫外吸收光谱;了解红外光谱的基本原理,以及影响红外光谱吸收频率的因素,熟悉红外光谱仪的操作,熟练分析简单有机化合物的红外吸收光谱。
新版广西师范大学物理学考研经验考研参考书考研真题

皇天不负有心人,看到自己通过初试的结果,总算是踏实了下来,庆幸自己这一年多的坚持还有努力,觉得这一切都是值得的。
其实在开始备考的时候自己也有很多问题,也感到过迷茫,当时在网上也看了很多前辈们的经验贴,从中也给了自己或多或少的帮助,所以也想把我的备考经验写下来,希望可以帮助到你们,文章也许会有一些凌乱,还请大家多多包涵,毕竟是第一次写经验贴,如果还有什么其他的问题大家可以给我留言,我一定会经常上来回复大家的!虽然成功录取,但是现在回想起来还是有很多懊悔,其实当初如果心态再稳定一些,可能成绩还会再高一些,这样复试就不会担惊受怕了。
其实,经验本是想考完研就写出来的。
可是自己最大的缺点就是拖延症加上不自制。
所以才拖到现在才写完。
备考对于我来说最感谢的要数我的室友了,要不是他们的监督自己也不会坚持下来。
总之考研虽然很辛苦,但是也很充实。
想好了方向之后,我就开始想关于学校的选择。
因为我本身出生在一个小地方,对大城市特别的向往,所以大学选择了大城市,研究生还想继续留在这。
希望你们从复习的开始就运筹帷幄,明年的这个时候旗开得胜,像战士一般荣耀。
闲话不多说,接下来我就和你们唠唠关于考研的一些干货!结尾有真题和资料下载,大家自取。
广西师范大学物理学的初试科目为:(101)思想政治理论和(201)英语一(625)高等数学和(825)普通物理(力学、电磁学)参考书目为:1.《高等数学》(第一、二册),四川大学编,高等教育出版社,1979年第四版2.《力学》,漆安慎编,高等教育出版社,2005年第二版;3.《电磁学》,梁灿彬编,高等教育出版社,2010年第二版关于英语无非几大模块:阅读,完型,新题型,翻译,作文。
首先最最最重要的就是阅读,如果你把阅读搞“好”了,其他的都不成问题而“好”的定义,不是简简单单的把题做对,“好”的定义有很多方面,下面的内容我会说。
其次是作文,我们都知道考研英语作文有两篇:大作文和小作文。
就英语一来说,大作文通常(是通常哈)是图画作文,小作文是一封信。
新版广西大学物理学考研经验考研参考书考研真题

刚上大学的时候,我的家人希望我能考研,因为我的本科学校很普通。
当时,我并没有想过。
直到这几年的学习,出于自身对专业课的兴趣越来越浓厚,想要继续深入系统的学习,而我们本科对专业课的学习知识一点皮毛,是远远不够的!怀着专业的热爱,我毅然决定考研,在大三上册就开始准备复习。
充满信心地去下定决心做一件事情是做好它的前提,最开始自己像一只无头苍蝇一般,没有方向。
只能靠自己慢慢摸索,查资料、看考研经验分享、问学长学姐,虽然这个过程很繁琐,但是我已经下定决心考研,所以无所畏惧!对于考研来说最关键的就是坚持。
一年的考研时间,我想,对于这个词,我是有很多话要说的。
我以为自己是个能坚持的人,但是考研这一年来,真正让我体会到了坚持的不易!正如很多研友的分享所说,考研谁不是一边想放弃一边又咬牙坚持着,那些坚持到最后的人,都会迎来他们的曙光。
文章可能有点长,末尾我也加了一些真题和资料的下载方式,大家放心阅读即可。
广西大学物理学的初试科目为:(101)思想政治理论和(201)英语一(618)量子力学和(836)普通物理参考书目为:1.曾谨言《量子力学导论》2.程守洙《普通物理学》关于考研英语考研英语几乎就是考阅读,做了历年的试卷后我越发觉得如果不能真正的读懂文章,那么阅读题目是很难做对的,而想要读懂这篇文章,主要就是要读懂文章中的长难句,这是需要训练的,真题就是很好的训练素材。
做完阅读题后,可以先不要急着对答案,把文章中的长难句和一些难以理解的句子试着自己翻译出来(可以借助词典),翻译完后再看看你先前的答案,有没有什么新的理解让你想改答案的,此时再去看看书后面对整篇文章的解析(而不是题目的解析),主要看你翻译的和解析翻译的差别,有没有理解上的偏差,进而再次思考自己的答案,并确定自己最终的答案,再对后面的答案,此时应该仔细揣摩自己做错的原因,仔细理解出题人的思路和其对文章的理解方式,找出与自己的思路的不同之处,下次做题尽量向他们一样思考。
广西大学2020年硕士研究生入学考试 《水力学(852)》考试大纲与参考书目

闭卷统考。研究生入学考试统一时间。
试卷结构
试卷结构
一、试卷满分及考试时间
本试卷满分为150分,考试时间为180分钟。
二、答题方式
答题方式为闭卷、笔试。
三、试卷内容结构
水静力学10%
水动力学90%
四、试卷题型结构
判断题(20分)
选择题(20分)
填空题(20分)
作图题(20分)
计算题(70分)
(八)水流衔接及消能
1.掌握泄水建筑物下游水跃衔接形式判别的方法
2.掌握主要消能的型式、原理、及适用的条件,底流消能的设计流量计算、产生远驱水跃时的处理方法
(九)液体流动的流场理论
1.掌握流场中速度、加速度、流线、迹线的计算以及液体微团运动的基本形式的分析(平移、线变形、角变形和旋转)与无涡流、有涡流的概念和区分
2.非恒定明渠流动:重点考核明渠水流的三种流态及判别、棱柱体渠道恒定渐变流水面曲线的绘制,要求掌握佛汝德数的物理意义以及断面比能和比能曲线的特性、临界水深计算及缓坡、陡坡和临界坡度的含义
(七)堰流及闸孔出流
1.理解堰流的水力特性,掌握堰流的基本公式
2.掌握各种堰型的特点与分类和水力计算方法,掌握闸孔出流水力计算方法
2.掌握流速势、流函数与流速分布的关系及计算,恒定平面势流的流速势及流函数概念、特性和存在的充要条件
(十)渗流
1.掌握渗流基本概念和渗流模型
2.掌握达西定律及其应用条件以及渗透系数的物理意义和均匀渗流与渐变渗流、井流的简单计算
(十一)水力学模型及试验基础
1.掌握流动相似、几何相似、运动相似及动力相似的概念及相互关系
考试内容和考试要求
考试内容与要求
【考查目标】
广西大学物理化学2004---2008年考研真题

广西大学物理化学考研真题2004---20082020.10.21(G)广西大学2004年硕士研究生入学考试试卷考试科目:物理化学(二)一、选择题(48分,每小题4分)1. 理想气体绝热向真空膨胀,则( )A.0,0==∆W SB.0,0=∆=∆U HC.0,0=∆=∆H GD.0,0=∆=∆G U 2. 将氧气分装在同一气缸的两个气室内,其中左气室内氧气状态为;2.273,2,3.1011311K T dm v kpa p ===右气室内状态为;2.273,1,3.1012322K T dm v kpa p === 现将气室中间的隔板抽调,使两部分气体充分混合。
此过程中氧气的熵变为:( )A.0>∆SB.0<∆SC.0=∆SD.都不一定3. 下列公式中那个是偏摩尔量的集合公式?( )A.∑=E B EM dn ZdZ B.0=∑EM B B Z n C.∑E EM B dZ X D.0=∑EM BB dZ X 4. 下述诸体系中,属于独立粒子体系的是:( )A.纯体液B.理想液态溶液C.理想的原子晶体D.理想气体E.真实气体5. 粒子的分配函数q 是表示( )A. 一个粒子的玻兹曼因子;B. 对一个粒子的玻兹曼因子取和;C. 对一个粒子的所有可能状态的玻兹曼因子取和;D. 对一个粒子的简单并度和玻兹曼因子的乘积取和;6. 已知373k 时液体A 的饱和蒸汽压为133.24kpa,液体B 的饱和蒸汽压为66.62kpa 。
设A 和B 形成理想溶液,当溶液中A 的物质的量分数为0.5时,在气体中A 的物质的分数为( )A. 1B. 1/2C. 2/3D. 1/37. (1)溶液的化学势等于溶液中各组分的化学势之和(2)对于纯组分,则化学势等于其Gibbs 自由能(3)理想溶液各组分在其全部浓度范围内服从Henry 定律(4)理想溶液各组分在其全部浓度范围内服从Raoult 定律上述说法正确的是( )A. (1) (2)B. (2) (3)C. (2) (4)D. (3) (4)8.在410看,)(2s O Ag 部分分解成)()(2S O s Ag 、,此平衡体系的自由度为( )A. 0B. 1C.2D. -19. 下图中,从P 点开始的步冷曲线为( )形状10. 对于有3AgNO 稍过量的I A g 溶胶,下列电解质中聚沉能力最弱的是( )A. NaClB. 4MgSOC. 3NaNoD. ])([63CN Fe K11. 液体在毛细血管中上升(或下降)的平衡高度反比于( )A. 液面曲率半径B. 空气压力C. 液体黏度D. 液体表面张力12. 当96500C 的电量通过一串联电路时,若电路串联有一银电量计和一铜电量计,则两电量计阴极析出的u C Ag 和( )A. 均为1molB. 分别为1mol mol 21C. 均为mol 21D. 分别为mol 21 1mol 二、将下列化学反应设计成电池(10分)(1))s ()()()(pb PbO l Hg s HgO s +=+(2))()()(g s AgBr m Br m A =+--++ 三、气体中臭气(3O )分解反应2332O O −→−,服从下列由实验确定的速率方程(12分):][][][d -2233O O k dt O =,依据下列建议的反应机理证明题给的速率方程正确。
中国矿业大学895物理化学B2020考研专业课初试大纲

895物理
化学
B 1.《物理化学》
(第五版),天
津大学物理化学
教研室编,高等
教育出版社,
2009 年;
2.《物理化学
核心教程》(第
二版),沈文霞
编,科学出版社,
2009年。
一、考试目的与要求
考试目的:评测学生对物理化学的基本概念、基本原理、基本方法掌握的
程度,考察学生运用上述内容分析和解决科研与生产问题的能力,并由此判断
学生是否具有进一步深造的基本素质和培养潜力。
考试要求:全面系统掌握物理化学的基本概念、基本原理、基本方法等基
础知识;具有物理化学相关知识的综合能力;初步具备运用物理化学理论认识、
分析和解决实际问题的能力。
二、考试范围
考试范围:气体;热力学第一定律;热力学第二定律;多组分系统热力学;
化学平衡;相平衡;电化学;界面现象;化学动力学;胶体化学
三、试题结构(包括考试时间,试题类型等)
考试时间:180分钟。
试题类型:选择题、简答题、综合分析题、计算题等。
允许使用无存储
功能的计算器。
初试自命题科目考试大纲格式(过程流体力学)
学院名称(盖章):填表人:。
852物理化学(二)考试大纲

852物理化学(二)考试大纲《物理化学》(多媒体版)葛华才,袁高清,彭程,高等教育出版社2008年;《物理化学》(第四版)天津大学物理化学教研室,高等教育出版社2001年本基本要求是在本科《物理化学》64学时教学要求的基础上有所扩充而提出的,具体分列如下:1. 热力学第一定律掌握理想气体状态方程和混合气体的性质(道尔顿分压定律、阿马格分容定律)。
了解实际气体的状态方程(范德华方程)。
了解实际气体的液化和临界性质。
了解对应状态原理与压缩因子图。
理解下列热力学基本概念:平衡状态,状态函数,可逆过程,热力学标准态热力学第一定律:理解热力学第一定律的叙述及数学表达式。
掌握内能、功、热的计算明了热力学焓、标准摩尔生成焓、标准摩尔燃烧焓、标准摩尔反应焓等概念及掌握其计算方法掌握标准摩尔反应焓与温度关系。
掌握理想气体绝热可逆过程的pVT关系及理解其功的计算。
了解节流膨胀。
2. 热力学第二定律了解卡诺循环。
热力学第二定律:理解热力学第二定律的叙述及数学表达式,掌握熵增原理。
掌握理想气体pVT变化、相变化和化学变化过程中系统熵变的计算方法和环境熵变的计算方法,以及掌握用总熵变判断过程的方法了解热力学第三定律。
明了Helmholtz函数和Gibbs函数以及标准生成Gibbs函数等概念并掌握其计算方法和各种平衡依据。
明了热力学公式的适用条件.理解热力学基本方程和Maxwell关系。
了解用它们推导重要热力学公式的演绎方法。
热力学第二定律应用克拉佩龙方程。
会从相平衡条件推导Clapeyron方程和Clapeyron-Clausius方程,并能应用这些方程进行有关的计算。
3. 多组分系统热力学掌握Raoult定律和Henry定律以及它们的应用。
理解偏摩尔量和化学势的概念。
理解理想系统(理想溶体及理想稀溶体)中各组分化学势的表达式。
理解能斯特分配定律。
了解稀溶液的依数性。
了解逸度和活度的概念。
了解逸度和活度的标准态和对组份的活度系数的简单计算方法。
广西大学2020年《普通物理(836)》考试大纲与参考书目

广西大学2020年《普通物理(836)》考试大纲与参考书目考试性质自命题考试考试方式和考试时间闭卷试卷结构考试题型(1)选择题,(2)填空题,(3)计算题考试内容一、课程性质和目的:本课程使学生对物理学所研究的各种运动形式以及它们之间的联系,有比较全面系统的认识;对大学物理课中的基本理论、基本知识能够正确地理解,并具有初步应用的能力。
二、课程考试内容第一部分、力学1、质点动力学:牛顿运动定律的应用,动量守恒定律的理解和应用,机械能守恒定律及应用。
难点:变力作用下质点动力学基本问题,变力做功的计算,机械能守恒定律的应用。
2、刚体力学基础:刚体定轴转动定律的应用,角动量,角动量守恒定律的应用。
难点:转动惯量的理解,刚体定轴转动定律的应用,角动量的理解,角动量守恒定律的条件和应用。
3、振动和波动:简谐振动的特征及简谐振动方程;平面简谐波函数。
难点:相位的理解,旋转矢量法的理解和应用;波函数的表示及物理意义。
第二部分、电磁学1、静电场:叠加原理求电场强度,静电场的高斯定理及应用,电势及电势的计算,静电场的环路定理,简单电容器电容的计算,介质中的高斯定理,电容器储存的静电能难点:叠加原理求电场强度的数学处理,用高斯定理求对称分布电场的场强,介质中的高斯定理。
2、稳恒磁场:毕奥—萨伐尔定律及计算,安培环路定理及其应用,安培定律及应用,磁力矩,磁介质中的安培环路定理。
难点:毕奥—萨伐尔定律应用中的数学处理,磁介质中的安培环路定理及应用。
3、变化的电磁场:法拉第电磁感应定律及应用,动生电动势及计算,磁场能量。
难点:动生电动势及计算,感生电场的性质,自感和互感的理解第三部分、光学杨氏双缝干涉,薄膜干涉;夫琅和费单缝衍射条纹分布规律,衍射光栅;马吕斯定律、布儒斯特定律。
难点:光程差和相位差的关系;半波带法的理解,光栅衍射条纹的分布规律,缺级的判断。
第四部分、热学1、气体分子动理论:理想气体的压强公式,理想气体的内能,能量按自由度均分定理,麦克斯韦速率函数及分布曲线,三种统计速率,气体分子平均碰撞频率与平均自由程。
广西大学2020年《材料科学基础(822)》考试大纲与参考书目

广西大学2020年《材料科学基础(822)》考试大纲与参考书目考试性质考试方式和考试时间试卷结构考试内容一、金属材料(一)原子结构和键合了解的内容:1. 原子结构。
2.高分子链。
重点:原子间的键合。
(二)晶体学基础了解的内容:1. 晶体的对称性。
2.极射投影3.倒易点阵理解的内容:1.中间相特性。
掌握的内容:1. 空间点阵与晶胞。
2.晶向指数和晶面指数。
3.晶带定律。
4.晶面间距。
5. 三种典型的金属晶体结构。
6.晶体的原子堆垛方式和间隙。
7.固溶体的性质。
重点:典型的金属晶体结构、空间点阵、密勒指数。
(三)晶体缺陷了解的内容:1.点缺陷的运动。
2.外表面。
3.相界理解的内容:1. 点缺陷的形成。
2.点缺陷的平衡浓度。
3.位错的应力场。
4.位错的应变能与线张力。
5.作用在位错线上的力。
6.位错间的交互作用力。
7.实际晶体结构中的伯氏矢量。
8.不全位错掌握的内容:1.刃型位错、螺型位错、混合位错的特征。
2.伯氏矢量的确定、特性与表示方法。
3.位错的滑移、攀移与交割。
4.位错的密度。
5.位错的生成与增值。
6.位错反应。
7.晶界和亚晶界。
8.堆垛层错9.孪晶界。
重点:位错类型及其特点、位错理论。
(四)固体中原子及分子的运动了解的内容:1.交换机制。
2.扩散系数D与浓度相关时的求解。
3.原子跳跃。
4.无规则行走与扩散距离。
理解的内容:1.扩散的热力学分析。
2.扩散激活能。
3.反应扩散。
掌握的内容:1.菲克第一定律、第二定律。
2.扩散方程的解(一端成分不受扩散影响的扩散体)。
3.柯肯达尔效应。
4.间隙机制。
5.空位机制。
6.扩散系数。
7.影响扩散的因素。
重点:扩散机制、扩散系数的影响因素。
(五)材料的形变和再结晶了解的内容:1.弹性变形的本质。
2.弹性变形的特征和弹性模量。
3.弹性的不完整性。
4.粘弹性。
理解的内容:1.多晶体的塑性变形:晶粒取向的影响。
2. 再结晶后的晶粒长大的影响因素。
3.再结晶退火后的组织。
广西大学861高分子化学与物理2020年考研专业课初试大纲

参考书目 潘祖仁 《高分子化学》化学工业出版社 2007年 第四版 魏无际 俞强 等《高分子化学与物理基础》化学工业出版社2011年 第二版
何平笙 《新编高聚物的结构与性能》 北京:科学出版社 2009年
Байду номын сангаас备注
考试内容 考试范围为指定参考书所涉及的所有内容,重点考察考生对高分子化学与高分子物理的基本概念、基本原理和基本知识的理解 ,兼顾考生对所学知识的综合运用。要求考生能充分理解高分子结构控制和聚合速率控制的基本原理,很好掌握高分子结构和性 质的基本内容和基本理论。 高分子化学部分:
1. 高分子科学及其发展历史,高分子的基本概念和命名方法,高分子化合物的合成方法及平均分子量和分子量分布概念; 2. 缩合聚合反应特征、缩聚反应平衡、反应动力学、缩聚物的分子量及分子量分布的的控制方法和计算,体型缩聚、凝胶 点及凝胶点方程控制与计算,缩聚反应及逐步聚合方法; 3. 自由基聚合反应特征、引发剂和引发反应、阻聚及阻聚作用、自由基聚合反应速率方程及聚合反应控制、链转移反应及 分子量控制、聚合反应热力学理论及单体结构对聚合反应活性的影响,自由基聚合技术的实施方法; 4. 正离子、负离子、络合配位聚合反应特征、机理和动力学,引发剂类型及活性中心的特征,单体结构对聚合反应活性中 心的选择; 5. 共聚合反应类型及重要性,共聚物的组成方程及控制,单体竞聚率的测定及影响,Q、e值对单体聚合反应活性的影响; 6. 聚合物的化学反应特征及影响因素,聚合物的相似转化反应,聚合物的交联接枝、嵌段及扩链反应, 聚合物的降解反应 ,防止聚合物的降解,以及聚合物老化的技术措施,以及绿色高分子概念。
2020《物理化学》考试大纲

2020年硕士研究生统一入学考试《物理化学》考试大纲第一部分考试说明一、考试性质物理化学是理学院化学系硕士生入学选考的专业基础课之一。
考试对象为参加理学院2020年全国硕士研究生入学考试的准考考生。
二、考试形式与试卷结构(一)答卷方式:闭卷,笔试(二)答题时间:180分钟(三)考试题型及比例(均为约占)选择题10-20%简答题20-30%计算及应用题 60-70%(四)参考书目傅献彩,沈文霞,姚天扬,侯文华编,物理化学(第五版,上册),高等教育出版社,2005。
傅献彩,沈文霞,姚天扬,侯文华编,物理化学(第五版,下册),高等教育出版社,2006。
第二部分考查要点(一)基本概念和术语热力学平衡态;系统与环境;热力学能;功;热;焓(反应焓、生成焓、燃烧焓);热容;状态函数;反应进度;吉布斯自由能;熵;亥姆赫兹自由能;偏摩尔量;化学势;稀溶液的依数性;逸度;逸度因子;活度;活度系数;理想溶液;实际溶液;标准平衡常数;经验平衡常数;化学反应亲和势;标准摩尔反应吉布斯函数;相与相律;原电池、电解池;阴阳(正负)极;电极电势;接触电势;极化、过电位;分解电压;电流密度;电解质溶液;离子迁移数;摩尔电导率;反应速率、基元反应、质量作用定律;速率常数;活化能;量子效率;表面自由能和表面张力;润湿;吸附量;亚稳态;胶体;电泳、电渗;ξ电位;表面活性剂;临界胶束浓度(CMC)。
(二)基本定律与理论1. 基础热力学:热力学第零、第一、第二、第三定律;盖斯定律(反应热计算);基尔霍夫定律;盖斯定律;卡诺循环;卡诺定理、熵增原理;焦耳-汤姆逊效应(节流膨胀);热力学基本方程2. 多组分系统:拉乌尔定律和亨利定律;稀溶液的依数性;相律;分配定律;3. 电化学:法拉第定律;能斯特方程4. 动力学、界面与胶体化学:化学反应的速率理论;气体反应碰撞理论、过渡态理论;光化学反应:第一定律和第二定律、量子效率;多相反应:菲克第一、第二定律;催化作用原理;吸附理论和等温方程式—弗兰德利希、郎缪尔吸附、BET吸附;弯曲液面的附加压力及拉普拉斯公式;双电层理论(三)基础知识及应用1. 基础热力学:熵等热力学参数计算;克劳休斯-克拉佩龙(Clausius-Clapeyron)方程;吉布斯-亥姆霍兹(Gibbs-Helmholtz)方程;反应热(燃烧热、中和热等)的测定。
广西大学2020年《现代汉语与古代汉语(896)》考试大纲与参考书目

广西大学2020年《现代汉语与古代汉语(896)》考试大纲与参考书目
考试性质
现代汉语与古代汉语是中国语言文学硕士生入学考试初试科目之一。
本考试大纲的制定力求反映语言类科目(古代汉语和现代汉
语)的特点,科学、公平、准确、规范的测评考生的相关知识基础、基本素质和综合能力。
考试方式和考试时间
答题方式为闭卷、笔试。
试卷由试题和答题纸组成。
答案必须写在答题纸相应的位置上。
试卷结构
试卷满分为150分。
其中现代汉语部分75分,古代汉语部分75分。
考试内容
现代汉语与古代汉语包括两方面的内容:1.古代汉语;2.现代汉语。
一、古代汉语:
包括文选、通论和常用词。
重点考察学生对于古代汉语基础理论的掌握程度、对于古代语言文字现象的分析能力和古文阅读能力。
二、现代汉语
包括教材涉及的现代汉语基础知识、文字、语音、词汇、语法、修辞及语用等内容。
重点考察学生运用现代汉语基础理论分析现
代汉语语言文字现象的各方面能力。
考试要求:
要求考生具备较好的汉语语言学知识和汉语分析能力。
参考书目
(1)《现代汉语》增订六版,黄伯荣,廖序东主编,高等教育出版社,2017
(2)《现代汉语通论》第三版,邵敬敏,上海教育出版社,2016
(3)《古代汉语》,王力,中华书局,1999。
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目
5.伍国栋著《民族音乐学概论增订版》,人民音乐出版社,2012。
孙继南、周柱铨《中国音乐通史简编》修订版,山东教育出版社,2012。
广西师范大学2020年研究生招生考试自命题科目复习参考书目
广西师范大学2020年研究生招生考试自命题科目复习参考书目。
新版广西大学材料与化工专业考研经验考研参考书考研真题

又是一年考研时节,每年这个时候都是考验的重要时刻,我是从大三上学期学习开始备考的,也跟大家一样,复习的时候除了学习,还经常看一些学姐学长们的考研经验,希望可以在他们的经验里找到可以帮助自己的学习方法。
我今年成功上岸啦,所以跟大家分享一下我的学习经验,希望大家可以在我的经历里找到对你们学习有帮助的信息!其实一开始,关于考研我还是有一些抗拒的,感觉考研既费时间又费精力,可是后来慢慢的我发现考研真的算是一门修行,需要我用很多时间才能够深入的理解它,所谓风雨之后方见才害怕难过,所以在室友们的鼓励和支持下,我们一起踏上了考研之路。
虽然当时不知道结局是怎样,但是既然选择了,为了不让自己的努力平白的付出,说什么都要坚持下去!因为是这一路的所思所想,所以这篇经验贴稍微有一些长,字数上有一些多,分为英语和政治以及专业课备考经验。
看书确实是需要方法的,不然也不会有人考上有人考不上,在借鉴别人的方法时候,一定要融合自己特点。
注:文章结尾有彩蛋,内附详细资料及下载,还劳烦大家耐心仔细阅读。
广西大学材料与化工专考研初试科目:(101)思想政治理论(204)英语二(302)数学二(857)物理化学(专)广西大学材料与化工专考研参考书目:关于英语复习。
我提一个建议,考研单词主要是用于阅读,所以知道意思即可,建议背单词书的同学不要死啃单词书,以“过单词”的方式背单词,每个单词记忆时间不要太长,不然很容易走神,效率也会很低,背诵单词应利用好零碎的时间,如吃饭之前半个小时,饭后半个小时,也可以穿插在复习专业课期间学累了的时候。
我大概早上会有半个小时的时间来背单词,考研单词大多数是不要求掌握拼写的,在阅读中见到能认出即可,所以速度可以快一点,多重复几遍。
早上大概背一到两个单元,晚上睡觉之前再听一遍录音,第二天再迅速的复习一下,效果还不错。
阅读还是要多读多看,一遍一遍地过。
大家应该也都报了相应的辅导班,老师会有自己的节奏,跟着走就好。
广西大学892建筑设计基础2020年考研专业课初试大纲

广西大学2020年研究生入学考试《建筑设计基础(892)》考试大纲与参考书目考试性质该考试是为广西大学招收建筑学学术型硕士研究生而设置的具有选择性质的自主命题初试业务课科目。
考试方式和考试时间闭卷统考。
研究生入学考试统一时间。
试卷结构试卷结构一、试卷满分及考试时间本试卷满分为150分,考试时间为180分钟。
二、答题方式答题方式为闭卷、笔试。
三、试卷内容结构设计基础 60%建筑构造 40%四、试卷题型结构填空题 (20分)名词解释(20分)选择题 (20分)解析题 (20分)论述题 (20分)作图题 (50分)考试内容考试内容与要求一、建筑设计基础【考查目标】1.理解和掌握建筑设计的基本概念、基本理论、设计原理、设计规范和标准。
2.理解建筑学的基本知识架构,理解促进建筑发展的各种社会、文化、技术因素。
3.掌握建筑分析、设计构思、深化、表达的方法。
4.能综合运用建筑设计的知识与方法分析问题、解决问题、进行设计。
【考查内容】(一)概论1.理解以下基础知识:建筑认知,建筑形式,建筑空间,建筑质感,建筑细部。
2.掌握基本建筑术语的概念及含义,掌握主要经济技术指标及其计算公式。
3.掌握建筑表达形式与方法,可视化的媒介,图示表达,模型表达,图示与文本。
(二)建筑物1.理解建筑外部空间设计的内容和要素,掌握建筑外部形体种类,建筑形体特征,建筑形体的二维图纸表达,建筑立面图。
2.理解和掌握建筑内部空间组成,建筑空间与人的使用关系,空间分割的图示表达(平面图与剖面图),如何绘制具有表现力的立面图、平面图与剖面图,垂直构件与水平构件的表达。
3.理解和掌握公共建筑的空间构成、功能关系及空间组织方式,功能分区的目的、原则与方法,交通与疏散的组织原则和方法。
4.理解建筑空间的尺度,建筑尺度的概念,空间尺度与人的使用关系,常用建筑构件的尺度与平、剖面表达。
5.了解支撑与包裹的基础知识,支撑体系,包裹体系,支撑、包裹体系与建筑空间的关系。
广西大学2020年《高等代数(855)》考试大纲与参考书目

广西大学2020年《高等代数(855)》考试大纲与参考书目考试性质广西大学硕士研究生入学考试初试科目。
《高等代数》作为全日制硕士研究生入学考试的专业基础课考试,其目的是考察考生是否具备进行本科生各专业硕士研究生学习所要求的水平。
本考试是一种测试应试者综合运用所学的高等代数的知识的尺度参照性水平考试。
考试范围包括高等代数的基本概念,理论和方法,考察考生的理解、分析、解决代数问题的能力。
考试方式和考试时间闭卷、笔试试卷结构(一)试卷满分及考察内容分数分配试卷满分为150分。
其中计算30分,简答30分,证明90分。
(二)试卷题型比例计算题20%,简答题20%,证明题60%行列式、线性方程组与矩阵:30%线性空间与线性变换40%二次型与欧氏空间20%综合题10%考试内容(一)、考试内容一元多项式,整除的概念,最大公因式,辗转相除法,因式分解定理,重因式,多项式函数,代数基本定理,复系数与实系数多项式的因式分解,有理系数多项式;第二章:行列式行列式的性质,行列式的计算,行列式按一行(列)展开,克拉默法则,行列式的乘法规则;第三章:线性方程组消元法,向量空间,向量线性相关性,矩阵的秩,线性方程组有解的判别定理,齐次线性方程组的解空间与基础解系,线性方程组解的结构;第四章:矩阵矩阵的概念,矩阵的运算,矩阵乘积的行列式与秩,矩阵的逆,矩阵的分块,初等矩阵,初等变换;第五章:二次型二次型与实对称矩阵,标准形,规范形(唯一性),正定二次型,实对称矩阵正定的判定条件和性质,半正定二次型,负定二次型,半负定二次型;第六章:线性空间集合,映射,线性空间的定义与性质,维数、基与坐标,基变换与坐标变换,线性子空间,子空间的交与和,子空间的直和,线性空间的同构;线性变换的定义,线性变换的运算,线性变换的矩阵,特征值与特征向量,对角矩阵,线性变换的值域与核,不变子空间,若当(Jordan)标准形,最小多项式;第八章:—矩阵—矩阵,不变因子,矩阵相似的条件,初等因子,若尔当标准形,有理标准形;第九章:欧几里得空间定义与基本性质,标准正交基,同构,正交变换,对称变换,子空间,实对称矩阵的标准形,酉空间介绍。
广西大学物理化学下册试题及答案
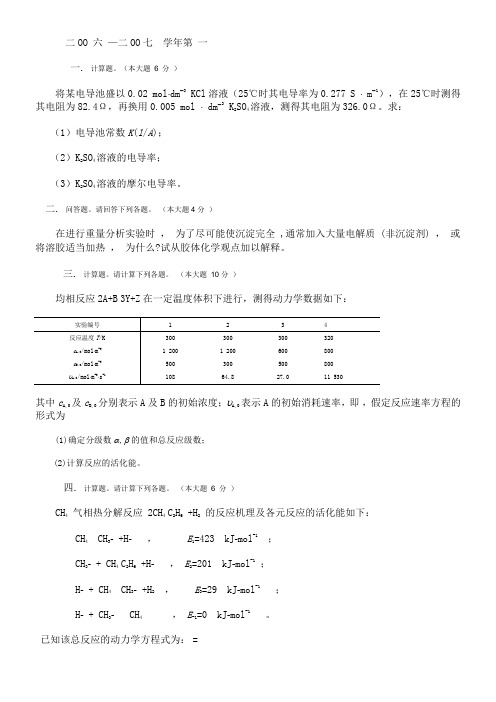
二OO 六—二OO七学年第一一.计算题。
(本大题6 分)将某电导池盛以0.02 mol⋅dm-3 KCl溶液(25℃时其电导率为0.277 S ⋅ m-1),在25℃时测得其电阻为82.4Ω,再换用0.005 mol ⋅ dm-3 K2SO4溶液,测得其电阻为326.0Ω。
求:(1)电导池常数K(l/A);(2)K2SO4溶液的电导率;(3)K2SO4溶液的摩尔电导率。
二.问答题。
请回答下列各题。
(本大题4分)在进行重量分析实验时,为了尽可能使沉淀完全 ,通常加入大量电解质 (非沉淀剂) ,或将溶胶适当加热,为什么?试从胶体化学观点加以解释。
三.计算题。
请计算下列各题。
(本大题10分)均相反应2A+B3Y+Z在一定温度体积下进行,测得动力学数据如下:实验编号123 4反应温度T/K300300300 320c A,0/mol⋅m-3 1 200 1 200600 800c B,0/mol⋅m-3500300500 800υA,0/mol⋅m-3⋅s-110864.827.0 11 530其中c A,0及c B,0分别表示A及B的初始浓度;υA,0表示A的初始消耗速率,即,假定反应速率方程的形式为(1)确定分级数α,β的值和总反应级数;(2)计算反应的活化能。
四.计算题。
请计算下列各题。
(本大题 6 分)CH4气相热分解反应 2CH4C2H6+H2的反应机理及各元反应的活化能如下:CH4 CH3- +H-,E1=423 kJ-mol-1;CH3- + CH4C2H6+H-,E2=201 kJ-mol-1;H- + CH4 CH3- +H2,E3=29 kJ-mol-1;H- + CH3- CH4,E-1=0 kJ-mol-1。
已知该总反应的动力学方程式为:=试求总反应的表观活化能。
五.计算题。
请计算下列各题。
(本大题8 分)下列电池的电动势在25℃时为1.448 V:Pt | H2( p ) | HCl ( b=0.1 mol·kg-1,γ±=0.796 ) |Cl2( p ) | Pt(1)写出电极反应和电池反应;(2)计算氯电极的标准电极电势E (Cl-|Cl2|Pt)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
广西大学2020年《物理化学(二)(859)》考试大纲与参考书目
考试性质
初试自命题
考试方式和考试时间
闭卷、笔试
试卷结构
选择题、填空题、判断题、计算题、相图题。
考试内容
一、考试的总体要求
要求考生全面系统地掌握物理化学的基本概念和基本定律并能综合运用,具备较强的分析问题和解决问题的能力。
二、考试的内容
1. 热力学基础
热力学第一定律、热力学能、焓、功和热,热化学,第一定律对理想气体的应用;热力学第二定律、熵函数,Clausius不等
式与熵增加原理、熵变的计算,Helmholtz自由能和Gibbs自由能,变化的方向与平衡条件。
2. 多组分系统
偏摩尔量,化学势,气体混合物中各组分的化学势,稀溶液中的两个经验定律,理想液态混合物,理想稀溶液中任一组分的化学
势,稀溶液的依数性,活度与活度因子。
3. 相平衡
相律,克拉贝龙方程,单组分系统相图分析,二组分系统相图分析,步冷曲线。
4. 化学平衡
化学反应的平衡常数和等温方程式,平衡常数的计算,标准摩尔生成Gibbs自由能,温度、压力及惰性气体对化学平衡的影响。
5. 电化学
电解质溶液基本概念和法拉第定律,离子迁移数,离子强度,离子独立移动定律,电导及应用;可逆电池和可逆电极,电池
电动势的测定,Nernst 方程计算,可逆电池的热力学,电池电动势的应用;极化作用及种类,超电势,电解池与原电池的极化
曲线,电解时电极上的竞争反应。
6. 化学动力学基础
反应速率,速率方程,具有简单级数的反应,典型的复杂反应;温度对反应速率的影响(Arrhenius 经验式),活化能,链
反应的特点,会用稳态近似、平衡假设和速控步等近似方法从复杂反应的机理推导出速率方程;催化反应的特点及本质。
7. 界面现象及胶体化学
表面张力及表面Gibbs自由能,弯曲表面上的附加压力和蒸气压,新相生成过程,吸附现象,润湿、铺展现象,表面活性剂及其
应用,固体表面的吸附,Gibbs 吸附等温式,Langmuir吸附等温式,气-固相表面催化反应特点;胶体的分类和制备,胶团结构
的书写,胶体的动力性质、光学性质、电学性质,双电层理论和ξ电势,溶胶的稳定性和聚沉作用。
参考书目
物理化学(上、下)第六版,天津大学物理化学教研室编,高等教育出版社。
