姜黄素对Aβ诱导的AD大鼠β—APP和BACE1基因表达的影响
姜黄素通过抑制氧化应激改善AD模型大鼠的学习和记忆能力
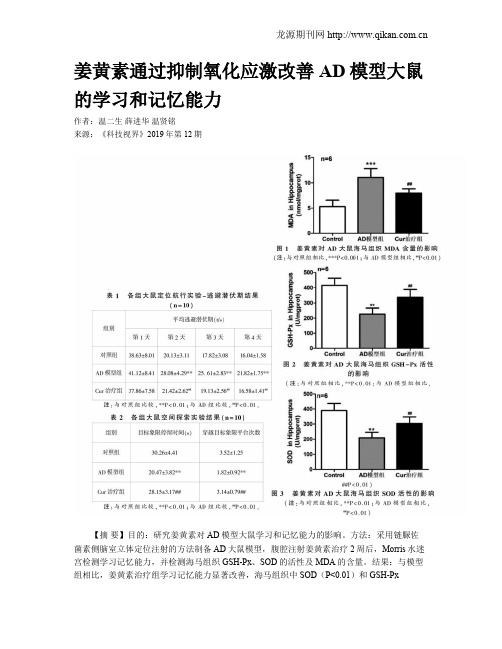
姜黄素通过抑制氧化应激改善AD模型大鼠的学习和记忆能力作者:温二生薛进华温贤铭来源:《科技视界》2019年第12期【摘要】目的:研究姜黄素对AD模型大鼠学习和记忆能力的影响。
方法:采用链脲佐菌素侧脑室立体定位注射的方法制备AD大鼠模型,腹腔注射姜黄素治疗2周后,Morris水迷宫检测学习记忆能力,并检测海马组织GSH-Px、SOD的活性及MDA的含量。
结果:与模型组相比,姜黄素治疗组学习记忆能力显著改善,海马组织中SOD(P<0.01)和GSH-Px(P<0.01)的活性明显升高,MDA(P<0.01)含量顯著降低。
结论:姜黄素能够改善AD模型大鼠的学习记忆能力,其机制可能与抑制海马区的氧化应激反应有关。
【关键词】姜黄素;AD;氧化应激中图分类号: R542.2 文献标识码: A 文章编号: 2095-2457(2019)12-0014-002DOI:10.19694/ki.issn2095-2457.2019.12.006阿尔茨海默病(Alzheimer’s Disease,AD)是引起老年痴呆症的主要原因,属于中枢神经系统退行性疾病,患者可表现为记忆力减退,认知功能障碍以及行为改变等临床症状[1]。
AD 发病率与年龄密切相关,由于世界人口老龄化过程不断加剧,AD的发病率也呈现逐年上升的趋势,日益成为全球范围广泛关注的社会问题,给家庭和社会带来沉重的精神和经济负担。
目前,AD的发病机制还不清楚,尚无有效的防治措施,因此寻找能够防治AD的有效药物具有重大的社会效益和经济效益。
姜黄素(curcumin,Cur)是一种广泛使用的中药材-姜黄的主要活性成分,姜黄素具有抗炎抗氧化、促进神经发育以及改善大脑的认知功能等作用[2-3],研究发现姜黄素能够提高细胞还原型谷胱甘肽(Glutathione, GSH)的水平,减少活性氧的产生,能够清除活性氧和活性氮等自由基的氧化作用[4],以及抑制脂质过氧化反应,清除过氧化反应中产生的活性自由基。
姜黄素对阿霉素致大鼠心脏毒性的保护作用及机制探讨

姜黄素对阿霉素致大鼠心脏毒性的保护作用及机制探讨高秋;杨松;陈燕春;季燕妮;周维【摘要】目的:观察姜黄素对阿霉素( ADR)致大鼠心脏毒性的保护作用,并探讨其可能的作用机制。
方法以ADR诱导大鼠心肌损伤模型,观察不同剂量姜黄素干预对大鼠心肌酶谱指标及心肌组织中超氧化物歧化酶( SOD )活性和丙二醛( MDA)的影响,采用免疫印迹法检测心肌组织中的凋亡相关蛋白Caspase-3和Bcl-2。
结果姜黄素显著抑制了ADR损伤后大鼠血清心肌酶指标的升高,上调了心肌组织SOD活性和Bcl-2蛋白表达,抑制MDA水平和Caspase-3蛋白表达升高。
结论姜黄素对ADR引起的大鼠心肌损伤具有保护作用,该作用与抑制ADR 导致的心脏组织氧化应激、进而减轻心肌细胞凋亡有关。
【期刊名称】《山东医药》【年(卷),期】2014(000)016【总页数】3页(P27-29)【关键词】心脏毒性;姜黄素;阿霉素;凋亡【作者】高秋;杨松;陈燕春;季燕妮;周维【作者单位】宜兴市人民医院,江苏宜兴,214200;宜兴市人民医院,江苏宜兴,214200;宜兴市人民医院,江苏宜兴,214200;宜兴市人民医院,江苏宜兴,214200;宜兴市人民医院,江苏宜兴,214200【正文语种】中文【中图分类】R654阿霉素(ADR)属于蒽醌类抗生素,被认为是最有效的蒽环类广谱抗癌药物之一。
然而,ADR在抗肿瘤的同时具有严重的心脏毒性,临床应用受到限制[1]。
ADR 的心脏毒性机制尚未完全明确,然而近期研究表明[2,3],其心脏毒性与心肌组织大量的自由基生成和脂质过氧化引起心肌细胞凋亡有关。
姜黄素是从姜科植物姜黄中提取的天然色素,为姜黄的主要活性成分。
姜黄素具有抗炎、保肝利胆、抗血脂、抗氧化、抗肿瘤及抗炎等诸多药理作用[4]。
近期研究[5,6]表明,姜黄素对缺血和炎症引起的心脏功能损害具有保护作用。
2013年5~6月,我们建立大鼠ADR急性心脏毒性模型,检测心脏组织中丙二醛(MDA)水平、超氧化物歧化酶(SOD)活性及凋亡相关蛋白Caspase-3和Bcl-2水平,以探讨姜黄素对ADR 致心脏损伤的保护作用及机制。
姜黄素对Aβ诱导的老年痴呆大鼠海马胶质纤维酸蛋白表达的影响

研究。 第一作者: 孟凡超( 1965-) ,男,主任医师,主要从事脑血管病研究。
man) ,图像分析系统( 北航 CM-2000B 型) ,RT-PCR 反应试剂盒 ( TakaRa,大连 宝 生 物 公 司) ,GFAP 引 物 ( 上 游 序 列 为 5' CTGAATTCTGCT-GGCTTCAAGG-3',下 游 序 列 5'-CTAA-GCTTGCTCTGCGTTGCGG-3',扩增片段长 590 bp) ,内参 β-actin( 上游 5'-CGTAAAGACCTCTATGCCAACA-3', 下 游 5'-CGGACTCATCGT ACTCCTGCT-3',扩增片段长 229 bp) 。 1. 1. 2 动 物 及 分 组 健 康 雄 性 SD 大 鼠 48 只,体 重230 ~ 250 g,由重庆医科大学实验动物中心提供。大鼠适应性喂养 1 w后,先经 Morris 水迷宫测试,四个象限测试中有两个象限超 过2 min未找到安全平台者视为记忆障碍。淘汰后剩余大鼠被 随机分为 3 组,每组 16 只。空白对照组: 海马注射等容量的生 理盐水,腹腔注射与姜黄素等量的 DMSO; AD 对照组: 腹腔注 射与姜黄 素 等 量 的 DMSO; 姜 黄 素 给 药 组: 腹 腔 注 射 溶 解 在 DMSO 的姜黄素,1 次 / d,剂量为 300 mg / kg,连续注射 7 d。 1. 2 方法 1. 2. 1 Aβ1 ~ 40 诱导大鼠认知障碍模型的制备 用无菌生理盐 水将 Aβ1 ~ 40 稀释成 10 μg / μl,37℃ 下孵育 1 w,使其变为聚集态 Aβ。3. 5% 水合氯醛腹腔麻醉大鼠,固定于立体定位仪上,颅顶 部正中切开皮肤,按大鼠脑立体定位图谱选择右侧海马 CA1 区 为注射靶区,于前囟向后 3. 0 mm、中线旁开 2. 2 mm 处钻开颅 骨,微量进样器自脑表面垂直进针 2. 8 mm,将 Aβ1 ~ 40 缓慢注入 ( 10 μl) ,留针 10 min 以保证溶液充分弥散,然后缓慢撤针。空 白对照组注入等体积生理盐水。各组术后均单笼饲养至大鼠 完全清醒。 1. 2. 2 Morris 水迷宫行为学测试 动物模型制备 1 个月后,
姜黄素对阿尔茨海默病(AD)模型大鼠的抗痴呆作用研究

姜黄素对阿尔茨海默病(AD)模型大鼠的抗痴呆作用研究李娟;聂晶;张敏【摘要】目的建立阿尔茨海默病(AD)大鼠模型,观察姜黄素对AD模型大鼠淀粉样前体蛋白(APP)和早老素-1(PS-1)表达的影响,探讨其相关的抗痴呆机制.方法 60只Wistar大鼠分为:对照组(A,n=15)、模型对照组(B,n=15)和低(C,n=15)、高剂量(D,n=15)姜黄素治疗组;Morris水迷宫实验检测各组大鼠的逃避潜伏时间和平台跨越次数;real-time PCR检测各组APP和PS-1 mRNA表达的变化;Western blot检测各组β淀粉样蛋白(Aβ)、APP和PS-1蛋白表达的变化.结果与A组比较,B组逃避潜伏时间出现显著性的延长(P<0.01),平台跨越次数显著性的减少(P<0.01).与B组比较,姜黄素治疗的C和D组AD大鼠的逃避潜伏时间显著的减低(P <0.05),和平台跨越次数显著增加(P<0.05).Real-time PCR和Western blot分析显示B组APP和PS-1 mRNA和蛋白的表达均显著高于A组(P<0.01),而姜黄素治疗的C和D组则可以显著减低APP和PS-l的表达(P<0.05).Western blot检测显示B组中Aβ的表达水平显著高于A组,C和D组Aβ的表达水平出现了显著的减低.结论姜黄素具有抗AD大鼠痴呆活性,下调APP和PS-1表达,减少AD大鼠脑组织中Aβ的异常聚集可能是其作用的主要机制.【期刊名称】《医学研究杂志》【年(卷),期】2013(042)006【总页数】5页(P173-176,201)【关键词】阿尔茨海默病;姜黄素;β淀粉样蛋白;淀粉样前体蛋白;早老素-1【作者】李娟;聂晶;张敏【作者单位】310003杭州,浙江省中西医结合医院老年病科;310003杭州,浙江省中西医结合医院老年病科;430022武汉,华中科技大学同济医学院附属同济医院神经内科【正文语种】中文阿尔茨海默病(Alzheimer disease,AD)又称老年性痴呆,是一种中枢神经系统退行性疾病,其发生率随年龄的增加而增高,流行病学统计显示60岁以上老年人AD的发生率可达到2%3%,随着世界人口老龄化的进程,AD已成为严重威胁老年人健康的四大疾病之一[1,2]。
姜黄素对糖尿病心肌病大鼠心肌细胞凋亡的影响

姜黄素对糖尿病心肌病大鼠心肌细胞凋亡的影响周开珩;张明【摘要】目的观察姜黄素对糖尿病心肌病大鼠心肌细胞凋亡的影响.方法将60只Wistar大鼠随机分为正常对照组、模型对照组和姜黄素小、大剂量组,每组15只.除正常对照组外,其他组建立大鼠1型糖尿病模型.姜黄素各剂量组灌胃姜黄素溶液;模型对照组与正常对照组灌胃等量0.9%氯化钠溶液.均每周2次,连续16周.取大鼠心脏行TUNEL凋亡染色,检测各组大鼠心肌细胞凋亡情况;Western blotting检测Bcl-2、Bax表达水平.结果 TUNEL凋亡染色结果显示,模型对照组大鼠心肌细胞出现不同程度凋亡.与正常对照组比较,模型对照组大鼠心肌细胞凋亡指数显著增加(P<0.05);与模型对照组比较,姜黄素各剂量组心肌细胞凋亡指数明显下降(P<0.05),且呈现剂量依赖性.Western blotting检测结果显示,模型对照组大鼠心肌细胞Bcl-2含量较正常对照组低,Bax含量较正常对照组高(P<0.01).与模型对照组比较,姜黄素各剂量组心肌细胞Bcl-2含量显著增加,Bax含量显著下降(P<0.01),且呈剂量依赖性.结论姜黄素能显著降低1型糖尿病模型大鼠心肌Bax含量,升高Bcl-2含量,减少1型糖尿病所致大鼠心肌细胞凋亡.%Objective To investigate the preventive effect of curcumin on rats with myocardial apoptosis caused by type 1 diabetes. After intragastric administration of curcumin,the expression of genes related to apoptosis and the number of apoptotic myocardium cells were detected. Methods Sixty Wistar rats were randomly divided into 4 groups ( 15 rats per group ):diabetes group, normal control group,curcumin low dose and high dose group. Animal model with type 1 diabetes was induced by intraperitoneal single injection of streptozotocin ( STZ) in each group except the normal one. After two weeks of STZinjection,the rats with diabetes were used for this study. The curcumin treatment groups were treated with curcumin via intragastric administration for 16 weeks ( twice a week) . Normal control group and diabetes group were administrated with equivalent volume of saline. After 16 weeks, the experimental animals were sacrificed and their hearts were arrested after 0. 9% sodium chloride solution perfusion. The number of myocardial cell apoptosis was detected by TUNEL staining and the expressions of Bcl-2 and Bax relate to the cell apoptosis were examined by western blot analysis. Results The result of TUNEL staining was confirmed that the apoptosis index in the rats of diabetes group was significantly higher than the normal control group ( P<0.05) . However, there was a significantly decline of apoptosis index in the diabetes rats after the treatment of curcumin ( P<0.05) and the result showed a significant dose dependence of curcumin ( P<0.05) . The results of Western blot analysis confirmed that there was a significant lower expression of Bcl-2 and a higher expression and a higher expression of Bax in the hearts of diabetes rats compared with normal control rats (P<0.01). After the treatment of curcumin, the expression of anti-apoptosis protein Bcl-2 was significantly increased and the expression of pro-apoptosis protein Bax was obviously decreased in the myocardial cells of rats in curcumin treated group compared with the diabetes group (P<0.01). The result was also in a dose-dependent manner (P<0.05). Conclusion The treatment of curcumin can significantly increase the expression of anti-apoptosis protein Bcl-2 and decrease the expression of pro-apoptosis protein Bax,which induced thedecrease of myocardial apoptosis in the heart of diabetes rats and could have the effects on the decline of myocardial apoptosis caused by diabetic cardiomyopathy.【期刊名称】《医药导报》【年(卷),期】2017(036)011【总页数】4页(P1264-1267)【关键词】姜黄素;心肌病;糖尿病,1型;细胞凋亡【作者】周开珩;张明【作者单位】浙江省宁波市医疗中心李惠利医院药剂科,宁波 315040;浙江省宁波市鄞州二院药剂科,宁波 315100【正文语种】中文【中图分类】R286;R965糖尿病心肌病(diabetic cardiomyopathy,DCM)是造成糖尿病患者死亡的主要原因[1],其发病机制复杂且目前尚未明确。
姜黄的最主要活性成分姜黄素改善胰岛素抵抗状态的研究进展

第2 0 卷 第 1 压荫 等 舴
Gu i d i n g J o u r n l a o f Tr a d i t i o n a l Ch i n e s e Me d i c i n e a n d Ph a r ma c y
[ A b s t r a c t ] T h i s p a p e r r e v i e w s t h e e f e c t o f c u r e u mi n o n r e s i s t a n t t o t h e e f e c t s o f i n s u l i n i n a d i p o s e c e l l mo d e l a n d a n i ma l
细胞 , 发现T N F — d 能够使 3 T 3 一 L 月 旨 肪细胞发 生胰 岛素 抵抗[ 8 1 。
1 5 I J ] 1  ̄ 1 2 g 姜黄素也没有 明显 的副作用【 l 】 。 胰 岛素抵抗 ( I R ) 使组
织对胰 岛素敏感性 降低 , 造成肝糖 产生 和输 出增加 , 同时骨 骼肌对 葡萄糖摄 取和利用 能力也会 降低[ 2 1 。 I R 是多种代 谢疾 病 的主线 , 为它们的共 同病理生理基础嘞 。 笔者 就姜黄素对胰 岛素抵抗状态的作用及机制 的研究进展予以综述 。
姜黄素对Aβ诱导的AD大鼠海马神经元ERK蛋白表达的影响

1 材料 与方 法
7天 , 放入 一 2 0 ℃冰箱 中备用 。大 鼠水 合 氯醛 麻 醉 后 , 固定 在脑 立体 定位 仪 上 , 头 部 消 毒 后 将皮 肤 沿 矢 状 线
切开 1 . 5 c m, 暴 露 颅 骨 。参 考 《 大 鼠 脑 立 体 定 位 图
在造 模后 2 4 h , 姜 黄 素 组 分别 给予 1 5 0 、 3 0 0 ag r / k g 二 甲基亚 砜 ( D MS O) 溶 解 的姜 黄 素 , 连 续 腹 腔 注射 1 4 天, 其 余各 组 大 鼠分 别 腹腔 注射 等体 积 的二 甲基 亚砜 。
2 0 1 4年 4月第 4 2卷第 2期
Vo 1 . 4 2, No . 2, Ap r . 2 0 1 4
中
医
药
学
报
・2 1・
Ac t a Ch i n e s e Me d i c i n e a n d P h a r ma c o l o g y
姜黄素对 A l 3 诱导的 A D大 鼠海 马 神 经 元 E R K 蛋 白表 达 的 影 响
和E R K 2蛋 白表 达 明显减 少 , 姜 黄 素治 疗组血 清和 海 马组 织 中 At 3含 量 显著 降低 , 海马 神 经元 E R K I和
E R K 2蛋 白表 达 明显增 多, 与模 型组相 比较 差异 均 有 显著 性 。结 论 : 姜 黄 素 可通 过 对 海 马神 经元 E R K1 和E R K 2调控 途 径 , 影响 A t 3生成与代 谢 , 减少 A t 3的神 经毒 性 作 用 , 从 而达到 治 疗 A D作 用 。
缝合 皮肤 并 消毒 。假手 术组 注人 等量 无 菌双蒸 水 。单
姜黄素对大鼠糖尿病防治作用的实验研究

姜黄素对大鼠糖尿病防治作用的实验研究王振富;钟灵【摘要】目的:探讨姜黄素对大鼠糖尿病的防治作用及其机制.方法:用四氧嘧啶(alloxan)诱导糖尿病大鼠模型,将SD大鼠30只随机分为3组(n=10):即正常对照组、糖尿病组和姜黄素治疗组,姜黄素治疗组行姜黄素(200 mg/kg)灌胃8周,测定糖尿病大鼠血糖(BG)、血脂,测定血清中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-P)活性以及丙二醛(MDA)含量.结果:与正常组比较,糖尿病组大鼠血糖、血脂明显升高,抗氧化酶活性降低,丙二醛含量明显增加(P<0.05,P<0.01);与糖尿病组比较,姜黄素治疗组大鼠血糖、血脂明显降低,抗氧化酶活性增强,丙二醛含量明显减少(P<0.05,P<0.01).结论:姜黄素可降血糖、血脂和提高机体抗氧化能力,具有防治糖尿病的作用.【期刊名称】《中国应用生理学杂志》【年(卷),期】2014(030)001【总页数】3页(P68-69,73)【关键词】姜黄素;糖尿病;血糖;血脂;抗氧化能力【作者】王振富;钟灵【作者单位】湖北民族学院医学院,恩施445000;湖北民族学院附属民大医院,恩施445000【正文语种】中文目前,在我国糖尿病的发病率呈逐年上升趋势,且发病年龄日渐低龄化。
糖尿病的死亡率仅次于意外死亡和肿瘤死亡,治疗糖尿病的西药虽很多,但大多不能根治,且副作用大。
因此,人们现在更加注重一些中药和降糖植物的研究,把它用于辅助治疗糖尿病。
姜黄素(curcuma longa linn)来源于植物姜黄的干燥根茎,具有破血行气、通经止痛之功效,可用于治疗胸胁刺痛、风湿肩臂疼痛、跌打肿痛、闭经、瘸瘕等多种病证。
姜黄的化学成分主要为姜黄素类和姜黄挥发油,姜黄素类主要含姜黄素(curcumin)、脱甲氧基姜黄素(demethoxycumin)和双脱甲氧基姜黄素(bisdemethoxycurcumin),其中姜黄素是姜黄发挥药理作用最重要的化学成分。
姜黄素对AD大鼠学习记忆的改善及其与脑组织NO、SOD、MDA和ChAT的关系

姜黄素对阿尔茨海默病(AD)模型大鼠的抗痴呆作用研究

i s e s s e n t i a l f o r t h e g r o w t h o f b r e a s t c a n c e r c e l l s [ J ] .C a n c e r S c i , 2 0 0 6 ,
续 选择传 代 培 养 , 流 式 细 胞 检 测 证 实 转 染 效 率 达 到
9 5 % 以上 , 并检测到 S MY D 3的 m R N A显 著 减 少 , 成 功 构建 了 S MY D 3基 因沉 默模 型 。笔 者对 C—M y c的 mR N A进行 定量 检 测 , 发现它在 S MY D 3基 因沉 默 后 明显减 少 , 推论 沉默 S MY D 3可抑 制 C—My c 基 因, 即 S M Y D 3可 能通过 激活 原 癌 基 因 c—M y c发 挥 其 促 增 殖 抑凋 亡作 用 。 原 癌基 因 C—M y c是 细 胞 生 长 分 化 等 生 理 过 程
象 异常 均可影 响其 降解 。
乳 腺癌 中 S MY D 3被沉 默 可直 接 或 间接 导致 C—
M y c 基 因表 达下 降 , 从 而减 弱肿瘤 细胞 的生长及 侵 袭 转移能 力 , 抑 制 肿 瘤 复 发 和 转 移 。这 一 结 论 提 示
S M Y D 3可作 为乳 腺 癌 治 疗 的又 一 有效 靶基 因 , 为 临
到 其 表 达 明显 升 高 。S MY D 3的 MY N D 型 锌 指 结
[ J ] .世 界 华 人 消 化 杂 志 , 2 0 0 8 ,1 6 ( 1 3 ) : 1 3 7 3—1 3 7 7
姜黄素对AD大鼠学习记忆能力的改善及其与大脑皮质NF-κB和Bcl-2\Bax表达的关系

姜黄素对AD大鼠学习记忆能力的改善及其与大脑皮质NF-κB和Bcl-2\Bax表达的关系目的观察姜黄素对阿尔茨海默病(AD)大鼠学习记忆能力的改善,以了解其对AD大鼠学习记忆能力的影响与大脑皮质内NF-κB及Bcl-2和Bax表达的关系,从而探讨姜黄素治疗AD的可能机制。
方法将90只大鼠随机分为6组,AD模型组、AD模型+姜黄素低剂量组、AD模型+姜黄素中剂量组、AD模型+姜黄素高剂量组、假手术组和正常对照组,每组各15只。
各组大鼠均通过Morris水迷宫观察其学习记忆能力的改变;采用免疫组织化学方法结合图像分析观察各组大鼠大脑皮质的NF-κB免疫反应性细胞的表达变化,采用Western blot 方法检测各组大鼠大脑皮质Bcl-2和Bax蛋白的表达。
结果姜黄素可有效改善AD大鼠的学习记忆能力,并呈剂效关系,大剂量的效果更好。
姜黄素可以缩短AD模型大鼠水迷宫测试的潜伏期(P<0.05),姜黄素低、中、高剂量治疗组大鼠寻找目标象限所需时间缩短;免疫组织化学结果显示:模型组NF-κB蛋白表达较对照组降低(P<0.01);姜黄素各剂量组NF-κB蛋白表达较模型组增高(P <0.05),且姜黄素高剂量组高于姜黄素低剂量组(P<0.05)。
Western blot结果显示:Bcl-2蛋白与NF-κB在各组大鼠大脑皮质中的表达趋于一致;模型组Bcl-2蛋白表达与正常对照组比较差异有统计学意义(P<0.01);姜黄素各剂量[30、60、100 mg/(kg·d)]组Bcl-2蛋白表达较模型组分别增加14.56%、22.12%和32.87%(P<0.05)。
AD模型组大鼠大脑皮质Bax蛋白表达与正常对照组比较差异有统计学意义(P<0.01);姜黄素不同剂量[30、60、100 mg/(kg·d)]组Bax蛋白表达与AD模型比较,分别减少26.37%、37.56%和47.32%(P<0.05)。
《2024年姜黄素在IL-1β诱导的大鼠软骨终板细胞退变过程中的作用》范文

《姜黄素在IL-1β诱导的大鼠软骨终板细胞退变过程中的作用》篇一一、引言软骨终板细胞退变是骨关节炎(OA)发生和发展的重要病理过程之一。
炎症因子如IL-1β(白介素-1β)在软骨终板细胞退变过程中起着关键作用。
近年来,天然植物成分如姜黄素因其抗炎、抗氧化和抗凋亡等特性而备受关注。
本文旨在探讨姜黄素在IL-1β诱导的大鼠软骨终板细胞退变过程中的作用。
二、方法2.1 实验材料实验所需材料包括大鼠软骨终板细胞、IL-1β、姜黄素等。
所有试剂均经过正规渠道购买,确保其质量可靠。
2.2 实验设计将大鼠软骨终板细胞分为对照组、IL-1β组和姜黄素组。
IL-1β组和姜黄素组分别添加IL-1β刺激软骨终板细胞退变,姜黄素组在IL-1β刺激前加入不同浓度的姜黄素。
2.3 实验方法采用细胞培养、酶联免疫吸附试验(ELISA)、实时荧光定量PCR(RT-PCR)等方法,观察各组细胞内相关基因及蛋白表达的变化,以评估姜黄素在软骨终板细胞退变过程中的作用。
三、姜黄素的作用机制3.1 抗炎作用姜黄素能够抑制炎症介质如NO(一氧化氮)、COX-2(环氧化酶-2)等的产生,从而减轻炎症反应。
在IL-1β诱导的软骨终板细胞退变过程中,姜黄素能够抑制炎症因子的释放,减轻炎症对细胞的损伤。
3.2 抗氧化作用姜黄素具有较强的抗氧化能力,能够清除自由基,减轻氧化应激对细胞的损伤。
在软骨终板细胞退变过程中,姜黄素能够保护细胞免受氧化损伤,维持细胞的正常功能。
3.3 抗凋亡作用姜黄素能够抑制细胞凋亡相关基因的表达,从而抑制细胞凋亡。
在软骨终板细胞退变过程中,姜黄素能够减轻细胞凋亡,维持细胞的存活。
四、实验结果通过ELISA、RT-PCR等方法检测各组细胞内相关基因及蛋白表达的变化,发现姜黄素能够显著抑制IL-1β诱导的软骨终板细胞退变过程中炎症因子、氧化应激和凋亡相关基因的表达。
与IL-1β组相比,姜黄素组细胞的退变程度明显减轻,表明姜黄素对软骨终板细胞具有保护作用。
姜黄素对APP/PS1双转基因小鼠海马CA1区AKT及p—AKT表达的影响

姜黄素对APP/PS1双转基因小鼠海马CA1区AKT及p—AKT表达的影响目的:观察姜黄素对AD模型APP/PS1双转基因小鼠丝/苏氨酸激酶(serine-threonine kinase,AKT,又称PKB)和磷酸化的丝/苏氨酸激酶(phosphorylated serine-threonine kinase,即p-AKT)表达的影响。
方法:将3月龄的APP/PS1双转基因小鼠随机分为5组,分别为模型组、罗格列酮组(10 mg·kg-1·d-1)、姜黄素高、中、低剂量组(400,200,100 mg·kg-1·d-1),选取同月龄同背景的非转基因小鼠为对照组。
连续灌胃3个月后,应用免疫组织化学和Western blot方法检测小鼠海马CA1区中AKT和p-AKT的蛋白表达。
结果:免疫组化染色,模型组小鼠大脑海马CA1区AKT和p-AKT阳性细胞均较对照组明显减少(P<0.05,P<0.01),与模型组相比,罗格列酮组与姜黄素高、中剂量组AKT和p-AKT阳性细胞均有明显恢复(P<0.05,P<0.01),其中姜黄素中剂量组p-AKT阳性细胞数增加最为显著(P<0.01)。
Western blot检测结果与免疫组化结果基本一致。
结论:姜黄素可以使AD模型APP/PS1双转基因小鼠海马CA1区中减少的AKT和p-AKT细胞有所恢复,提示姜黄素可能通过调节AKT 及其磷酸化过程,从而进一步调节PI3K/AKT途径的胰岛素信号转导通路发挥抗AD作用。
标签:姜黄素;APP/PS1双转基因小鼠;丝/苏氨酸激酶;磷酸化的丝/苏氨酸激酶迄今为止,阿尔茨海默病(Alzheimer′s disease,AD)的发病机制还不十分确切,研究表明,脑内胰岛素缺乏及胰岛素抵抗所致的脑胰岛素信号转导障碍是散发性AD(sporadic AD,SAD)神经变性病级联反应的核心环节[1-2]。
姜黄素对 Aβ诱导的 AD大鼠海马神经元ERK蛋白表达的影响

姜黄素对Aβ诱导的 AD大鼠海马神经元ERK蛋白表达的影响李树学;韩玉生;纪显玥;史之茂;周忠光【期刊名称】《中医药学报》【年(卷),期】2014(000)002【摘要】目的:探讨姜黄素(curcumin)对老年性痴呆(Alzhelmer s'disease,AD)大鼠海马神经元细胞外信号调节激酶( ERK)蛋白表达的影响。
方法:采用Aβ1-40右侧海马区注射,制备AD大鼠模型,腹腔注射姜黄素给予治疗,采用ELISA法法检测血清与海马组织中Aβ的含量,免疫组化法检测海马区神经元中ERK1、ERK2蛋白表达。
结果:AD模型组大鼠血清和海马组织中Aβ含量显著升高,海马神经元ERK1和ERK2蛋白表达明显减少,姜黄素治疗组血清和海马组织中Aβ含量显著降低,海马神经元ERK1和ERK2蛋白表达明显增多,与模型组相比较差异均有显著性。
结论:姜黄素可通过对海马神经元ERK1和ERK2调控途径,影响Aβ生成与代谢,减少Aβ的神经毒性作用,从而达到治疗AD作用。
【总页数】3页(P21-23)【作者】李树学;韩玉生;纪显玥;史之茂;周忠光【作者单位】黑龙江中医药大学,黑龙江哈尔滨150040;黑龙江中医药大学,黑龙江哈尔滨150040;北京中医药大学,北京100029;黑龙江中医药大学,黑龙江哈尔滨150040;黑龙江中医药大学,黑龙江哈尔滨150040【正文语种】中文【中图分类】R285.5;R749.1+6【相关文献】1.姜黄素对放线菌素D/TNF-α诱导的PC12细胞和大鼠海马神经元损伤的影响[J], 行妍妍;熊国吟;汪军兵;谢赛;龚正;陆大祥;董军;唐红梅;潘锐;邓钦莹2.姜黄素对Aβ诱导的老年痴呆大鼠海马胶质纤维酸蛋白表达的影响 [J], 孟凡超;王运良;尹红蕾;娄季宇;韩冰;耿爽3.经鼻给予TGFβ1对氯化锂-匹罗卡品诱导的SE大鼠海马神经元凋亡调控因子Bcl-2、Bax蛋白表达的影响 [J], 李家林;李良勇;王玉4.辛醇预处理对红藻氨酸诱导的癫(癎)大鼠海马神经元凋亡和胶质纤维酸性蛋白表达的影响 [J], 黄建敏;唐雄林;黄灵;蒙兰青;李雪斌;黄端雅5.姜黄素对血管性痴呆模型大鼠海马神经元凋亡和蛋白表达的影响 [J], 黄新武;李国春;李华;张红;刘剑因版权原因,仅展示原文概要,查看原文内容请购买。
姜黄素对老年鼠脑内氧化性平衡和星形胶质细胞的影响

姜黄素对老年鼠脑内氧化性平衡和星形胶质细胞的影响张盼;俞彬;刘莎;段雅乐;赵政【摘要】以SD大鼠为动物模型,采用Western blotting、酶活性测定、免疫荧光和高效液相色谱-质谱(LC-MS)方法考察姜黄素处理12周后正常衰老大鼠皮层和海马的氧化性平衡和星形胶质细胞形态功能的变化.结果显示,姜黄素降低了老年鼠脑内氧化产物MDA和8-OHdG的含量,提升了r谷氨酰胺半胱氨酸合成酶(GCS)的活性并且促进GSH的产生,提示姜黄素可显著改善伴随正常衰老过程的脑内氧化性平衡;同时姜黄素可以抑制胶质纤维酸性蛋白(GFAP)的过度表达,提升GS活性,增加GDNF水平和D-丝氨酸含量,表明其抑制星形胶质细胞过度活化的同时也改善了星形胶质细胞的功能.【期刊名称】《华东师范大学学报(自然科学版)》【年(卷),期】2015(000)006【总页数】9页(P108-116)【关键词】姜黄素;衰老;氧化应激;星形胶质细胞【作者】张盼;俞彬;刘莎;段雅乐;赵政【作者单位】华东师范大学脑功能基因组学教育部重点实验室,上海市脑功能基因组学重点实验室,神经药理研究室,上海200062;华东师范大学脑功能基因组学教育部重点实验室,上海市脑功能基因组学重点实验室,神经药理研究室,上海200062;华东师范大学脑功能基因组学教育部重点实验室,上海市脑功能基因组学重点实验室,神经药理研究室,上海200062;华东师范大学脑功能基因组学教育部重点实验室,上海市脑功能基因组学重点实验室,神经药理研究室,上海200062;华东师范大学脑功能基因组学教育部重点实验室,上海市脑功能基因组学重点实验室,神经药理研究室,上海200062【正文语种】中文【中图分类】Q1890 引言氧化应激是指由体内活性氧(ROS)的产生与清除失衡导致的组织和细胞的氧化损伤.脑组织的氧化损伤是导致认知功能障碍的重要原因.Maugeri研究了氧化应激和衰老之间的关系,结果发现自由基水平和认知功能呈负相关(p<0.000 1)[1].Fukui等将3月龄的 Wistar大鼠连续5 d置于高氧环境中(氧化应激模型),结果大鼠在水迷宫和八臂迷宫任务中表现出记忆能力明显下降,使用Vitamin E(抗氧化剂)则可逆转氧化应激造成的认知损伤[2].作为哺乳动物脑内分布最广泛的一类细胞,星形胶质细胞是脑内抗氧化系统的重要组成部分,其专属标志酶谷氨酰胺合成酶(GS)在脑内GSH的合成代谢中发挥着重要作用[3],可保护神经元免受ROS诱导的损伤[4];同时星形胶质细胞分泌的神经营养因子(GDNF、BDNF等)对于神经再生起到非常重要的作用[5];此外,星形胶质细胞分泌的D-丝氨酸是诱发LTP的必要条件[6].以上几方面体现了星形胶质细胞对于认知功能的重要性.大量研究表明,姜黄素具有抗炎、抗氧化的功能[7-8].Wang等利用Aβ诱导的大鼠Alzheimer’s disease模型发现姜黄素可以通过抑制星形胶质细胞的过度活化来改善大鼠的认知损伤[9].但是较长时间的姜黄素处理对正常衰老大鼠脑内的氧化状态及星形胶质细胞的影响还未见报道,这方面的研究对于姜黄素的临床应用具有更加实际的指导意义.前期研究中分别用姜黄素处理正常衰老的大鼠6周和12周,结果表明,姜黄素处理12周对于正常老年鼠认知功能的改善作用更加明显,较长时间的姜黄素处理可以提高老年鼠的认知功能,此外还发现其机制与姜黄素促进老年鼠的神经发生和对一些功能基因表达的影响有关,其中一部分基因与氧化应激(如Met、Nts、ATP8)和星形胶质细胞功能有关(如Slc38a4,参与谷氨酸谷氨酰胺循环)[10].本研究观察姜黄素处理12周对老年鼠脑内氧化性平衡和星形胶质细胞(形态、营养因子、谷氨酰胺合成酶和D-丝氨酸等)的影响,为姜黄素改善老年鼠认知功能提供分子依据.1 材料与方法1.1 材料1.1.1 实验动物雄性SD大鼠,购自上海西普尔-必凯实验动物有限公司.本实验分3组:年轻对照组(Young control)(2月龄SD大鼠),对照组(Control)和姜黄素处理组(Curcumin)(均为18月龄SD大鼠).姜黄素处理组给予姜黄素处理12周,其他两组给予正常饲料.大鼠正常饲料与实验饲料(姜黄素含量为480 mg/kg)均购自苏州双狮实验动物饲料科技有限公司.姜黄素来自于SanjivaniPhytopharma Pvt.Ltd,India[10].根据大鼠摄食量测量结果,大鼠日平均摄食量约为25 g,因此预计实验组大鼠每日摄入姜黄素为12 mg/只.每组15只大鼠,其中免疫荧光实验每组9只,其他实验每组6只.本动物实验方法和目的符合人类的道德伦理标准和国际惯例,并且经由华东师范大学动物实验伦理委员会批准(AR201404022),在动物实验期间遵守有关的法规、实验动物伦理福利原则.1.1.2 实验仪器冰冻切片机(Leica),荧光显微镜(NIKON),Spectra Max M5多功能酶标仪(Molecular Devices公司),电泳凝胶成像仪(Bio-rad公司),micrOTOFQⅡ型质谱仪(德国Bruker Dal-tonics公司),HPLC(Agilent Technologies 1200).1.1.3 试剂GFAP抗体(Abcam),GS抗体(Bioworld),GAPDH 抗体(康城生物),RIPA裂解液、Bradford蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒和超敏ECL化学发光试剂盒(碧云天),丙二醛(MDA)、8-羟基脱氧鸟苷(8-OHdG)、还原型谷胱甘肽(GSH)、γ-谷氨酰半胱氨酸合成酶(GCS)和谷氨酰胺合成酶(GS)试剂盒(南京建成),BDNF Elisa和GDNF Elisa试剂盒(ShanghaiWanLang Bio-TechnoloqyCa.,Led),D-丝氨酸和 Marfey试剂(Sigma).1.2 实验方法1.2.1 Western Blot实验处理12周后的老年鼠断头处死,迅速剥离脑组织,在冰上分离出皮层和海马,液氮中速冻.每20 mg组织加入200μL RIPA(PMSF浓度为1 mmol/L)裂解液,充分裂解后14 000 g离心5 min,取上清,测定蛋白浓度.跑胶条件:5%浓缩胶,10%分离胶,恒压80 V跑到底.转膜条件:PVDF膜0.2 A恒流55 min.转完膜后5%脱脂牛奶室温封闭1 h,TBST洗膜(摇床3×5 min),4℃过夜孵育一抗,二抗室温孵育1 h,TBST洗膜(摇床3×5 min)后上机检测.1.2.2 酶活性试验依据试剂盒说明书依次添加各反应成分,MDA于532 nm处检测各组吸光值,GSH于420 nm处检测各组吸光值,GCS于340 nm处检测各组吸光值,GS于412 nm处检测各组吸光值,8-OhdG、BDNF和GDNF采用双抗体夹心ELISA法进行检测,450 nm处检测各组吸光值.1.2.3 免疫荧光实验1.2.3.1 脑灌注固定处理12周后老年鼠腹腔注射戊巴比妥(50 mg/kg),将针头从心尖部插入左心室,生理盐水(37℃预热)200 mL迅速冲净脑内血液,4℃的4%多聚甲醛灌注结束后断头并分离脑组织.将取出的脑组织置于4%多聚甲醛溶液中固定4 h,然后用蔗糖溶液梯度脱水至脑组织沉降至瓶底.1.2.3.2 冰冻切片将脑组织从蔗糖中取出,平稳放置于载物台的包埋剂上并迅速放置于切片机的冷冻台上快速冷冻至脑组织变白.将包埋冷冻好的脑组织固定于切片机的标本台上,刀片厚度为30μm,切片晾干后于37℃烘箱中烘烤过夜.1.2.3.3 免疫荧光将-80℃保存的切片取出,室温放置10 min.用0.1%Triton X-100的PBS溶液漂洗5 min.室温封闭(5%山羊血清,3%Triton,3%BSA in PBS)2 h.一抗4℃孵育过夜,二抗37℃孵育30 min.PBS清洗干净,封片.1.2.4 高效液相色谱-质谱(LC-MS)检测皮层和海马的D-丝氨酸D-丝氨酸测定按本实验室建立的LC-MS法进行[11].大鼠脑组织样品匀浆离心后,取上清液并加入Marfey试剂对样品中L/D-丝氨酸进行衍生化处理.HPLC为Agilent Technologies 1 200,色谱柱采用Agilent,ZORBAXSB-C18,(150 mm×2.1 mm,5μm),流动相A为0.025%甲酸铵(pH 用甲酸调至4.6),B为乙腈.洗脱程序;0~15 min,5%~50%B;15~19 min,50%~5%B;19~25 min,5%B.质谱采用电喷雾离子源(ESI),负离子模式,在m/z 50~500范围内进行全离子扫描,并选择m/z为356.1的分子离子峰用于定量.1.2.5 数据统计应用SPSS 10.0软件,组间比较采用LSD或 Mann-Whitney U test,结果用mean±SEM 表示.*,#p<0.05;**,##p<0.01;***,###p<0.001.2 结果2.1 姜黄素对老年鼠脑内氧化性平衡的影响与年轻对照组相比,对照组老年鼠脑内MDA和8-OHdG含量明显增加,GSH 水平明显减少,GCS活性明显降低.经过姜黄素处理的老年鼠脑内MDA和8-OHdG含量明显减少(见图1 A,B),GSH的水平大幅度提升(见图1 C),GCS的活性明显升高(见图1 D).图1 姜黄素对MDA、8-OHdG和GSH的水平与GCS活性的影响Fig.1 The effect of curcumin on MDA,8-OHdG,GSH levels and GCS activity注:结果用mean±SEM表示,#p<0.05,##p<0.01,###p<0.001与Young control组比较,*p<0.05,**p<0.01与Control组比较2.2 姜黄素对老年鼠星形胶质细胞的影响与年轻对照组相比,在对照组老年鼠皮层、海马DG区和CA1区的星形胶质细胞过度活化,突起变短,有突破折样表现,给予姜黄素后形态明显改善,细胞突起变得细长,胞体也有所减小(见图2);GFAP在对照组老年鼠脑内表达增加,反映了星形胶质细胞的过度活化状态,而姜黄素的处理可明显降低老年鼠皮层(见图3 A,B)中GFAP的表达,在海马虽然没有统计学差异,但是也能观察到GFAP有下降趋势(见图3 C,D,p=0.058),表明姜黄素抑制了星形胶质细胞的过度活化.2.3 姜黄素对老年鼠星形胶质细胞功能的影响皮层(见图4 A,C)和海马(见图4 B,D)中GS蛋白表达在3组之间没有差异.酶活性实验结果表明与年轻对照组相比,GS活性在老年鼠中明显减低,而姜黄素则可明显增加其活性(见图4 E);BDNF和GDNF的含量在老年鼠中降低,姜黄素对BDNF的含量没有影响(见图5 A),但是可明显增加老年鼠皮层和海马中GDNF的含量(见图5 B);老年鼠皮层和海马中的D-丝氨酸明显降低,姜黄素可增加皮层中D-丝氨酸的含量,海马中的D-丝氨酸则有上升的趋势(见图6).图2 姜黄素对星形胶质细胞形态的改善作用Fig.2 The effect of curcumin onthe improvement of the morphology of astrocytes图3 老年鼠GFAP蛋白的表达Fig.3 Expression of GFAP in aged rats detected by western注:A和B,姜黄素降低了老年鼠皮层GFAP的表达;C和D,姜黄素降低了海马GFAP的表达,但没有统计学差异;结果用mean±SEM表示,*p <0.05与Control比较图4 姜黄素对GS的影响Fig.4 The effect of curcumin on GS注:A和C,皮层GS的蛋白表达;B和D,海马GS的蛋白表达;E,皮层和海马中GS的活性;结果用mean±SEM表示,#p<0.05与Young control组比较,*p<0.05与Control组比较图5 姜黄素对BDNF和GDNF水平的影响Fig.5 The effect of curcumin on BDNF and GDNF levels注:结果用mean±SEM 表示,#p<0.05,##p<0.01,与Young control组比较,*p<0.05与Control组比较图6 姜黄素对老年鼠皮层和海马中D-丝氨酸含量的影响Fig.6 The effect of curcumin on the content of D-serine in the cortex and hippocampus of aged rats注:结果用mean±SEM表示,*p<0.05,**p<0.01与Control组相比较3 结论在脑内GSH既可以阻断毒性化合物对DNA、RNA及蛋白质的损害,又可以作为重要的还原剂,保护体内蛋白质或酶分子中的巯基免遭氧化,还可参与蛋白质合成、细胞免疫和酶促反应[12-13].脑内的GSH随着年龄的增加进行性减少,并且这种减少可以导致老年认知功能障碍[14].本实验结果表明,长期摄入姜黄素可以改善正常老年鼠脑内的氧化应激状态:降低皮层和海马内氧化产物MDA和8-OHdG的含量(见图1 A,B),提高GCS活性(GCS是GSH合成反应中的限速酶,决定着GSH生物合成的速率和量)(见图1 D),并增加脑内的GSH水平(见图1 C),这表明姜黄素通过GCS和GSH起到了抗氧化的作用.氧化应激是大脑衰老进程中的一个关键性的损害因素,虽然星形胶质细胞内含有很多抗氧化物质并发挥保护神经元的作用,但是星形胶质细胞自身也会受到氧化应激的影响而发生一系列形态和功能的变化.星形胶质细胞的形态随着年龄的增长呈现过度活化的状态,此时胞体变的肥大,突起增多,严重时有突破折样表现[15-17],其标记物GFAP在脑内绝大部分区域的表达都会增加[18-19].结果显示,姜黄素可以抑制老年鼠星形胶质细胞的过度活化(见图2),降低其标记物GFAP 的蛋白过度表达(见图3).有研究表明,GSH可以抑制神经毒性物质导致的星形胶质细胞过度活化[20],而减轻氧化应激和抑制GFAP表达可以进一步改善AD 大鼠的认知功能[21].因此认为姜黄素通过诱导脑内GSH的产生,减轻了老年鼠皮层和海马的氧化损伤,这些效应有可能与姜黄素抑制星形胶质细胞的过度活化和改善星形胶质细胞的功能有关.星形胶质细胞在脑内GSH的合成代谢中发挥着重要的作用[3]:谷氨酰胺合成酶(GS)是星形胶质细胞专属标志酶,参与谷氨酸谷氨酰胺循环,对于神经递质的代谢具有重要作用,星形胶质细胞吸收谷氨酸和γ-氨基丁酸,在胞体内由GS催化合成谷氨酰胺,合成的谷氨酰胺被神经元吸收可以脱氨参与到GSH的形成中去.研究表明GS酶活性降低可以导致脑内GSH水平下降[22],随着年龄的增加星形胶质细胞的GS酶活性明显下降[23],但是其基因和蛋白表达水平未见改变[24].在研究结果中,老年鼠脑内的GS蛋白表达未见改变,而酶活性却明显降低,与相关报道一致.姜黄素处理虽然对GS蛋白表达没有影响,但是增强了GS酶的活性(见图4),由此可见,长期的姜黄素治疗可能通过改善星形胶质细胞功能从而促进脑内GSH的合成,产生氧化应激的良性循环,进一步起到对老年鼠认知功能的改善作用.星形胶质细胞参与构成“干细胞微环境”,其分泌的神经营养因子包括GDNF、BDNF等可促进神经发生[25-26].在实验中,姜黄素增加了GDNF的水平(见图5 B),但对BDNF没有影响(见图5 A).这提示姜黄素可能通过促进GDNF的分泌来诱导神经发生.D-丝氨酸在体内是由丝氨酸消旋酶将L-丝氨酸转化而来的[27],主要由星形胶质细胞合成释放,其脑内分布与 N-甲基-D-天门冬氨酸(N-methyl-d-aspartate,NMDA)受体一致[28].D-丝氨酸作为NMDA受体的内源性配体,能激活NMDA受体的甘氨酸结合位点,为突触提供营养、支持以及传递调控,有助于突触的形成,并参与学习和记忆等生理活动[29-30].而衰老时D-丝氨酸的含量和合成功能明显下降,导致NMDA受体依赖的突触可塑性下降,并出现认知损伤[31].有研究表明长期喂食抗氧化剂L-NAC可以改善氧化还原状态,增加D-丝氨酸及NMDA受体依赖的突触可塑性[32],但是姜黄素与D-丝氨酸的关系却未见报道.在本文结果中,老年鼠脑内的D-丝氨酸含量明显降低,而姜黄素提高了老年鼠脑内D-丝氨酸的含量(见图6).这提示姜黄素可能通过调控星形胶质细胞对D-丝氨酸的合成释放改善了老年鼠的认知能力.[参考文献][1] MAUGERI D,SANTANGELO A,BONANNO M R,et al.Oxidative stress and aging:Studies on an East-Sicilian,ultraoctagenarian population living in institutes or at home[J].Arch Gerontol Geriatr Suppl,2004(9):271-277.[2] FUKUI K,OMOI N O,HAYASAKA T,et al.Cognitive impairment of rats caused by oxidative stress and aging,and its prevention by vitamin E [J].Ann N Y AcadSci,2002,959:275-284.[3] ASCHNER M.Neuron-astrocyte interactions:Implications for cellular energetics and antioxidant levels[J].Neurotoxicology,2000,21(6):1101-1107.[4] FEMANDEZ-FEMANDEZ S,ALMEIDA A,BOLANOS J P.Antioxidant and bioenergetic coupling between neurons and astrocytes[J].Biochem J,2012,443(1):3-11.[5] GORDON T.The physiology of neural injury and regeneration:The role of neurotrophicfactors[J].J Commun Disord,2010,43(4):265-273.[6] YANG Y,GE W,CHEN Y,et al.Contribution of astrocytes to hippocampal long-term potentiation through release of D-serine [J].Proc Natl Acad Sci USA,2003,100(25):15194-15199.[7] CHHUNCHHA B,FATMA N,KUBO E,et al.Curcumin abates hypoxia-induced oxidative stress based-ER stress-mediated cell deathin mouse hippocampal cells(HT22)by controlling Prdx6 and NF-kappa Bregulation[J].Am J Physiol Cell Physiol,2013,304(7):C636-C655. [8] SOETIKNO V,SARI F R,LAKSHMANANAK A P,et al.Curcumin alleviates oxidative stress,inflammation,and renal fibrosis in remnant kidney through the Nrf2-keap1 pathway[J].Mol Nutr Food Res,2013,57(9):1649-1659.[9] WANG Y,YIN H,WANG L,et al.Curcumin as a potential treatmentfor Alzheimer’s disease:A study of the effects of curcumin on hippocampal expression of glial fibrillary acidic protein[J].Am J Chin Med,2013,41(1):59-70.[10] DONG S,ZENG Q,MITCHELL E S,et al.Curcumin enhances neurogenesis and cognition in aged rats:Implications for transcriptional interactions related to growth and synaptic plasticity[J].Plos One,2012,7(2):e31211.[11]王伟莉.HPLC-ESI-MS法测定大鼠脑组织中神经递质L/D-丝氨酸的含量[J].华东师范大学学报:自然科学版,2013(6):165-170.[12] AOYAMA K,WATABE M,NAKAKI T.Regulation of neuronal glutathione synthesis[J].J Pharmacol Sci,2008,108(3):227-238. [13] DRINGEN R,HIRRLINGER J.Glutathione pathways in the brain [J].Biol Chem,2003,384(4):505-516.[14] CURRAIS A,MAHER P.Functional consequences of age-dependent changes in glutathione status in the brain[J].Antioxid Redox Signal,2013,19(8):813-822.[15] CERBAI F,LANA D,NOSI D,et al.The neuron-astrocyte-microglia triad in normal brain ageing and in a model of neuroinflammation in the rat hippocampus[J].Plos One,2012,7(9):e45250.[16] BERCIANO M T,ANDRES M A,CALLE E,et al.Age-induced hypertrophy of astrocytes in rat supraoptic nucleus:A cytological,morphometric,and immunocytochemicalstudy[J].Anat Rec,1995,243(1):129-144.[17] ITOH Y,YAMADA M,SUEMATSU N,et al.An immunohistochemical study of centenarian brains:Acomparison[J].J Neurol Sci,1998,157(1):73-81.[18] ZHANG R,KADAR T,SIRIMANNE E,et al.Age-related memory decline is associated with vascular and microglial degeneration in agedrats[J].Behav Brain Res,2012,235(2):210-217.[19] LIVELY S,SCHLICHTER L C.Age-related comparisons of evolutionof the inflammatory response after intracerebral hemorrhage in rats [J].Transl Stroke Res,2012,3(Suppl 1):132-146.[20] ENONGENE E N,SUN P N,MEHTA C S.Sodium thiosulfate protects against acrylonitrile-induced elevation of glial fibrillary acidic protein levels by replenishing glutathione[J].Environ Toxicol Pharmacol,2000,8(2):153-161.[21] JAVED H,KHAN M M,AHMAD A,et al.Rutin prevents cognitive impairments by ameliorating oxidative stress and neuroinflammation in rat model of sporadic dementia of Alzheimer type[J].Neuroscience,2012,210:340-352.[22] GHODDOUSSI F,GALLOWAY M P,JAMBEKAR A,et al.Methionine sulfoximine,an inhibitor of glutamine synthetase,lowers brain glutamine and glutamate in a mouse model of ALS[J].J Neurol Sci,2010,290(1-2):41-47.[23] HEAD E,LIU J,HAGEN T M,et al.Oxidative damage increaseswith age in a canine model of human brain aging[J].J Neurochem,2002,82(2):375-381.[24] WU Y,ZHANG A Q,YEW D T.Age related changes of various markers of astrocytes in senescence-accelerated mice hippocampus [J].Neurochem Int,2005,46(7):565-574.[25] ISLAM O,LOO T X,HEESE K.Brain-derived neurotrophic factor (BDNF)has proliferative effects on neural stem cells through the truncated TRK-B receptor,MAP kinase,AKT,and STAT-3 signaling pathways[J].Curr Neurovasc Res,2009,6(1):42-53.[26] CHEN Y,AI Y,SLEVIN J R,et al.Progenitor proliferation in the adult hippocampus and substantianigra induced by glial cell line-derived neurotrophic factor[J].Exp Neurol,2005,196(1):87-95.[27] SCHELL M J.The N-methyl D-aspartate receptor glycine site and D-serine metabolism:An evolutionary perspective[J].Philos Trans R Soc Lond B Biol Sci,2004,359(1446):943-964.[28] BILLARD J M.D-serine signalling as a prominent determinant of neuronal-glial dialogue in the healthy and diseased brain[J].J Cell Mol Med,2008,12(5B):1872-1884.[29] NAGAI T,YU J,KITAHARA,et al.D-serine ameliorates neonatal PolyI:C treatment-induced emotional and cognitive impairments in adult mice[J].J Pharmacol Sci,2012,120(3):213-227.[30] FOSSAT P,TURPIN F R,SACCHU S,et al.Glial D-serine gates NMDA receptors at excitatory synapses in prefrontal cortex[J].Cereb Cortex,2012,22(3):595-606.[31] TURPIN F R,POTIER B,DULONG J R,et al.Reduced serine racemase expression contributes to age-related deficits in hippocampalcognitive function[J].Neurobiol Aging,2011,32(8):1495-1504. [32] HAXAIRE C,TURPIN F R,POTIER B,et al.Reversal of age-related oxidative stress prevents hippocampal synaptic plasticity deficits by protecting D-serine-dependent NMDA receptor activation[J].Aging Cell,2012,11(2):336-344.。
2021年姜黄素对AD小鼠尿中相关神经丝蛋白的动态影响

打开文本图片集[摘要] 目的通过动态观察阿尔茨海默病(Alzheimer′s disease, AD)模型(APP/PS1双转基因)小鼠尿阿尔茨海默相关神经丝蛋白(Alzheimerassociated neuronal thread protein, AD7CNTP)浓度的变化,判断姜黄素的治疗作用。
方法3月龄AD小鼠30 只,随机分为5 组,模型组、罗格列酮组(10 mg·kg-1·d-1),姜黄素治疗高、中、低剂量组(400,200,100 mg·kg-1·d-1);另选用同月龄的C57BL/6J小鼠6只作为对照组。
连续灌胃6个月,分别于灌胃4,5,6个月收集尿液,应用酶联免疫吸附试验(ELISA)检测尿AD7CNTP 浓度的变化。
结果同一时间点小鼠尿AD7CNTP浓度变化组间比较灌胃4,5,6个月后模型组与对照组相比小鼠尿AD7CNTP 浓度均较高(P<0.05);其他各组小鼠尿AD7CNTP均较模型组浓度低,且仅有治疗4个月的姜黄素高剂量组与模型组相比无统计学差异。
不同时间点小鼠尿AD7CNTP浓度的组内动态比较随鼠龄增长各组小鼠尿AD7CNTP浓度均有所升高,但各治疗组均低于同时段的模型组。
灌胃5个月和6个月与4个月相比,对照组与各治疗组组内比较均有显著差异(P<0.01),各组灌胃6个月与5个月相比存在差异但均无统计学意义。
结论随着AD小鼠病情的进展,尿AD7CNTP浓度存在波动,中药单体姜黄素可以抑制AD小鼠病程的进展。
[关键词] 姜黄素;阿尔茨海默病;阿尔茨海默相关神经丝蛋白;阿尔茨海默病小鼠[稿件编号] 20130129005[基金项目] 国家自然科学基金面上项目(81073076);教育部高等学校创新团队项目(IRT0810)[通信作者] *王蓬文,博士生导师,Tel(010)84013195,Emailpw_wang@16com [作者简介] 陈晓培,硕士研究生,Emailpingqingsong15@16com阿尔茨海默病(Alzheimer′s disease,AD)是一种隐匿起病、以进行性认知功能损害为临床特征的神经变性病[1],部分学者认为AD属于神经内分泌疾病,甚至有学者认为AD是3型糖尿病。
姜黄素对Aβ25-35诱导去血清培养PC12细胞p53、p21基因表达的影响

姜黄素对Aβ25-35诱导去血清培养PC12细胞p53、p21基因表达的影响谢朝阳;梅寒芳;祝其锋【期刊名称】《中国药理通讯》【年(卷),期】2005(022)003【摘要】目的:在β-淀粉样肽(25—35)[βamyloid peptide-(25—35),Aβ25—35]诱导去血清培养PC12细胞周期异常模型的基础上.研究姜黄素(Curcumin,Cur)对Ap25-35诱导体外去血清培养的PC12细胞p53、p21基因表达的影响;方法:种入培养瓶的PC12细胞贴壁后用常用的去血清培养法使细胞同步于G0期,每次实验分对照组(0)、诱导组和保护组,通过RT—PCR和Western blot从mRNA及蛋白水平检测p53、p2l基因表达水平的变化.结果用5μmol/LCur预处理细胞1h,再加入终浓度为25μmol/L Aβ25-35处理0~20h,与Aβ25-35诱导组比较,【总页数】2页(P34-35)【作者】谢朝阳;梅寒芳;祝其锋【作者单位】广东医学院生物化学与分子生物学研究所,湛江524023【正文语种】中文【中图分类】R749.16【相关文献】1.姜黄素对β-淀粉样肽(25-35)诱导去血清培养PC12细胞周期异常与细胞凋亡的影响 [J], 谢朝阳;祝其锋;吴斌华2.原花青素对Aβ25-35诱导去血清培养PC12细胞CyclinD1、CDK4、E2F1基因表达的影响 [J], 谢朝阳;吴斌华;祝其锋3.姜黄素影响Aβ25-35诱导去血清培养PC12细胞周期变化与细胞凋亡的可能机制 [J], 谢朝阳;梅寒芳;祝其锋4.姜黄素对Aβ25-35诱导去血清培养PC12细胞周期变化与凋亡的影响 [J], 谢朝阳;梅寒芳;祝其锋5.原花青素对Aβ25-35诱导去血清培养PC12细胞细胞周期相关基因表达变化的影响 [J], 梅寒芳;谢朝阳;祝其锋因版权原因,仅展示原文概要,查看原文内容请购买。
姜黄素对AD大鼠学习记忆的改善及其与脑组织NO、SOD、MDA和ChAT的关系

姜黄素对AD大鼠学习记忆的改善及其与脑组织NO、SOD、MDA和ChAT的关系张向荣;赵志英;张春燕【期刊名称】《医学研究杂志》【年(卷),期】2012(041)009【摘要】Objective To investigate the amelioration and mechanism of curcumin to the learning and memory ability of Alzheimer disease (AD) rats.Methods Preparing the model of the AD rats. Ninety Wistar rats were divided randomly into the control group, imitated operating group, AD model group, AD model plus curcumin low level group, AD model plus curcumin middle level group, AD model plus curcumin high level group. Observing and evaluating the change of learning and memory ability in Morris water maze. Tests of activities of SOD and contents of NO、MDA with chemistry of detecting kits. Observing the change of expressing of ChAT in hippocampus and Meynert nucleus. Results Curcumin had abilityof therapy on AD, curcumin could ameliorate the learning and memory ability of AD and showed dose dependence. Curcumin could shorten the incubation period of experimental rats testing in water maze. Compared with control group, down-regulation of ChAT was found in AD modelgroup (P<0. 01), Using the curcumin could raise the expressing of ChAT, there exist significantly differences between curcumin low level and high level group(P<0.01) . Compared with control group,down-activities ofSOD, up-contents of NO 、MDA were found in AD model group (P <0. 05 or P <0. 01) . Using the curcumin could raise the activities of SOD and reduce the contents of NO、MDA,there exist significantly differences between AD model group and curcumin group(P<0.05 or P<0. 01), Conclusion Curcumin had the therapeutic action to AD, and improve the learning and memory ability of AD rats. The therapeutic action ameliorated of curcumin to AD are related with in promoted the restore of choline nervous system function and strengthened the cleaning of oxygen free radicals and reduced oxidative stress in brain of AD rats.%目的研究姜黄素对阿尔茨海默病(AD)大鼠学习记忆能力的改善及其机制.方法制备AD大鼠模型.将90只Wistar大鼠,随机分为正常对照组、假手术组、AD模型组、AD模型+姜黄素低剂量组、AD模型+姜黄素中剂量组、AD模型+姜黄素高剂量组,共6组.Morris水迷宫对其学习记忆能力的改变进行观察和评价.检测脑组织中一氧化氮(N0)、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性.观察各组大鼠海马、Meynert核的记忆相关神经递质胆碱乙酰转移酶(ChAT)的表达变化.结果姜黄素对AD有治疗作用,可改善AD大鼠学习记忆能力,且剂量不同,治疗效果也有差别.姜黄素可以缩短AD模型大鼠水迷宫测试的潜伏期;模型组大鼠脑内ChAT表达与正常对照组相比明显降低(P<0.01),姜黄素各剂量治疗组ChAT表达上调,高剂量组与低剂量组相比明显升高(P<0.01);AD模型组大鼠脑组织中NO、MDA含量增高,SOD活力降低,与正常对照组比较有显著性差异(P <0.05或P<0.01);姜黄素低、中、高剂量组大鼠脑组织中SOD活性均升高,NO、MDA含量均降低,与AD 模型组大鼠相比有显著性差异(P <0.05或P<0.01).结论姜黄素对AD有治疗作用,可改善AD大鼠学习记忆能力,且剂量不同,治疗效果也有差别.姜黄素改善AD大鼠的学习记忆能力与促进胆碱能神经系统功能的恢复、清除自由基、减轻由氧化应激所致的神经细胞损伤有关.【总页数】5页(P82-86)【作者】张向荣;赵志英;张春燕【作者单位】014010 包头,包钢(集团)公司第三职工医院;包头医学院;包头第八医院【正文语种】中文【相关文献】1.高压氧联合石菖蒲挥发油对老年痴呆症大鼠模型学习记忆功能及脑组织SOD、MDA水平的影响 [J], 邬丽红;张明华2.健脑口服液对血管性痴呆大鼠学习记忆及脑组织SOD、MDA和AchE活性的影响 [J], 王金萍;王占庆;曾明;徐娟;刘玉萍3.兔脑提取物对老年痴呆大鼠脑组织中GSH—PX、SOD,MDA及ChAT水平的影响 [J], 张铭;方基香4.醒脑化痰针法对血管性痴呆大鼠学习记忆及脑组织SOD和MDA的影响 [J], 曹金梅;刘文刚;吴淮5.姜黄素对缺血再灌注大鼠脑组织SOD,MDA和亚硝酸盐含量的影响 [J], 石晶;陶沂;胡晋红;田亚平因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
姜黄素对Aβ诱导的AD大鼠β—APP和BACE1基因表达的影响
作者:韩玉生等
来源:《医学信息》2015年第06期
摘要:目的探讨姜黄素(curcumin)对老年性痴呆(Alzhelmer'sdisease,AD)大鼠海马区β-淀粉样前体蛋白(amyloid protein precursor,APP)和β-分泌酶(amyloidβsecretase1,BACE1)基因表达的影响。
方法采用Aβ1-40右侧海马区注射,制备AD大鼠模型,腹腔注射姜黄素给予治疗,采用RT-PCR法检测海马组织中β-APP和BACE1mRNA表达。
结果与正常组相比,模型组大鼠海马区神经元中β-APPmRNA和BACE1mRNA表达明显升高;与模型组相比较,姜黄素各剂量组β-APPmRNA和BACE1mRNA表达有不同程度降低,差异均有显著性。
结论姜黄素可通过对BACE1mRNA调控作用,阻断β-APP裂解进程,抑制Aβ在脑内生成与沉积,从而减少Aβ对神经元毒性作用。
关键词:姜黄素;老年性痴呆;β-APPmRNA;BACE1mRNA
研究表明,Aβ沉积是AD病理机制的中心环节和治疗靶点, AD治疗的关键在于如何抑制Aβ的生成和代谢。
姜黄素能够有效地抑制Aβ的生成和聚集,从而改善AD学习记忆能力A减退和认知功能障碍 [1-2] ,但其具体机制仍然不明确,因此我们进行如下研究。
1 资料与方法
1.1 实验动物与分组雄性SD大鼠,体重(250±20)g,清洁级,由黑龙江中医药大学实验动物中心提供,实验动物许可证号:SCXK黑2008004。
给予充足水和食物常规饲养1w后进行实验。
实验前经Morris水迷宫筛选,将大鼠随机分成正常组、假手术组、模型组、姜黄素组低剂量组和姜黄素高剂量组,每组10只。
1.2 主要试剂与仪器纯度99%的姜黄素和Aβ1-40由Sigma公司生产;RT-PCR引物、Trizol RNA抽提试剂盒(Invitrogen);逆转录试剂盒及PCR试剂和DNA marker(AKARA公司);琼脂糖和溴化乙啶(美国Amresco公司)。
淮北正华生产的大鼠脑立体定位仪和Morris水迷宫;上海安亭TGL-16G台式离心机;德国Eppendorf公司5331型PCR扩增仪;美国UVP公司GDS-8000型凝胶成像分析系统;日本岛津紫外分光光度计。
1.3 模型制备Aβ1-40用无菌生理盐水稀释后在37℃恒温箱中孵育7d,置于-20℃冰箱中保存备用。
大鼠经10%的水合氯醛麻醉,固定在大鼠脑立体定位仪上,剪去头部毛发,常规消毒。
参考《大鼠脑立体定位图谱》[3]沿大脑矢状线切开皮肤暴露出颅骨,注射点选择:前囟
后3mm,中线向右旁开2mm,垂直进针3.5mm,缓慢注射Aβ1-40溶液2ul(10ug),5min内注射完,留针5min。
颅骨孔用牙科泥封堵后,常规缝合头部的皮肤和局部消毒。
假手术组除注入等量无菌双蒸水外其余处置同模型组。
术后大鼠分别单笼饲养直至完全清醒。
1.4给药方法在术后24h动物清醒后开始给药。
姜黄素用二甲基亚砜(DMSO)溶解,低剂量组和高剂量组分别按150 mg/kg 、300 mg/kg浓度腹腔注射,正常组、假手术组、模型组大鼠分别腹腔注射等体积的二甲基亚砜,连续给药14d 。
1.5指标检测各组大鼠在给药14d后麻醉,心脏灌注生理盐水后取出大脑,在冰上分离海马组织用于RT-PCR法检测大鼠海马区脑组织β-APPmRNA和BACE1mRNA表达。
具体操作用严格按试剂盒说明书进行。
1.6 RT-PCR引物设计β-APPmRNA引物序列:上游5-CCCATCAGGGACCAAAACC3',下游5'GAAGGGCATCGCTTACAAACT3',长度218bp;BACE1mRNA引物序列:上游
5'TTCGTTTGCCCAAGAAA GTAT3',下游5'GTAGGTATTGCTGAGGAAGGA3',长度219 bp;β-actin引物序列:上游5-CTCGCTGTCCACCTTCCA-3下游
5'GCTGTCACCTTCACCGTTC 3',长度256 bp。
由大连宝生物设计合成。
1.8 数据统计实验数据以均数±标准差(x±s)来表示,用SPSS18.0进行统计,采用单因素方差分析,各组间比较t检验,以P
2 结果
2.1 BACE1mRN和β-APP mRNA在各组大鼠海马组织中表达正常组和假手术组BACE1和β-APP mRNA表达呈现出较暗的条带,模型组大鼠海马区BACE1和β-APP mRNA表达明显增强,表现为高亮强度的条带。
姜黄素低、高剂量组在不同程度上降低BACE1和β-APP mRNA的表达。
结果见表1与图。
图1
3 讨论
AD最基本的病理改变是老年斑(senile plaque,SP),"β淀粉样蛋白级联假说"认为,由β-APP经BACE1等裂解产生的Aβ异常增加是形成SP的主要原因[4]。
动物研究表明:敲除BACE1基因后,Aβ产生显著减少,在抑制BACE1的表达时,AD模型动物的认知功能障碍明显得到改善[5-6]。
正常情况下,大量APP代谢主要通过α途径,不产生Aβ;少量APP经β途径,由β-分泌酶(BACE1)裂解APP,生成可溶性片段sAPPβ和含膜成分的C99,再经γ-分泌酶裂解C99产生Aβ[7-8]。
在病理状态下,APP代谢主要经过β途径,产生大量的Aβ,导致AD发生。
因
此,BACE1是Aβ的生成是限速酶,在AD发病机制中处于核心地位,通过抑制BACE1的表达来调节Aβ的代谢,是治疗AD的一种有效策略[9]。
在本实验中,我们发现姜黄素能降低AD大鼠血清及海马组织中Aβ水平,在抑制海马中β-APP蛋白和基因表达同时,也使BACE1mRNA水平明显降低。
因此我们推测:姜黄素可通过对BACE1mRNA调控作用,阻断β-APP裂解进程,抑制Aβ在脑内生成与沉积,从而减少Aβ对神经元毒性作用。
参考文献:
[1]Ono K,Naiki H,YamadaM,et al.The devolepment of preventives and therapeutics for Alzheimer′s disease that inhibite the for mation of beta-amyloid fibrils(fAbeta),as well as destabize preformed fAbta[J].Curr Pham Des,2006,12(33):4357-4375.
[2]尹红蕾,秦新月,王运良,等.姜黄素对海马内注射Aβ1-40后大鼠认知功能障碍的影响[J].中国实用神经疾病杂志,2009,12(9):6-8.
[3]诸葛启钏,大鼠脑立体定位图谱[M].版.北京:人民卫生出版社,2005.
[4]Blennow K,de Leon MJ,Zetterberg H.Alzheimer's disease[J].Lancet,2006,368:387-403.
[5]Ohno M,Sametsky EA,Younkin LH et al.BACE1 deficiency rescues memorydeficits and cholinergic dysfunction in a mouse model of Alzheimer's disease[J].Neuron,2004,41:27-33.
[6]Chiocco MJ,Lamb BT.Spatial and temporal control of age-related APP processingin genomic-based beta-secretase transgenic mice[J].Neurobiol Aging,2007,28:75-84.
[7]Müller T,Meyer H E,Egensperger R,et al.The amyloid precursor proteinintracellular domain(AICD)as modulator of gene expression,apoptosis,andcytoskeletaldynamics-Relevance for Alzheimer's disease[J].Prog Neurobiol,2008,85:393-406.
[8]Volbracht C,Penzkofer S,Mansson D,et al.Measurement of cellular b-site of APPcleaving enzyme 1 activity and its modulation in neuronal assay systems[J].AnalBiochem,2009,387:208-220.
[9]Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer's disease:progress andproblems on the road to therapeutics[J].Science,2002,297:353-356.编辑/王敏。
