疫苗生产企业不良事件报告指南【模板】
药品不良反应报告和监测检查指南

药品不良反应报告和监测检查指南(试行)药品不良反应报告和监测是药品上市后监管的重要内容,是药品生产企业对其生产的药品进行全生命周期管理的主要内容和重要责任,是药品安全评价的重要依据。
为推进药品生产企业开展不良反应报告和监测工作,指导食品药品监督管理部门开展对企业药品不良反应报告和监测工作的检查,制定本检查指南。
本指南适用于食品药品监督管理部门开展对药品生产企业不良反应报告和监测工作的检查。
1.检查目的1.1通过对药品生产企业执行《药品不良反应报告和监测管理办法》情况进行检查,促进企业规范开展药品不良反应报告和监测工作,推进相关工作全面开展。
1.2确定药品生产企业具备符合法律法规所要求的机构、人员、制度、体系和设施。
1.3检查药品生产企业是否严格履行报告和监测责任,是否存在可能对公众健康造成威胁的因素和风险。
1.4必要时,检查结果可作为监管措施的依据。
2.检查类型2.1常规检查:指按计划开展的例行检查,通常为系统性检查,可选取一个或多个特定药品作为实例检查企业药品不良反应报告和监测体系运转情况。
常规检查应坚持问题导向,如新药监测期内、首次进口5年内的药品为重点检查内容。
常规检查范围包括组织机构、人员管理、质量管理体系、个例药品不良反应、药品群体不良事件、境外发生的严重药品不良反应、定期安全性更新报告、药品重点监测、评价及控制9个方面,检查内容参见检查要点(见附件1)。
疫苗生产企业的个例报告、群体不良事件检查内容,参考《全国疑似预防接种异常反应监测方案》(卫办疾控发〔2010〕94号)有关要求。
2.2有因检查:指因一个或多个特殊问题,对生产企业开展的针对性检查,以确认生产企业是否存在违反相关法规的行为。
启动有因检查原因如下:2.2.1药品安全性出现问题:未能及时发现或沟通相关风险,产品撤市或暂停生产、销售时未提前告知等。
2.2.2报告责任未履行:迟报、瞒报、报告质量差、报告信息不准确等。
2.2.3未完成监管机构的要求:未按要求开展药品重点监测;未按要求实施相关产品的风险管理计划;未按要求提供资料,或提供的数据信息不符合要求。
疫苗安全事故通报

疫苗安全事故通报近期,我们收到了关于某疫苗的安全事故报告,特此向各位发布通报。
请大家详细阅读以下内容,了解相关情况。
一、事故概述据相关部门通报,自2月15日起,我国某疫苗生产企业生产的疫苗在部分批次中发现了质量问题。
经过调查,发现该批次疫苗存在剂量失调、容器封装不完整等问题,可能对接种人群产生不良影响。
二、事故影响1. 安全隐患:该疫苗质量问题可能导致接种人群的身体健康受到威胁,存在一定的安全风险。
2. 公众关切:安全问题涉及疫苗,引起了社会公众广泛关注和担忧,对疫苗接种产生了怀疑和不信任。
三、处理措施1. 紧急召回:生产企业已经启动紧急召回程序,回收相关批次疫苗,并已向相关医疗机构下发通知。
2. 停止接种:各医疗机构应立即停止使用相关产品,确保患者安全。
3. 调查与追责:有关部门成立了调查组,对事件原因和责任进行全面调查,一旦查明问题,将依法追究相关责任人的法律责任。
4. 修复声誉:生产企业需要积极采取措施,通过透明公开的沟通方式,增恢复社会对疫苗的信任,提升品牌声誉。
四、应对策略1. 摆事实讲道理:相关部门应尽快公布调查结果,通过数据和事实回应公众关切,消除误解。
2. 安抚公众情绪:加强宣传,提供权威信息和解答,增强公众对疫苗安全的信心。
3. 提升监管能力:加强对疫苗生产环节的监管力度,建立完善的质量控制体系,确保疫苗品质过硬。
4. 优化危机管理机制:进一步健全疫苗安全事件的应急响应机制,加强危机管理和风险防范,提升应对能力。
五、倡议与呼吁1. 倡导科学接种:疫苗接种是预防传染病的重要手段,我们应该继续支持并积极参与疫苗接种工作,不因此次事件而怀疑整个疫苗行业。
2. 加强监督合力:社会各界应积极监督疫苗生产过程,对疫苗质量问题提出举报和投诉,共同维护公众利益和安全。
3. 鼓励科研创新:支持科研机构和生产企业加大疫苗研发力度,提升疫苗质量和效果,并加强国际合作交流,共同应对全球疫苗安全挑战。
以上为疫苗安全事故通报,请各位务必认真对待,并将相关信息传达给更多的人。
疫苗不良事件通报表填写指引第二版

服務機構(必填): 請填寫所屬服務機構之名稱。若通報者變更所屬服務 機構,請務必更新此欄位資訊。
使用線上通報系統者,請搜尋內建醫事機構資料庫選取;基層診所 及藥局請直接搜尋選取「基層診所」或「基層藥局」。
電話(必填): 請填寫上班時間可聯絡的固定市內電話號碼及分機號碼; 若無固定電話者請填寫可聯絡的電話號碼。
填表時若遇資料不明的情況,請填寫「UNK」表示未知、「NA」表示不適 用、「NI」表示填表時尚無資料(但未來可能會有資料)之狀況。
日期資料填寫格式為 yyyy/mm/dd(西元);時間資料以「時」為單位。
相關通報資料請填入於指定欄位中,絕非必要的情況下(如相關照片、過於 龐大複雜的實驗室檢查數據),請勿使用「詳見附檔」的填寫方式通報。
疫苗不良事件(Vaccine Adverse Event, VAE): 即預防接種後不良事件(Adverse Event Following Immunization, AEFI)。係指接 種疫苗者,在接種疫苗之後任何時間所出現任何身體上的不良情況,這些事件發 生時序上在疫苗接種之後,但不表示為接種疫苗所致。
請避免使用非標準或含糊之醫學縮寫。
區段一:通報者資訊及個案接種疫苗與就醫資訊
1. 發生日期時間(必填): 請填寫該疫苗不良事件的最初始發生日期時間,在無 法斷定特定日期的狀況下,請依據醫療專業判斷給定一個估計日期;時間資 料非必填,請盡可能提供此資訊。若個案發生一個以上之獨立的不良事件, 請依最嚴重者的症狀發生日期為主。
若為新生兒先天性畸形的狀況,發生日期即為出生日期。
若胎兒為先天性畸形而行人工流產或自發性流產時,發生日期即為懷孕 終止日期。
2. 通報者獲知日期(必填)2: 請填寫獲知此疫苗不良事件的日期。前開所稱「獲 知此疫苗不良事件」,係指通報者具備下列資訊之日期 a.獲知來源 b.個案資
《疫苗生产现场检查指南》(征求意见稿)

《疫苗生产现场检查指南》(征求意见稿)一、目的为指导检查员对疫苗生产企业的生产现场检查,制定本指南,作为疫苗生产现场检查基础性技术指导文件。
检查员可参照本指南的要求,对企业的生产和质量管理进行检查。
检查过程中,检查员应依据《药品生产质量管理规范》及其附录来确定检查缺陷所涉及的条款。
二、法规依据1.《中华人民共和国药品管理法》2.《中华人民共和国疫苗管理法》3.《中华人民共和国药品管理法实施条例》4.《中华人民共和国药典》5.《药品注册管理办法》6.《药品生产质量管理规范》及其附录7.《药品注册核查管理规定》8.《疫苗储存和运输管理规范》9.《生物制品批签发管理办法》10.《药品不良反应报告和监测管理办法》11.《疫苗流通和预防接种管理条例》12.《药品召回管理办法》13.《药品说明书和标签管理规定》14.《药品生产企业现场检查风险评定原则》15.《医疗废物管理条例》16.《病原微生物实验室生物安全管理条例》17.《食品药品监管总局国家卫生计生委关于进一步加强疫苗流通监管促进疫苗供应工作的通知》(食药监药化监〔2017〕76号)18.药监管理部门批准的制造及检定规程三、细胞基质、菌毒种和原辅料检查(一)细胞基质细胞基质系指可用于疫苗生产的所有动物或人源的连续传代细胞系、二倍体细胞株、原代细胞及重组工程细胞等。
企业应当按照《中国药典》和药品GMP 要求建立符合生产要求的细胞库。
生产和检定用细胞应符合现行《中国药典》三部生物制品通则中“生物制品生产检定用动物细胞基质制备及检定规程”的相关要求。
1)生产和检定用细胞历史来源清晰、有证明资料。
2)生产用原代细胞制备和检定应符合《中国药典》的要求;制备注射用减毒活疫苗的原代细胞和动物组织应来源于无特定病原体(SPF)级动物(包括鸡胚);制备口服疫苗和灭活疫苗的原代细胞应来自清洁级或清洁级以上动物。
3)传代细胞应按照《中国药典》要求建立细胞库并符合规定。
工作细胞库的生物学特性、遗传学特性应与主细胞库一致,传代次数与已批准的要求一致,不应超过规定的代次。
食品药品监管总局关于印发药品不良反应报告和监测检查指南(试行)的通知-食药监药化监〔2015〕78号
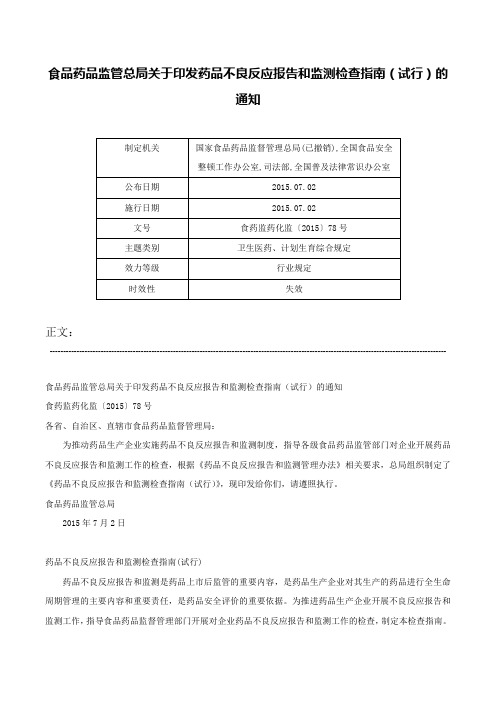
食品药品监管总局关于印发药品不良反应报告和监测检查指南(试行)的通知正文:----------------------------------------------------------------------------------------------------------------------------------------------------食品药品监管总局关于印发药品不良反应报告和监测检查指南(试行)的通知食药监药化监〔2015〕78号各省、自治区、直辖市食品药品监督管理局:为推动药品生产企业实施药品不良反应报告和监测制度,指导各级食品药品监管部门对企业开展药品不良反应报告和监测工作的检查,根据《药品不良反应报告和监测管理办法》相关要求,总局组织制定了《药品不良反应报告和监测检查指南(试行)》,现印发给你们,请遵照执行。
食品药品监管总局2015年7月2日药品不良反应报告和监测检查指南(试行)药品不良反应报告和监测是药品上市后监管的重要内容,是药品生产企业对其生产的药品进行全生命周期管理的主要内容和重要责任,是药品安全评价的重要依据。
为推进药品生产企业开展不良反应报告和监测工作,指导食品药品监督管理部门开展对企业药品不良反应报告和监测工作的检查,制定本检查指南。
本指南适用于食品药品监督管理部门开展对药品生产企业不良反应报告和监测工作的检查。
1.检查目的1.1通过对药品生产企业执行《药品不良反应报告和监测管理办法》情况进行检查,促进企业规范开展药品不良反应报告和监测工作,推进相关工作全面开展。
1.2确定药品生产企业具备符合法律法规所要求的机构、人员、制度、体系和设施。
1.3检查药品生产企业是否严格履行报告和监测责任,是否存在可能对公众健康造成威胁的因素和风险。
1.4必要时,检查结果可作为监管措施的依据。
2.检查类型2.1常规检查:指按计划开展的例行检查,通常为系统性检查,可选取一个或多个特定药品作为实例检查企业药品不良反应报告和监测体系运转情况。
预防接种不良反应报告调查处理工作规范(5-3兰州会议修改稿)

中国生物技术股份有限公司预防接种不良反应报告调查处理工作规范1.目的为加强中国生物技术股份有限公司(以下简称:中生股份)所属生产企业疫苗的安全性监测,准确掌握预防接种后不良反应的发生情况,科学评价和不断改善疫苗质量,规范预防接种不良反应的报告调查和处理,践行中国医药集团总公司“关爱生命,呵护健康”的经营理念,依据国家相关法规,特制订本管理工作规范。
2.适用范围中生股份、中生股份所属生产企业(以下简称:所属企业)和疫苗经营企业。
3.组织机构3.1成立由中生股份领导、营销中心和所属企业负责人组成的预防接种不良反应工作领导小组(以下简称:领导小组),中生股份领导(营销中心总经理)任小组组长、营销中心分管领导和所属企业分管领导任小组副组长。
3.2领导小组下设办公室,为中生股份预防接种不良反应报告调查和处理工作的日常办事机构,设在营销中心医学事务部。
3.3办公室成员由营销中心医学事务部、所属企业负责预防接种不良反应的质量保证部经理和相关工作人员组成。
办公室主任由营销中心医学事务部医学总监担任,副主任由所属企业负责不良反应的质量保证经理担任。
4、职责4.1领导小组职责:建立中生股份预防接种不良反应管理体系,负责管理、组织和协调中生股份及所属企业的疫苗不良反应的报告、调查和处理工作。
4.2办公室职责:承担中生股份疫苗接种不良反应的日常管理工作,并履行以下主要职责:4.2.1 制订中生股份预防接种不良反应报告调查处理工作规范,并组织实施;4.2.2 负责中生股份内所有疫苗接种不良反应的信息收集、整理、核实、报告、汇总和反馈工作;4.2.3 负责提供疫苗的有关信息,必要时提供书面材料;4.2.4 负责组织预防接种不良反应现场调查及处理工作,并提出因预防接种所引发或可能由预防接种引发的不良反应病例的经济补偿建议;4.2.5 组织预防接种不良反应的监测工作,并负责对疑似严重不良反应(如:死亡病例、群体性反应病例/事件和聚集性疑似异常反应)的调查、分析,评价预防接种与不良反应发生的关联性;4.2.6 接受国家药品监督管理部门、药品不良反应监测机构的业务指导,参加药品不良反应监测机构组织的专业培训;4.2.7 对中生股份内从事预防接种不良反应报告、资料收集等相关人员进行培训和指导;4.2.8 建立中生股份预防接种不良反应信息数据库,并与中国疾病预防控制中心、国家药品食品监督管理局药品不良反应监测中心进行信息沟通;4.3办公室成员的职责4.3.1办公室主任的职责●负责主持办公室的全面工作。
AEFI个案报告卡和调查表表样

附表1疑似预防接种异常反应个案报告卡1.编码□□□□□□□□□□□□□□2.姓名*3.性别* 1男2女□4.出生日期* 年月日□□□□/□□/□□5.职业□□6.现住址7.联系电话8.监护人10.反应发生日期* 年月日□□□□/□□/□□11.发现/就诊日期* 年月日□□□□/□□/□□12.就诊单位13.主要临床经过*发热(腋温℃)* 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 4无□局部红肿(直径cm) * 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□局部硬结(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□14.初步临床诊断□□15.是否住院* 1是2否□16.病人转归* 1痊愈2好转3 后遗症4死亡5不详□17.初步分类* 1一般反应2待定□18.反应获得方式1被动监测2主动监测□19.报告日期* 年月日□□□□/□□/□□20.报告单位*21.报告人22.联系电话说明:* 为关键项目。
附表2群体性疑似预防接种异常反应登记表群体性疑似预防接种异常反应编码:县国标码□□□□□□-首例发生年份□□□□-编号□□发生地区:疫苗名称*:生产企业*:规格(剂/支或粒) :有无批签发合格证:接种单位:接种人数*:反应发生人数*:报告单位*:报告人:联系电话:- 2 -附表3疑似预防接种异常反应个案调查表一、基本情况1.编码* □□□□□□□□□□□□□□2.姓名*3.性别* 1男2女□4.出生日期* 年月日□□□□/□□/□□5.职业□□6.现住址7.联系电话8.监护人二、既往史1.接种前患病史1有2无3不详□如有,疾病名称2.接种前过敏史1有2无3不详□如有,过敏物名称3.家族患病史1有2无3不详□如有,疾病名称4.既往异常反应史1有2无3不详□如有,反应发生日期年月日□□□□/□□/□□接种疫苗名称临床诊断三、可疑疫苗情况(按最可疑的疫苗顺序填写)疫苗1 疫苗2 疫苗31.疫苗名称*2.规格(剂/支或粒)3.生产企业*4.疫苗批号*5.有效日期6.有无批签发合格证书7.疫苗外观是否正常8.保存容器9.保存温度(℃)10.送检日期11.检定结果是否合格四、稀释液情况疫苗1 疫苗2 疫苗31.稀释液名称2.规格(ml/支)3.生产企业4.稀释液批号5.有效日期6.稀释液外观是否正常7.保存容器8.保存温度(℃)9.送检日期10.检定结果是否合格五、注射器情况疫苗1 疫苗2 疫苗31.注射器名称2.注射器类型3.规格(ml/支)4.生产企业5.注射器批号6.有效日期7.送检日期8.检定结果是否合格六、接种实施情况疫苗1 疫苗2 疫苗31.接种日期*2.接种组织形式*3.接种剂次*4.接种剂量(ml或粒)*5.接种途径*6.接种部位*7.接种单位8.接种地点9.接种人员10.有无预防接种培训合格证11.接种实施是否正确七、临床情况1.反应发生日期* 年月日□□□□/□□/□□2.发现/就诊日期* 年月日□□□□/□□/□□3.就诊单位4.主要临床经过*发热(腋温℃)* 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 4无□局部红肿(直径cm) * 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□局部硬结(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□5.初步临床诊断□□6.是否住院* 1是2否□如是,医院名称病历号住院日期年月日□□□□/□□/□□出院日期年月日□□□□/□□/□□7.病人转归* 1痊愈2好转3 后遗症4死亡5不详□如死亡,死亡日期年月日□□□□/□□/□□是否进行尸体解剖1是2否□尸体解剖结论八、其他有关情况1.疫苗流通情况及接种组织实施过程2.同品种同批次疫苗接种剂次数及反应发生情况3.当地类似疾病发生情况九、报告及调查情况1.反应获得方式1被动监测2主动监测□2.报告日期* 年月日□□□□/□□/□□3.报告单位*4.报告人5.联系电话6.调查日期* 年月日□□□□/□□/□□7.调查单位8.调查人十、结论1.做出结论的组织* 1医学会2调查诊断专家组3疾控机构4医疗机构□5接种单位组织级别* 1省级2市级3县级4乡级5村级□2.反应分类* 1一般反应2异常反应3疫苗质量事故4接种事故□5偶合症6心因性反应7待定如为异常反应,机体_____________(参照《医疗事故分级标准》)□损害程度3.最终临床诊断* □□4.是否严重疑似预防接种1是2否□异常反应是否群体性疑似预防接1是2否□种异常反应如是,群体性疑似预防接□□□□□□□□□□□□种异常反应编码说明:* 为关键项目。
疫苗涉案事件分析报告模板

疫苗涉案事件分析报告模板一、事件概述近年来,疫苗涉案事件频发,引起了广泛的关注和担忧。
这些事件涉及到疫苗的质量和安全问题,对大众健康和信任造成了严峻影响。
本报告旨在对疫苗涉案事件进行分析,以期提供对相关问题的深度熟识和沉思。
二、事件背景疫苗涉案事件主要包括疫苗质量问题、疫苗失效问题和疫苗安全问题。
其中,疫苗质量问题指的是疫苗生产过程中出现的质量控制不达标的状况,如疫苗成分不符合标准、疫苗接种后出现副作用等;疫苗失效问题指的是疫苗在运输、储存和使用过程中失去了应有的免疫效果;疫苗安全问题则是指疫苗接种后引发严峻的不良反应或病情的恶化。
三、事件影响疫苗涉案事件对大众健康和社会信任带来了严峻影响。
起首,疫苗涉案事件可能导致疫苗接种率下降,增加了大众感染传染病的风险。
其次,疫苗涉案事件会破坏大众对政府和相关机构的信任,降低大众对疫苗接种的意愿和信心。
最后,疫苗涉案事件对疫苗生产企业造成了巨大的声誉损失和经济损失。
四、事件原因疫苗涉案事件的发生原因多种多样,主要包括监管不力、制度缺陷、生产环节问题和信息传播不畅等。
一方面,监管部门在疫苗监管过程中存在监管漏洞和失职现象,监管不力导致了疫苗质量问题的发生。
另一方面,制度缺陷和管理不善也给疫苗涉案事件提供了可乘之机。
此外,生产环节中的质量控制问题和信息传播不畅也是疫苗涉案事件发生的重要原因。
五、事件应对针对疫苗涉案事件,我们需要加强疫苗监管体系建设,完善监管制度和监管机制,提高监管部门的监管能力和监管水平。
同时,疫苗生产企业要加强质量控制,严格恪守相关法律法规和质量标准,确保疫苗的质量和安全。
此外,加强与大众的沟通和信息发布,提高大众对疫苗的认知和理解,增强大众对疫苗接种的信心和意愿。
六、结论与建议疫苗涉案事件是一个复杂的问题,需要多方共同努力来解决。
政府、监管部门、疫苗生产企业和大众都应该承担起各自的责任,共同推动疫苗质量和安全的提升。
加强监管、完。
药品不良反应事件监测报告制度模版(4篇)

药品不良反应事件监测报告制度模版第一章总则第一条为了遵守国家药品管理法律法规的要求,建立健全药品不良反应(以下简称“不良反应”)事件监测报告制度,加强药品不良反应的监测与评价,提高药品的安全性和有效性,保障人民群众的生命健康,根据国家药品监督管理局有关规定,制定本制度。
第二条本制度适用于我单位从事药品生产、经营、使用、监测、疫苗接种、临床试验等关键环节的全体工作人员。
第三条本制度应以科学、合理、规范、准确为原则,注重及时反映新药上市后的使用风险,要求上级药品监督管理部门及时了解并处理药品的不良反应事件。
第二章监测报告的范围和内容第四条不良反应监测报告的范围包括:(一)药品生产过程中发现的不良反应事件;(二)药店、医疗机构及其他单位对患者或使用者反映的药品不良反应;(三)药品临床试验期间发生的不良反应;(四)疫苗接种中发生的不良反应事件;(五)其他与药品安全有关的不良反应事件。
第五条药品不良反应监测报告应包括以下内容:(一)不良反应事件的基本信息,包括不良反应的名称、发生时间、发生地点、患者基本信息等;(二)不良反应事件的严重程度和后果的描述;(三)可能导致不良反应的药品的信息,包括药品的通用名称、生产厂家、批号、有效期等;(四)报告人信息,包括报告人姓名、联系方式、所属单位等;(五)其他与不良反应事件相关的信息。
第三章报告程序第六条不良反应事件的监测报告应该在事件发生后24小时内及时进行,对于较为重要和紧急的不良反应事件要在报告后的48小时内,口头报告上级药品监督管理部门,书面报告在72小时内上报相应部门。
第七条不良反应事件的监测报告要求主动留意、积极调查、真实、完整,不得故意隐瞒、回避和粉饰事实。
第八条监测报告的内容应保密,不得随意泄露,确保报告人的个人信息不外传。
第十章附则第十三条本制度自印发之日起施行,有效期2年。
有效期届满,进行评估,经批准后在2周内进行修订或重新制定。
药品不良反应事件监测报告制度模版(2)1.目的为了保障药品安全使用,及时发现和监测药品不良反应事件,提供科学依据和参考意见,制定药品不良反应事件监测报告制度。
疫苗不良反应突发事件预案

疫苗不良反应突发事件预案背景随着疫苗接种的普及,预防疾病的效果得到了显著提升。
然而,为了确保疫苗接种的安全性,在少数情况下不可避免地可能会发生不良反应突发事件。
为了应对这些事件,制定一个完善的预案是至关重要的。
目的本预案的目的是为了规范并组织应对疫苗不良反应突发事件的工作,以最大程度地减少人员伤害和社会反应,并确保及时有效地处置该事件。
预案内容1. 事件报告与调查- 当发生疫苗不良反应突发事件时,相关机构应立即向卫生部门报告,并尽快进行事件调查。
- 调查人员应收集并分析事件相关的数据和证据,确定事件原因和影响范围。
2. 应急处置措施- 停止相关疫苗的使用,并对已接种者进行及时的医疗救治和跟踪观察。
- 加强卫生部门的医疗资源,确保能够应对大规模疫苗不良反应事件的发生。
- 启动应急通知机制,及时向公众发布相关信息,并提供相应的科学指导和安抚措施。
3. 风险评估与管理- 卫生部门应建立完善的风险评估与管理机制,对不同疫苗及其接种人群进行风险评估,并制定相应的管理措施。
- 监测疫苗接种后的不良反应情况,及时调整风险管理策略,保障公众的安全和健康。
4. 信息公开与沟通- 建立公开透明的信息通报机制,及时向公众发布疫苗不良反应事件的最新进展和处理措施。
- 加强对媒体和社交媒体的监测和应对,防止不实信息的传播和恐慌情绪的扩散。
总结疫苗不良反应突发事件的发生是一种不可预测的风险,但通过制定和实施本预案,我们能够及时应对事件、降低损失,并进一步增强公众对疫苗接种的信心。
因此,大家应紧密合作,认真落实该预案的各项内容,保障疫苗接种工作的顺利进行。
预防接种异常反应报告制度范本(2篇)

预防接种异常反应报告制度范本一、引言随着预防接种工作的不断推进,异常反应事件的发生与处理变得越来越重要。
为了及时掌握和处置异常反应事件,保障公众的健康安全,我国建立了预防接种异常反应报告制度。
该制度的实施可以有效监测接种异常反应情况,提供科学依据,进一步完善预防接种工作。
本文就预防接种异常反应报告制度的范本进行详细介绍。
二、报告制度的背景与目的1. 背景接种异常反应是指在预防接种后,接种者出现的与预期不符合的不良反应。
虽然接种异常反应的发生率较低,但其对接种工作的影响和社会关注度逐年提升。
为了及时监测接种异常反应情况,快速准确处理和发现问题,建立预防接种异常反应报告制度势在必行。
2. 目的该报告制度的目的在于:(1)及时掌握各类接种异常反应发生的情况,提供科学依据;(2)完善接种安全监测与预警体系,加强接种工作的风险控制;(3)促进异常反应事件的及时上报和处理,保障公众的健康安全。
三、接种异常反应报告的对象1. 接种单位包括各级疾控中心、医疗机构等预防接种单位。
2. 接种人员包括预防接种单位工作人员、监测人员及其他相关人员。
四、报告的内容1. 基本信息(1)报告单位:填写报告单位全称及地址。
(2)报告人:填写报告人姓名、职务、联系方式等。
(3)接种单位:填写接种单位全称及地址。
(4)接种人员:填写接种人员姓名、职务、联系方式等。
2. 异常反应情况(1)接种者信息:填写接种者姓名、年龄、性别、身份证号码等。
(2)接种疫苗:填写接种的疫苗名称、批号、生产企业等。
(3)异常反应发生时间:填写异常反应发生的具体日期及时间。
(4)异常反应症状:详细描述接种者出现的异常反应症状及表现。
(5)处理措施:详细描述接种单位对异常反应的处理措施和效果。
3. 结果与建议(1)发生率计算:根据报告的异常反应情况,计算异常反应的发生率。
(2)风险评估与预警建议:根据异常反应情况,评估风险等级,并提出相应的预警建议。
五、报告流程与要求1. 报告流程(1)发现异常反应:接种单位及时发现接种者的异常反应情况。
预防接种异常反应报告制度范文(4篇)

预防接种异常反应报告制度范文一、目的和背景为了保护人民群众的健康权益,及时监测和控制疫苗接种引起的异常反应,加强疫苗安全监测工作,我们特制定了预防接种异常反应报告制度。
本制度的目的是规范预防接种异常反应的报告工作,加强相关部门之间的信息共享和协作,保障人民群众的健康安全。
二、适用范围本制度适用于所有从事疫苗接种的医疗机构、预防接种门诊等专业机构。
三、报告内容和要求1. 异常反应的定义:对于疫苗接种导致的不良反应,包括但不限于局部反应、全身反应、过敏反应、传染性疫苗相关疾病等,都需要及时进行报告。
2. 异常反应报告的时间:疫苗接种后,及时报告异常反应,以便能够准确记录和分析异常反应情况。
3. 异常反应报告的内容:报告应包括接种者的基本信息、接种疫苗的情况、异常反应的症状和程度等。
4. 异常反应报告的途径:报告可以通过电话、电子邮件、传真等方式进行,接收报告的单位应及时对接收到的报告进行核实、整理和分析。
5. 异常反应报告的保密性:接收到报告的单位应严格保护受影响者的隐私,未经相关人员同意,不得将报告内容泄露给任何无关部门和个人。
四、报告流程1. 异常反应的观察和记录:医疗机构在疫苗接种后应密切观察接种者的反应情况,并及时记录异常反应的症状和程度。
2. 异常反应的报告:接种者或其家属、医生等应尽快将异常反应情况报告给所在医疗机构或相关部门。
3. 报告的处理:医疗机构或相关部门接收到报告后,应及时核实报告内容,整理信息,并进行统计和分析,如有需要,还可以向上级部门汇报。
五、责任分工1. 医疗机构:负责观察和记录异常反应情况,并及时向相关部门报告。
2. 相关部门:负责接收和处理异常反应报告,对异常反应进行核实、整理和分析,并及时向上级部门汇报。
六、监督和考核1. 上级部门对各级医疗机构和相关部门的异常反应报告工作进行监督和考核。
2. 对于未按要求报告异常反应情况的单位,将按照相关法律法规进行处罚。
七、附则本制度自发布之日起执行,对于之前发生的异常反应情况,也适用本制度进行报告和处理。
预防接种异常反应报告制度样本(3篇)

预防接种异常反应报告制度样本1.预防接种实施单位要建立预防接种异常反应和事故监测系统,开展预防接种异常反应和事故的登记、报告与调查处理。
2.接种前应严格掌握各种疫苗的禁忌症。
3.报告人实施预防接种的计划免疫工作人员、各级疾病预防控制机构和医疗保健机构工作人员为预防接种异常反应和事故报告的责任报告人。
4.报告种类4.1预防接种后,无其它原因体温≥38.5℃或主诉临床症状超过____小时。
4.2预防接种后引起的死亡、群体性反应或事故。
4.3下列可能发生的预防接种异常反应:(1)预防接种后____小时内发生:①急性过敏反应②过敏反应③持续____小时以上无法安抚尖叫(2)预防接种后____天内发生①严重局部反应②脓毒病③注射部位脓肿(细菌性/无菌性)(3)预防接种后____天内发生①癫痫发作②脑病③感染性多发性神经根神经炎④过敏性紫癜(4)预防接种后____个月内发生①急性弛缓性麻痹(脊灰疫苗接种后4-____天,接触服苗者4-____天)②臂神经炎(接种含破伤风类毒素疫苗后2-____天,出现臂/肩部神经功能异常,无其他神经系统受累)③血小板减少(接种麻疹疫苗/麻疹-腮腺炎-风疹联合疫苗后15-____天,导致青肿和/或出血,血小板计数<5____104/ml)(5)卡介苗接种后1-____个月内发生①淋巴结炎(包括化脓性淋巴结炎)②播散性卡介苗感染③骨炎/骨髓炎5.报告内容受种者姓名、性别、出生日期、住址、接种疫苗名称、剂次、接种者、接种时间、出现反应时间、反应或事故类型、发生反应或事故的可能原因、初步诊断和诊断单位、转归。
6.报告时限、程序和形式6.1发生预防接种一般反应,由接种单位处理和作好调查登记,每月汇总后报告市疾病预防控制中心。
6.2发现(疑似)预防接种异常反应或事故时应及时开展救治,城镇在____小时内、农村在____小时内向市疾病预防控制中心报告。
6.3发现(疑似)预防接种反应引起的死亡病例、群体性反应或严重事故时:(1)接种单位、医疗机构及其医务人员,应以最快的通讯方式,向市卫生局、市药监局和市疾病预防控制中心报告。
疫苗预防接种不良事件个案报告卡最新模板

预防接种不良事件个案报告卡
1.姓名*
2.身份证件类别*
3.身份证件号码(儿童/父母)* □□□□□□□□□□□□□□□□□□
4.性别* □男□女
如为女性:□孕妇□哺乳期妇女□均否
5.出生日期* 年月日
6.人群分类
7.现住址* 省(自治区、直辖市)市(州、盟)县(区、市、旗)乡(镇、街道)
8.联系电话
9.监护人
11.反应发生日期和时间* 年月日时分□□□□/□□/□□
12.发现日期* 年月日□□□□/□□/□□
13.简要临床发病经过*描述症状/体征/疾病/检测结果异常等:
14.发热(腋温℃)* 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 4无□
15.局部红肿(直径cm) * 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□
16.局部硬结(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□
17.其他症状:
18.初步临床诊断*
与已作出的诊断无关的其他重要症状:
19.不良事件编码(暂不填)ICD MedDRA编码
20.初步分类*1一般反应2待定□
21.是否严重* 1.是(死亡、危及生命、住院治疗或延长现住院时间、持续的或显著的人体伤残/失能、
先天性异常以及如不及时治疗可能导致上述情形的情况;需要治疗的其他重度疾病)2.
否
□
22.病情转归* 1 治愈2好转3加重4后遗症5 死亡6 治疗7不详□
23.初始报告来源*1受种者/监护人2上市许可持有人3临床医生4接种单位5其他□
24.报告日期* 年月日□□□□/□□/□□
25.报告单位*
26.报告人
27.报告单位联系电话
说明:* 为必填项目。
疫苗不良反应申报表格

获悉不良事件日期:年月日填表及报告日期:年月日
注:如果“获悉不良事件日期”与“填表及报告日期”的间隔时间超过24小时,须填写以下延迟报告不良事件的原因:
6.DS&E接收人签名:收到日期:年月日
DS&E联系方式:,传真:
药物滥用*妊娠|___|___| WG抽烟其它*
不良事件描述,包括治疗和实验室数据**
不良事件(症状,体征,过程,用药,起止时间等):
**不够可另附纸张
患者是否康复?
否是
需要住院或延长住院时间?
是否
持续的伤残或功能丧失?
是否
威胁生命?
是否
重要的医学事件?
(例如抽搐)
是否
死亡(日期和时间):
_________________________
不详
是
否
不良事件:
2.患者信息和不良事件信息
首字母缩写
(名/姓)
||| ||
出生日期
(日月年)
|||||||
性别
女
男
身高(cm)
||||
体重(kg)
||||
疫苗接种状态:(包括其它厂家的疫苗)
相关基础疾病/合并疾病/手术等.(如果纸张不够可以另附纸张):
其它相关病史:
过敏*免疫缺陷*频繁感染*代谢性疾病*酗酒
不良事件收集表格
请附上相关信息,例如实验室报告单,诊断,医生意见等,并抹去患者信息。
1.疫苗信息
可疑疫苗
(商品名)
剂量
给药途径/接种部位
接种日期
日期时间
首次接种?
加强接种?
过去是否能耐受疫苗?
1.
商品名:
长生生物问题疫苗事件汇报PPT模板

根据原国家食药监局新闻发言人的解释,按照相关规定,中检院对企业报请批签 发的疫苗,逐批进行安全性指标检验,对效价有效性指标按国际通行做法随机抽 取5%进行检验。"经查批签发记录,该2批次疫苗安全性指标符合标准,效价有 效性指标不在抽样检验范围内。”发言人说。发言人表示,这次2批次百白破疫 苗效价指标不合格的原因和结,论,需要根据企业自查、调查组调查和有效期 内疫苗样品检验结果综合分析后做出,将及时向社会公布有关信息同时,将抽取 两家住国6-8周生产所有在有效期内的百白破疫苗样品进行检验,检验结论需 作出。但截至目前,未有检验结果相关信息披露。
汇报结束,谢谢聆听
本模板有完整的逻辑框架,内容详实,稍作修改可直接 使用,参考和实用价值高!
科室:XX科
汇报人:XXX
27
疫苗是指用各类病原微生物制作的用于预防接种的生物制品。其中用细 菌或螺旋体制作的疫苗亦称为菌苗。疫苗分为活疫苗和死疫苗两种。常 用的活疫苗有卡介苗,脊髓灰质炎疫苗、麻疹疫苗、鼠疫菌苗等。常用 的死疫苗有百日咳菌苗、伤寒菌苗、流脑菌苗、霍乱菌苗等。据估计,免 疫接种每年能避免200万至300万例因白喉、破伤风、百日咳和麻疹导 致的死亡。全球疫苗接种覆盖率(全球获得推荐疫苗的儿童所占的比例) 在过去几年中- -直保持稳定。
公司说,飞行检查查出问题的都封存了,已经上市的不存在品质问题,没有发生不良反应。这 种态度让人百般不解。已经上市的,已经注射的,存不存在问题,这几天你就知道了?以前没 有检查过的你生产了好几年的疫苗产品,都过去这么长时间了, 你说没有问题就没有问题了? 什么没有品质问题不存在不良反应?假的疫苗有没有不良反应是几天就能知道的事情吗,有没 有可能有长期的负面效果呢?假的疫苗没有不良反应就对了吗?无效的狂犬病疫苗,让接种者 实际上暴露在狂犬病的威胁之下(关键接种者还认为自己接种了),而狂犬病是致死率几乎 100%的病,这种疫苗不是一-句“没有不良反应”就可以撇清责任的,它实际上是害人的,甚 至可以说是十分危险的了。
疫苗安全事故调查报告生产过程存在违规行为引发安全隐患

疫苗安全事故调查报告生产过程存在违规行为引发安全隐患疫苗是一种预防和控制传染病的重要手段,具有重要的公共卫生意义。
然而,近年来疫苗安全问题不断引发社会关注。
为了保障公众的健康和安全,对于疫苗的生产过程必须严格控制和监管。
本篇文章将对某疫苗安全事故进行调查,并指出了生产过程中存在的违规行为,从而引发了安全隐患。
事故调查报告显示,该疫苗生产过程中存在一系列违规行为,这些行为导致了疫苗安全隐患的产生。
首先,在原料采购环节,有关部门对供应商的资质和质量管理体系把关不严,导致了水平不达标的原料进入生产流程。
其次,在生产工艺中,部分操作人员没有按照规定的程序和标准进行操作,造成了疫苗生产过程中的交叉污染。
比如,在制造环节中,疫苗种植细菌的培养基未经严格消毒处理,导致了细菌的污染。
此外,在疫苗灌装环节,操作人员未能严格按照标准操作,使得部分疫苗出现了漏液以及瓶盖未经严密封闭的问题,进一步增加了疫苗的污染风险。
调查报告还指出,生产过程中的管理问题也是事故发生的重要原因。
首先,对于操作人员的安全培训和技术能力要求不够,使得操作人员存在一定的差异化水平,无法保证操作的标准化和规范化。
其次,生产过程中缺乏严格的质量管理体系,对于生产环节的监控和质量控制不够严谨。
这使得问题在产生后不能及时发现和处理,进一步放大了事故的风险。
基于此,我们提出了以下几点建议,以确保疫苗生产过程的安全和质量稳定。
首先,相关部门需要加强对供应商的资质审核和质量管理体系评估,确保原料的质量符合标准要求。
其次,操作人员应接受严格的培训,提高其操作技能和质量意识,保证操作过程的标准化。
同时,在生产过程中加强质量管理,如建立完善的检测机制、制定详细的操作程序、加强现场管理和监控,以及建立完善的纪录和追溯体系等。
此外,补充应急预案,以便在事故发生时能够及时、有效地处置,以最大限度地减少事故对公众健康和社会安全的影响。
总之,疫苗安全事故是对公众健康和社会安全的重大挑战。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
疫苗生产企业不良事件报告指南目录前言3疑似预防接种异常反应个案报告41 疑似预防接种异常反应定义及分类 (4)2 个案报告范围、程序、时限 (5)3《疑似预防接种异常反应个案报告卡》填写说明 (6)4 个案报告调查相关工作及要求 (9)附表1 (10)群体性疑似预防接种异常反应报告111 定义 (11)2 报告程序、时限 (11)3《群体性疑似预防接种异常反应登记表》填写说明11 4 群体性疑似预防接种异常调查相关工作及要求 (14)附表2 (15)境外发生的严重疑似预防接种异常反应个案报告161个案报告 (16)2 境外疫苗安全性信息 (17)附表3 (18)定期安全性更新报告191 定义 (19)2 报告程序、时限和内容 (19)附录22一、名词解释 (22)二、相关法律法规 (24)前言为加强疫苗生产企业(包括进口药品的境外制药厂商)疑似预防接种异常反应(Adverse Event Following Immunization,AEFI)报告工作,根据《药品管理法》、《疫苗流通和预防接种管理条例》、《药品不良反应报告和监测管理办法》、《全国疑似预防接种异常反应监测方案》等法律、法规制定本指南。
疫苗生产企业应当按照《全国疑似预防接种异常反应监测方案》规定,报告所发现的AEFI;按照《药品不良反应报告和监测管理办法》规定,报告进口疫苗和国产疫苗在境外发生的严重AEFI,并对本企业生产疫苗的预防接种不良反应报告和监测资料进行定期汇总分析,汇总国内外安全性信息,进行风险和效益评估,撰写定期安全性更新报告。
同时,疫苗生产企业应当配合相关部门对AEFI进行调查,并提供调查所需的资料。
疫苗生产企业应建立疫苗预防接种不良反应报告和监测管理制度。
设立专门机构并配备一定数量的具有专业知识及组织能力的管理人员和技术人员,承担本单位的疫苗预防接种不良反应报告和监测工作。
疑似预防接种异常反应个案报告1疑似预防接种异常反应定义及分类1.1 定义疑似预防接种异常反应(AEFI):是指在预防接种后发生的怀疑与预防接种有关的反应或事件。
1.2 分类AEFI经调查诊断分析,按发生原因分成以下五种类型:1.2.1疫苗不良反应:合格的疫苗在实施规范接种后,发生的与预防接种目的无关或意外的有害反应,包括一般反应和异常反应。
1.2.1.1一般反应:在预防接种后发生的,由疫苗本身所固有的特性引起的,对机体只会造成一过性生理功能障碍的反应,主要有发热和局部红肿,同时可能伴有全身不适、倦怠、食欲不振、乏力等综合症状。
1.2.1.2异常反应:合格的疫苗在实施规范接种过程中或者实施规范接种后造成受种者机体组织器官、功能损害,相关各方均无过错的药品不良反应。
1.2.2 疫苗质量事故:由于疫苗质量不合格,接种后造成受种者机体组织器官、功能损害。
1.2.3 接种事故:由于在预防接种实施过程中违反预防接种工作规范、免疫程序、疫苗使用指导原则、接种方案,造成受种者机体组织器官、功能损害。
1.2.4 偶合症:受种者在接种时正处于某种疾病的潜伏期或者前驱期,接种后巧合发病。
1.2.5 心因性反应:在预防接种实施过程中或接种后因受种者心理因素发生的个体或者群体的反应。
2 个案报告范围、程序、时限2.1 报告范围以AEFI发生时限进行划分,疫苗生产企业遇到以下情形的均需报告:——24小时内:如过敏性休克、不伴休克的过敏反应(荨麻疹、斑丘疹、喉头水肿等)、中毒性休克综合征、晕厥、癔症等。
——5天内:如发热 (腋温≥38.6℃)、血管性水肿、全身化脓性感染(毒血症、败血症、脓毒血症)、接种部位发生的红肿(直径>2.5cm)、硬结(直径>2.5cm)、局部化脓性感染(局部脓肿、淋巴管炎和淋巴结炎、蜂窝组织炎)等。
——15天内:如麻疹样或猩红热样皮疹、过敏性紫癜、局部过敏坏死反应(Arthus反应)、热性惊厥、癫痫、多发性神经炎、脑病、脑炎和脑膜炎等。
——6周内:如血小板减少性紫癜、格林巴利综合征、疫苗相关麻痹型脊髓灰质炎等。
——3个月内:如臂丛神经炎、接种部位发生的无菌性脓肿等。
——接种卡介苗后1—12个月:如淋巴结炎或淋巴管炎、骨髓炎、全身播散性卡介苗感染等。
——其他:怀疑与预防接种有关的其他严重疑似预防接种异常反应。
2.2 报告程序、时限AEFI个案报告实行属地化管理。
疫苗生产企业发现怀疑与预防接种有关的AEFI时,应当在发现后48小时内填写AEFI个案报告卡,向受种者所在地的县级疾病预防控制机构报告;发现怀疑与预防接种有关的死亡、严重残疾、对社会有重大影响的AEFI时,应当在2小时内填写AEFI个案报告卡,向受种者所在地的县级疾病预防控制机构和药品监督管理部门报告,并同时将有关情况向企业所在地的省级药品监督管理部门报告。
企业通过各级疾病预防控制机构或各级药品监督管理部门获知的AEFI,应进行整理归档,并在定期安全性更新报告(简称PSUR)中进行汇总、分析。
3《疑似预防接种异常反应个案报告卡》填写说明《疑似预防接种异常反应个案报告卡》见附表1(﹡为关键项目)。
3.1 基本情况3.1.1 编码 *:县国标码6位+发生年份4位+流水号4位,由全国预防接种管理系统自动生成,疫苗生产企业可不填。
3.1.2 姓名 *:填写受种者真实姓名,尚未取名的儿童可填写父或母姓名+“子”或“女”。
3.1.3 性别 *:选填1-男 2-女。
3.1.4 出生日期 *:按年月日格式填写,日期指公历日期(下同)。
3.1.5 职业:选填01-幼托儿童 02-散居儿童 03-大学生 04-中学生 05-小学生06-教师 07-保育员及保姆 08-餐饮食品业 09-商业服务 10-医务人员 11-工人 12-民工 13-农民 14-牧民 15-渔(船)民16-干部职员17-离退人员18-家务及待业19-其他20-孕妇21-产妇。
3.1.6 现住址:填写受种者当前的家庭住址,包括省、市、县、乡、村各级名称和门牌号。
3.1.7 联系电话:填写受种者的联络电话,如为儿童,填写其监护人电话,号码内包括地区码。
3.1.8 监护人:XXX种者为儿童,填写其监护人姓名。
3.2 可疑疫苗接种情况(按最可疑的疫苗顺序填写)AEFI通常涉及一种疫苗,但个别情况下受种者可能同时或先后接种数种疫苗(一般最多3种)。
因此,必须对所有的可疑疫苗进行调查,按最可疑的疫苗顺序填写此项内容,与反应根本无关的疫苗不必填写。
例如,同时接种了OPV(口服)、DPT(左臂)和HepB(右臂)后,在左臂注射部位出现无菌化脓,则可以完全排除系OPV和HepB 引起,只填写DPT即可;但如果出现全身过敏性皮疹,则3种疫苗均有可能引起,都应填写,最可疑的疫苗排在前面。
3.2.1 疫苗名称 *:填写疫苗通用名全称。
3.2.2 规格:按“剂/支(粒)”填写疫苗的规格,只填数字。
例如DPT为4剂/支,填写“4”即可, OPV为1剂/粒,填写“1”即可。
3.2.3 生产企业 *:填写疫苗生产企业全称。
3.2.4疫苗批号*:填写接种疫苗安瓿或包装上所标名的生产批号。
3.2.5 接种日期 *:按“年月日”格式填写。
3.2.6 接种组织形式 *:选填 1-常规 2-强化 3-应急 4-其它。
3.2.7接种剂次 *:疫苗接种的第几剂(针),只填写数字,例如DPT第2针,填写“2”即可。
3.2.8 接种剂量 *:填写接种的疫苗剂量,脊灰糖丸疫苗或某些胶囊疫苗的剂量单位为“粒”,注射疫苗为“ml”。
只填写数字,例如DPT 接种0.5ml,填写“0.5”。
3.2.9 接种途径*:选填1-肌内2-皮下3-皮内4-口服5-其它。
3.2.10 接种部位 *:选填1-左上臂 2-右上臂 3-左臀部 4-右臀部 5-大腿内侧 6-其它。
3.3 临床情况3.3.1 反应发生日期 *:反应的症状最早出现日期,按“年月日”格式填写。
3.3.2 发现/就诊日期 *:责任报告单位和报告人发现AEFI的日期,或诊为AEFI的最早就诊日期。
按“年月日”格式填写。
3.3.3 就诊单位:指在就诊日期就诊的医疗卫生机构名称。
3.3.4 主要临床经过 *:按时间顺序描述反应的发生经过,包括临床症状、体征、实验室检查(如血液、尿液、粪便、脑脊液等)结果、辅助检查(如X线、心电图、超声波、CT等)结果、初步临床诊断以及反应的治疗手段和效果等情况。
发热(腋温℃)*:选填1-37.1-37.5 2-37.6-38.5 3-≥38.6 4-无。
局部红肿(直径cm)*:选填1-≤2.5 2-2.6-5.0 3->5.0 4-无。
局部硬结(直径cm)*:选填1-≤2.5 2-2.6-5.0 3->5.0 4-无。
3.3.5 初步临床诊断:填写最主要的临床诊断名称。
3.3.6 是否住院 *:选填1-是 2-否。
如是,医院名称:填写住院医院名称。
病历号:填写住院医院的病历号。
住院日期:按“年月日”格式填写。
出院日期:按“年月日”格式填写。
3.3.7 病人转归 *:选填1-治愈 2-好转 3-后遗症 4-死亡 5-不详。
如死亡,死亡日期:按“年月日”格式填写。
是否进行尸体解剖:指是否对尸体进行病理解剖,选填1-是 2-否。
尸体解剖结论:按尸体解剖诊断书上的死因诊断结论填写。
3.4 报告及结论3.4.1 初步分类 *:选项1-一般反应 2-待定(其它)。
3.4.2 反应获得方式:AEFI是通过被动监测(或称常规监测)报告方式还是主动监测(即接种人员主动随访)报告方式获得,选填1-被动监测报告 2-主动监测报告。
3.4.3 报告日期 *:反应最早上报的日期,按“年月日”格式填写。
3.4.4 报告单位 *:填写反应报告的责任报告单位名称,如“某某医院”等。
3.4.5 报告人:XXX应报告人的真实姓名。
3.4.6 联系电话:填写报告单位的联系电话。
4 个案报告调查相关工作及要求疫苗生产企业应当配合药品监督管理部门、卫生行政部门、药品不良反应监测机构和疾病预防控制机构对死亡、严重残疾和对社会有重大影响的AEFI进行调查,并向调查人员提供所需要的疫苗相关信息。
同时迅速开展自查,必要时报企业所在地的省级药品监督管理部门。
附表1疑似预防接种异常反应(AEFI)个案报告卡(样表).群体性疑似预防接种异常反应报告1 定义群体性AEFI:是指短时间内同一接种单位的受种者中,发生的2例及以上相同或类似临床症状的严重疑似预防接种异常反应;或短时间内同一接种单位的同种疫苗受种者中,发生相同或类似临床症状的非严重疑似预防接种异常反应明显增多。
2 报告程序、时限群体性AEFI报告实行属地化管理。
疫苗生产企业应当在发现群体性AEFI后2小时内填写《群体性疑似预防接种异常反应登记表》,以电话等最快方式向受种者所在地的县级疾病预防控制机构报告,并同时将有关情况向企业所在地的省级药品监督管理部门报告。
