合工大高鸿宾有机化学第四版课件13章___羧酸衍生物
有机化学(第四版)习题解答

高鸿宾(主编)有机化学(第四版)习题解答化学科学学院罗尧晶编写高鸿宾主编《有机化学》(第四版)作业与练习第二章饱和烃:烷烃和环烷烃练习(P60—62):(一的1,3,5,7,9,11小题)、(五)、(六)、(十三)第三章不饱和烃:烯烃和炔烃作业:(P112—117):(二)、(四)、(七)、(十一)、(十五的2,3小题)、(十六的2~5小题)、(二十一)第四章二烯烃共轭体系练习:(P147—149):(三)、(十)、(十一)、(十三)第五章芳烃芳香性作业:(P198—202):(二)、(三)、(九)、(十)、(十六)、(十七)、(十八的2、5~10小题)、(二十四)第六章立体化学练习:(P229—230):(五)、(六)、(七)、(十二)第七章卤代烃作业:(P263);(P290-295):(P263):(习题7.17)、(习题7.18)、(习题7.19)。
(P290-295):(六)、(七)、(八)、(十的1、2、5小题)、(十三的1、2小题)、(十四的1、2小题)第九章醇和酚作业:(P360—362):(二)、(三的2、4小题)、(五)、(九的1、3小题)第十一章醛、酮和醌作业:(P419—421):(一)、(三)、(七题的1—9小题)、(十三)、(十四)第十二章羧酸练习:(P443—444):(一)、(三)、(五)、(七)第十三章羧酸衍生物练习:(P461—464):(一)、(四)、(六)、(七)(八题的1、3小题)、第十四章β-二羰基化合物作业:(P478—480):(一)、(五)、(七)第十五章有机含氮化合物作业:(P526—530):(三)、(四)、(八)、(十一)第二章 烷烃和环烷烃 习题解答(一)题答案:(1) 3-甲基-3-乙基庚烷 (2)2,3 -二甲基-3-乙基戊烷 (3)2,5-二甲基-3,4 -二乙基己烷 (4)1,1-二甲基-4-异丙基环癸烷 (5)乙基环丙烷 (6)2-环丙基丁烷 (7)1,5-二甲基-8-异丙基二环[4.4.0]癸烷(8)2-甲基螺[3.5]壬烷 (9)5-异丁基螺[2.4]庚烷 (10)新戊基 (11)2′-甲基环丙基 (12)1′-甲基正戊基(四)题答案:(1)的透视式: (2)的透视式: (3)的透视式:Cl HCH 3H 3C ClHCH 3CH 3ClHHCH 3Cl ClCH 3H H(4)的投影式: (5)的投影式:BrBr CH 3HH H 3CBrBr CH 3CH 3HH(五)题解答:都是CH 3-CFCl 2的三种不同构象式; 对应的投影式依次分别如下:ClClClClClClFFFHH H H H H H H ( )( )( )123验证如下:把投影式(1)的甲基固定原有构象位置不变,将C-C 键按顺时针方向分别旋转前面第一碳0°、60°、120°、180°、240°得相应投影式如下:ClCl ClClClClClCl ClFF FF F H HH H H HHH H H H H HH H ( )( )( )( )( )ab c de各投影式对应的能量曲线位置如下:由于(a )、(c )、(e )则为(1)、(2)、(3)的构象,而从能量曲线上,其对应能量位置是一样的,所以前面三个透视式只是CH 3-CFCl 2的三种不同构象式。
高鸿宾《有机化学》(第4版)课后习题-羧酸(圣才出品)
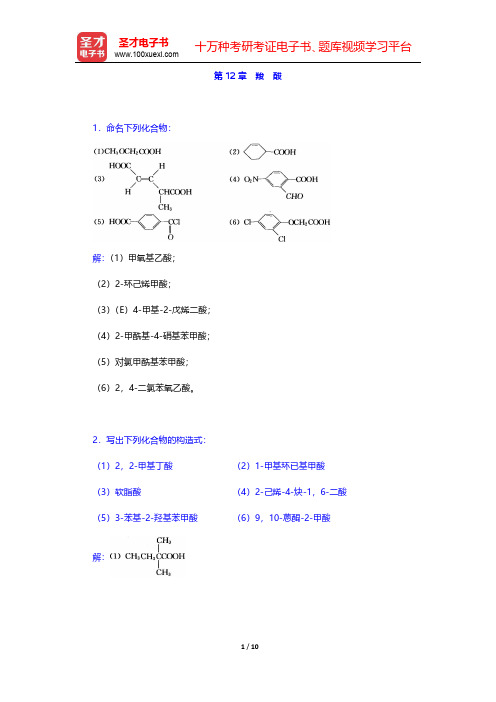
第12章羧酸
1.命名下列化合物:
解:(1)甲氧基乙酸;
(2)2-环己烯甲酸;
(3)(E)4-甲基-2-戊烯二酸;
(4)2-甲酰基-4-硝基苯甲酸;
(5)对氯甲酰基苯甲酸;
(6)2,4-二氯苯氧乙酸。
2.写出下列化合物的构造式:
(1)2,2-甲基丁酸(2)1-甲基环已基甲酸(3)软脂酸(4)2-己烯-4-炔-1,6-二酸(5)3-苯基-2-羟基苯甲酸(6)9,10-蒽醌-2-甲酸
解:
3.试比较下列化合物的酸性大小:
(1)(A)乙醇,(B)乙酸,(C)丙二酸,(D)乙二酸
(2)(A)三氯乙酸,(B)氯乙酸,(C)乙酸,(D)羟基乙酸
解:对于脂肪族羧酸与吸电子基团相连时—COOH酸性增强,与给电子基团相连时,酸性减弱。
(1)酸性:
(2)酸性:
4.用化学方法区别下列化合物:
(1)(A)乙酸,(B)乙醇,(C)乙醛,(D)乙醚,(E)溴乙烷
(2)(A)甲酸,(B)草酸,(C)丙二酸,(D)丁二酸,(E)反丁烯二酸
解:
5.完成下列反应式:
解:
6.试写出在少量硫酸存在下,5-羟基己酸发生分子内酯化反应的机理。
解:
7.完成下列转化:
解:
(3)方法一:
方法二:
(7)方法一:
8.用反应式表示如何把丙酸转变为下列化合物:(1)丁酸;(2)乙酸;(3)2-甲基-3-羟基戊酸乙酯
解:
(2)方法一:
方法二:。
8《有机化学》(第四版)高鸿宾_华南理工大学课件(共十四章)

δ δC H 面外(SP ) δN O
3
( C H 面外 SP 2、 ) SP
同碳多甲基结构有双尖峰, 吸收峰强度加强。
低频指纹区反映化合物的微小差异变化 十分灵敏。 例如:
δCH3 δ CH(CH )
3
1380cm-1处为单峰(m)
电磁波照射频率/Hz 60 200 300
B0
图8.12 核磁共振谱示意图
NMR谱图给出的结构信息: 化学位移——说明氢周围电子状况。 自旋裂分——则峰的分裂,说明相邻氢的个数. 偶合常数——自旋裂分所产生谱线的间距。 峰面积(积分线)—— 说明相同化学环境的氢 的个数的。
图8.13 乙醇的1H–NMR谱和它的三种不同质子积分曲线
8.2.2 有机化合物基团的特征频率 相同的基团或价键在特定的位置区域出 现相同的吸收峰 ——基团的特征吸收峰(特 征峰)。 影响化学键振动频率的因素: ▲ 成键原子质量越小,其化学键的振动频率 越高。 化学键 伸缩振动频率范围/cm-1
C―H 2850~2950 O―H 3200~3600 N―H 3350~3500 比C―C、C―N、C―O键的1600-1300cm-1频率高。
T/%
高频区
指纹区
图8.3 正辛烷的红外光谱图
T/%
图8.4 2–甲基庚烷的红外光谱图
表8.2 常见有机化合物基团的伸缩振动特征频率
化学键类型 频率cm-1
化学键类型
频率cm-1
单键
O H(醇、酚) O H(羧酸) N H C H C H C H C O 3200~3600 2500~3600 3350~3500 3310~3320 3000~3100 2850~2950 1025~1200
有机化学(第四版)全套课件(新)

酚的命名、结构和性质
命名
01
酚的命名与醇相似,通常以羟基所连的芳环作为母体,再加上
羟基的位置和数目来命名,如苯酚、甲酚等。
结构
02
酚的分子结构中含有羟基直接连在芳环上的结构。根据羟基的
数目和位置,可分为一元酚、二元酚等。
性质
03
酚具有弱酸性,能与碱反应生成盐。此外,酚还能发生氧化、
取代、缩合等反应。
• 溶剂效应:溶剂对亲核取代反应也有影响。极性溶剂有利于SN2反应的进行, 而非极性溶剂有利于SN1反应的进行。此外,溶剂的粘度、极性等性质也会影 响反应的速率和选择性。
• 温度和催化剂:温度对亲核取代反应的速率也有影响。一般来说,升高温度有 利于反应的进行。有些卤代烃的亲核取代反应需要催化剂的参与,如路易斯酸 等,它们可以降低反应的活化能,从而加快反应速率。
芳香烃存在同分异构现象,即分子式相同但结构不同的化合物。例如,二甲苯有三 种同分异构体:邻二甲苯、间二甲苯和对二甲苯。
芳香烃的性质
芳香烃的物理性质与其结构密切 相关,如熔点、沸点、溶解度等
。
芳香烃的化学性质主要表现为亲 电取代反应,如硝化、磺化、卤 化等。此外,还可以发生加成反
应和氧化反应等。
不同结构的芳香烃具有不同的化 学性质。例如,苯环上带有给电 子基团的芳香烃更容易发生亲电
苯分子中的碳原子采取sp2杂化,形成一个平面六 边形结构,每个碳原子与相邻的两个碳原子和一 个氢原子形成σ键。
苯具有一些特殊的化学性质,如亲电取代反应、 加成反应和氧化反应等。
芳香烃的命名和同分异构现象
芳香烃的命名通常以苯环为母体,侧链作为取代基进行命名。
当苯环上有多个取代基时,需要遵循一定的命名原则,如编号最小原则、优先顺序 原则等。
高鸿宾《有机化学》(第四版)复习提纲-48...2021年有机化学

有机化学复习提纲教材:高鸿宾主编《有机化学》(第四版)化学与化工学院李秀华编稿第一章绪论1、有机化合物的定义。
2、碳原子的SP、SP2、SP3杂化轨道的杂化原理和共价键的构成方式。
3、诱导效应的概念。
4、酸碱的概念。
第二章饱和烃:烷烃和环烷烃1、烷烃、脂环烃的命名。
2、环烷烃的环结构与稳定性的关系。
3、烷烃的卤代反应历程(自由基型取代反应历程)。
4、烷烃的卤代反应取向与自由基的稳定性。
5、脂环烃的取代反应。
6、脂环烃的环的大小与开环加成活性关系。
7、取代环丙烷的开环加成规律。
第三章不饱和烃:烯烃和炔烃1、碳-碳双键、碳-碳三键的组成。
2、π键的特性。
3、烯烃、炔烃的命名;烯烃的Z,E-命名法,4、烯烃、炔烃的加氢催化原理及其烯烃、炔烃的加氢反应活性比较。
5、炔烃的部份加氢——注意区分顺位部分加氢和反位部分加氢的条件或试剂。
6、何谓亲电加成?(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高,亲电加成活性越大)7、烯烃、炔烃可以与哪些试剂进行亲电加成,这些加成有哪些应用。
8、亲电加成反应规律(MalKovniKov规律)。
9、烯烃、炔烃与HBr的过氧化物效应加成及其规律。
(惟一只有溴化氢才能与烯烃、炔烃存在过氧化物效应,其它卤化氢不存在过氧化物效应。
)10、烯烃亲电加成与炔烃亲电加成活性的比较。
11、不同结构的烯烃亲电加成活性的比较——不饱和碳上电子密度越高的烯烃或越容易生成稳定碳正离子的烯烃,亲电加成反应的活性越大。
12、碳正离子的结构和碳正离子的稳定性之间的关系——正电荷越分散,碳正离子就越稳定。
13、碳-碳双键的α-碳上有支链的烯烃与卤化氢加成时的重排反应。
(P88)14、烯烃与次卤酸加成及加成规律。
炔烃与水加成及重排产物。
15、烃炔与HCN的亲核加成规律及其应用。
16、烯烃的环氧化反应。
17、烯烃α-氢的氯代和溴代反应。
(烯烃α-氢的卤代与双键加成反应条件不同)18、金属炔化物的生成及其在增长碳链上的应用。
3(上)《有机化学》(第四版)高鸿宾,华南理工大学课件(共十四章)

炔烃: 炔烃:
X Y+ C C C X
X C Y C X
Y C Y
加成反应—— 试剂的两部分分别加到重键 加成反应 两端的碳原子上的反应。 两端的碳原子上的反应。
3.5.1 加氢
烯烃和炔烃在催化剂存在下, 烯烃和炔烃在催化剂存在下,与氢气 进行加成反应,生成烷烃: 进行加成反应,生成烷烃:
CH3 CH CH2
CH3CH2C CCH3
(CH3)2CHC CH
(CH3)2C CH2
甲基乙烯 甲基乙烯 甲基乙基乙炔 甲基乙基乙炔
异丙基乙炔 异丙基乙炔 不对称二甲基乙烯 不对称二甲基乙烯 二甲基
对称甲基乙基 甲基乙基乙烯 CH3CH CHCH2CH3 对称甲基乙基乙烯
(2) 系统命名法
• 确定母体 选择含碳碳重键在内 含碳碳重键在内的连续最长碳链作为母 选择含碳碳重键在内的连续最长碳链作为母 根据其碳原子的个数称“某烯” 某炔” 体,根据其碳原子的个数称“某烯”或“某炔”。 • 编号 使碳碳重键的编号最小 编号最小; 使碳碳重键的编号最小; • 写出取代基的位次、数目、名称 写出取代基的位次、数目、 • 当碳原子数超过 时,称“某碳烯”或“某碳炔” 当碳原子数超过10时 某碳烯” 某碳炔”
不饱和烃: 第三章 不饱和烃:烯烃和炔烃
(2) Z,E–标记法 标记法 3.3.4 烯炔的命名 3.4 烯烃和炔烃的物理性质 3.5 烯烃和炔烃的化学性质 3.5.1 加氢 3.5.2 亲电加成 (1) 与卤素的加成 (2) 与卤化氢加成 Markovnikov 规则 (3) 与硫酸加成 (4) 与次卤酸加成 (5) 与水加成 (6) 硼氢化反应 (7) 羟汞化 脱汞反应 羟汞化–脱汞反应
13《有机化学》(第四版)高鸿宾,华南理工大学课件(共十四章)

N
O C
Cl
苯甲酰氯
O 2 (CH3CO)2O + HO
O OH OH O O + CH3COCCH3
OH
O CH3C O + 2 CH3COOH
O
O O CCH3
吡啶
OH + CH3COO OCCH3
水杨酸
阿司匹林
O
酯
醇
O
酯
酯交换反应
H+, 94%
CH2 CH C
OCH3 + CH3CH2CH2CH2OH
本章小结: 1、羧酸衍生物的命名──酰卤和酰胺以所含酰基 结构命名;酸酐、酯是根据来源的酸和醇命 名。 2、羧酸衍生物酰基上的亲核取代反应活性由快到 慢是: 水解 > 醇解 > 氨解 酰卤 > 酸酐 > 酯 > 酰胺 3、酰胺与Br2 / NaOH(或NaOBr)作用发生 Hofmann降解反应,用于合成伯胺。
第十三章 羧酸衍生物(待改写)
13.1 羧酸衍生物的命名 13.2 羧酸衍生物的物理性质 13.3 羧酸衍生物的波谱性质 13.4 羧酸衍生物的化学性质 13.4.1 酰基上的亲核取代反应 (1)水解 (2) 醇解 (3) 氨解 13.4.2 酰基上的亲核取代反应机理 13.4.3 羧酸衍生物的相对反应活性
CH3(CH2)7CH CH(CH2)7COOC2H5
Na,C 2H5OH 50%
油酸乙酯
CH3(CH2)7CH CH(CH2)7CH2OH
油醇
工业上制备不饱和醇的唯一途径 (3) Rosenmund 还原 酰氯 H2 催化剂:Pd–BaSO4 醛
COCl
H2,Pd-BaSO4, 150℃,79% -S N
有机化学_高鸿宾_第四版_答案__第十三章__羧酸衍生物
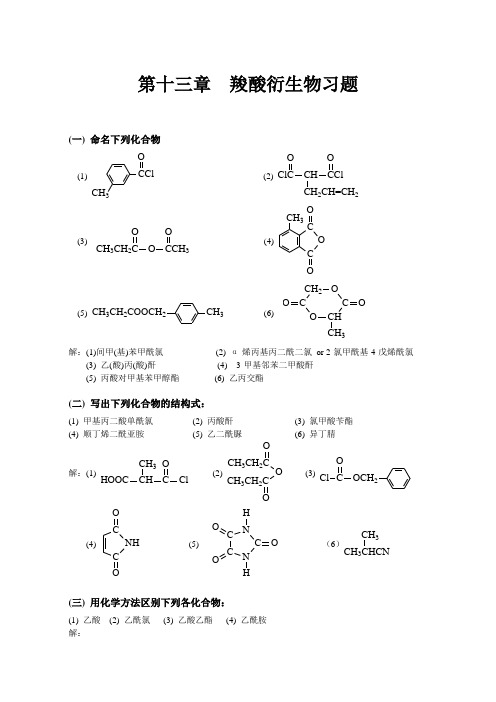
第十三章 羧酸衍生物习题(一) 命名下列化合物(1)CH 3O(2) CH 2CH=CH 2O O(3)CH 3CH 2O 3O O(4)C O C CH 3O O(5) CH 3CH 3CH 2COOCH 2(6) O CHC O CH 2C OO CH 3解:(1)间甲(基)苯甲酰氯 (2) α-烯丙基丙二酰二氯 or 2-氯甲酰基-4-戊烯酰氯(3) 乙(酸)丙(酸)酐 (4) 3-甲基邻苯二甲酸酐 (5) 丙酸对甲基苯甲醇酯 (6) 乙丙交酯(二) 写出下列化合物的结构式:(1) 甲基丙二酸单酰氯 (2) 丙酸酐 (3) 氯甲酸苄酯 (4) 顺丁烯二酰亚胺 (5) 乙二酰脲 (6) 异丁腈解:(1)HOOC ClCH 3O(2)CH 3CH 2CCH 3CH 2O O(3)Cl C OOCH 2(4)C NH O O(5)C N O OOHH(6)CH 3CH 3(三) 用化学方法区别下列各化合物:(1) 乙酸 (2) 乙酰氯 (3) 乙酸乙酯 (4) 乙酰胺 解:x xxxCH 3COOH CH 3COClCH 3COOC2H 5CH 3CONH 2溶解溶解分层乙酰氯乙酸乙酯乙酸乙酰胺产生NH 红色石蕊试纸(四) 完成下列反应:解:红色括号中为各小题所要求填充的内容。
(1)C CO ONH+COOHC ON 4(2) H 2OCH 2OHCH 2N(2) HOCH 2CH 2CH 2COOH25∆OOHOCH 2CH 2CH2CH 2OH(3)CH 2=C COOHCH 3323CH 2=C COClCH 3CH 2=C COOCH 2CF 3CH 3(4)C Cl O+ (CH 3)2CuLi-78 Co纯醚C CH 3O(5) I(CH 2)10C ClO+ (CH 3)2CuLi-78 Co纯醚I(CH 2)10C CH 3O(6) C 2H 5O C (CH 2)8C Cl OO(CH 3CH 2)2Cd C 2H 5O C(CH 2)8C C 2H 5OO∆苯+(7)C NH CO O22COOHNH 2(8)COOH CHOCOClH , Pd-BaSO 3(五) 完成下列转变:(1) CH 3COOHClCH 2COCl(2)C NBr COO(3)3COOHO (4)OO C C OO(5)CH 3CH=CH 2CH 3CHCONH 2CH 3(6)OCH 2CH 3CH 2CONH 2解:(1) CH 3COOH ClCH 2COCl 2PClCH2COOH23(2)C C OOC NBr C OH 2NiC OCOO C NH C OO3(1) NaOH2225(3)323OH24。
《有机化学》(第四版)高鸿宾,华南理ご笱Э渭共十62页PPT

36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
Thank you
39、没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿
9《有机化学》(第四版)高鸿宾_华南理工大学课件(共十四章)
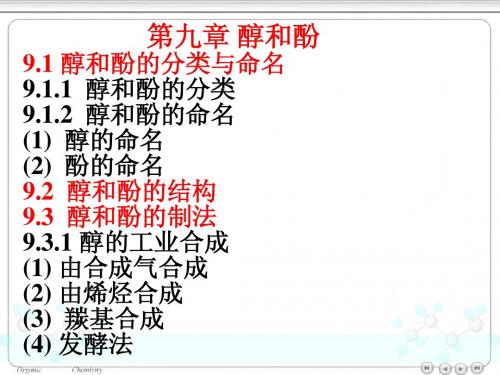
(3) 羰基合成
钴催化剂 CH3CH CH2 + CO + H2 130~175℃ ~25 MPa
CH3CH2CH2CHO + CH3CHCHO
CH3
H2, Ni 或 Cu △,~5 MPa
CH3CH2CH2CH2OH + CH3CHCH2OH CH3
(4) 发酵法 乙醇的制备: 淀粉
淀粉酶
麦芽糖 麦芽糖酶 葡萄糖
OH OH HO OH OH
叔醇
酚:按分子中所含羟基的数目分类:
OH
一元酚
二元酚
三元酚
9.1.2 醇和酚的命名
(1) 醇的命名 (a) 普通命名法:——用于简单的醇。 烃基的名称 + ―醇”
CH3 CH3 CHCH2OH
CH2 CHCH2 OH
CH2OH
异丁醇
烯丙醇
苯甲醇 苄醇
CH2=CHCH2OH
R2SO4 + H2O 2 ROH + H2SO4 △ O O + H ROH + R-C-OH △ R-C-OR + H2O
ROH + CH3 ( TsCl)
δ+
SO2Cl
N
△
O RO-S CH3 + O ( ROTs)
N
. HCl
ROO2S
二甲亚砜
CH3 KCN RCN + CH3 SO3K ( TsK) NaBr RBr + TsONa
弱酸 H2CO3 PKa值 6. 38
9. 89 15.5
弱酸
PKa值
15 .74 15.9 18.0 25.0
OH CH3OH
H2O CH3CH2OH (CH3)3COH HC≡CH
醇和酚的相对酸性: 碳酸>苯酚>水>乙醇
高鸿宾《有机化学》教材精讲及典型真题解析考研考点讲义

碳原子 sp2、sp杂化轨道及乙烯乙炔的空间结构 — 1—
sp2sp杂化轨道 乙烯、乙炔分子模型
3.有机化学反应
有机化合物的性质通过有机化学反应来体现,并取决于有机物结构中的特殊官能团
4.有机化学反应类型
有机化学反应分为自由基型取代和加成,离子型亲电取代、加成和亲核 取代与加成,氧化与还原, 降解,重排,缩合,消去反应,周环反应等
③把双键碳或参键碳看成以单键和多个原子相连。
例如:—C≡N> —C≡CH> —CHCH2 (5)写出全称,用 1,2,3…表示取代基的位次,用一、二、三……表示取代基的个数,用“,”将阿拉
伯数字隔开,用半字线“-”将阿拉伯数字与汉字隔开。
師 師
例:Cl師 帪SO3H
Br
CH3CHCHCH2OH CH3 OH
H
(CH2)3CH3
CC
CH3CH2
H
2.烯炔的亲电加成概论
(1)环正离子中间体机理(反式加成)适用于加溴、氯、次卤酸 (2)碳正离子中间体机理(反式或顺式加成) (3)烯烃亲电加成试剂:X2,HX,H2SO4,HOX,BH3/H2O2,H2O, Hg2 +/H2SO4 重点在于分清试剂中的正电部分和负电部分。产物分布符合马氏规则。注意加成过程中的碳正 离子重排对产物结构的判断。 烯烃亲电加成(立体化学)
3.小环烷烃的开环反应
环烷烃活性分析:小环不稳定易开环,中环稳定,大环较稳定,性质与链烃同。
开环反应为离子型反应机理。
环丙烷与 H2,Br2,HBr,HI,H2SO4等开环反应。 环丁烷只与 H2,Br2开环, 环戊烷在较高温度下加氢开环。
多环物质注意开环位置
H3CCHCH2 +HBr→ CH3CHCH2CH2
高鸿宾第四版有机化学13章答案
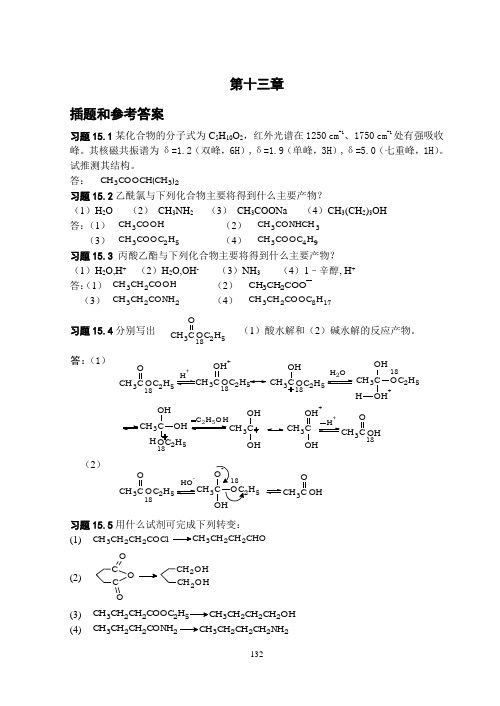
第十三章插题和参考答案习题15.1某化合物的分子式为C 5H 10O 2,红外光谱在1250 cm -1、1750 cm -1处有强吸收峰。
其核磁共振谱为δ=1.2(双峰,6H ),δ=1.9(单峰,3H ),δ=5.0(七重峰,1H )。
试推测其结构。
答: CH 3COOCH(CH 3)2习题15.2乙酰氯与下列化合物主要将得到什么主要产物?(1)H 2O (2) CH 3NH 2 (3) CH 3COONa (4)CH 3(CH 2)3OH 答:(1) CH 3COOH (2) CH 3CONHCH 3 (3) CH 3COOC 2H 5 (4) CH 3COOC 4H 9习题15.3 丙酸乙酯与下列化合物主要将得到什么主要产物? (1)H 2O,H + (2)H 2O,OH - (3)NH 3 (4)1–辛醇, H + 答:(1) CH 3CH 2COOH (2) CH 3CH 2COO (3) CH 3CH 2CONH 2 (4) CH 3CH 2COOC 8H 17习题15.4分别写出 CH 3C OOC 2H 518(1)酸水解和(2)碱水解的反应产物。
答:(1)CH 3C O OC 2H 51818H+25OC 2H 5CH 3C OH OH+H18OH3COH 2H 5H CH 3COH OHCH 3COH +OHH+3C O OH183C OH +OC 2H 518CH C OH OC 2H 5OH 2(2)CH 3C O OC 2H 518OH -H 53COH3C O OH习题15.5用什么试剂可完成下列转变:(1) CH 3CH 2CH 2COCl 3CH 2CH 2CHO(2)C OC OOCH 2OH CH 2OH(3) CH 3CH 2CH 2COOC 2H 53CH 2CH 2CH 2OH(4) CH 3CH 2CH 2CONH 23CH 2CH 2CH 2NH 2答:(1) Rosenmund 还原 (2) LiAlH 4 (3) Na-C 2H 5OH (4) LiAlH 4习题15.6 用反应式表示如何从丙酸甲酯制备下列各醇:(1)2–甲基–2–丁醇 (2)3–乙基–3–戊醇 答:(1) H 2O,H+3CH 3C CH 2CH 3CH 3OHCH 3CH 2COOCH 3(2)H 2O,H+25C 2H 5C CH 2CH 3C 2H 5OHCH 3CH 2COOCH 3习题15.7用怎样的Grignard 试剂与羧酸酯合成3–戊醇?用反应式写出合成过程。
有机化学_高鸿宾_第四版_答案(第十一章至第二十章全)

第十一章 醛、酮和醌(一) 写出丙醛与下列各试剂反应时生成产物的构造式。
(1) NaBH 4,NaOH 水溶液 (2) C 2H 5MgBr ,然后加H 2O (3) LiAlH 4 , 然后加H 2O (4) NaHSO 3 (5) NaHSO 3 , 然后加NaCN (6) OH - , H 2O(7) OH - , H 2O , 然后加热 (8) HOCH 2CH 2OH , H + (9) Ag(NH 3)2OH(10) NH 2OH解:(1)、CH 3CH 2CH 2OH (2)、CH 3CH 2C 2H 5OH(3)、CH 3CH 2CH 2OH(4)、CH 3CH 2CHSO 3NaOH(5)、CH 3CH 2CHCN OH(6)、CH 3CH 2CHCHCHO 3OH(7)、CH 3CH 2CH=CCHOCH 3(8)、OCH 3CH 2C OH(9)、CH 3CH 2COO - + Ag(10)、CH 3CH 2CH=NOH(二) 写出苯甲醛与上题各试剂反应时生成产物的构造式,若不反应请注明。
(1)、C 6H 5CH 2OH (2)、C 6H 5C 2H 5OH(3)、C 6H 5CH 2OH(4)、C 6H 53Na OH (5)、C 6H 5OH(6)、不反应 (7)、不反应(8)、OC OC 6H 5H(9)、C 6H 5COO - (10)、C 6H 5C=NOH(三) 将下列各组化合物按其羰基的活性排列成序。
(1)CH 3CH O,CH 3CCHO O, CH 3CCH 2CH 3O,(CH 3)3CCC(CH 3)3O(2)CH 33OC 2H 53O ,解:(1)CH 3CHOCH 3O CH 32CH 3O(CH 3)33)3O(2)CH33O C 2H 53O(四) 怎样区别下列各组化合物?(1)环己烯,环己酮,环己烯 (2) 2-己醇,3-己醇,环己酮(3)CHO3CH 2CHO COCH 3OH3CH 2OH,,,,解:(1)OOH析出白色结晶褪色不褪色xx(2)CH 32)3CH 3OHCH 3CH 22)2CH 3OHO2,4-二硝基苯腙(黄色结晶)xxxCHI 3 (黄色结晶)(3) p-CH 3C 6H 4CHO C 6H 5CH 2CHOC 6H 5COCH3C 6H 5CH 2OHp-CH 3C 6H 4OH323Ag 镜Ag 镜x xxCu 2O (砖红)xx 显色xCHI 3(黄)(五) 化合物(A)的分子式C 5H 120,有旋光性,当它有碱性KMnO 4剧烈氧化时变成没有旋光性的C 5H 10O(B)。
《有机化学》课件第13章 羧酸及其衍生物

羧酸的命名
CH3(C2H )14COOH
十六酸(软脂酸) Palmitic acid(棕榈酸)
CH3(C2H )16COOH
十八酸(硬脂酸) Stearic acid
CH3
O
CH3CHCH2CH2COH
4-甲基戊酸 (4-Methylpentanoic acid)
O CH3CH2COH
丙酸 (Propanoic acid)
伯胺
Gabriel Reaction
54
己内酰胺-贝克曼重排
Beckmann Rearrangement
55
O CH3 H C N CH3
N,N-二甲基甲酰胺
32
羧酸衍生物-命名
O
OO
CH3 C OCH2CH3 乙酸乙酯 O
CH3OCCH2COCH3 丙二酸二甲酯
O C CH3 COOH
O CH2 CH C O
乙酰水杨酸(Aspirin)
丙稀酸环己酯
33
羧 酸 衍 生 物 的 沸 点
34
羧 酸 衍 生 物 沸 点 差 异 的 解 释
苯甲酰溴
O Cl S Cl
亚硫酰氯
O S Cl O
苯磺酰氯
30
羧酸衍生物-命名
OO
OO
CH3 C O C CH3
乙酸酐
O
CH3 C O C H 甲乙酸酐
O
O
O
OPOPO
O
邻苯二甲酸酐
五氧化二磷 (P2O5)
31
羧酸衍生物-命名
O CH3 C NH2
乙酰胺
O C NH2
苯甲酰胺
O
NH
O
邻苯二甲酰亚胺
《有机化学》(第四版)高鸿宾,华南理工大学课件

CH3 CH3 CH2 C CH CH3
CH3 CH3
二甲基乙基异丙基甲烷
(3) 系统命名法
International Union of Pure and Applied Chemistry,缩写作IUPAC
系统命名是由三部分构成:
取代基
的
母体
位次与名称
化合物 的
名称
碳原子的个数
直链烷烃的命名与普通命名法相同。
1
2
3
4 CH2CH2CH3
CH3 CH2 CH2 CH C5H C6H2 C7H2 C8H2 C9 H3
CH CH3
CH3
4-isopropyl-5-propylnonane
(5–丙基–4 –异丙基壬烷)
• 当两个或更多的相同取代基出现时,使用 前缀di-, tri-, tetra-等:
CH3
CH3
98
CH3CH2
CH3 CH2CH3
CH3
CH
7
C6 H2
C5 H2
CH CH
43
C2H2C1H3
(I)
1
2
CH3CH2
CH3 CH2CH3
CH3 C3 H
C4 H2
C5 H2
CH CH
67
C8 H2C9 H3
( II )
(c) 确定化合物的名称 • 将取代基的名称写在母体名称的前面,在
取代基名称的前面加上它的位次号,并用 半个汉字长的横线“–”将两者连接。 • 当含有几个不同的取代基时,按照“次序 规则”,将“优先”的基团列在后面,各取 代基 之间用半个汉字长的横线“–”连接。
上“环”字,称“环某烷”。环上有支链时,支 链作为取代基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酰基是 吸电子基
R-C
p- 共 轭 的 强 度 : -Cl <
第三周 期元素
<
-O-R' <
烃基是 斥电子基
-NH2
电负性:
O > N
即酰氯的羰基碳最正。∴活性:酰氯>酸酐>酯>酰胺
酰基化试剂的相对活性
② L-愈易离去,越有利于第二步反应(消除反应) 酸性:HCl > RCOOH > ROH > NH3 pKa:~2.2 4~5 16~19 34 离去能力:Cl->-OCOR>-OR’ >-NH2
R-C-R' R'
热水中进行
加热 催化剂, + H orOH 催化, 高温下长时间回流
难!
酰基上的亲核取代
O O
H 2O , N a 2C O 3
例:
(C 6 H 5 ) 2 C H C H 2 C 3 ,3 -二 苯 基 丙 酰 氯
Cl
0 C , 95%
o
(C 6 H 5 ) 2 C H C H 2 C
OH
3 ,3 -二 苯 基 丙 酸
羧酸衍生物
酰氯、酸酐:分子间无氢键作用,挥发性强,有刺鼻气味的液体。 沸点随着相对分子质量↑而↑。遇水水解。 酯:酯不溶于水。低级酯是有酯香味的液体。高级脂肪酸的高级 脂肪醇酯为固体,俗称“蜡”。
酰胺:分子间氢键作用强,一般为固体,但DMF或DEF为液体,是 常用的非质子性溶剂。低级酰胺可溶于水,随着分子量↑,水溶 解度↓。
羧酸衍生物
羧酸衍生物的化学性质
13.4 羧酸衍生物的化学性质
13.4.1 酰基上的亲核取代 (1) 水解
O R-C-Cl O (R-C)2O HCl RCOOH + H2O RCOOH +
ôô á
O R-C-OR' O R-C-NH2
O 水解速度: R-C-Cl
剧烈放热
R'OH NH3
O
O
O
2
> (R-C) 2 O > R-C-OR' > R-C-NH
酰基上的亲核取代
小
结
水解、醇解、氨解的结果是在HOH、HOR、HNH2等 分子中引入酰基,因而酰氯、酸酐是常用的酰基化试剂。 酯的酰化能力较弱,酰胺的酰化能力最弱,一般不用作酰 基化试剂。
羧酸衍生物的化学性质 13.4.2 酰基上的亲核取代反应机理 该反应历程分两步完成:
(1) R-C sp 2ôô
97%-98%
C C
CONHC COOH
6H 5
H
O ClCH 2 COC 2 H 5 + NH
78%-84%
。
O ClCH 2 C-NH
2
+ C 2 H 5 OH
N-未取代的酰胺与胺反应生成N-取代酰胺。例如:
CH 3 CONH + NH 2 HCl
80%
2
O NH C-CH
3
+ NH 4 Cl
C H 3C O -K + + H 2N
乙酸钾
Br
对溴苯胺
酰基上的亲核取代
(2) 醇解
ô ô ô ô
O R-C-Cl O (R-C)2O + HOR' O R-C-OR' ' O R-C-NH2
O O O
HCl RCOOH RCOOR' +
ô
R'OH ' NH3
O R-C-NH
2
醇解速度:
R-C-Cl
乙酰氯
羧酸衍生物
O C-Cl
苯甲酰氯
O C H 3- C C H 3C H 2- C O O C C
O O O
乙丙(酸)酐
邻苯二甲酸酐
O C H 3- C - O C H 3
乙酸甲酯
C H 2- O N O 2 C H 2O C O C H 3 C H 2O C O C H 3
乙二醇二乙酸酯
CH-ONO2 C H 2- O N O 2
酚酯
C H 3C O
O CH 2 =CH-C-OCH 3 + CH 3 CH 2 CH 2 CH 2 OH
低级醇酯 H + ,94% 酯交换反应
O CH 2 =CH-C-OCH 2 CH 2 CH 2 CH 3 + CH 3 OH
高级醇酯
酰基上的亲核取代
(3) 氨解
O R-C-Cl O (R-C)2O O R-C-OR'
d
+
O L
d
-
+ Nu
-
³ ôôôô
ôO R-C-L Nu
Nuôô±ô°ô ô ô ô -
(2)
O R-C
L
ôô²ô ô
R-C
O
Nu
+ L-
Nu
Lôôôôôôô ¨ ù Nu(ôôôô)ô ³ ô
O -Cl ô -O-CR ô -OR'ô -NH2
ôôô ù é ù ôôô ±ù °ô
成 , 后反 消应 除是 ,分 最步 终完 生成 成的 取: 代先 产亲 物核 。加
13.4.1 酰基上的亲核取代 (1) 水解 (2) 醇解 (3) 氨解
13.4.2 酰基上的亲核取代反应机理
13.4.3 酰基化试剂的相对活性
13.4.4 还原反应 (1) 用氢化铝锂还原
(2) 用金属钠-醇还原 (3) Rosenmund还原
第十三章 13.4 羧酸衍生物的化学性质
13.4.5 与Grignard试剂的反应 (1) Grignard试剂与酯的反应 (2) Grignard试剂与酰氯的反应 13.4.6 酰氨氮原子上的反应 (1) 酰胺的酸碱性 (2) 酰胺脱水 (3) Hofmann降解反应
油酸乙酯
N a , C 2H 5O H 49%-51%
C H 3( C H 2) 7C H = C H ( C H 2) 7C H 2O H
油醇
羧酸衍生物的还原
(3) Rosenmund还原
酰氯经催化氢化还原为伯醇:
O R-C-Cl + H
2
Pd
RCH 2 OH
若采用Rosenmund还原,可使酰氯还原为醛:
丙三醇三硝酸酯 甘油三硝酸酯
O C H 3- C - N H 2
乙酰胺
O H-C-N
CH3 CH3
O C C O NH
O C NH
N,N-二 甲 ( 基 ) 甲 酰 胺
DMF
(D im eth y l F o rm am id e)
邻苯二甲酰亚胺
己内酰胺
第十三章 13.2 羧酸衍生物的物理性质
物态及水溶解性:
腈:偶极矩大,低级腈可溶于水的液体,高级腈不溶于水。
沸点:
酰卤、酸酐、酯、腈的沸点低于羧酸; 伯酰胺的沸点高于羧酸。
第十三章 13.3 羧酸衍生物的波谱性质 IR光谱
羧酸衍生物
例1:丙酸酐的红外光谱。 例2:乙酸乙酯的红外光谱。
NMR谱
例:乙酸乙酯的核磁共振谱。
第十三章
羧酸衍生物
13.4 羧酸衍生物的化学性质
P455 习题13.5。
羧酸衍生物与格氏试剂的反应 13.4.5 与Grignard试剂的反应
(1) Grignard试剂与酯的反应
慢于酮,生成的酮不能存在于体系中:
d-
O
d- d+
O MgX
无水乙醚
O
-MgX(OR")
R-C-OR" + R'MgX
d
+
R-C-OR" R'
R-C-R'
酮 活性高于酯 不能存在于体系中
不需过量! R'MgX 无水乙醚
OMgX R-C-R' R'
H2
O/H+
OH R-C-R' R '( 3 。
醇)
酯与格氏试剂的反应是制备含有两个相同烃基的3°醇的好方法。
羧酸衍生物与格氏试剂的反应
例1:
O C 6 H 5 -C-OC
2H 5
OMgBr + C 6 H 5 MgBr
纯醚,苯 回流
C 6 H 5 -C-OC C 6H 5
O R-C-OR'
Na+C2H5OH
RCH2OH + R'OH
C 2 H 5 OH
¨ ôôôô³ôôô²²ôôôôôôôô²²ôô ô ô¨ á ô¨
例: n-C 11 H 23 COOC 2 H 5 + Na
月桂酸乙酯
n-C 11 H 23 CH 2 OH + C 2 H 5 OH
月桂醇
C H 3( C H 2) 7C H = C H ( C H 2) 7C O O C 2H 5
> (R-C) 2 O > R-C-OR' >
可逆,酯交换 从低级酯制高级酯 (如涤纶的生产)
难!
常用酰基化剂 直接醇解
难,醇需过量
酰基上的亲核取代
例:
O 2 ( C H 3C ) 2O +
常用酰基化试剂
O HO OH
H 2S O 4 93%
O O C C H 3 + 2 C H 3C O O H
H2O (HO-) ô R'OH ô
NH3
羧酸衍生物的化学性质 13.4.2 酰基化试剂的相对活性
水解、醇解、氨解的实验事实证明,羧酸衍生物酰化活性大 小的顺序为:酰氯>酸酐>酯>酰胺。Why?
该反应是亲核加成-消除机理。 ①
d
+
O L
d
