2017年山东大学山大理论化学考试大纲
2017年普通高等学校招生全国统一考试大纲

2017年普通高等学校招生全国统一考试大纲化学Ⅰ. 考核目标与要求化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,将在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。
化学科命题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。
一、对化学学习能力的要求1. 接受、吸收、整合化学信息的能力(1)对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。
(2)通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储。
(3)从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块。
2. 分析和解决化学问题的能力(1)将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题。
(2)将分析和解决问题的过程及成果,能正确地运用化学术语及文字、图表、模型、图形等进行表达,并做出合理解释。
3. 化学实验与探究的能力(1)掌握化学实验的基本方法和技能,并初步实践化学实验的一般过程。
(2)在解决化学问题的过程中,运用化学原理和科学方法,能设计合理方案,初步实践科学探究。
二、对知识内容的要求层次高考化学命题对知识内容的要求分为了解、理解(掌握)、综合应用三个层次,高层次的要求包含低层次的要求。
其含义分别为:了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题。
能“知其然”,还能“知其所以然”。
综合应用:在理解所学各部分化学知识之间的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题。
山东大学2017年教育部全国第四轮学科评估结果
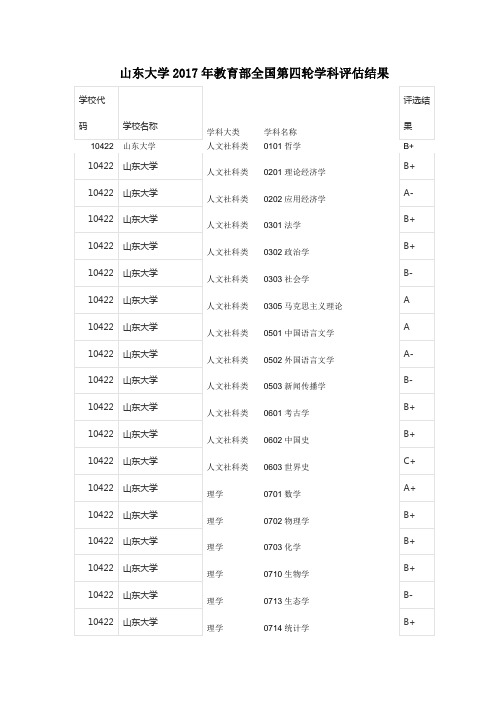
山东大学2017年教育部全国第四轮学科评估结果
学科大类学科名称
人文社科类0101
哲学
人文社科类0201理论经济学
人文社科类0202应用经济学
人文社科类0301法学
人文社科类0302政治学
人文社科类0303社会学
人文社科类0305马克思主义理论人文社科类0501中国语言文学人文社科类0502外国语言文学人文社科类0503新闻传播学
人文社科类0601考古学
人文社科类0602中国史
人文社科类0603世界史
理学0701数学
理学0702物理学
理学0703化学
理学0710生物学
理学0713生态学
理学0714统计学
工学0801力学
工学0802机械工程
工学0803光学工程
工学0805材料科学与工程
工学0807动力工程及工程热物理工学0808电气工程
工学0809电子科学与技术
工学0810信息与通信工程
工学0811控制科学与工程
工学0812计算机科学与技术
工学0814土木工程
工学0815水利工程
工学0817化学工程与技术
工学0830环境科学与工程
工学0831生物医学工程
工学0835软件工程
医学1001基础医学
医学1002临床医学
医学1003口腔医学
医学1004公共卫生与预防医学医学1007药学
医学1011护理学
管理学1201管理科学与工程管理学1202工商管理
管理学1204公共管理。
2016-2017年山东大学硕士研究生考试628理论化学考研大纲-新祥旭考研辅导

628理论化学考试大纲一、考试目的:《理论化学》是2014年化学专业硕士研究生入学统一考试的科目之一。
《理论化学》考试要力求反映化学专业硕士学位的特点,科学、公平、准确、规范地测评考生的专业基础素质和综合能力,以利于选拔具有发展潜力的优秀人才入学,为国家科技发展和经济腾飞培养综合素质高、复合型的化学专业人才。
二、考试要求:考生应掌握本科目的基本概念和基础知识,具备对基本概念与基础知识的理解与综合运用能力。
三、考试形式和试卷结构:《理论化学》试卷满分150分。
其中,物理化学(含结构化学)合计100分为必答,另外50分可选择无机化学(50分)或分析化学(含化学分析及仪器分析)(50分)作答。
答题方式为闭卷、笔试。
答题时允许使用计算器。
四、考试内容:物理化学(含结构化学)(100分)该科目大纲共计十九章,其中第一至第十章考题占75分,第十一至第十九章(结构化学部分)考题占25分。
第一章热力学第一定律1.热力学概论1.1热力学的目的、内容和方法1.2热力学基本概念:体系与环境,体系的性质;热力学平衡态和状态函数2.热力学第一定律2.1热和功2.2热力学能2.3热力学第一定律的表述与数学表达式3.体积功与可逆过程3.1等温过程的体积功3.2可逆过程与最大功4.焓与热容4.1焓的定义4.2焓变与等压热的关系4.3等压热容和等容热容5.热力学第一定律对理想气体的应用5.1理想气体的热力学能和焓5.2理想气体的Cp与Cv之差5.3理想气体的绝热过程6.热力学第一定律对实际气体的应用6.1节流膨胀与焦耳-汤姆逊效应7.热力学第一定律对相变过程的应用8.化学热力学8.1化学反应热效应等压热效应与等容热效应;反应进度;8.2赫斯定律与常温下反应热效应的计算:赫斯定律;标准摩尔生成焓与标准摩尔燃烧焓8.3标准反应焓变与温度的关系—基尔霍夫定律第二章热力学第二定律1.自发过程的共同特征2.热力学第二定律3.卡诺定理3.1卡诺循环3.2卡诺定理4.过程的热温商与熵函数4.1可逆过程的热温商与熵函数的概念4.2不可逆过程的热温商与体系的熵变5.过程方向和限度的判据5.1克劳修斯不等式5.2熵增加原理6.△S的计算6.1简单状态变化过程△S的计算6.2相变过程△S的计算7.热力学第二定律的本质与熵的统计意义7.1热力学第二定律的本质7.2熵和热力学概率—玻兹曼公式8.热力学第三定律与规定熵8.1热力学第三定律8.2规定熵8.3化学反应过程熵变的计算9.亥姆霍兹自由能与吉布斯自由能9.1亥姆霍兹自由能及△A判据9.2吉布斯自由能及△G判据10.过程△G的计算与应用10.1理想气体等温过程△G的计算10.2纯物质相变过程△G的计算11.热力学关系式11.1四个热力学基本关系式11.2对应系数关系式与麦克斯韦关系式第三章化学势1.溶液组成的表示法2.偏摩尔量与化学势2.1偏摩尔量的定义和集合公式2.2化学势的定义及其与温度、压力的关系3.稀溶液中两个经验定律3.1拉乌尔定律3.2亨利定律4.混合气体中各组分的化学势4.1理想气体的化学势4.2非理想气体的化学势5.理想溶液的定义、通性及各组分的化学势5.1理想溶液的定义及各组分的化学势5.2理想溶液的通性6.稀溶液中各组分的化学势7.稀溶液的依数性7.1蒸汽压下降7.2凝固点下降和沸点上升7.3渗透压8.非理想溶液中各组分的化学势与活度的概念第四章化学平衡1.化学反应的等温方程式与标准平衡常数1.1化学反应的等温方程式1.2标准平衡常数2.平衡常数的表达式2.1气相反应的平衡常数的表达式3.复相化学平衡3.1平衡常数的表达式3.2解离压力4.平衡常数的测定与平衡转化率的计算5.标准生成吉布斯自由能5.1标准生成吉布斯自由能5.2反应的标准吉布斯自由能改变的计算6.温度、压力及惰性气体对化学平衡的影响6.1温度对平衡常数影响—标准平衡常数与温度的关系6.2压力对化学平衡的影响6.3惰性气体对化学平衡的影响7.同时平衡与反应的耦合第五章多相平衡1.多相体系平衡的一般条件2.克拉贝龙方程3.相律3.1独立组分数、自由度3.2相律4.单组分体系的相图—水的相图5.二组分体系的相图及其应用5.1双液系:理想和非理想完全互溶双液系;杠杆规则与蒸馏原理;部分互溶和不互溶双液系5.2简单低共溶混合物体系5.3形成化合物体系:稳定化合物;不稳定化合物5.4完全互溶和部分互溶双液系的相图6.三组分体系的相图及其应用6.1等边三角形坐标表示法6.2部分互溶的三液体体系6.3二盐一水体系第六章统计热力学初步(非必考内容)第七章电化学(一)电解质溶液1、离子的迁移(1)电解质溶液的导电机理、法拉第定律(2)离子的迁移和离子迁移数的概念2、电解质溶液的电导(1)电导、电导率和摩尔电导率(2)电导测定的仪器及方法(3)电导率和摩尔电导率随浓度的变化规律(4)离子独立移动定律及离子摩尔电导率3、电导测定的应用(1)求算弱电解质的电离度及电离平衡常数(2)求算微溶盐的溶解度和溶度积(3)电导滴定4、强电解质的活度和活度系数(1)溶液中离子的活度和活度系数、离子平均活度、离子平均活度系数、离子平均质量摩尔浓度(2)离子强度5、强电解质溶液理论(基本了解)(1)离子氛模型及德拜-尤格尔公式(2)不对称离子氛模型及德拜-尤格尔-盎萨格电导公式(二)可逆电池电动势6、可逆电池(1)可逆电池必须具备的条件(2)可逆电极的种类及电极反应(3)电池电动势的测定(方法原理、所用主要仪器)(4)电池表示式(电池组成及结构的书写惯例)(5)电池表示式与电池反应的“互译”7、可逆电池热力学(1)可逆电池电动势与浓度的关系A.能斯特(Nernst)公式及其中各参数的意义B.电池标准电动势的测定和求算(2)电池电动势E及其温度系数与电池反应热力学量的关系(3)离子的热力学量8、电极电势(1)电池电动势产生的机理A.电极–溶液界面电势差B.溶液–溶液界面电势差、盐桥(构成及作用)C.电池电动势的产生(2)电极电势A.标准氢电极(构成及规定)B.任意电极电势数值和符号的确定C.电极电势的能斯特(Nernst)公式D.参比电极(种类及作用)9、由电极电势计算电池电动势(1)单液化学电池(2)双液化学电池(3)单液浓差电池(4)双液浓差电池(5)双联浓差电池10、电极电势及电池电动势的应用(1)判断反应趋势(2)求化学反应的平衡常数(3)求微溶盐活度积(4)求离子平均活度系数(5)pH值的测定(6)电势滴定(三)不可逆电极过程11、电极的极化(1)不可逆电极电势(2)电极极化的原因(浓差极化、活化极化)(3)过电势(概念、测量方法及仪器)12、电解时的电极反应(1)阴极反应(2)阳极反应13、金属的腐蚀与防护(1)金属腐蚀现象及原理(2)金属腐蚀的防护措施14、化学电源(1)化学电源定义及种类(2)常用化学电源(锌锰干电池、铅酸蓄电池等)(3)高能电池(锂离子电池、燃料电池等)第八章表面现象与分散系统(一)表面现象1、表面吉布斯函数、表面张力(物理意义)2、纯液体的表面现象(1)附加压力(2)曲率对蒸气压的影响(3)液体的润湿与铺展(4)毛细管现象3、气体在固体表面上的吸附(1)气固吸附(定义、作用)A.气固吸附的类型(物理吸附与化学吸附的比较)B.吸附平衡与吸附量C.吸附曲线的种类及特征(2)朗格缪尔(Langmuir)单分子层吸附等温式A.朗格缪尔气固吸附理论(基本假设、吸附公式推导及应用)(3)BET多分子层吸附等温式(4)其它吸附等温式4、溶液的表面吸附(1)溶液表面的吸附现象A.正吸附、负吸附B.表面活性剂(定义、结构特征)(2)吉布斯吸附公式(3)表面活性剂的吸附层结构(4)表面膜5、表面活性剂及其作用(1)表面活性剂的分类(2)胶束和临界胶束浓度(3)表面活性剂的作用(作用类型、原理及与表面活性剂结构特征的关系)(二)分散系统6、分散系统的分类7、溶胶的光学及力学性质(1)光学性质–丁达尔效应(现象、应用)(2)力学性质–布朗运动(扩散、沉降与沉降平衡)8、溶胶的电性质(1)电动现象(电泳、电渗)(2)溶胶粒子带电的原因(3)溶胶粒子的双电层(4)溶胶粒子的结构(书写或示意图表达)9、溶胶的聚沉和絮凝(1)外加电解质对溶胶聚沉的影响(2)溶胶的相互聚沉(3)大分子化合物对溶胶稳定性的影响10、溶胶的制备与净化方法11、高分子溶液(简单了解)第九章化学动力学基本原理1、化学动力学概论(1)化学动力学的任务及目的(2)化学动力学发展简史(3)反应机理的概念(总反应、基元反应、简单反应、复合反应、反应分子数的概念以及它们之间的关系)2、反应速率和速率方程(1)反应速率的表示方法(2)反应速率的实验测定(化学法和物理法的原理及优缺点)(3)反应速率的经验表达式(4)反应级数的概念(5)质量作用定律及其适用范围(反应级数与反应分子数的关系)(6)速率常数(其单位与反应级数的关系)3、简单级数反应的动力学规律(1)简单级数反应的定义,简单反应与简单级数反应之间的关系(2)一级反应、二级反应、三级反应、零级反应(对应的速率公式及其特点、半衰期公式及特征)4、反应级数的测定(1)积分法(2)微分法(3)过量浓度法(孤立法)5、温度对反应速率的影响(1)阿仑尼乌斯(Arrhenius)经验公式(2)活化能的概念及其实验测定A.活化分子与活化能B.活化能的求算方法(3)阿仑尼乌斯公式的一些应用6、简单碰撞理论(1)简单碰撞理论的基本假设(2)碰撞数、有效碰撞分数的物理意义(3)简单碰撞理论的成功与失败7、过渡态理论(1)势能面的概念及物理意义(2)反应途径、过渡态理论中的活化能(3)过渡态理论的成功与失败8、单分子反应理论(简单了解)。
2017年山大山东大学考研真题、研究生招生简章、招生目录及考试大纲汇总

2017年山大山东大学考研真题、研究生招生简章、招生目录及考试大纲汇总山东大学考研真题、考研答案及考研资料,由布丁考研网山大在读学长收集整理,真题都是来自官方原版,权威可靠,内部资料都是我们当年考山大时用的,考上后针对新的大纲重新进行了整理,参考价值极高。
此外,我们还有很多备考山大的经验,学弟学妹们有任何报考的疑问均可以咨询我们。
我们还提供一对一VIP辅导,除了传授报考山东大学的内部信息、备考方法及经验外,把专业课的所有重点、难点、考点全部道出,在最短的时间内快速提升成绩,特别适合二战、在职、本科不是985和211、基础比较差的同学。
山东大学2017年招收攻读硕士学位研究生简章一、培养目标培养热爱祖国,拥护中国共产党的领导,拥护社会主义制度,遵纪守法,品德良好,具有服务国家服务人民的社会责任感,掌握本学科坚实的基础理论和系统的专业知识,具有创新精神、创新能力和从事科学研究、教学、管理等工作能力的高层次学术型专门人才以及具有较强解决实际问题的能力、能够承担专业技术或管理工作、具有良好职业素养的高层次应用型专门人才。
二、招生专业(一)考生可登录“中国研究生招生信息网”或“山东大学研究生招生信息网”查看山东大学2016年硕士研究生招生专业目录。
(二)招生专业目录中专业代码第三位为“5”的专业为专业学位专业(领域),第五位为“Z”的专业为我校自主设置的二级学科专业,第五位为“J”的专业为交叉学科专业。
三、招生计划(一)除各类专项计划外, 我校2016年预计招收硕士研究生4400人,其中推荐免试研究生的接收比例约占总招生人数的40%,最终招生总人数以正式下达的招生计划文件为准、拟招收推免生人数以最后推免生系统确认的录取人数为准。
(二)我校招生专业目录中公布的招生人数均为一志愿招生人数(含推免生人数),招生人数仅供参考,具体录取人数将根据国家下达给我校的招生计划及报考情况作适当调整。
(三)我校各招生单位均留有部分招生计划用于接收优秀二志愿调剂考生,二志愿招生计划约600人。
【化学】年全国高考化学考试大纲(带题型示例的出处)

PS:本资料由逗你学整理提供,我们的目标是用最小的力气学习!网页搜索:手机应用商店搜索:逗你学或者扫描下方二维码收看免费的知识点视频,3 分钟提高50 分!高考其实可以更简单2017 年全国高考化学考试大纲根据教育部考试中心《2017 年普通高等学校招生全国统一考试大纲(理科·课程标准实验版)》(以下简称《大纲》),结合基础教育的实际情况,制定《2017 年普通高等学校招生全国统一考试理科综合考试大纲的说明(课程标准实验版)》(以下简称《说明》)的化学科部分制定《说明》既要有利于化学新课程的改革,又要发挥化学作为基础学科的作用;既要重视考查考生对中学化学知识的掌握程度,又要注意考查考生进入高等学校继续学习的潜能;既要符合《普通高中化学课程标准(实验)》和《普通高中课程方案(实验)》的要求,符合教育部考试中心《大纲》的要求,符合普通高中课程改革实验的实际情况,又要利用高考命题的导向功能,推动新课程的课堂教学改革Ⅰ 考核目标与要求化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,将在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养化学科命题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展一、对化学学习能力的要求1. 接受、吸收、整合化学信息的能力(1)对中学化学基础知识能正确复述、再现、辨认,并能融会贯通【例1】(新增)短周期元素W、X、Y、Z 的原子序数依次增加m、p、r 是由这些元素组成的二元化合物,n 是元素Z 的单质,通常为黄绿色气体,q 的水溶液具有漂白性,0.01 mol·L–1r 溶液的pH 为2,s 通常是难溶于水的混合物上述物质的转化关系如图所示下列说法正确的是A.原子半径的大小W<X<YB.元素的非金属性Z>X>YC.Y 的氢化物常温常压下为液态D.X 的最高价氧化物的水化物为强酸【答案】C(2016 年全国I·T13)【说明】本题主要考查考生对原子结构和元素性质周期性变化规律的理解考生需要熟练掌握短周期主族元素,并将原子结构、元素单质性质、化合物性质与相关化学反应等内容进行综合运用,正确得出相关元素的名称及其化合物,并进而对元素的原子半径大小、非金属性强弱的比较、氢化物的熔点和沸点、氢化物的水化物的酸碱性强弱等做出判断(2)通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储【例2】(新增)某分子的球棍模型如图所示,图中“棍”代表单键或双键或叁键,不同颜色的球代表不同元素的原子,该模型图可代表一种A.卤代羧酸B.酯C.氨基酸D.醇钠【说明】本题给出了一个有机分子的球棍模型,其中不同颜色的球代表不同元素的原子,要求考生观察模型中不同原子的链接成键情况,从而得知原子的成状态,并对分子的组成进行分析【例3】浓度均为0.10 mol·L-1、体积均为V0 的MOH 和ROH 溶液,分别加水稀释至体积V,pH 随lg V/V0 的变化如图所示,下列叙述错误的是A.MOH 的碱性强于ROH 的碱性B.ROH 的电离程度:b 点大于a 点C.若两溶液无限稀释,则它们的c(OH-)相等D.当lg V/V0=2 时,若两溶液同时升高温度,则c(M+)/c(R+)增大T13)【答案】D(2015 年全国I·【说明】本题创建了pH- lg V/V0 关系图的新情景,考查考生从中准确提取关键信息,应用相关知识,采用分析、综合的方法解决问题的能力试题巧妙地利用图像提供多种信息,分别用于选项中的相应问题的解答,考查考生的观察能力和思维能力,同时4 个选项呈现多角度的设问,综合程度高(3)从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块【例4】(新增) 以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH)已知两个醛分子在一定条件下可以自身加成.下式中反应的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得.(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件)【说明】(94 年35 题)本题要求考生从醛的“自身加成”反应中,获取该反应的关键信息,并能与已学过的烯烃与水加成反应、醇氧化为醛以及不饱和键的加成等反应结合,形成比较系统的有机反应转化知识块,最后写出由乙烯制备正丁醇的化学方程式2. 分析和解决化学问题的能力(1)将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题【例5】银质器皿日久表面会逐渐变黑,这是生成了Ag2S 的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去下列说法正确的是A.处理过程中银器一直保持恒重 B.银器为正极,Ag2S 被还原生成单质银 C.该过程中总反应为2Al + 3Ag2S = 6Ag + A12S3D.黑色褪去的原因是黑色Ag2S 转化为白色AgClT10)【答案】B(2013 年全国I·【说明】本题紧密联系生活实际,以电化学原理为基础,考查考生对原电池的构成要素、工作原理、电极反应等知识的了解程度原电池工作过程中,化学能转化为电能,其基本工作原理是氧化还原反应因此,本题融合了“三大守恒原理”(质量守恒、电荷守恒、得失电子守恒)以及常见金属元素与非金属元素的性质、盐类水解原理等知识,考查考生运用这些原理和知识解决实际生活中化学问题的能力(2)将分析和解决问题的过程及成果,能正确地运用化学术语及文字、图表、模型、图形等进行表达,并做出合理解释【例6】(新增)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(3)①2O2(g)+N2(g)=N2O4(l) △H1②N2(g)+2H2(g)=N2H4(l) △H2③O2(g)+2H2(g)=2H2O(g) △H3④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol上述反应热效应之间的关系式为△H4= ,联氨和N2O4 可作为火箭推进剂的主要原因为(5)联氨是一种常用的还原剂向装有少量AgBr 的试管中加入联氨溶液,观察到的现象是联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀理论上1kg 的联氨可除去水中溶解的O2kg;与使用Na2SO3 处理水中溶解的O2 相比,联氨的优点是【说明】(2016 年甲卷26 题)本题给出了有关联氨的物理和化学性质的信息,要求考生从动力和热量两个角度分析并阐释其作为火箭推进剂的原因;同时根据联氨与氧气反应的产物,利用化学术语及文字说明其作为高压锅炉除氧试剂的优点3. 化学实验与探究的能力(1)掌握化学实验的基本方法和技能,并初步实践化学实验的一般过程【例7】下列实验中,所采取的分离方法与对应原理都正确的是选项目的分离方法原理A. 分离溶于水的碘乙醇萃取碘在乙醇中的溶解度较大B.分离乙酸乙酯和乙醇分液乙酸乙酯和乙醇的密度不同C.除去KNO3 固体中混杂的NaCl重结晶NaCl 在水中的溶解度很大D.除去丁醇中的乙醚蒸馏丁醇与乙醚的沸点相差较大【答案】D(2013 年全国I·T13)【说明】本题是物质分离和提纯方面的实验题,考查考生对中学化学相关实验知识和基本技能的掌握程度形式上,本题将实验目的、分离方法与原理等内容以表格形式融于一体;内容上,本题涉及的物质既有无机物,也有有机物涉及的物质基本性质有溶解度、密度与沸点等即考查了考生对化学实验常用分离和提纯方法具体应用范围的掌握,也考查了考生对这些分离和提纯方法所涉及原理的理解程度与应用能力要求考生能在灵活运用相关知识的基础上,正确理解萃取、分液、蒸馏及重结晶等分离提纯方法的含义及其适用条件(2)在解决化学问题的过程中,运用化学原理和科学方法,能设计合理方案,初步实践科学探究(新增)【例8】某种催化剂为铁的氧化物化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN 溶液后出现红色一位同学由此得出该催化剂中铁元素价态为+3 的结论(1)请指出该结论是否合理并说明由(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:3 mol/L H2SO4、3%H2O2、6 mol/L HNO3、0.01 mol/L KMnO4、NaOH 稀溶液、0.1 mol/L KI、20% KSCN、蒸馏水① 提出合理假设假设1:;假设2:;假设3:②设计实验方案证明你的假设③实验过程:根据②的实验方案,进行实验请按下表格式写出实验操作步骤、预期现象与结论实验操作预期现象与结论步骤1:步骤2:步骤3:…(1) 该结论不正确稀HNO3 有强氧化性,若该铁的价态为 +2 价,则被氧化为 +3 价同样可使KSCN 溶液变血红色(2) ①提出合理假设假设1:催化剂中铁元素的价态为 +3 价假设2:催化剂中铁元素的价态为 +2 价假设3:催化剂中铁元素的价态既有+3 价也有+2 价②设计实验方法证明你的假设(见下表)③实验过程实验操作预期现象与结论步骤1:将适量稀H2SO4 加入溶液呈黄绿色,说明溶液中含Fe2+或Fe3+少许样品于试管中,加热溶解;步骤2:取少量溶液,滴加酸性KMnO4 溶液若KMnO4 溶液的紫红色褪去为无色溶液,则说明催化剂中铁元素的价态含 +2 价;若不褪色,则说明催化剂中铁元素的价态不含 +2 价步骤3:另取少量溶液,滴加KSCN 溶液若溶液变为血红色,则说明催化剂中铁元素的价态含 +3 价;若溶液无明显变化,则说明催化剂中铁元素的价态不含 +3 价究为背景,考查Fe3+和Fe2+的转化、Fe3+的检验等相关知识;以探究实验的核心环节为载体,考查考生对实验方案设计和评价能力二、对知识内容的要求层次高考化学命题对知识内容的要求分为了解、理解(掌握)、综合应用三个层次,高层次的要求包含低层次的要求其含义分别为:了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或直接使用理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题能“知其然”,还能“知其所以然” 综合应用:在理解所学各部分化学知识之间的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题Ⅱ 考试范围与要求考试分为必考和选考两部分必考为必修模块“化学1”、“化学2”和选修模块“化学反应原理”的内容;选考为选修模块“物质结构与性质”和“有机化学基础”的内容,考生从三个选考模块中任意选考一个模块的内容必考内容必考内容涵盖必修模块“化学1”“化学2”和选修模块“化学反应原理”的内容根据化学的学科体系和学科特点,必考部分的内容包括:化学学科特点和基本研究方法、化学基本概念和基本理论、常见无机物及其应用、常见有机物及其应用和化学实验基础五个方面1.化学学科特点和基本研究方法(1)了解化学的主要特点是在原子、分子水平上认识物质了解化学可以识别、改变和创造分子(2)了解科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法认识化学是以实验为基础的一门科学(3)了解物质的组成、结构和性质的关系了解化学反应的本质、基本原理以及能量变化等规律(4)了解定量研究方法是化学发展为一门科学的重要标志(5)了解化学与生活、材料、能源、环境、生命、信息技术等的关系了解“绿色化学”的重要性2.化学基本概念和基本理论(1)物质的组成、性质和分类① 了解分子、原子、离子和原子团等概念的含义② 理解物理变化与化学变化的区别与联系③ 理解混合物和纯净物、单质和化合物、金属和非金属的概念④ 理解酸、碱、盐、氧化物的概念及其相互联系(2)化学用语及常用物理量① 熟记并正确书写常见元素的名称、符号、离子符号② 熟悉常见元素的化合价能根据化合价正确书写化学式(分子式),或根据化学式判断元素的化合价③ 掌握原子结构示意图、电子式、分子式、结构式和结构简式等表示方法(“了解变掌握”,新增“电子式”)④ 了解相对原子质量、相对分子质量的定义,并能进行有关计算⑤ 理解质量守恒定律⑥ 能正确书写化学方程式和离子方程式,并能进行有关计算⑦了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(V m)、物质的量浓度(c)、阿伏加德罗常数(N A)的含义⑧ 能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算(3)溶液① 了解溶液的含义② 了解溶解度、饱和溶液的概念③ 了解溶液浓度的表示方法理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算④ 掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法(“了解” 变“掌握”)⑤ 了解胶体是一种常见的分散系,了解溶液和胶体的区别(新增)(4)物质结构和元素周期律① 了解元素、核素和同位素的含义② 了解原子的构成了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系③ 了解原子核外电子排布规律④ 掌握元素周期律的实质了解元素周期表(长式)的结构(周期、族)及其应用⑤ 以第3 周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系⑥ 以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系⑦ 了解金属、非金属元素在周期表中的位置及其性质递变规律⑧ 了解化学键的定义了解离子键、共价键的形成(5)化学反应与能量① 了解氧化还原反应的本质了解常见的氧化还原反应掌握常见氧化还原反应的配平和相关计算② 了解化学反应中能量转化的原因及常见的能量转化形式③ 了解化学能与热能的相互转化了解吸热反应、放热反应、反应热等概念④ 了解热化学方程式的含义,能正确书写热化学方程式(新增)⑤ 了解能源是人类生存和社会发展的重要基础了解化学在解决能源危机中的重要作用⑥了解焓变(ΔH)与反应热的含义⑦ 理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算⑧ 理解原电池和电解池的构成、工作原理及应用,能书写电极反应和总反应方程式(“了解”变“理解”)了解常见化学电源的种类及其工作原理⑨ 了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施(“理解”变“了解”)(6)化学反应速率和化学平衡① 了解化学反应速率的概念和定量表示方法能正确计算化学反应的转化率(α)(新增)② 了解反应活化能的概念,了解催化剂的重要作用(新增)③ 了解化学反应的可逆性及化学平衡的建立(新增)④ 掌握化学平衡的特征(新增)了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算⑤ 理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律⑥ 了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用(7)电解质溶液① 了解电解质的概念,了解强电解质和弱电解质的概念② 理解电解质在水中的电离以及电解质溶液的导电性(“了解”变“理解”)③ 了解水的电离、离子积常数④ 了解溶液pH 的含义及其测定方法,能进行pH 的简单计算⑤ 理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算(新增)⑥ 了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用⑦ 了解离子反应的概念、离子反应发生的条件掌握常见离子的检验方法⑧ 了解难溶电解质的沉淀溶解平衡理解溶度积(K sp)的含义,能进行相关的计算(“了解”变“理解”)(8)以上各部分知识的综合应用3.常见无机物及其应用(1)常见金属元素(如Na、Mg、Al、Fe、Cu 等)① 了解常见金属的活动顺序② 了解常见金属及其重要化合物的制备方法,掌握其主要性质及其应用(新增)③ 了解合金的概念及其重要应用(2)常见非金属元素(如H、C、N、O、Si、S、Cl 等)① 了解常见非金属元素单质及其重要化合物的制备方法,掌握其主要性质及其应用(新增)② 了解常见非金属元素单质及其重要化合物对环境的影响(3)以上各部分知识的综合应用4.常见有机物及其应用(1)了解有机化合物中碳的成键特征(2)了解有机化合物的同分异构现象,能正确书写简单有机化合物的同分异构体(新增)(3)掌握常见有机反应类型(新增)(4)了解甲烷、乙烯、苯等有机化合物的主要性质及应用(5)了解氯乙烯、苯的衍生物等在化工生产中的重要作用(6)了解乙醇、乙酸的结构和主要性质及重要应用(7)了解糖类、油脂、蛋白质的组成和主要性质及重要应用(8)了解常见高分子材料的合成及重要应用(9)以上各部分知识的综合应用5.化学实验(1)了解化学实验是科学探究过程中的一种重要方法(2)了解化学实验室常用仪器的主要用途和使用方法(3)掌握化学实验的基本操作能识别化学品标志了解实验室一般事故的预防和处理方法(4)掌握常见气体的实验室制法(包括所用试剂、反应原理、仪器和收集方法)(5)掌握常见物质检验、分离和提纯的方法掌握溶液的配制方法(6)根据化学实验的目的和要求,能做到:① 设计实验方案;② 正确选用实验装置;③ 掌握控制实验条件的方法;(“了解”变“掌握”)④ 预测或描述实验现象(新增)、分析或处理实验数据,得出合理结论;⑤ 评价或改进实验方案(7)以上各部分知识与技能的综合应用选考内容选考内容为选修模块“物质结构与性质”和“有机化学基础”,考生从中任意选一个模块考试(删掉“化学技术”模块变为2 选1)(一)物质结构与性质1.原子结构与元素的性质(1)了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36 号元素原子核外电子、价电子的电子排布式和轨道表达式(2)了解电离能的含义,并能用以说明元素的某些性质(3)了解电子在原子轨道之间的跃迁及其简单应用(4)了解电负性的概念,并能用以说明元素的某些性质1.化学键与分子结构(1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质(2)了解共价键的形成、极性、类型(键和键),了解配位键的含义(3)能用键能、键长、键角等说明简单分子的某些性质(4)了解杂化轨道理论及简单的杂化轨道类型(sp、sp2、 sp3)(5)能用价层电子对互斥理论或者杂化轨道理论推测简单分子或离子的空间结构3.分子间作用力与物质的性质(1)了解范德华力的含义及对物质性质的影响(2)了解氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响4.晶体结构与性质(1)了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别(2)了解晶格能的概念,了解晶格能对离子晶体性质的影响(3)了解分子晶体结构与性质的关系(4)了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系(5)理解金属键的含义,能用金属键理论解释金属的一些物理性质了解金属晶体常见的堆积方式(6)了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算(二)有机化学基础1.有机化合物的组成与结构(1)能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式(2)了解常见有机化合物的结构了解有机化合物分子中的官能团,能正确地表示它们的结构(3)了解确定有机化合物结构的化学方法和物理方法(如质谱、红外光谱、核磁共振氢谱等)(新增)(4)能正确书写有机化合物的同分异构体(不包括手性异构体)(5)能够正确命名简单的有机化合物(6)了解有机分子中官能团之间的相互影响(“能举例说明”变“了解”)2.烃及其衍生物的性质与应用(1)掌握烷、烯、炔和芳香烃的结构与性质(2)掌握(“了解”变“掌握”)卤代烃、醇、酚、醛、羧酸、酯的结构与性质,以及它们之间的相互转化(3)了解烃类及衍生物的重要应用以及烃的衍生物合成方法(新增)(4)根据信息能设计有机化合物的合成路线(新增)3.糖类、氨基酸和蛋白质(1)了解糖类、氨基酸和蛋白质的组成、结构特点、主要化学性质及应用(2)了解糖类、氨基酸和蛋白质在生命过程中的作用(新增)4.合成高分子(1)了解合成高分子的组成与结构特点能依据简单合成高分子的结构分析其链节和单体(2)了解加聚反应和缩聚反应的含义(3)了解合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献三、题型示例例1(新增)化学与社会、生活密切相关对下列现象或事实的解释正确的是选项现象或事实解释A 用热的烧碱溶液洗去油污Na2CO3 可直接与油污反应B 漂白粉在空气中久置变质漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3C 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl 混合使用K2CO3 与NH4Cl 反应生成氨气会降低肥效D FeCl3 溶液可用于铜质印刷线路板制作FeCl3 能从含有Cu2+的溶液中置换出铜【答案】D (2014 年新课标Ⅰ理综题·T8)【说明】本题紧密联系社会与生活,体现了化学在社会与生活中的广泛应用题目以油污洗除、漂白粉变质、农业施肥与铜质印刷线路板的制作等相关现象或事实为基础,并利用离子水解、氧化还原反应、沉淀反应、置换反应及平衡移动原理等化学反应原理进行解释,内容还涉及常见金属元素与非金属元素的性质及应用,考查考生对相关元素知识与反应原理的了解程度及运用能力例2(新增)下列关于有机化合物的说法正确的是A.2-甲基丁烷也称为异丁烷B.由乙烯生成乙醇属于加成反应C.有3 种同分异构体D.油脂和蛋白质都属于高分子化合物【答案】B(2016 年新课标Ⅰ理综题·T9)【说明】本题是关于有机化合物基本概念的问题,主要考查的是必考内容中基本有机化合物的命名、反应类型、同分异构体以及日常生活中有机高分子化合物的概念及应用例3 (新增)某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解:再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,震荡后仍有固体存在该白色粉末可能为A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3C.Na2SO3、BaCO3 D.Na2CO3、CuSO4【答案】C (2016 年新课标Ⅱ理综题·T12)【说明】本题是关于混合物的成分鉴别的实验题通过对混合物的性质探究,由实验现象判断、归纳并形成实验结论本题从知识层面考差了考生对碳酸盐、亚硫酸盐、硫酸盐以及氯化银、铜和铝的化合物等相关性质的理解和掌握情况,涉及的内容不仅覆盖面广,而且都是元素化合物的核心知识例4 右图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是。
2017年高考考试大纲化学(word版)

2017年高考考试大纲化学总纲普通高等学校招生全国统一考试(以下简称“高考”)是合格的高中毕业生和具有同等学力的考生参加的选拔性考试。
高等学校根据考生成绩,按已确定的招生计划,德、智、体全面衡量,择优录取。
因此,高考应具有较高的信度、效度,必要的区分度和适当的难度。
普通高等学校招生全国统一考试大纲(以下简称《考试大纲》)是高考命题的规范性文件和标准,是考试评价、复习备考的依据。
《考试大纲》明确了高考的性质和功能,规定了考试内容与形式,对指导高考内容改革、规范高考命题都有重要意义。
《考试大纲》根据普通高等学校对新生文化素质和能力的要求,参照《普通高中课程标准》,并考虑中学教学实际而制定。
《国务院关于深化考试招生制度改革的实施意见》明确提出深化高考考试内容改革,依据高校人才选拔要求和国家课程标准,科学设计命题内容,增强基础性、综合性,着重考查学生独立思考和运用所学知识分析问题、解决问题的能力。
高考考试内容改革注重顶层设计、统筹谋划,突出考试内容的整体设计,科学构建了高考评价体系。
高考评价体系通过确立“立德树人、服务选拔、导向教学”这一高考核心立场,回答了“为什么考”的问题;通过明确“必备知识、关键能力、学科素养、核心价值”四层考查目标以及“基础性、综合性、应用性、创新性”四个方面的考查要求,回答了高考“考什么”和“怎么考”的问题。
《考试大纲》是高考评价体系的具体实现,也体现了高考考试内容改革的成果和方向。
《考试大纲》是教育部考试中心和各分省命题省市在命题中都应当严格遵循的,是制定《考试说明》的原则依据。
各分省命题省市在《考试大纲》的基础上,结合本省市高考方案和教学实际制订符合本省市的《考试说明》。
本《考试大纲》的解释权归教育部考试中心。
化学Ⅰ.考核目标与要求化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,将在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。
山东大学化学与化工学院

山东大学化学与化工学院《化工传递过程原理》理论课程教学大纲编写人:秦绪平审定人:编制时间:2017.4.20 审定时间:一、课程基本信息:二、课程描述化工传递过程原理这一课程的实质是结合通量表达式建立数学模型,并强调动量、热量与质量传递过程的类似性和差别。
本课程根据守恒定律,分别建立动量、热量和质量传递的基本微分方程,将已知的物理问题归纳为数学表达式,然后根据具体问题,将方程简化、求解,最后求出速度、温度或浓度分布规律。
本课程使用了偏微分方程,并做了充分的解释,使学生可以掌握这些内容。
The course of Chemical Transfer Process is build mathematic model along with the flux expressions, and emphasis the similarities and differences among the momentum, heat, and mass transfer transport.According to the law of conservation, this course established the basic differential equations of the momentum, heat and mass transfer, using the known physical problems summarized as mathematical expressions. Then according to the specific problem, the equation is simplified and solved. Last the velocity, temperature and concentration distribution are obtained. We introduce the use of partial differential equations with sufficient explanation that the students can master the material presented.三、课程教学目标和教学要求【教学目标】1、本课程在学生所学高等数学基本概念的基础上,进一步学习掌握动量、热量和质量传递所遵循的基本物理过程的规律及类似性;2、根据守恒定律,分别建立动量、热量和质量传递的基本微分方程,即建立数学模型,将已知的物理问题归纳为数学表达式;3、根据具体问题,将方程简化、求解,求出速度、温度或浓度分布规律;4、力图使学生掌握处理工程问题的基本思路和方法,能够实际应用所学知识解决研究和工程中遇到的问题。
2017年普通高等学校招生全国统一考试大纲(化学)

2017年普通高等学校招生全国统一考试大纲化学Ⅰ考核目标与要求化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,将在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。
化学科命题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。
一、对化学学习能力的要求1. 接受、吸收、整合化学信息的能力(1)对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。
(2)通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储。
(3)从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块。
2. 分析和解决化学问题的能力(1)将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题。
(2)将分析和解决问题的过程及成果,能正确地运用化学术语及文字、图表、模型、图形等进行表达,并做出合理解释。
3. 化学实验与探究的能力(1)掌握化学实验的基本方法和技能,并初步实践化学实验的一般过程。
(2)在解决化学问题的过程中,运用化学原理和科学方法,能设计合理方案,初步实践科学探究。
二、对知识内容的要求层次高考化学命题对知识内容的要求分为了解、理解(掌握)、综合应用三个层次,高层次的要求包含低层次的要求。
其含义分别为:了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题。
能“知其然”,还能“知其所以然”。
综合应用:在理解所学各部分化学知识之间的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题。
2017年高考化学考试大纲说明及题型示例

一、考核目标与要求
化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,将在测试考生进
一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。
化学科命题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态
环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。
2017 年普通高等学校招生全国统一考试
理科综合 ( 化学部分)考试大纲的说明
根据教育部考试中心《 2017 年普通高等学校招生全国统一考试大纲(理科)》 (以下简称《大纲》),
结合基础教育的实际情况, 制定《 2017 年普通高等学校招生全国统一考试理科综合考试大纲的说明
(理科) 》
(以下简称《说明》)的化学科部分。
④ 掌握化学平衡的特征。 了解化学平衡常数( K)的含义, 能利用化学平衡常数进行相关计算。
考试分为必考内容和选考内容。 必考内容涵盖必修模块 “化学 1”“化学 2”和选修模块 “化学反应原理 ”的 内容;选考为选修模块 “物质结构与性质 ”和 “有机化学基础 ”的内容,考生从两个选考模块中任意选考一个 模块。
必考内容
必考内容涵盖必修模块 “化学 1”“化学 2”和选修模块 “化学反应原理 ”。根据化学的学科体系和学科特点, 必考部分的内容包括:化学学科特点和基本研究方法、化学基本概念和基本理论、常见无机物及其应用、 常见有机物及其应用和化学实验基础五个方面。
③ 掌握原子结构示意图、电子式、分子式、结构式和结构简式等表示方法。 ④ 了解 相对原子质量、相对分子质量的定义,并能进行有关计算。 ⑤ 理解质量守恒定律。 ⑥ 能正确书写化学方程式和离子方程式,并能进行有关计算。 ⑦ 了解物质的量( n )及其单位摩尔( mol )、摩尔质量( M )、气体摩尔体积( Vm )、物质的量浓 度( c)、阿伏加德罗常数( N A)的含义。 ⑧ 能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进
山东大学化学与化工学院学院-山东大学课程中心

山东大学化学与化工学院《化工原理》理论课程教学大纲编写人:王振芳审定人:编制时间:审定时间:一、课程基本信息:二、课程描述《化工原理》是一门工程性很强的课程,它是化学工程学科的基础,是理解各种化工过程的关键。
它主要研究化工单元操作的基本原理,典型设备及其设计计算方法。
作为化工专业的一门专业基础课,起着承前启后,由理及工的桥梁作用。
旨在培养学生单元操作与设备选择的能力、工程设计能力、操作与调节生产过程的能力和分析解决实际问题的能力。
使学生掌握常见化工单元操作过程及设备的基础知识、基本理论和基本计算能力,为后续专业课程和将来从事工程技术工作打好良好的基础。
三、课程教学目标和教学要求【教学目标】1化工原理属于专业基础课,是专业课与基础课的桥梁。
让学生学会专业课的学习方法,顺利完成基础课到专业课的过渡;2让学生熟练掌握化工单元操作的基本原理、典型设备的设计方法以及设备的操作与调节;3掌握工程问题的思维方式,工程问题的处理方法;4加强学生单元操作与设备选择的能力、工程设计能力、操作与调节生产过程的能力的培养;5让学生初步掌握理解“三传”的基本概念,“三传”的类似性,为专业课的学习打下良好的基础。
【教学要求】1在单元操作的教学中主要贯穿两条主线:一是传递过程(动量、热量、质量传递);二是工程问题处理方法;2按照“过程分析-数学描述-实例分析”的方式展开,体现“定性-定量-应用”三个不同层次。
3强调过程的共性,将化工单元操作按过程共性分块,阐明共同的原理和科学基础;4重点介绍工程问题的处理方法,帮助学生掌握化工原理及相关专业课的学习方法。
5教学过程应注意以下几个能力的培养:单元操作与设备选择的能力、工程设计能力、操作与调节生产过程的能力、过程开发或科研能力。
四、课程教学内容及学时分配化工原理共46学时绪论(授课3学时)【教学目标和要求】1了解化工原理研究对象、目的及内容;2了解化工原理在专业课中的地位;3掌握单元操作的分类,特点和单元操作的学习方法、研究方法。
生化山东大学绝密总结

复习提纲(一)第一部分糖1.糖的化学本质2.糖的生理功能3.单糖的分类4.重要单糖的结构式,包括链状结构和环状结构(Haworth式),如葡萄糖,果糖,核糖,核酮糖,半乳糖,甘露糖等5.同分异构体,构造,构型,构象,立体异构体,手性,DL构型的定义,手性碳RS表示法6.旋光性,变旋现象,旋光性相关的计算7.差向异构体,异头物8.单糖的化学性质9.还原性和非还原性双糖定义,例子10.麦芽糖,蔗糖,纤维二糖,乳糖的组分和糖苷键类型11.淀粉,糖原,纤维素的结构和糖苷键的类型12.糖链与蛋白连接方式(糖苷键类型)13.蛋白聚糖的定义第二部分脂质1.脂质的定义2.脂质的分类3.脂质的生物学功能4.油脂(三酰基甘油酯)的定义和基本结构5.蜡的定义6.脂肪酸定义,脂肪酸的两种系统命名法7.必需脂肪酸的定义,例子8.类二十碳烷及其衍生物9.三酰基甘油的水解和皂化,皂化值,与其相关的计算10.氢化和卤化,碘值,与其相关的计算11.酸败,酸值,乙酰值12.甘油碳原子的立体专一性编号13.膜脂及其种类14.甘油磷脂的结构15.鞘氨醇脂结构及其种类16.神经酰胺,神经节苷脂17.甾醇环的结构和碳原子编号18.与脂类相关的细胞信号分子19.辅酶Q,多萜醇20.脂蛋白的定义第三部分蛋白质1.蛋白质的生物学功能2.蛋白质的组成,凯氏定氮法,粗蛋白质含量的计算3.了解蛋白质分类4.氨基酸,所有氨基酸的结构式,单字母表示,三字母表示5.氨基酸侧链C原子的希腊字母编号6.组成蛋白质氨基酸依据侧链性质的分类,各个氨基酸侧链的性质7.疏水相互作用的定义8.必需,非必需,半必需氨基酸9.外消旋物,内消旋物10.朗伯-比尔定律,相关计算11.酸的解离系数,pKa,pI计算12.两性电解质,两性电解质pI值的计算13.氨基酸的化学反应14.分配层析法的原理15.电泳的原理16.双缩脲反应17.肽的写法18.肽键的性质,肽单位19.自由基,自由基链式反应20.蛋白质一级结构及其意义21.蛋白质一级结构的测定过程22.肽链部分水解的化学方法23.肽链氨基酸残基排列顺序的推导24.Edman法蛋白质氨基酸序列测定的原理25.人工合成多肽的原理26.蛋白家族,同源蛋白质,直系同源蛋白,旁系同源蛋白27.蛋白质二级结构,超二级结构,结构域,三级结构,四级结构的定义28.二面角,拉氏构象图29.二级结构的类型30.α螺旋的各种特征参数,注意每圈(重复单位)的长度31.β折叠片的各种特征参数,注意每个重复单位的长度32.β转角和γ转角的定义33.纤维状蛋白质的种类,特点,例子,注意活用概念推理34.维持三级结构的作用力35.寡聚蛋白36.别构蛋白,别构效应37.同促效应,异促效应38.正协同效应,负协同效应39.正效应物,负效应物40.蛋白质变性,常用的变性剂41.分子伴侣42.肌红蛋白的氧合曲线43.Hill曲线和Hill系数44.血红蛋白的结构45.变构效应46.血红蛋白的氧合曲线47.Bohr效应及其生理意义48.BPG的别构效应49.ELISA, Western Blot原理50.IHC和IF的原理51.蛋白质盐析的原理,盐溶的原理52.肽链的拆离方法;二硫键的打开53.葡聚糖凝胶过滤法分离蛋白质的方法(分子筛,分子排阻层析)54.SDS-PAGE测量蛋白质分子量的原理55.亲和层析第四部分酶学1. 酶的概念及其作用特点2.酶的化学本质及其组成、类型,掌握相关概念3. 酶促反应动力学56.影响酶促反应的因素: 底物(米氏方程,米氏常数Km的意义)、酶浓度、PH、温度、激活剂、抑制剂(抑制作用的类型、特点、动力学Ks 和Kcat型抑制剂)57.4. 酶的活性中心及其相关概念58.5. 酶催化的高效性和专一性的有关理论59.6. 酶催化高效性因素60.7. 丝氨酸蛋白酶的作用机理,注意几种丝氨酸蛋白酶作用的异同点(胰凝乳蛋白酶、胰蛋白酶和弹性蛋白酶)61.8. 别构调控与别构酶相关概念62.9. 别构酶的结构特点和性质10. 酶原激活、共价修饰酶、同工酶,诱导酶,别构酶等概念11. 酶活力,比活力及其计算第五部分核酸1.核酸的种类和分布2.核酸的理化性质3.核酸的结构的概念及特点一级结构(Chargaff规则)、二级结构(特点、稳定的因素)、三级结构、4.真核生物基因组DNA的结构特点5.RNA的结构特点原核和真核mRNA结构的异同、tRNA的一二三级结构特点、rRNA的结构特点6.核酸的水解及理化性质7.核酸的变性与复性8.分子杂交9.双脱氧法测序原理10.PCR原理第六部分重要的维生素的功能及其缺乏症。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
628理论化学考试大纲一、考试目的:《理论化学》是2014年化学专业硕士研究生入学统一考试的科目之一。
《理论化学》考试要力求反映化学专业硕士学位的特点,科学、公平、准确、规范地测评考生的专业基础素质和综合能力,以利于选拔具有发展潜力的优秀人才入学,为国家科技发展和经济腾飞培养综合素质高、复合型的化学专业人才。
二、考试要求:考生应掌握本科目的基本概念和基础知识,具备对基本概念与基础知识的理解与综合运用能力。
三、考试形式和试卷结构:《理论化学》试卷满分150分。
其中,物理化学(含结构化学)合计100分为必答,另外50分可选择无机化学(50分)或分析化学(含化学分析及仪器分析)(50分)作答。
答题方式为闭卷、笔试。
答题时允许使用计算器。
四、考试内容:物理化学(含结构化学)(100分)该科目大纲共计十九章,其中第一至第十章考题占75分,第十一至第十九章(结构化学部分)考题占25分。
第一章热力学第一定律1.热力学概论1.1 热力学的目的、内容和方法1.2 热力学基本概念:体系与环境,体系的性质;热力学平衡态和状态函数2.热力学第一定律2.1 热和功2.2 热力学能2.3 热力学第一定律的表述与数学表达式3.体积功与可逆过程3.1 等温过程的体积功3.2 可逆过程与最大功4.焓与热容4.1 焓的定义4.2 焓变与等压热的关系4.3 等压热容和等容热容5.热力学第一定律对理想气体的应用5.1 理想气体的热力学能和焓5.2 理想气体的Cp与Cv之差5.3 理想气体的绝热过程6.热力学第一定律对实际气体的应用6.1 节流膨胀与焦耳-汤姆逊效应7.热力学第一定律对相变过程的应用8.化学热力学8.1 化学反应热效应等压热效应与等容热效应;反应进度;8.2 赫斯定律与常温下反应热效应的计算:赫斯定律;标准摩尔生成焓与标准摩尔燃烧焓8.3 标准反应焓变与温度的关系—基尔霍夫定律第二章热力学第二定律1.自发过程的共同特征2.热力学第二定律3.卡诺定理3.1 卡诺循环3.2 卡诺定理4.过程的热温商与熵函数4.1 可逆过程的热温商与熵函数的概念4.2 不可逆过程的热温商与体系的熵变5.过程方向和限度的判据5.1 克劳修斯不等式5.2 熵增加原理6.△S的计算6.1 简单状态变化过程△S的计算6.2 相变过程△S的计算7.热力学第二定律的本质与熵的统计意义7.1 热力学第二定律的本质7.2 熵和热力学概率—玻兹曼公式8.热力学第三定律与规定熵8.1 热力学第三定律8.2 规定熵8.3 化学反应过程熵变的计算9.亥姆霍兹自由能与吉布斯自由能9.1 亥姆霍兹自由能及△A判据9.2 吉布斯自由能及△G判据10.过程△G的计算与应用10.1 理想气体等温过程△G的计算10.2 纯物质相变过程△G的计算11.热力学关系式11.1 四个热力学基本关系式11.2 对应系数关系式与麦克斯韦关系式第三章化学势1.溶液组成的表示法2.偏摩尔量与化学势2.1 偏摩尔量的定义和集合公式2.2 化学势的定义及其与温度、压力的关系3.稀溶液中两个经验定律3.1 拉乌尔定律3.2 亨利定律4.混合气体中各组分的化学势4.1 理想气体的化学势4.2 非理想气体的化学势5.理想溶液的定义、通性及各组分的化学势5.1 理想溶液的定义及各组分的化学势5.2 理想溶液的通性6.稀溶液中各组分的化学势7.稀溶液的依数性7.1 蒸汽压下降7.2 凝固点下降和沸点上升7.3 渗透压8.非理想溶液中各组分的化学势与活度的概念第四章化学平衡1.化学反应的等温方程式与标准平衡常数1.1 化学反应的等温方程式1.2 标准平衡常数2.平衡常数的表达式2.1 气相反应的平衡常数的表达式3.复相化学平衡3.1 平衡常数的表达式3.2 解离压力4.平衡常数的测定与平衡转化率的计算5.标准生成吉布斯自由能5.1 标准生成吉布斯自由能5.2 反应的标准吉布斯自由能改变的计算6.温度、压力及惰性气体对化学平衡的影响6.1 温度对平衡常数影响—标准平衡常数与温度的关系6.2 压力对化学平衡的影响6.3 惰性气体对化学平衡的影响7.同时平衡与反应的耦合第五章多相平衡1.多相体系平衡的一般条件2.克拉贝龙方程3.相律3.1 独立组分数、自由度3.2 相律4.单组分体系的相图—水的相图5.二组分体系的相图及其应用5.1 双液系:理想和非理想完全互溶双液系;杠杆规则与蒸馏原理;部分互溶和不互溶双液系简单低共溶混合物体系形成化合物体系:稳定化合物;不稳定化合物5.4 完全互溶和部分互溶双液系的相图6.三组分体系的相图及其应用6.1 等边三角形坐标表示法6.2 部分互溶的三液体体系6.3 二盐一水体系第六章统计热力学初步(非必考内容)第七章电化学(一)电解质溶液1、离子的迁移(1)电解质溶液的导电机理、法拉第定律(2)离子的迁移和离子迁移数的概念2、电解质溶液的电导(1)电导、电导率和摩尔电导率(2)电导测定的仪器及方法(3)电导率和摩尔电导率随浓度的变化规律(4)离子独立移动定律及离子摩尔电导率3、电导测定的应用(1)求算弱电解质的电离度及电离平衡常数(2)求算微溶盐的溶解度和溶度积(3)电导滴定4、强电解质的活度和活度系数(1)溶液中离子的活度和活度系数、离子平均活度、离子平均活度系数、离子平均质量摩尔浓度(2)离子强度5、强电解质溶液理论(基本了解)(1)离子氛模型及德拜-尤格尔公式(2)不对称离子氛模型及德拜-尤格尔-盎萨格电导公式(二)可逆电池电动势6、可逆电池(1)可逆电池必须具备的条件(2)可逆电极的种类及电极反应(3)电池电动势的测定(方法原理、所用主要仪器)(4)电池表示式(电池组成及结构的书写惯例)(5)电池表示式与电池反应的“互译”7、可逆电池热力学(1)可逆电池电动势与浓度的关系A. 能斯特(Nernst)公式及其中各参数的意义B. 电池标准电动势的测定和求算(2)电池电动势E及其温度系数与电池反应热力学量的关系(3)离子的热力学量8、电极电势(1)电池电动势产生的机理A. 电极–溶液界面电势差B. 溶液–溶液界面电势差、盐桥(构成及作用)C. 电池电动势的产生(2)电极电势A. 标准氢电极(构成及规定)B. 任意电极电势数值和符号的确定C. 电极电势的能斯特(Nernst)公式D. 参比电极(种类及作用)9、由电极电势计算电池电动势(1)单液化学电池(2)双液化学电池(3)单液浓差电池(4)双液浓差电池(5)双联浓差电池10、电极电势及电池电动势的应用(1)判断反应趋势(2)求化学反应的平衡常数(3)求微溶盐活度积(4)求离子平均活度系数(5)pH值的测定(6)电势滴定(三)不可逆电极过程11、电极的极化(1)不可逆电极电势(2)电极极化的原因(浓差极化、活化极化)(3)过电势(概念、测量方法及仪器)12、电解时的电极反应(1)阴极反应(2)阳极反应13、金属的腐蚀与防护(1)金属腐蚀现象及原理(2)金属腐蚀的防护措施14、化学电源(1)化学电源定义及种类(2)常用化学电源(锌锰干电池、铅酸蓄电池等)(3)高能电池(锂离子电池、燃料电池等)第八章表面现象与分散系统(一)表面现象1、表面吉布斯函数、表面张力(物理意义)2、纯液体的表面现象(1)附加压力(2)曲率对蒸气压的影响(3)液体的润湿与铺展(4)毛细管现象3、气体在固体表面上的吸附(1)气固吸附(定义、作用)A. 气固吸附的类型(物理吸附与化学吸附的比较)B. 吸附平衡与吸附量C. 吸附曲线的种类及特征(2)朗格缪尔(Langmuir)单分子层吸附等温式A. 朗格缪尔气固吸附理论(基本假设、吸附公式推导及应用)(3)BET多分子层吸附等温式(4)其它吸附等温式4、溶液的表面吸附(1)溶液表面的吸附现象A. 正吸附、负吸附B. 表面活性剂(定义、结构特征)(2)吉布斯吸附公式(3)表面活性剂的吸附层结构(4)表面膜5、表面活性剂及其作用(1)表面活性剂的分类(2)胶束和临界胶束浓度(3)表面活性剂的作用(作用类型、原理及与表面活性剂结构特征的关系)(二)分散系统6、分散系统的分类7、溶胶的光学及力学性质(1)光学性质–丁达尔效应(现象、应用)(2)力学性质–布朗运动(扩散、沉降与沉降平衡)8、溶胶的电性质(1)电动现象(电泳、电渗)(2)溶胶粒子带电的原因(3)溶胶粒子的双电层(4)溶胶粒子的结构(书写或示意图表达)9、溶胶的聚沉和絮凝(1)外加电解质对溶胶聚沉的影响(2)溶胶的相互聚沉(3)大分子化合物对溶胶稳定性的影响10、溶胶的制备与净化方法11、高分子溶液(简单了解)第九章化学动力学基本原理1、化学动力学概论(1)化学动力学的任务及目的(2)化学动力学发展简史(3)反应机理的概念(总反应、基元反应、简单反应、复合反应、反应分子数的概念以及它们之间的关系)2、反应速率和速率方程(1)反应速率的表示方法(2)反应速率的实验测定(化学法和物理法的原理及优缺点)(3)反应速率的经验表达式(4)反应级数的概念(5)质量作用定律及其适用范围(反应级数与反应分子数的关系)(6)速率常数(其单位与反应级数的关系)3、简单级数反应的动力学规律(1)简单级数反应的定义,简单反应与简单级数反应之间的关系(2)一级反应、二级反应、三级反应、零级反应(对应的速率公式及其特点、半衰期公式及特征)4、反应级数的测定(1)积分法(2)微分法(3)过量浓度法(孤立法)5、温度对反应速率的影响(1)阿仑尼乌斯(Arrhenius)经验公式(2)活化能的概念及其实验测定A. 活化分子与活化能B. 活化能的求算方法(3)阿仑尼乌斯公式的一些应用6、简单碰撞理论(1)简单碰撞理论的基本假设(2)碰撞数、有效碰撞分数的物理意义(3)简单碰撞理论的成功与失败7、过渡态理论(1)势能面的概念及物理意义(2)反应途径、过渡态理论中的活化能(3)过渡态理论的成功与失败8、单分子反应理论(简单了解)第十章复合反应动力学典型复合反应动力学(速率公式及动力学特征)(1)对峙反应(可逆反应)(2)平行反应(竞争反应)(3)连串反应(连续反应)2、复合反应近似处理方法(1)稳态近似法(中间产物非常活泼且浓度极低)(2)平衡态近似法3、链反应(1)链反应的三个步骤(2)直链反应(3)支链反应4、反应机理的探索和确定(稳态近似法和平衡态近似法的应用)5、催化反应(1)催化反应的基本原理(催化剂的作用)(2)不同类型的催化反应(均向催化反应、复相催化反应、酶催化反应)6、光化学概要(1)光化学定律、量子效率和能量转换效率、光化学反应(2)光化学与热反应的比较7、快速反应及其研究技术(简单了解)第十一章量子力学基础1、微观粒子的运动特征(1)黑体辐射和能量量子化(2)光电效应和光的波粒二象性(3)原子结构模型及氢原子光谱(4)实物微粒的二象性(5)不确定关系2、量子力学基本假设(1)状态的描述(2)力学量的描述(3)状态方程(4)测量问题(5)态叠加原理3. Schrodinger方程和一维势箱中的粒子4. 三维势箱中的粒子第十二章原子结构1、单电子原子的Schrodinger方程2、单电子原子的Schrodinger方程的解(1) 坐标变换(2) 分离变量(3) Φ方程、R方程和Θ方程(4) 单电子原子波函数(5) 量子数的物理意义(6) 波函数和电子云的图形3、电子自旋和Pauli原理4、多电子原子Schrodinger方程及其解5、屏蔽效应和原子轨道能级第十三章原子光谱1、氢原子光谱的精细结构(1)相对论效应(2)电子自旋效应(3)选择定则(4)塞曼效应2、多电子原子的角动量和光谱项符号3、由电子组态求光谱项(1)不等价电子的光谱项(2)等价电子的光谱项4、多电子原子光谱第十四章分子的对称性1、对称操作和对称元素2、对称类型—点群3、分子的对称性及极性4、分子的对称性及旋光性第十五章分子轨道理论1、氢分子离子H2+的结构(1)氢分子离子H2+的Schrodinger方程(2)氢分子离子H2+的Schrodinger方程的解(3)关于积分Sab, Haa和Hab(4)结果的讨论2、分子轨道理论大意3、原子轨道的线性组合和成键三原则4、双原子分子(1)同核双原子分子(2)异核双原子分子5、双原子分子的光谱项6、简单分子轨道(HMO)方法和共轭分子结构7、电荷密度、键级、自由价、分子图和化学活性8、分子轨道对称性守恒原理第十六章价键理论1、海特勒-伦敦法解H2分子2、价键理论大意3、价键理论对一些简单分子的应用4、杂化轨道理论(1)s-p杂化(2)s-p-d等性杂化轨道的简单讨论5、定域分子轨道和离域分子轨道-甲烷第十七章分子光谱1、分子光谱的产生2、跃迁矩3、双原子分子的转动光谱4、双原子分子的振动光谱5、线性AB2(D∝h)型三原子的简正振动6、红外光谱7、拉曼光谱8、核磁共振9、光电子能谱第十八章晶体结构(了解)第十九章X射线结构分析(了解)无机化学(50分)基本原理1. 物质状态:气体、液体、固体(晶体和无定形固体)的基本性质及其变化规律;溶液的组成、浓度、性质;非电解质稀溶液的依数性。
