四大基本反应类型精编版
四大基本反应类型
CO2+H2O=H2CO3SO2+H2O=H2SO3
SO3++H2O=H2SO4
4.金属氧化物+水===碱
K2O+H2O=2KOH
CaO+H2O=Ca(OH)2金属活动性前三位
Na2O+H2O=2NaOH
5.CO+O2
2CO+O2 2CO2
6.CO2+C
CO2+C 2CO
2、氧化还原反应与四种基本反应类型的关系。
反应类型
反Hale Waihona Puke 规律举例化合反应点燃或加热
1.金属+氧气=========金属氧化物
3Fe+2O2 Fe3O42Mg+O2 2MgO
2Cu+O2 2CuO 2Hg+O2 2HgO
2.非金属+氧气 非金属氧化物
C+O2 CO2S+O2 SO2
4P+5O2 2P2O52H2+O2 2H2O
复分解反应
1.酸+碱=盐+H2O
NaOH+HCl=NaCl+H2O Ca(OH)2+2HCl=CaCl2+2H2O
Ba(OH)2+H2SO4=BaSO4↓+2H2O
2.酸+盐=新酸+新盐
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl= NaCl+H2O+CO2↑
CaCO3+2HCl= CaCl2+H2O+CO2↑
3.盐+盐=新盐+新盐
精编版初中四大基本反应类型练习(含答案)

(2)金属活动性顺序表(注重基础)
A 按金属活动性由强到弱的顺序写出 K Ca
14 种常见金属的活动性顺序表。 (H)
B、排在氢前面的金属置换酸中的氢生成氢气。
C、排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。
(一般不使用
Na)
D、 Fe 与排在其后的金属的盐溶液反应也只能生成 亚铁盐 。
A 、 金属氧化物 + 酸 → 盐 + 水 例如:
B、 碱 + 酸 → 盐 + 水 例如: C、 碱 + 盐 → 另一种碱 + 另一种盐 例如:
D、 盐 + 盐 → 两种新盐 例如: E、 盐 + 酸 → 另一种盐 + 另一种酸 例如: 二、化学反应发生的条件 化学反应能否发生与反应物质本身的性质(内因)和外界条件(外因)有关。 (1)外界条件 例如,燃烧需要点燃,氢气还原氧化铜需要加热,水分解需要通电,碳酸钙分解需要高温, 氯酸钾分解制氧气需要加热和催化剂,像点燃、加热、高温、通电、催化剂都是外界条件。
(二)、非金属 + 氧气 -------- 非金属氧化物 6、氢气在空气中燃烧: 7、红磷在空气中燃烧: 8、硫粉在空气中燃烧: 9、碳在氧气中充分燃烧: 10、碳在氧气中不充分燃烧:
(三)、金属氧化物 + 水 -------- 碱(可溶性) 11、生石灰溶于水: 12、氧化钠溶于水:
(四)、非金属 + 水 -------- 非金属氧化物 13、二氧化碳和水反应: 14、二氧化硫溶于水: 15、三氧化硫溶于水:
初中化学四大基本反应类型
四种基本反应类型
化合反应 由两种或两种以上的
定 物质生成另
种物
义 质的反应。
四大基本反应类型特点

四大基本反应类型特点
一、化合反应:
是由两种或两种以上物质生成另一种物质的反应。
特点(多变一)
A+B+...=C (化合价可变可不变)
(1)生成物是一种物质。
(2)反应物不止一种物质。
(3)生成物一定要有固定组成,是纯净物。
二、分解反应:
是由一种物质生成两种或两种以上其他物质的反应。
特点(一变多)
A= B+C+...(化合价可变可不变)
(1)反应物是一种物质。
(2)生成物不止一种物质。
(3)反应物有固定组成,是纯净物。
三、置换反应:
是由一种单质跟一种化合物反应,生成另一种单质和另一种化合物的反应。
特点:A+BC=AC+B 简记为“一换一”。
(1)反应物和生成物都是两种物质。
(2)反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物。
四、复分解反应:
是由两种化合物互相交换成分,生成另外两种化合物的反应。
特点:AB+CD=AD+CB (化合价不变)
(1)生成物、反应物都是两种物质。
(2)所有的生成物和反应物都是化合物。
(3)反应在溶液中进行。
最新四大基本反应类型
化合反应:2H2+O2 2H2O
分解反应:2H2O2 2H2O+O2↑
CuSO4·5H2O CuSO4+5H2O
置换反应:H2+CuO Cu+H2O
复分解反应:NaOH+HCl=NaCl+H2O
与CO2反应
1.CO2+ H2O=H2CO3
2. CO2+2NaOH=Na2CO3+H2O
3. CO2+Ca(OH)2=CaCO3↓+H2O
3.非金属氧化物+水===酸
CO2+H2O=H2CO3SO2+H2O=H2SO3
SO3++H2O=H2SO4
4.金属氧化物+水===碱
K2O+H2O=2KOH
CaO+H2O=Ca(OH)2金属活动性前三位
Na2O+H2O=2NaOH
5.CO+O2
2CO+O2 2CO2
6.CO2+C
CO2+C 2CO
D.围棋
我的答案:C√答对
4. CO2+Na2CO3+H2O=2NaHCO3
5. CO2+C=2CO(高温)
有CO2生成的反应
化合反应2CO+O2 2CO2C+O2 CO2
分解反应CaCO3 CaO+CO2↑H2CO3=H2O+CO2↑
置换反应C+2CuO 2Cu+CO2↑
复分解反应
1、单选题。
1.古代把计量叫“度量衡”,其中,“度”是测量()的过程。(2.0分)
一换一
A+BC=B+AC
四大反应类型

四大反应类型是指化学反应中最常见的四种反应类型,分别是:
1.氧化还原反应:是一种物质中电子流动的反应。
在这种反应中,
电子流动从一种物质(称为氧化剂)流向另一种物质(称为还原剂),氧化剂的化学性质发生变化,而还原剂的化学性质得到改善。
2.放热反应:是指反应过程中产生热量的反应。
这种反应一般都是
自发反应,即不需要外界加热就可以进行。
3.放冷反应:是指反应过程中产生冷量的反应。
这种反应通常都需
要外界加热才能进行。
4.酸碱反应:是指酸和碱反应的反应。
在这种反应中,酸会损失一
个或多个氢离子,而碱会损失一个或多个氧离子,生成盐和水。
化学反应的四种基本类型

一、化学反应的四种基本类型与化合价变化两种或两种物质化合成一种物质的反应。
有的化合反应前后有元素化合价变化,有的化合反应前后没有元素化合价变化 有变化的如:C 0+O O2==C +4O -22 ;铁生锈4 F 0e +3O 02==2 F +3e 2 O -23 ;完成下列化学方程式:铁、红磷、氢气、硫磺在氧气中燃烧,木炭不充分燃烧、铜丝在空气中加热。
①、 ② ;③ ;④ ⑤、 ;⑥、 。
反应前后没有元素化合价变化的如:C +2aO -2+H +12O -2= C +2a (O -2H +1)2 ;完成下列化学方程式:氧化钠、氧化钾、氧化钡、二氧化碳、二氧化硫、三氧化硫、五氧化二磷、五氧化二氮与水反应,碳酸钙变成碳酸氢钙。
① ,② ,③ ④ ,⑤ ,⑥ ,⑧ ,⑨ 有的分解反应前后有元素化合价变化,有的分解反应前后没有元素化合价变化。
有变化的如: 如:2H +I 2O -12==2H +12O -2+O O2↑; 2H +2gO -2==2H Og +O O2↑。
完成下列化学方程式:电解水、加热氯酸钾制氧气、加热高锰酸钾制氧气,① ② 、③ 。
反应前后没有元素化合价变化的如:小苏打受热分解 2N +1aH +1C +4O -23==N +1a 2C +4O -23+C +4O -22↑+H +12O -2;完成下列化学方程式:①煅烧石灰石 ,②碳酸分解 ③碳酸氢銨受热分解 ,④碳酸氢钾受热分解 ⑤氨水分解 ,⑥碳酸氢钙受热分解单质+化合物=新单质+新化合物,反应前后一定有元素化合价变化如Z On +2H +1C -1l =H 02↑+Z +2nC -1l 2 ;F 0e +C +2uS +6O -24=F +2eS +6O -24+C 0u ;3C O +2F +3e 2O -23=4F 0e +3C +4O -22↑;H 02+C +2uO -2 = C 0u +H +12O -2完成下列化学方程式:① Fe +H 2SO 4= + ;② Al + H 2SO 4= + ;③ Mg +HCl = + ;④Zn +H 2SO 4= + ;⑤ Al + HCl = + ;⑥ Fe + HCl = + ;⑦C + CuO = + ;⑧ C + Fe 3O 4= + ;⑨H 2+ CuO = + ;⑩ H 2+ Fe 3O 4= + ;1+化2=化3+化4,因为只是化合物之间交换成分,故反应前后没有元素化合价变化。
(完整)初中化学四大基本反应类型

初中化学考点——四大基本反应类型四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应一、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应1、非金属单质与氧气生成非金属氧化物。
如2H2+O2点燃H2O2、金属与氧气反应生成金属氧化物。
如3Fe+2O2点燃Fe3O43、金属氧化物与水反应,生成相应的碱。
如CaO+H2O= Ca(OH)2注:K2O、Na2O、BaO、CaO能与水反应,生成相应的碱,其他不能。
4、非金属氧化物与水反应,生成相应的酸。
如CO2+H2O= H2CO3注:能发生此反应的非金属氧化物有CO2、SO2、SO35、其它如2CO+ O2点燃2CO2二、分解反应:由一种物质生成两种或两种以上其他物质的化学反应叫做分解反应。
1、不溶性碳酸盐高温分解如CaCO3高温CaO+CO2↑2、不溶性碱受热分解如Cu(OH)2△CuO + H2O注:除KOH、NaOH、Ba(OH)2之外,都能分解生成相应的氧化物和水3、某些酸式盐受热分解(了解)如 2NaHCO3=====Na2CO3+CO2↑+H2O4、某些碱式盐受热分解(了解)如 Cu2(OH)2CO3△ 2CuO+CO2↑+H2O其它如:水的电解、双氧水分解、高锰酸钾受热分解、氯酸钾受热分解三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫做置换反应。
1、活泼金属与酸反应(金属为金属活动顺序中氢以前的金属,酸不包括浓硫酸和硝酸)例如:Fe+2HCl=FeCl2+H2↑Mg+ 2HCl = MgCl2+ H2↑H2SO4 + Fe = FeSO4+ H2↑2HCl + Zn = ZnCl2 + H2↑ H2SO4 + Zn = ZnSO4+ H2↑注:这里的酸,一般只稀盐酸和稀硫酸。
硝酸与金属反应不生成氢气。
2、金属与盐反应,生成新盐与新金属。
盐(含较不活泼金属)+金属(较活泼)——金属(较不活泼)+盐(含较活泼金属)例如:Fe+CuSO4===FeSO4+Cu 2AgNO3+ Cu= Cu(NO3)2 +2 Ag注:反应物中的盐须溶于水,金属须比盐中金属活泼,钾、钙、钠三种金属不跟盐溶液发生置换反应。
四大基础反应类型

四大化学反应类型化合反应:化合反应指的是由两种或两种以上的物质反应生成一种新物质的反应。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
可简记为A+B=AB.1.金属+氧气→金属氧化物很多金属都能跟氧气直接化合。
例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。
如:2.非金属+氧气→非金属氧化物经点燃,许多非金属都能在氧气里燃烧,如:C+O2=点燃=CO23.金属+非金属→无氧酸盐许多金属能与非金属氯、硫等直接化合成无氧酸盐。
如:2Na+Cl2==点燃==2NaCl4.氢气+非金属→气态氢化物.因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。
如:2H2+O2=点燃=2H2O5.碱性氧化物+水→碱.多数碱性氧化物不能跟水直接化合。
判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。
如:Na2O+H2O=2NaOH.对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。
如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸.除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。
如:CO2+H2O=H2CO37.碱性氧化物+酸性氧化物→含氧酸盐Na2O+CO2=Na2CO3.大多数碱性氧化物和酸性氧化物可以进行这一反应。
其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵氨气易与氯化氢化合成氯化铵。
如:NH3+HCl=NH4Cl9.硫和氧气在点燃的情况下形成二氧化硫S+O2==点燃==SO2分解反应:由一种物质生成两种或两种以上其它的物质的反应叫分解反应。
简称一分为二,表示为AB=A+B。
只有化合物才能发生分解反应。
氯酸钾加热分解成氯化钾和氧气等(二氧化锰为催化剂)2KClO₃(MnO₂)===(△)2KCl+3O₂高锰酸钾可以加热分解成锰酸钾、二氧化锰、氧气。
初中化学知识点总结(精编)-中考必备

化学知识点总结1. 初中反应方程式现象大全及应用(着重看黑色字体的方程式)2. 四大基本反应类型(1)化合反应:由两种或两种以上物质生成另一种物质的反应。
(2)分解反应:由一种反应物生成两种或两种以上其他物质的反应。
(3)置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
(4)复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。
3. 1—20号元素元素符号常用的相对原子质量:1—18号元素核外电子分布图4. 金属+盐溶液→新金属+新盐中:①金属的相对原子质量>新金属的相对原子质量时,反应后溶液的质量变重,金属变轻。
②金属的相对原子质量<新金属的相对原子质量时,反应后溶液的质量变轻,金属变重。
5. 物质的学名、俗名及化学式(1)金刚石、石墨:C(2)水银、汞:Hg(3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2(5))盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3(7)氢硫酸:H2S(8)熟石灰、消石灰:Ca(OH)2(9)苛性钠、火碱、烧碱:NaOH(10) 纯碱、苏打:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO310H2O(11) 碳酸氢钠、酸式碳酸钠、小苏打:NaHCO3(12) 胆矾、蓝矾、硫酸铜晶体:CuSO45H2O(13) 铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14) 甲醇(有毒、误食造成失明甚至死亡):CH3OH(15) 酒精、乙醇:C2H5OH(16) 醋酸、乙酸(具有酸的通性)CH3COOH(CH3COO—醋酸根离子)(17) 氨气:NH3(碱性气体)(18)氨水、一水合氨:NH3H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19) 亚硝酸钠:NaNO2(工业用盐、有毒)6. 用CO还原氧化铜的实验步骤:“一通、二点、三灭、四停、五处理”“一通”先通氢气,“二点”后点燃酒精灯进行加热;“三灭”实验完毕后,先熄灭酒精灯,“四停”等到室温时再停止通氢气;“五处理”处理尾气,防止CO污染环境。
初中化学四大基本反应类型

初中化学四大基本反应类型一、化合反应1、镁在空气中燃烧: 2Mg +O2 =点燃= 2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu + O2=△= 2CuO 现象:铜丝变黑。
4、铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3 现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P + 5O2 =点燃= 2P2O5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧: S + O2 =点燃= SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O2=点燃= CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C + O2 =点燃=2CO10、二氧化碳通过灼热碳层:C + CO2 =高温= 2CO(是吸热的反应)11、一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2 现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO3现象:石蕊试液由紫色变成红色。
注意: 酸性氧化物+水→酸如:SO2 + H2O === H2SO3 SO3 + H2O === H2SO4 13、生石灰溶于水:CaO + H2O === Ca(OH)2(此反应放出热量) 注意:碱性氧化物+水→碱氧化钠溶于水:Na2O + H2O =2NaOH 氧化钾溶于水:K2O+ H2O=2KOH 氧化钡溶于水:BaO + H2O=Ba(OH)214、钠在氯气中燃烧:2Na + Cl2=点燃= 2NaCl15、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4•5H2O二、分解反应:1、水在直流电的作用下分解:2H2O=通电= 2H2↑+ O2 ↑现象:(1)电极上有气泡产生。
四大基本反映类型

四大基本反应类型化合反应:指的是由两种或两种以上的物质生成一种新物质的反应(combination reaction)。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
分解反应:分解反应,是化学反应的常见类型之一,是化合反应的逆反应。
它是指一种化合物分解成二种或二种以上较简单的单质或化合物的反应。
置换反应:置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。
复分解反应:复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
其实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水,使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。
可简记为AB+CD=AD+CB。
化合反应1.金属+氧气→金属氧化物很多金属都能跟氧气直接化合。
例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。
4Al+3O2 = 2Al2O32.非金属+氧气→非金属氧化物经点燃,许多非金属都能在氧气里燃烧,如:C+O2=点燃=CO23.金属+非金属→无氧酸盐许多金属能与非金属氯、硫等直接化合成无氧酸盐。
如:2Na+Cl2==点燃==2NaCl4.氢气+非金属→气态氢化物. 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。
如:2H2+O2=点燃=2H2O5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。
判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。
如:Na2O+H2O=2NaOH.对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。
如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。
四大基本反应类型附实例--简单易记

类型
定义
代表式
特者两种以上的物质,生成另一种物质的反应
A+B→C
多变一
可能变化
(就某些反应中某些元素而言)
反应物A、B
即可代表单质,
又可代表化合物
;A、B为单质
CO2+H2O=H2CO3;NH3+HCl=NH4Cl
A、B为化合物
分解反应
由一种物质生成两种或者两种以上其他物质的反应
A→B+C
一变多
可能变化
(就某些反应中某些元素而言)
生成物中的B、C
即可代表单质,
又可代表化合物
;B、C为单质
;H2CO3=CO2+H2O
B、C为化合物
置换反应
由一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应
A+BC→
B+AC
一换一
肯定变化
(就所有反应中某些元素而言)
A、B必为单质
反应范围:
金属和酸金属和盐氢气碳和金属氧化物碳和水蒸气co2cucuo2c2高温fe2hclh2fecl2feh2so4h2feso4ab必为单质bcac必为化合物复分解反应有两种化合物互相交换成分生成另外两种化合物的反应abcdadcb互相交换肯定不变就所有反应所有反应中所有元素所有元素而言反应物生成物均为化合物反应范围
①金属和酸
②金属和盐
③氢气、碳和金属氧化物
④碳和水蒸气
Fe+2HCl=H2↑+FeCl2
Fe+H2SO4=H2↑+FeSO4
A、B必为单质,BC、AC必为化合物
复分解反应
有两种化合物互相交换成分,生成另外两种化合物的反应
四种基本化学反应类型

四种基本化学反应类型九大化学基本反应类型:1、无机反应。
2、有机反应。
3、氧化还原反应。
4、离子反应。
5、自发反应,非自发反应。
6、放热反应,吸热反应。
7、可逆反应,不可逆反应。
8、异构反应。
9、核反应。
1、无机反应:分解反应(指一种化合物在特定条件下分解成二种或二种以上较简单的单质或化合物的反应);化合反应(指的是由两种或两种以上的物质生成一种新物质的反应)。
2、有机反应:加成反应(加成反应展开后,重键关上,原来重键两端的原子各相连接上一个代莱基团);消法反应(有机化合物在适度的条件下,从一个分子脱下个小分子(例如水、卤化氢等分子),而分解成不饱和(双键或三键)化合物的反应)。
3、氧化还原反应(氧化还原反应是在反应前后,某种元素的化合价有变化的化学反应)。
4、离子反应(存有离子出席的化学反应)。
5、自发反应,非自发反应。
6、放热反应,吸热反应。
7、可逆反应,不可逆反应。
8、异构反应(氧气变小臭氧臭氧变小氧气)。
9、核反应不是化学反应。
四大基本反应类型就是化学反应中十分关键的反应类型,为化合反应,水解反应,转让反应和为丛藓科扭口藓水解反应。
1、化合反应:化合反应指的是由两种或两种以上的物质反应生成一种新物质的反应。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
2、水解反应:由一种物质分解成两种或两种以上其它的物质的反应叫做水解反应。
只有化合物就可以出现水解反应。
3、置换反应:一种单质与化合物反应生成另外一种单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。
4、为丛藓科扭口藓水解反应:由两种化合物互相交换成分,分解成另外两种化合物的反应。
《四种基本反应类型》 知识清单

《四种基本反应类型》知识清单化学变化中,物质发生反应的类型多种多样,但从宏观角度可以归纳为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应。
接下来,咱们就详细聊聊这四种反应类型。
一、化合反应化合反应,简单来说,就是由两种或两种以上的物质生成一种新物质的反应。
其特点可以总结为“多变一”。
比如,氢气和氧气在点燃的条件下生成水,化学方程式为:2H₂+O₂点燃 2H₂O 。
再比如,碳在氧气中充分燃烧生成二氧化碳,C +O₂点燃CO₂。
还有很多常见的化合反应,像金属单质与氧气的反应,比如铁在氧气中燃烧生成四氧化三铁,3Fe + 2O₂点燃 Fe₃O₄。
化合反应在日常生活和工业生产中有着广泛的应用。
例如,在炼铁过程中,一氧化碳和氧化铁的反应就是化合反应,生成铁和二氧化碳,这是炼铁的重要原理。
二、分解反应分解反应与化合反应正好相反,它是由一种物质生成两种或两种以上其他物质的反应。
特点是“一变多”。
比如,水在通电的条件下分解生成氢气和氧气,2H₂O 通电 2H₂↑+ O₂↑ 。
还有实验室制取氧气常用的方法,加热高锰酸钾分解生成锰酸钾、二氧化锰和氧气,2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑ 。
分解反应在实际应用中也非常重要。
例如,发酵粉中的碳酸氢钠受热分解产生二氧化碳,使面团膨胀,用于制作糕点、馒头等。
三、置换反应置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
根据不同的分类标准,可以分为金属与酸的置换反应、金属与盐溶液的置换反应等。
金属与酸的置换反应,比如锌和稀硫酸反应生成硫酸锌和氢气,Zn + H₂SO₄= ZnSO₄+ H₂↑ 。
金属与盐溶液的置换反应,比如铁和硫酸铜溶液反应生成硫酸亚铁和铜,Fe + CuSO₄= FeSO₄+ Cu 。
置换反应在金属的冶炼和提纯中有着重要的作用。
比如,工业上用焦炭还原氧化铁来炼铁,3C + 2Fe₂O₃高温 4Fe + 3CO₂↑ 。
四种基本反应划分的标准

四种基本反应划分的标准
根据基本反应的特点,可以将基本反应分为四大类:化合反应、分解反应、置换反应和还
原反应。
1. 化合反应:指两个或多个物质反应生成新的物质的过程。
化合反应通常是非可逆的,释放能量,并伴随着物质的化学键的形成。
例如:2H2(g) + O2(g) → 2H2O(l)。
2. 分解反应:指一个化合物分解为两个或多个物质的过程。
分解反应通常是热反应或电解反应,在这些反应中需要吸收能量。
例如:2H2O(l) → 2H2(g) + O2(g)。
3. 置换反应:指一个或多个原子取代另一个化合物中的原子的过程。
在置换反应中,常见的情
况包括金属与金属的置换、非金属与非金属的置换,以及金属与非金属的置换。
例如:
2AgNO3(aq) + Cu(s)→ 2Ag(s) + Cu(NO3)2(aq)。
4. 还原反应:指一种化学反应,其中一种物质失去氧化态或氧化态下的电子,而另一种物质获
得该电子。
还原反应常常涉及氧化还原反应。
例如:2Fe3+(aq)+ 3S2-(aq)→ 2FeS(s)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
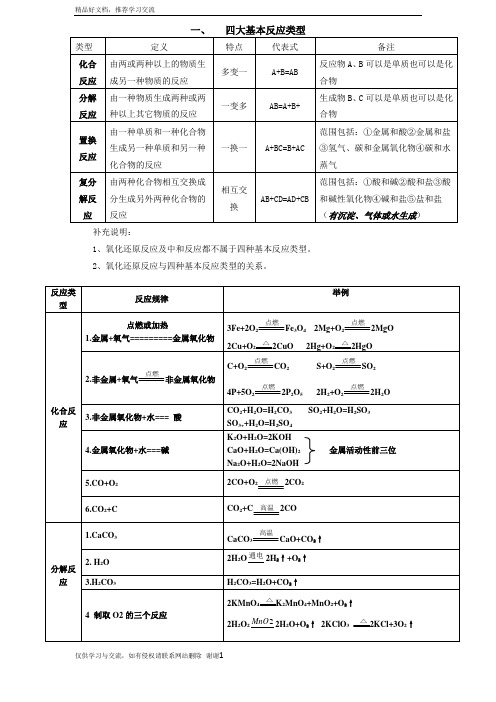
反应类型
反应规律
举例
化合反应
点燃或加热
1.金属+氧气=========金属氧化物
3Fe+2O2 Fe3O42Mg+O2 2MgO
2Cu+O2 2CuO 2Hg+O2 2HgO
2.非金属+氧气 非金属氧化物
C+O2 CO2S+O2 SO2
4P+5O2 2P2O52H2+O2 2H2O
有水生成的反应
化合反应:2H2+O2 2H2O
分解反应:2H2O2 2H2O+O2↑
CuSO4·5H2O CuSO4+5H2O
置换反应:H2+CuO Cu+H2O
复分解反应:NaOH+HCl=NaCl+H2O
与CO2反应
1.CO2+ H2O=H2CO3
2. CO2+2NaOH=Na2CO3+H2O
3. CO2+Ca(OH)2=CaCO3↓+H2O
3.非金属氧化物+水===酸
CO2+H2O=H2CO3SO2+H2O=H2SO3
SO3++H2O=H2SO4
4.金属氧化物+水===碱
K2O+H2O=2KOH
CaO+H2O=Ca(OH)2金属活动性前三位
Na2O+H2O=2NaOH
5.CO+O2
2CO+O2 2CO2
6.CO2+C
CO2+C 2CO
4. CO2+Na2CO3+H2O=2NaHCO3
5. CO2+C=2CO(高温)
有CO2生成Βιβλιοθήκη 反应化合反应2CO+O2 2CO2C+O2 CO2
分解反应CaCO3 CaO+CO2↑H2CO3=H2O+CO2↑
置换反应C+2CuO 2Cu+CO2↑
复分解反应
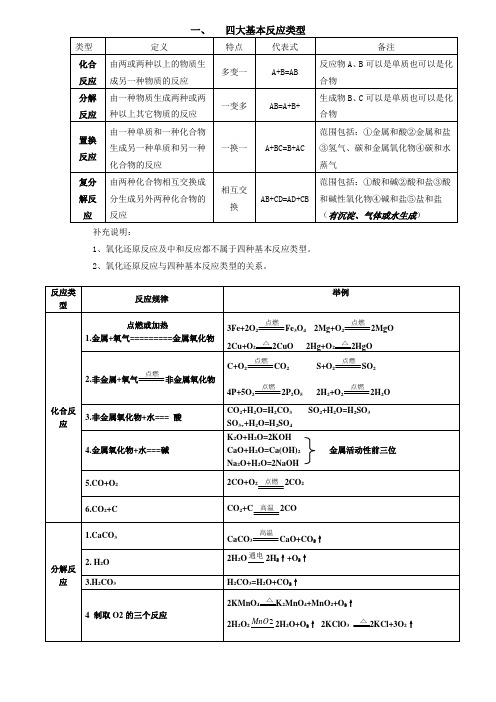
一、四大基本反应类型
类型
定义
特点
代表式
备注
化合反应
由两或两种以上的物质生成另一种物质的反应
多变一
A+B=AB
反应物A、B可以是单质也可以是化合物
分解反应
由一种物质生成两种或两种以上其它物质的反应
一变多
AB=A+B+
生成物B、C可以是单质也可以是化合物
置换反应
由一种单质和一种化合物生成另一种单质和另一种化合物的反应
4C+Fe3O4 3Fe+4 CO2↑C+2CuO 2Cu+CO2↑
4.氢气+氧化铜
H2+CuO Cu+H2O
其
他
1.CO2+碱=盐+水
CO2+2NaOH=Na2CO3吸收除去CO2
CO2+Ca(OH)2=CaCO3↓+H2O检验CO2
2.有机物的燃烧CH4、C2H5OH、C6H12O6的燃烧反应
CH4+2O2 CO2+2H2O
C2H5OH+3O2 2CO2+3H2O
C6H12O6+6O2 6CO2+6H2O
3.CO+CuO
CO+CuO Cu+CO2
二、出现水或二氧化碳的反应
与水反应
1.2H2O=2H2↑+O2↑(电解)
2. H2O+CO2=H2CO3
3. H2O+CaO=Ca(OH)2
4.CuSO4+5H2O== CuSO4·5H2O
复分解反应
1.酸+碱=盐+H2O
NaOH+HCl=NaCl+H2O Ca(OH)2+2HCl=CaCl2+2H2O
Ba(OH)2+H2SO4=BaSO4↓+2H2O
2.酸+盐=新酸+新盐
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl= NaCl+H2O+CO2↑
CaCO3+2HCl= CaCl2+H2O+CO2↑
3.盐+盐=新盐+新盐
CaCl2+Na2CO3=CaCO3↓+2NaCl
4.碱+盐=新碱+新盐
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
5金属氧化物+酸=盐+水
Fe2O3+6HCl=2FeCl3+3H2O CuO+H2SO4=CuSO4+H2O
置换反应
1.金属+酸=盐+H2↑(MgAlZnFe)
一换一
A+BC=B+AC
范围包括:①金属和酸②金属和盐③氢气、碳和金属氧化物④碳和水蒸气
复分解反应
由两种化合物相互交换成分生成另外两种化合物的反应
相互交换
AB+CD=AD+CB
范围包括:①酸和碱②酸和盐③酸和碱性氧化物④碱和盐⑤盐和盐(有沉淀、气体或水生成)
补充说明:
1、氧化还原反应及中和反应都不属于四种基本反应类型。
分解反应
1.CaCO3
CaCO3 CaO+CO2↑
2. H2O
2H2O 2H2↑+O2↑
3.H2CO3
H2CO3=H2O+CO2↑
4制取O2的三个反应
2KMnO4 K2MnO4+MnO2+O2↑
2H2O2 2H2O+O2↑2KClO3 2KCl+3O2↑
5. NaHCO3(小苏打)
2NaHCO3 Na2CO3+H2O+CO2↑
Fe+2HCl=FeCl2+H2↑
2.金属+盐=新金属+新盐
Fe+CuSO4=FeSO4+Cu Zn+FeSO4=ZnSO4+Fe
Fe+2AgNO3=Fe(NO3)2+2Ag 2Al+3CuSO4=Al2(SO4)3+3Cu
3.碳+金属氧化物(Fe2O3/Fe3O4/CuO)
3C+Fe2O3 2Fe+3 CO2↑
