元素课件5
化学必修元素周期表ppt课件

ppt课件.
41
总结:
碱金属的原子结构
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子
化学性质相似
1) 都易失电子表现强还 原性
2) 化合物中均为+1价
核电荷数
2.递变性: 电子层数
原子半径
核对最 外层电 子的引 力
失电 子能 力
还原 性
金 属 性
(电子层数的影响大于核电荷数的影响)
很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
ppt课件.
40
通过比较碱金属单质与氧气、水的反应, 我们可以看出,元素性质与原子结构有密 切关系,主要与原子核外电子的排布,特 别是 最外层电子数 有关。原子结构相 似的一族元素,它们在化学性质上表现出
相似性 和递变性 。
在元素周期表中,同主族元素从上到下原 子核外电子层数依次 增多 ,原子半径逐 渐 增大 ,失电子能力逐渐 增强 ,金 属性逐渐 增强 。
通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子,它们的化学性
质彼此相似 ,它们都能与 水 等非金属单质以及氧气 反应,表现出金属性(还原性).
4Li+O2=2Li2O
2Na+O2=Na2O2 2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
上述反应的产物中,碱金属元素的化合价都是 +1 。
49
卤族元素: 氟(F)
F +9 2 7
氯(Cl)
Cl + 1 7 2 8 7
溴(Br)
Br +35 2 8 18 7
碘(I)
I +53 2 8 1818 7
高三化学总复习之 元素周期律PPT课件
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III
B
IV B
VB
VI B
VII B
VIII
IB
II 1 B3
1 4
1 5
1 6
1 7
1 8
M L k
18 8 2
最4 外
1 9
2 0
2 1
2 2
2 3
24
25
26
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
层5 电
3
71
3
82
3 9
4 0
4 1
增 强
Rb Sr In Sn Sb Te I
酸 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
第20页/共31页
3.气态氢化物的热稳定性
热稳定性增强
热 稳 定 性 减 弱
B CNO F
热
Si P S Cl
稳
定
As Se Br
性
Te I
增 强
At
热稳定性减弱
第21页/共31页
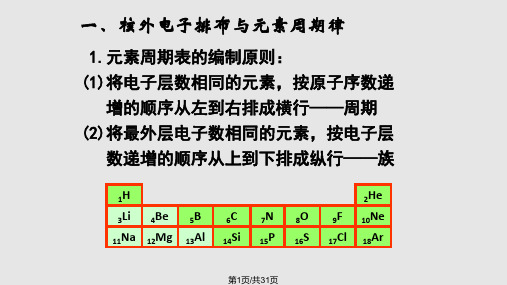
一、核外电子排布与元素周期律
1.元素周期表的编制原则: (1)将电子层数相同的元素,按原子序数递
增的顺序从左到右排成横行——周期 (2)将最外层电子数相同的元素,按电子层
数递增的顺序从上到下排成纵行——族
1H
2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
课件5:碳、硅及无机非金属材料

CuO 的硬质玻璃管 (3)通过盛放灼热铜网的硬质玻璃管 (4)通过
盛有饱和 NaHCO3溶液的洗气瓶或酸性 KMnO4溶液的洗气瓶 (5)
通过盛有饱和 NaHCO3 溶液 (6)通过盛有 CuSO4 溶液
2.如何用所提供的试剂和方法除去各粉末状混合物中的杂质 (括号内为杂质)。将所选答案的编号填入下表内相应的空格内(如 果不需要外加试剂,则对应答案栏可空着)。
知识梳理
考点二 碳、硅的氧化物
1.一氧化碳 (1)物理性质: 无 色气体、 有毒 , 难 溶于水。 (2)化学性质 ①可燃性。CO 燃烧的化学方程式为2CO+O2=点==燃==2CO2,燃 烧时发出 淡蓝 色的火焰。
②还原性。CO 还原 CuO 的化学方程式为 CuO+CO===△==Cu+CO2。
答案:(1)√ (2)× (3)√ (4)√ (5)√ (6)× (7)√
熟记可用 CO2 制取的弱酸(或酚) 碳酸酸性比硅酸、次氯酸、苯酚、偏铝酸等强,将 CO2 气体
通入 Na2SiO3、NaClO、
、NaAlO2 盐溶液中,均能发生
反应而生成相应的弱酸和碳酸(氢)盐,这是“强酸制弱酸”原理的 应用。如:
2.二氧化碳和二氧化硅的比较
物质 结构
二氧化硅(SiO2)
二氧化碳(CO2)
空间立体网状 结构,
不存在单个分子
存在单个 CO2 分子
主要物 理性质
硬度 大 ,熔、沸
点 高 ,常温下为
熔、沸点 低 ,常温
固 体,不溶于水
下为气体,微溶于水
①与水 化 反应
不反应
学
只与氢氟酸反应:
性 ②与酸 SiO2+4HF=== 质 反应 SiF4↑+2H2O
高考化学一轮复习名师讲解课件第五章物质结构元素周期律5-368张PPT - 副本

【解析】 本题主要考查对化学反应的实质即旧化学键的 断裂与新化学键的生成的理解程度以及物质中所含化学键类型 的判断。 A 选项中没有非极性共价键的断裂与形成;B 选项中 没有离子键的断裂,也没有非极性共价键的断裂与生成;C 选
- 项中没有非极性共价键的生成; D 选项中反应前有 Na+与 O2 2 的
【解析】
KOH 中含有 K+和 OH-有离子键也有共价键,
属于离子化合物,A 正确; N2 属于单质,含有 N≡ N,B 不正 确; MgCl2 中含有 Mg2+和 Cl-只含有离子键, C 不正确; NH4Cl 中含有共价键,全部由非金属元素组成,但属于离子化合物, D 不正确。
【答案】 A
(1)有化学键被破坏的变化不一定是化学变化, 如 HCl 溶于 水、NaCl 晶体熔化。 (2) 许多非金属单质和许多共价化合物在熔化时并不破坏 共价键,如 O2、HCl、CO2、H2O 等。
【解析】 NH4Cl 中既含有共价键,也含有离子键,A 错; 非金属原子以共价键结合形成的可能为共价化合物如 HCl,也 可能为单质如 H2、 O2,B 错;NH4NO3 为离子化合物,C 错; 共价化合物,最少含有两种不同的非金属元素,非金属原子是 通过共用电子对形成共价化合物的,D 对。
【答案】 D
(3)既含有离子键又含有共价键的物质,如 Na2O2、CaC2、 NH4Cl、NaOH、Na2SO4 等。 (4)无化学键的物质,稀有气体,如氩气、氦气等。 2.化学键对物质性质的影响 (1)对物理性质的影响 金刚石、晶体硅、石英、金刚砂等物质,硬度大、熔点高, 就是因为其中的共价键很强,破坏时需消耗很多的能量。
熔点、沸点、溶解度
,而
化学键影响物质的化学性质和物理性质。 ③存在于由共价键形成的多数
制造5大元素以及鱼骨图介绍课件

PPT学习交流
13
鱼骨图的三种类型
整理问题型
各要素与特性值间不存在原因关 系,而是结构构成团系。
原因型
鱼头在右,特性值通常以“为什么 ……”来写。
对策型
鱼头在左,特性值通常以“如何 提高/改善……”来写。
PPT学习交流
14
鱼骨图的基本结构:
3
2 45
1 6
○○○○○ 7
PPT学习交流
15
鱼骨图分析法的步骤:
生产管理五要素
在生产当中只有充分的了解掌握好“人、机、料、法、环”才 能在产品的“质量、产量、成本、5S、纪律、安全”等方面得 到很好的控制。从而不断的优化生产,提高生产效 率。做到精益生产
PPT学习交流
9
QC7 工具
特性要因图 (鱼骨图)
PPT学习交流
10
万事皆有因:
• 问题无时无刻不在我们周围。 • 问题是我们的朋友,但是它是大多数人不愿意碰到的朋友。 • 我们需要秉持着找朋友的态度来找出问题,及其发生的原因。 • 下面介绍一种分析方法,教我们如何正确找出产生问题的真正
PPT学习交流
5
生产管理五要素 —— 法
所谓法: 顾名思义,方法\技术。指生产过程中所需遵循的规章制度。 它包括工艺指导书,标准工序指引,生产图纸,生产计划表,产品 作业标准,检验标准,各种操作规程等。他们在这里的作用是能及 时准确的反映产品的生产和产品质量的要求。要按照规程作业是 产能质量和生产进度的一个条件。
• 它使我们问自己:问题为什么会发生?使项目小组聚焦于问题的原因, 而不是问题的症状。
• 能够集中于问题的实质内容,而不是问题的历史或不同的个人观点。 • 以团队努力,聚集并攻克复杂难题。 • 辨识导致问题或情况的所有原因,并从中找到根本原因。 • 分析导致问题的各原因之间相互的关系。 • 采取补救措施,正确行动。
有机合成课件——Chapter 5 元素有机试剂元素在有机合成中的应用

Chapter 5 元素有机试剂 在有机合成中的应用
前言
¾ 通常将含P、Mg、Cu、Si、B、Li、Na、K、Sn、Pb、 Bi、Te、 Ru、Rh、Pd、Pt、Ni、Mn、Mo等元素的 有机合成试剂称为“元素有机试剂”。
¾ 广义的元素有机试剂是指含有除C、H、N、O之外的 其它元素的有机试剂。
¾ 其中过渡金属配合物、有机金属化合物等在元素有机 试剂中占重要地位,因此大多数教科书将有机金属试 剂作为一个单独章节重点介绍。
¾ 近年来,这些试剂在有机合成中扮演着日益重要的角 色,这里重点介绍其中应用较多的一些试剂。
2
本章教学计划
1、有机金属试剂 2、有机磷、硫、硅试剂 3、其它元素有机试剂
(1) 有机硼试剂 (2) 有机锡试剂 4、过渡金属及其配合物在C-C键形成反应中的应用
CdCl2
RMgX
R2Cd
PhMgBr, FeCl3
Br
Ph
TMEDA, THF
15
¾ Grignard试剂还可以与含有极性的双键或三键化合物如烯烃、 炔烃、醛、酮、羧酸、酯、酰氯、腈、异腈、砜、亚砜、硫
代酯、亚硝基化合物,或者环氧化合物等进行加成反应,这 是Grignard试剂最主要的用途。特别是与醛、酮、酯的加成 反应,在有机合成上具有很重要的价值;Grignard试剂与二 氧化碳反应制备羧酸也是合成上重要的反应。
¾ 通常膦的极性比胺弱得多,但亲核性却比胺强很 多,因而反应范围广泛。所有三烃基膦化合物 中,PPh3最为价廉易得,应用也最为普遍。
24
4
应用举例
¾ PPh3与Cl2、Br2、I2等一起使用,可作为醇甚至酚的卤代试剂。
¾ 溴和三苯基膦能将醇甚至酚转化为相应的溴代烃。磷极易与氧 结合,能夺取醇或酚分子中的氧原子,利于溴的进攻。三苯基 膦从还而有起一到个稳作定用溴就的是作与用溴,结使合其形不成易二挥溴发化。三同苯样基,鏻氯和(Ph三3P苯B基r2)膦, 也能将醇转化为相应的氯代烃。
第5节表示元素的符号(PPT课件(初中科学)29张)

复习回顾
1、物质由_ 分子_、原子、_离__子_____构成 2、物质由__ _元__素____组成 3、符号的作用及意义?
(1)能简单明了地表示事物 (2)可避免由于外形不同引起的混乱 (3)可避免表达的文字语言不同而引起的混乱
目
肆叁贰壹
录
练
元 表元 的元
习 巩 固
素 周 期
C.镁、银、汞 D.锰、铜、钠
4.下列化学用语中,既能用来表示宏观意义,又能
表示微观意义的是( D )
A.2Zn
B.mO
C. 5S
D. C
5.下列化学符号表示两个氧原子的是(A )
A.2O B.2O2 C.CO2
D.O2
知识拓展: 正常人每天都要摄取各种有益于身体的微量元素。即:铁、锌、铜、锰、
碘、钴、锶、铬、硒等微量元素。 微量元素虽然在人体中需求量很低,但其作用却非常大。如:“锰”能刺
元素周期表发现历史
门捷列夫元素周期表 现在科学家以此为基础制作了现在使用的元素周期表
元素周期表
元 有 7 个横行(称为周期),
素
__7_个A族(主族)
周 期 表
有 18
个纵列(称为族) 分为_4__大类
__7_个B族(副族) _1__个VIII族
_1__个0族
元素按 核电荷数由小到大 顺序,从左到右排列, 由此可估计元素的性质等会产生 周期性 变化。
肆 练习巩固
1.下列元素符号书写正确的(D )
A.MN
B. CA
C. mg
D. Zn
2.“2N”表示的意义是( C )
A.表示两个氮元素 B.表示两种氮元素 C.表示两个氮原子 D. 既表示两个氮元素,又表示两个氮原子
元素PPT课件5 人教版

•
12、跌倒了,一定要爬起来。不爬起来,别人会看不起你,你自己也会失去机会。在人前微笑,在人后落泪,可这是每个人都要学会的成长。
•
13、要相信,这个世界上永远能够依靠的只有你自己。所以,管别人怎么看,坚持自己的坚持,直到坚持不下去为止。
•
14、也许你想要的未来在别人眼里不值一提,也许你已经很努力了可还是有人不满意,也许你的理想离你的距离从来没有拉近过......但请你继续向前走,因为别人看不到你的努力,你却始终看得见自己。
练习
• 下列说法有没有错误?把错误的说法加以 改正。
• ①水是由1个氧元素和2个氢元素组成 的。
• ②氧气由2个氧元素组成。
改正
• 1.水是由氧元素和氢元素两 种元素组成的。
• 2. 氧气只有氧元素一种元素 组成。
元 素 在 地 壳 中 的 含 量
地壳中含量相对较多的
前五位元素的名称是什么
生物 体内 含量 相对 较多 的前 五位 元素 名称
•
15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。
(1)下列原子哪一组不属于同种元
素( D )
原子种 质子数 中子数 相对原子质量 类
A
6
6
12
B
6
7
13
C
6
8
14
D
7
14
ABC组的质子数相同,因此属于同种元素
(2)氧元素与氮元素的本质区别
D
•A、核外电子数不同 •B、元素符号不同 •C、相对分子质量不同 •D、核电荷数不同
2.特点
•只讲种类; •不讲个数
宏观概念 元素
组成
高考化学大一轮复习 第5章 物质结构 元素周期律 51 元素周期表和元素周期律课件

12/12/2021
30
板块一
板块二
板块三第三十页,共五十页。
高考一轮总复习 ·化学 (经典版)
2.用 A+、B-、C2-、D、E、F、G 和 H 分别表示含有 18 个电子的八种微粒(离子或分子),请回答下列问题:
(1)A 元素是___K___、B 元素是__C__l__、C 元素是__S__。 (用元素符号表示)
题组一 等电子粒子的判断与应用 1.A+、B+、C-、D、E 五种粒子(分子或离子)中,每 个粒子均有 10 个电子,已知: ①A++C-===D+E↑;②B++C-===2D。
12/12/2021
28
板块一
板块二
板块第三二十八页,共五十页。
高考一轮总复习 ·化学 (经典版)
请回答: (1)C-的电子式是_____··O_····_··H__]_-______。 (2)分别写出 A+和 D 反应、B+和 E 反应的离子方程式: ________N__H_+ 4__+__H_2_O____N__H_3_·_H_2_O_+__H__+_____、 _________H_3_O__+_+__N_H__3=_=_=__N_H__+ 4 _+__H_2_O_________。
高考一轮总复习 ·化学 (经典版)
第5章 物质结构(jiégòu) 元素周期律
第1节 原子结构
12/12/2021
1
板块一
板块二
板块三第一页,共五十页。
高考一轮总复习 ·化学 (经典版)
考试说明
1.了解原子结构示意图、分子式、结构式和结构简式 的表示方法。
2.了解相对原子质量、相对分子质量的定义,并能进 行有关计算。
12/12/2021
化学:1.3.2《元素的电负性及其变化规律》课件(5)(鲁科版选修3)

6. A、B、C、D四种元素,已知A元素是自然界 中含量最多的元素;B元素为金属元素,已知 它的原子核外K、L层上电子数之和等于M、N层 电子数之和;C元素是第3周期第一电离能最小 的元素,D元素在第3周期中电负性最大。 (1)试推断A、B、C、D四种元素的名称和符号。 O Ca Na Cl (2)写出上述元素两两化合生成的离子化合物 的 化学式。
第3节 原子结构与元素性质
元素的电负性及其变化规律
【复习】第一电离能的变化规律,并解释为什么 N的第一电离能大于O的第一电离能
【联想· 质疑】 电子亲和能
思考:第一电离能是原子失电子能 力的定量描述,那么原子得电子能 力的有如何用定量去描述呢?
二、电负性
1、电负性Байду номын сангаас概念:
电负性是元素的原子在化合物中 的 吸引电子能力的标度。元素的电负 性越大,表示其原子在化合物中吸引 电子的能力越强。
3、电负性的意义
反映了原子间的成键能力 和成键类型
一般认为: 大于 2.0的元素为非金 电负性 属元素 小于 2.0的元素为金属 电负性 元素。
规律二
一般认为: 如果两个成键元素间的电负性差值 大于1.7,他们之间通常形成 离 子 键 如果两个成键元素间的电负性差值 小于1.7,他们之间通常形成 共 价 键
2、电负性的递变规律:
电负性最大
。
电负性逐渐 增 大 电 负 性 有
减 小
的 电负性最小 趋 势
原因?
1、同周期从左至右元素的电负性逐渐增大 原因:同周期从左至右,电子层数相同,核电荷数 增大,原子半径递减,有效核电荷递增,对外层电 子的吸引能力逐渐增强,因而电负性只增加 2、同一主族中,从上到下,元素的电负性逐渐减小 原因:同主族元素从上到下,虽然核电荷数也增多, 但电子层数增多引起原子半径增大比较明显,原子 和对外层电子的吸引能力逐渐减弱,元素的电负性 值递减
第五章原子结构与元素周期系ppt课件

1885年 巴尔默(J. J. Balmer) 上述五条谱线的波长可以用一个简单公式表示:
=B
n2 n2
4
n=3 n=4 n=5 n=6 n=7
= 656.210 nm = 486.074 nm = 434.010 nm = 410.120 nm = 397.007 nm
1890年 里德堡(J. R. Rydberg) 描画碱研讨微观粒子的运动时,不能忽略其动摇性 。 微观粒子具有波粒二象性。
粒子的德布罗依波长和半径
粒子 质量/ kg 速度/(m·s–1) 波长/ m
电 子 9×10–31
106 108
7×10–10 7×10–12
氢原子
1.6×10–
27
103 106
4×10–10 4×10–13
Bohr实际(三点假设):
①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量;〔量子化条件〕
②通常,电子处在离核最近的轨道上,能 量最低——基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态;
③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。
h E2 E1 E2 E1
5.3.2核外电子运动形状的近代描画 1.薛定谔方程
波函数 的几何图象可以用来表示微观粒 子活动的区域。
1926 年,奥地利物理学家薛定谔 〔Schodinger ) 提出用于描画核外电子运动 形状的一个动摇方程,被命名为薛定谔方程。 波函数 就是经过解薛定谔方程得到的。
薛定谔〔SchrÖdinger〕方程
〔1〕元素的最终组分称为简单原子,它们是不可分 割的微粒,在一切化学变化中均坚持其独特性质。
〔2〕同一元素的各个原子,其外形、分量等各种性 质那么各不一样。
第五元素木工识图课件

第五元素木工识图课件一、识图的方法二、1、图样的概念各种工业产品或者是设计产品,都是有图样的。
所谓图样,实际上就是一种图形语言,它是利用图形来解释,分析和演算产品的结构、开头和内在联系的。
2、图样的分类由于工业生产过程中不同阶段的需要,对于图样就有不同的要求。
从一张图样上包括的内容来分,产品图样大致有这样几种:A:结构装配图结构装配图是设计图样中重要的一种,它能够全面表达产品的结构。
结构装配图应该有产品所有结构和装配的关系,如各种接合、各种装饰工艺,以及装配工序所需用的尺寸和技术要求等。
B:零件图零件图是产品各个零件的图样。
零件图上有零件的图形、尺寸、技术要求和加工注意事项等。
大多数工业产品,除了产品零件图外,还包括产品附近件的图样。
所以零件图实际上是生产工业产品的基本依据。
C:组件图组件图是介于结构装配图和零件图之间的一种图样,它是由几个零件装配成产品的一个组件的图样,如家具中的抽屉、榈门等。
生产分工不细的时候,常常用组件图代价零件图加工零件和装配成组件。
D:大样图工业产品中常常有曲线形的零件、开头和弯曲都有一定要求,加工比较困难。
为了满足加工要求,把曲线形的零件划成和成品一样大小的图形,这就是大样图。
在生产中,通常将大样图先复印在胶合板上,然后用锯按线条锯下,制成划线用的样板。
对于圆规不能划出的曲线,可以用一定尺寸的方格线,正确绘制线条的形状,大样图上方格线的大小,要根据零件大小和曲线复杂程序决定。
一般取5的倍数,应用起来较为方便。
E:立体图又称为草图或示意图。
在一张立体图上,同时能看到三个方向(上下、左右和前后六个方向中的三个)立体感很强的图形。
由于它有这个特点,对初学识图的人很有帮助,先看了立体图,在脑子里就有个大概的模样,然后再看看结构装配图或零件图就比较容易些,因此立体图作为结构装配图或零件图的辅助图形比较合适。
立体图在制图学中有“透视图”和“轴测图”的分别。
“透视图”就像摄影照片一样,一件物品近大远小,跟肉眼看到的完全一样;而“轴测图”的画法就不同了,它是把远处和近处画成与实际产品一样大小,平行的还是平行,这样画起来较为容易。
元素PPT课件5

思考
电解水的实验说明水是 由什么组成的?什么是 元素?
•你还知道哪些物质 中含有氧元素,并把 它们表示出来。
一、元素:
1.定义:具有相同的核电荷数(质子数) 的一类原子的总称
说明:元素是一个宏观概念。包括三要素: 1、具有相同的核电荷数 2、同一类原子。 3、总称
(1)下列原子哪一组不属于同种元 素( D )
练习
• 下列说法有没有错误?把错误的说法加以 改正。 • ①水是由1个氧元素和2个氢元素组成 的。 • ②氧气由2个氧元素组成。
改正
• 1.水是由氧元素和氢元素两 种元素组成的。 • 2. 氧气只有氧元素一种元素 组成。
元 素 在 地 壳 中 的 含 量
地壳中含量相对较多的 前五位元素的名称是什么
活动与探究
用C、H、O三种元素可以组成 多少种物质?
H2O
1、水由氢元素和氧元素组成; 2、1个水分子由2个氢原子和1个氧原子构成
组成
宏观概念
元素
物质
构成
微观概念
构成
分子
原子
构成
• 4.维生素C(C6H8O6)主要存在于
蔬菜、水果中,它能促进人体生长发 育,增强人体对疾病的抵抗力,近年 来科学家还发现维生素C有防癌作用。 3 它由 种元素组成,它的一个分子中 共有 个原子。 20
生物 体内 含量 相对 较多 的前 五位 元素 名称
为了书写和学术交流的方便, 采用国际统一的符号来表示各种元素。
二、元素符号
•“一大二小”
元素怎么表示
元素符 元素名 号 称 改正 元素符 元素名 号 称 改正
NA
AL cA
钠
铝 锰
cA
C H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)元素符号的定义:
每种元素都用一个国际上通用的符号来 表示,这种符号叫元素符号。
(2)书写元素符号时应注意:
①.由一个字母表示的元素符号要大写; 如:H、O、N等 ②.由两个字母表示的元素符号,第一个字母
大写,第二个字母小写。“一大二小”
如:
Cu 、Ca 、Ne、Na、Mg、 Mn等
如Co和CO完全不同的物质。
硒
碘
1.0-2.0mg/kg
20-30mg/kg
以上都是指元素的含量
地壳中元 素的含量
记忆方法:氧硅铝,我铁了心。 (养闺女,我铁了心)
按质量计,各种元素在地壳里的含量差别很大,如图所示。地 壳里氧、硅、铝、铁的含量相对较多。
地壳中含量前四位的元素: 空气中含量最多的元素: 海水中含量前四位的元素:
2Mg: 2个镁原子
nS: n个硫原子 2、用符号和数字表达含义
5O 5个氧原子:
氮元素 : N
2个铜原子: 2Cu 3个磷原子:3P
超级市场里有成百上千种商品,为了便于顾客 选购,必须分门别类、有序地摆放。
元素周期表外框图
三、元素周期表简介 1、元素周期表上分两大区域 2、横行——叫周期 7个横行就是7个周期。 3、纵行——族 18个纵行16个族
N
一个氮原子
表示铜元素 Cu 铜单质 一个铜原子 表示碳元素 C
表示氖元素
Ne
表示一个氖原子
表示一个碳原子
(2)符号H、2H表示的意义? 表示一个氢原子 H: 表示氢元素; 2H: 表示2个氢原子
注意:元素符号前有数字只表示微观的意义 (几个某原子),不表示宏观意义(某元素)。
练习: 1、说说下列符号的意义 Cl :氯元素、一个氯原子 2N: 2个氮原子
元素周期表是学习和研究化学的重要工具。
原子序数 核电荷数 质子数
16.00
8O 氧
元素符号 元素名称 相对原子质量
原子序数数值=核电荷数=质子数
再见
课题2
元素
复习
说明以下物质是怎样构成的?
氧气: 氧原子
水:
氧分子
氧气
水分子 水
氧原子和氢原子
二氧化碳: 氧原子和碳原子
氧化汞: 氧原子和 汞原子
二氧化碳分子 氧化汞分子
二氧化碳
氧化汞
氧化汞
氧气
水
二氧化碳
分子
HgO
O2
H2O
CO2
碳原子和 氧原子
汞原子和 氧原子 氢原子和 氧原子 氧原子
思考:它们分子中都含什么相同原子?
分析 分子
HgO O2
相同原子 核电荷数(即质子数) O O 8
8
8 8
H2O
CO2
O
O
一、元素 (1)什么是元素: 元素是具有相同核电荷数(即核内质子数) 的一类原子的总称。
把核电荷数为8(即质子数为8)的所有的氧 原子 统称为氧元素
氧气、水、二氧化碳、氧化汞中都有氧元素
O2 H2O CO2
HgO
核电荷数为1的所有氢原子统称为氢元素 核电荷数为6的所有的碳原子统称为碳元素 判断某两个原子是否为同种元素的依据是什么?
核电荷数即核内质子数相同,元素相同 核电荷数即核内质子数不同,元素不同
元素的种类:
是由原子的核电荷数(即核内质子数)决定的。 核电荷数即核内质子数相同,元素相同 核电荷数即核内质子数不同,元素不同 注意: 1.元素是质子数相同的一类原子的总称,不是 微粒; 2.决定元素种类的是质子数或核电荷数; 3.元素的区别:质子数的不同;(同类元素中子 数可能不同) 4一种元素可以形成很多种物质,或者多种物 质含有一种元素。
(2)元素的分类
金属元素 铁元素、铜元素元素
“钅”及汞
非金属元素 氢元素、氧元素、氮元素、氖元素、 硫元素、硅元素、溴元素
P76页资料
……
“气” “石” “氵”
(3)元素的存在:
新稀宝(锌硒宝片) 配料表:含锌硒碘蛋白质粉,明胶等。 功效成分:锌 40-80mg/kg
氧、硅、铝、铁
氮
氧、氢、氯、钠
生物细胞中含量前三位的元素: 氧、碳、氢
(…钙)
注意以下问法 含量最多的非金属元素
含量最多的金属元素
物质、 元素、分子、原子间的术语关系如何表达呢?
元素
具有相同 核电荷数 的同类原 子
组成 构成 构成
宏观组成:
物质 构成 只讲种类
不讲个数
微观构成:
原子
分子
既讲种类 又讲个数
想一想 水由什么组成?
水由什么构成? 而水分子由什么构成?
物 质 组 成
水由氢元素和氧元素组成;
物质由元素来组成;
水分子由氧原子和氢原子构成; 一个水分子由一个氧原子和二个 氢原子构成; 分子由原子来构成
构 水由水分子构成; 成 物质由微粒来构成;
分 子
构 成
(4)元素与原子的比较:
元素
概念 区别 举例
原子
具有相同核电荷数(即核 内质子数)的一类原子的 化学变化中的最小粒子 总称。 用于描述物质的宏观组成;用于描述微观构成;既 只讲种类,不表示个数 表示种类,又讲个数
水是由氢元素和氧元素 组成的
一个水分子是由2个氢原 子和1个氧原子构成的。
联系
元素是一类原子的总称,原子和元素是个体和总体 的关系。化学反应中元素种类不变,原子种类和个 数也不变。
二、元素符号
科学是没有国界的,科学又是为大众的。为了书写和学术 交流的方便,采用国际统一的符号来表示各种元素。
历史上,道尔顿曾用图形加字母的方式作为元素符号, 如图所示。但由于后来发现的元素越来越多,符号设 计越来越复杂,不便于记忆和书写,故未能被广泛采 用。
最后,国际上统一采用元素拉丁文名称的第一个 字母来表示元素,如氢元素的拉丁文名称为 Hydrogenium,元素符号就写为H,氧元素的 拉丁文名称为Oxygenium,元素符号就写为O。 如果几种元素拉丁文名称的第一个字母相同时, 就附加一个小写字母来区别。例如用C表示碳元 素,Cu表示铜元素,Cl表示氯元素,Ca表示钙 元素。
熟记1~20号元素的名称和元素符号
氢、氦 氮、氧、氟、氖 磷、硫、氯、氩
锂、铍、硼、碳 钠、镁、铝、硅 钾、钙
(3)元素符号表示的意义:
思考: 元素符号O表示的意义? 元素符号O: 表示氧元素; 表示一个氧原子 元素符号表示一种元素(宏观含义),
还表示这种元素的一个原子(微观含义)。
想一想: (1)元素符号N、Cu、Ne、C表示的意义? 表示氮元素
