标准溶液与基准物质到底啥关系
标准溶液的配制方法及基准物质

标准溶液的配制方法及基准物质标准溶液是指已知准确浓度的溶液,它是滴定分析中进行定量计算的依据之一。
不论采用何种滴定方法,都离不开标准溶液。
因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。
配制标准溶液的方法一般有以下两种:直接配制法用分析天平准确地称取一定量的物质,溶于适量水后定量转入容量瓶中,稀释至标线,定容并摇匀。
根据溶质的质量和容量瓶的体积计算该溶液的准确浓度。
能用于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是用来确定某一溶液准确浓度的标准物质。
作为基准物质必须符合下列要求:(1)试剂必须具有足够高的纯度,一般要求其纯度在%以上,所含的杂质应不影响滴定反应的准确度。
(2)物质的实际组成与它的化学式完全相符,若含有结晶水(如硼砂Na2B 4 O7•10H2O),其结晶水的数目也应与化学式完全相符。
(3)试剂应该稳定。
例如,不易吸收空气中的水分和二氧化碳,不易被空气氧化,加热干燥时不易分解等。
(4)试剂最好有较大的摩尔质量,这样可以减少称量误差。
常用的基准物质有纯金属和某些纯化合物,如Cu, Zn, Al, Fe和K2Cr2O7,Na2CO3, MgO , KBrO3等,它们的含量一般在%以上,甚至可达% 。
应注意,有些高纯试剂和光谱纯试剂虽然纯度很高,但只能说明其中杂质含量很低。
由于可能含有组成不定的水分和气体杂质,使其组成与化学式不一定准确相符,致使主要成分的含量可能达不到%,这时就不能用作基准物质。
一些常用的基准物质及其应用范围列于表中。
表常用基准物质的干燥条件和应用在常量组分的测定中,标准溶液的浓度大致范围为 mol∙L-1至1 mol∙L-1,通常根据待测组分含量的高低来选择标准溶液浓度的大小。
为了提高标定的准确度,标定时应注意以下几点:⑴标定应平行测定3- 4次,至少重复三次,并要求测定结果的相对偏差不大于% 。
⑵为了减少测量误差,称取基准物质的量不应太少,最少应称取g以上;同样滴定到终点时消耗标准溶液的体积也不能太小,最好在于20mL以上。
标准滴定溶液和基准物质

例如: 溶液1L时 例如 欲配制 0.01000mol.L-1 K2Cr2O7 溶液 时,首先在分 析天平上精确称取2.9420 克K2Cr2O7 置于烧杯中,加入适量 置于烧杯中, 析天平上精确称取 水溶解后,定量转移到 容量瓶中, 水溶解后,定量转移到1000mL容量瓶中,再定容即得。 容量瓶中 再定容即得。
酸
碱或KMnO4 碱或 碱
还原剂 氧化剂 EDTA AgNO3
氯化物
三、标准溶液的配制
(一) 直接配制法:准确称取一定质量的基准试 一 直接配制法: 剂或纯度相当的其它物质,溶解后定量转移到 剂或纯度相当的其它物质,溶解后定量转移到 容量瓶中,稀释至一定体积,根据称取物质的 容量瓶中 稀释至一定体积, 质量和容量瓶的体积即可计算出该标准溶液准 确浓度。 确浓度。
第二节
标准滴定溶液和 基准物质
一、标准滴定溶液
已知其准确浓度的溶液。 已知其准确浓度的溶液。 (常用四位有效数字表示) 常用四位有效数字表示) 例如: 例如:cHCl = 0.1002 mol.L-1
二、试剂与基准物质
(一) 试剂:指化学实验中使用的药品。 一 试剂:指化学实验中使用的药品。
一般试剂等级及标志
表6-10: 滴定分析常用基准物质(p203) 10: 滴定分析常用基准物质(p203)
配置标准溶液的基准物质

配置标准溶液的基准物质
配置标准溶液时,常常使用具有已知浓度的基准物质。
基准物质是一种已知纯度和浓度的化学物质,用于制备标准溶液。
常见的基准物质包括:
1. 纯度高的固体化合物:例如,可以使用纯度较高的化学试剂,如无水物或纯化的无水盐类,作为基准物质。
2. 标准物质:某些化学物质的浓度可以通过准确的化学分析方法确定。
这些已经被认证的标准物质可以作为基准物质,用于制备标准溶液。
3. 标准溶液:某些化合物的溶液已经具有已知的浓度,并经过了验证。
这些标准溶液可作为基准物质,用于校准和制备其他溶液。
在选择基准物质时,需要确保它具有足够高的纯度和稳定性,以确保标准溶液的准确性和可重复性。
此外,还应根据所需浓度的范围和特定应用的要求选择适合的基准物质。
请注意,在实验室中,正确的实验技术和仪器校准也是确保标准溶液准确性的重要因素。
标准溶液的配制及标定

标准溶液的配制及标定一、概述:标准溶液是已知准确浓度的溶液。
标准溶液在容量分析中广泛应用,它是根据加入已知浓度和体积的标准溶液以求出被测物质的含量,因此际准溶液必须准确可靠。
根据物质的性质、特点分别按下列方法配制。
1.直接配制法:准确称取一定量的基准物质,加水溶解后,移入容量瓶中以水桥至刻度,根据物质的质量和溶液的体积,计算出标准溶液的准确浓度。
直接配制法的优点是方便,配好就可以使用。
基准物质:所谓基准物质是用来直接配制标准溶液或标定未知浓度溶液的物质,基准物质应符合下列要求:(1)纯度高,一般要求在99. 9%以上。
(2)组成恒定,实际组成与化学式完全相符,如含结晶水,其含量也应固定不变,与化学式完全一致。
(3)性质稳定,不易分解、吸湿、吸收C02、被空气氧化等。
(4)具有较人的摩尔质量,可减少称量误差(称取量人).2.间接配制法:有些物质不符合基准物质的条件,就必须采用间接配制法。
如NaOH易吸收空气中的水份和CO:: I:, HC1易挥发:HzSOl易吸水:KMnOl易发生氧化还原反应等。
所以先配成接近所需浓度的溶液,再用基准物质或另一种已知准确浓度的标准溶液来测定其准确浓度,这个操作过程称为“标定”。
标定方法有两种。
(1)用基准物质标定:称取一定量基准物质,溶解后用待标定的溶液滴定,根据基准物质的质帚及消耗标定溶液的体积,即可算出该溶液的准确浓度。
(2)用另一种标准溶液标定(比较法)。
准确吸取一定量的待标定溶液,用已知准确浓度的标准溶液滴定;或准确吸取一定量标准溶浓,用待标定溶液滴定。
根据两种溶液的体枳及标准溶液浓度就可算出待标定溶液的准确浓度.二、配制标准溶液一般规定:1.配制室内应尽量设法调节室内温度在2 0°C左右,避免受强烈的阳光照射,并且应当与其它产生有影响气体的操作分隔。
2.配制标液所需试剂应当选用分析纯品试剂,标定所用基准物质必须使用纯度很高的所谓“保证试剂”,必要时还需要进行提纯。
滴定法分析概述-基准物质和标准溶液-滴定分析中的计算

标准溶液浓度的表示方法
➢ 物质量的浓度:单位体积溶液所含物质的量
nB
mB MB
(mol)或(mmol)
CB
nB VB
mB M BVB
(mol / L)或(mmol / L)
➢ 滴定度 :
TA 指每毫升标准溶液含有溶质的质量
TA
mA V
CAM A V 1000
(g / mL)
TT/A指每毫升滴定剂溶液相当于待测物的质量 (T指标液,A指待测物) (g / mL)或(mg / mL)
称大样----减少称量误差
准确称取0.25g左右K2Cr2O7,于小烧杯中溶解 后定量转移到250mL容量瓶中定容,用25mL移
液管移取3份于锥形瓶中,分别用Na2S2O3滴定.
Er
0.0002 0.25
0.08%
0.1%
标定0.10mol·L-1NaOH:
若用H2C2O4·2H2O,约0.15g, 应称大样; 若用KHC8H4O4,约0.5g, 称小样为好(?)
MnO4
)
n
(Fe2
)
例 以K2Cr2O7为基准物质,采用析出I2的方法标 定0.020mol·L-1Na2S2O3溶液的浓度,需称多少克 K2Cr2O7?如何做才能使称量误差不大于0.1%?
解: Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O I2+2S2O32-=2I-+S4O62-
解:
mFe 0.005000 21.50 0.1075(g)
第三节 滴定分析中的计算
分析化学中常用的量和单位
物质的量 n (mol、 mmol)
摩尔质量M (g·mol-1)
使用基准物质配置标准溶液的流程

使用基准物质配置标准溶液的流程概述配置标准溶液是化学实验中常见的操作步骤之一,能够提供一种精确的浓度和组成,以用于定量分析和校准仪器。
基准物质是已知浓度的化学品,可用于准确测量其他未知浓度的物质。
本文将介绍使用基准物质配置标准溶液的流程。
流程步骤1.确定目标浓度:首先,需要确定所需标准溶液的目标浓度。
这通常是实验需求的一部分,例如在分析中必须使用特定浓度的溶液。
2.选择基准物质:根据目标浓度,选择合适的基准物质。
基准物质应具有稳定性、易得性和纯度高等特点,以确保最终溶液的准确性和可靠性。
3.准备称量容器:准备一个干净的容器用于称量基准物质。
建议使用玻璃容器,避免使用塑料容器,以免基准物质与塑料发生反应。
4.称量基准物质:将所需量的基准物质精确地称量到容器中。
使用天平进行称量时,需先将天平归零,并在称量前确认所使用的天平的准确度和灵敏度。
5.溶解基准物质:将称量好的基准物质溶解在适量的溶剂中。
通常情况下,使用纯净水作为溶剂。
搅拌或轻轻摇晃容器以促进基准物质的溶解。
6.体积调整:根据目标浓度,调整溶液的体积以获得所需浓度。
可通过加入适量的纯净溶剂或者浓缩溶液来调整体积。
7.混匀搅拌:当溶液体积调整完成后,需进行混匀搅拌,以确保溶质和溶剂充分混合均匀。
搅拌的时间和速度根据实验需求来决定。
8.校准浓度:将配置好的标准溶液送往实验室认证中心或使用合适的仪器进行浓度校准,以确保其符合实验要求。
9.存储和标识:将标准溶液存储于干燥、阴凉和避光的地方,避免阳光直射。
在容器上标记清楚溶液的浓度、配制日期和有效期,以便后续使用。
注意事项•在配制标准溶液的过程中,应使用准确的实验仪器和清洁的实验室设备,以避免外部因素的干扰。
•称量基准物质时,应注意防止水汽、灰尘和其他杂质的污染。
使用干燥、干净的工具进行操作。
•溶解基准物质时,可根据实际情况调整溶剂的体积和浓度,以确保所得的标准溶液符合实验要求。
•在搅拌和混匀溶液的过程中,可使用适当的实验设备如磁力搅拌器或摇床,并根据实验要求调整搅拌的时间和速度。
分析化学及实验:基准物质与标准溶液

可标定物质:
1 原子吸收光谱测定金属含量 2 硫酸亚铁铵中的Fe2+ 3 NaOH等碱 4 Ag+ 5 高锰酸钾 6 HCI等酸 7 硫代硫酸钠 8 Cl9 EDTA
标定溶液浓度的两种方法:
(一) 用基准物 质标定
称取一定量的基准物质,溶解后用待标定的溶液滴定, 然后根据基准物质的质量及待标定溶液所消耗的体积, 即可算出该溶液的准确浓度。大多数标准溶液是通过标 定的方法测定其准确浓度的。
用托盘天平称取4.0g的NaOH,溶解在1000 mL蒸馏水中,搅拌 均匀。装瓶,贴标签,待标。
(3)标 定
用KHP为基准物 KHP+NaOH=KNaP+ H2O M(KHP)=204.2g/mol m(KHP)=C(NaOH) V(NaOH)M(KHP) 标定溶液的范围控制在20-25ml内: 若消耗0.1mol/L的NaOH溶液20ml需KHP的质量为m1 m1=0.1*20*204.2/1000=0.40g 若消耗0.1mol/L的NaOH溶液25ml需KHP的质量为m2 m2=0.1*25*204.2/1000=0.51g 因此称量范围在0.40-0.51g之间,用减量法称三份于锥形瓶中,
由于需称量的Na2CO3的质量少,没有达到200mg以上,为减少误差, 扩大10倍称量,因此称量范围在1.需06-1.30g之间,称为大份称量法。
例2:配制0.1mol/L的NaOH溶液1000ml,并标定。
解:因NaOH在空气中会吸潮和空气中的CO2,所以只能用标定法配制
(1)m(NaOH)= CVM=0.1*1*40=4.0g (2)配制方法:
固定分析试样的质量,那么滴定度也可直接表示每毫升标准溶液相当于 被测组分的质量分数(%)
标准溶液与基准物质到底啥关系

标准溶液与基准物质到底啥关系标准溶液与基准物质到底啥关系?基准物质是分析化学中⽤于直接配制标准溶液或标定滴定分析中操作溶液浓度的物质。
基准物质应符合五项要求:⼀、纯度(质量分数)应≥99.9%;⼆、组成与它的化学式完全相符,如,含有结晶⽔,其结晶⽔的含量均应符合化学式;三、性质稳定,⼀般情况下不易失⽔、吸⽔或变质,不与空⽓中的氧⽓及⼆氧化碳反应;四、参加反应时,应按反应式定量地进⾏,没有副反应;五、要有较⼤的摩尔质量,以减⼩称量时的相对误差。
标准溶液与基准物质到底啥关系?⽂章⾥有。
先来认识下标准溶液与基准物质标准溶液:已知准确浓度的溶液,在各种滴定分析⽅法中都要⽤到标准溶液,可根据溶质的性质、特点,按不同⽅法配置,配制⽅法有直接配置法和间接配置法。
基准物质:能⽤来配制标准溶液或测定标准溶液浓度的物质。
应具备如下条件:1、组成恒定并与化学式相符,若含结晶⽔,其结晶⽔的实际含量也应与化学式严格相符。
2、纯度⾜够⾼(达99.9%以上),杂质含量应低于分析⽅法允许的误差限。
3、性质稳定,不易吸收空⽓中的⽔分和⼆氧化碳,不分解,不易被空⽓氧化。
4、有较⼤的摩尔质量,以减少称量时的相对误差。
5、试剂参加滴定反应时,应严格按反应式定量进⾏,没有副反应。
如何配制标准溶液?标准溶液是指已知准确浓度的溶液,它是滴定分析中进⾏定量计算的依据之⼀。
不论采⽤何种滴定⽅法,都离不开标准溶液。
因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。
配制标准溶液的⽅法⼀般有以下两种:1、直接配制法⽤分析天平准确地称取⼀定量的物质,溶于适量⽔后定量转⼊容量瓶中,稀释⾄标线,定容并摇匀。
根据溶质的质量和容量瓶的体积计算该溶液的准确浓度。
能⽤于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是⽤来确定某⼀溶液准确浓度的标准物质。
作为基准物质必须符合下列要求:1)试剂必须具有⾜够⾼的纯度,⼀般要求其纯度在99.9%以上,所含的杂质应不影响滴定反应的准确度。
标准溶液的配制方法及基准物质
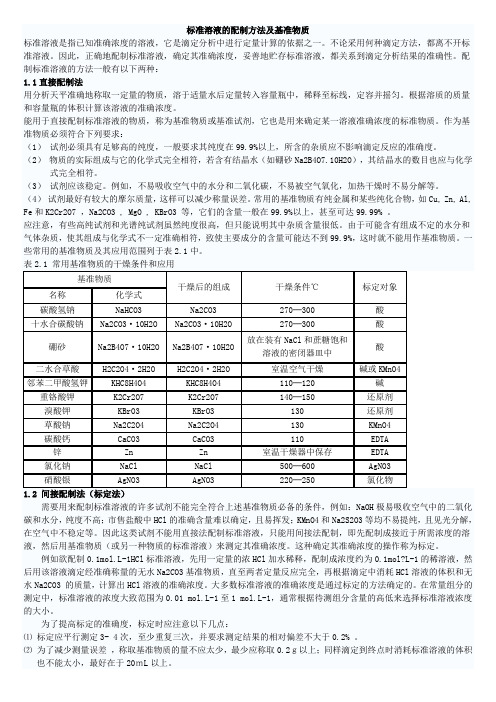
⑶配制和标定溶液时使用的量器,如滴定管,容量瓶和移液管等,在必要时应校正其体积,并考虑温度的影响。
⑷标定好的标准溶液应该妥善保存,避免因水分蒸发而使溶液浓度发生变化;有些不够稳定,如见光易分解的AgNO3和 KMnO4等标准溶液应贮存于棕色瓶中,并置于暗处保存;能吸收空气中二氧化碳并对玻璃有腐蚀作用的强碱溶液,最好装在塑料瓶中,并在瓶口处装一碱石灰管,以吸收空气中的二氧化碳和水。
对不稳定的标准溶液,久置后,在使用前还需重新标定其浓度。
2 标准溶液浓度表示方法2.1 物质的量浓度(c,简称浓度)物质的量浓度是指单位体积溶液中含溶质B的物质的量,以符号cB表示。
即cB =nB /VB (2.1)因nB = mB/MB(2.2)所以mB=cBVBMB(2.3)式(2-1)中,B代表溶质的化学式,nB为溶质B的物质的量,它的SI单位是mol,VB表示溶液的体积,其SI单位是m3;所以物质的量浓度cB的SI单位是mol.m-3,在分析化学中常用的单位为mol.L-1或mol.dm-3 。
在式(2-2)中,mB是物质B的质量,常用单位为g,MB是物质B的摩尔质量,其SI单位是Kg.mol-1,在分析化学中常用的单位为g .mol-1。
以此为单位时,任何原子、分子或离子的摩尔质量在数值上就等于其相对原子质量、分子质量或相对离子质量。
2.2 滴定度(T)在工业生产中,由于测定对象比较固定,常使用同一标准溶液测定同一种物质,因此常用滴定度表示标准溶液的浓度,使计算简便、快速。
滴定度是指1mL标准溶液相当于被测物质的质量(单位为g.mL-1或mg.mL-1),以符号TA/B 表示。
其中A为被测物质,B为滴定剂。
例如,1.00mL K2Cr2O7标准溶液恰好能与0.005682g Fe完全反应,则此K2Cr2O7溶液对Fe的滴定度TFe/K2Cr2O7 = 0.005682g/mL-1。
在实际生产过程中,常常需要对大批试样测定其中同一组分,标准溶液的浓度若用滴定度表示,计算被测组分的含量就很简便。
基准物质和标准溶液的概念 -回复

基准物质和标准溶液的概念-回复基准物质和标准溶液是化学分析实验中的重要概念,用于确定、校正和比较其他化学物质的浓度或性质。
基准物质是已知浓度和确定纯度的物质,而标准溶液是基准物质在溶液中的稀释溶液。
下面,我们将一步一步回答有关这两个概念的问题,以便更好地理解它们的意义和应用。
问题1:基准物质是什么?回答1:基准物质是已知浓度和确定纯度的物质。
通常,基准物质是高纯度化合物或元素,其性质已经被广泛研究和确认。
这些物质经过特殊处理和检测方法,确保其质量符合特定标准,以保证其浓度的准确性和稳定性。
问题2:为什么需要基准物质?回答2:在化学分析实验中,我们经常需要准确测量样品的浓度或性质。
但是,由于样品的复杂性或分析方法的限制,直接测量样品可能不太可行或准确。
基准物质的引入可以提供一种可靠的基准来校准分析方法,使得测量结果更加准确和可比较。
问题3:标准溶液是什么?回答3:标准溶液是基准物质在溶剂中的稀释溶液。
通过稀释基准物质可以得到不同浓度的溶液,这样可以方便地调整分析物质的浓度,以适应不同的分析要求。
标准溶液通常经过严格的浓度测定和质量控制,确保其浓度的准确性和稳定性。
问题4:如何制备标准溶液?回答4:制备标准溶液需要以下步骤:1. 选择合适的基准物质:根据分析要求,选择与样品性质相近的基准物质,确保准确度和可比性。
2. 确定溶液浓度:根据测定目标和分析方法,确定所需的标准溶液浓度。
3. 准确称量基准物质:使用准确的称量设备,按照所需浓度计算量,称取合适的基准物质。
4. 溶解基准物质:将基准物质溶解在适当的溶剂中,常用的溶剂包括水、乙醇、二甲基亚砜等。
搅拌或超声处理可加速溶解过程。
5. 调整溶液体积:将溶液转移到容量瓶中,并用适量的溶剂补充至刻度线,确保溶液浓度和体积的精确性。
6. 严格质量控制:对制备好的标准溶液进行浓度测定和质量控制,确保溶液的准确性和稳定性。
7. 标记和保存:在容量瓶上标记标准溶液的浓度和制备日期,并根据需要进行适当的保存和保养。
基准物质与标准溶液英语

基准物质与标准溶液英语
基准物质和标准溶液是化学分析中非常重要的概念,它们被广泛应用于质量控制、校准、定量分析等领域。
基准物质是指已知的纯物质,它的化学纯度和分析数据都已经被确定。
基准物质通常被用作分析方法和仪器的标准化参考物。
标准溶液则是指已知浓度的溶液,通常是通过溶解基准物质来制备的。
标准溶液被广泛应用于定量分析中,用来检验样品的浓度或者校准分析仪器的测量结果。
基准物质和标准溶液的英语表达:
1. 基准物质的英文表达:Reference substance
2. 标准溶液的英文表达:Standard solution
例句:
1. The reference substance used in this study was of high purity and well-characterized.
这项研究中使用的基准物质是高纯度的且已经被很好地确定。
2. The standard solution was prepared by dissolving the reference substance in a suitable solvent.
标准溶液是通过将基准物质溶解于适合的溶剂中制备的。
- 1 -。
化学中的基准物质名词解释

化学中的基准物质名词解释引言:在化学领域,基准物质是指用于度量、校准和比较的参考物质。
这些物质具有高纯度、稳定性和可追溯性,广泛用于分析、测试和质量控制等领域。
本文将对化学中常见的几种基准物质进行解释和探讨,介绍它们的特性、应用和重要性。
一、纯净水(Purified water)纯净水是化学实验中常用的基准物质之一。
它是通过多种方法去除水中杂质得到的,具有高纯度和良好的化学稳定性。
在许多实验中,纯净水被用作稀释、洗涤和溶解试剂等用途。
此外,纯净水还能被用作标准物质的配制和实验室仪器的冲洗。
纯净水也是制药和食品工业中常用的基准物质,用于生产过程的洗涤和清洁。
二、标准气体(Standard gas)标准气体是化学分析和测试中重要的基准物质之一。
标准气体是指经过精确浓度测定和校准后,以确定值为基准的气体。
通常情况下,标准气体以压力和体积的形式存在,可以用于校准气体分析仪器和测量仪器,如气相色谱仪和质谱仪等。
标准气体广泛应用于环境监测、工业过程控制和燃烧热力学等领域,对于确保测量结果的准确性和可比性至关重要。
三、标准溶液(Standard solution)标准溶液是一种已知浓度的化学物质溶液,用于校准和测量其他溶液中化学物质的浓度。
标准溶液中的浓度通常通过化学计量方法和准确仪器来确定,具有可追溯性和高精度。
标准溶液广泛应用于分析化学、生物化学和环境化学等领域,常见的应用包括pH值测定、纯度分析和定量分析等。
四、标准样品(Reference material)标准样品是一种已知组成和性质的物质,用于校准和比较其他物质的特定性质。
标准样品可以是纯物质、混合物或复杂的天然产物。
通过使用标准样品,科学家和化学工程师可以验证实验结果的准确性,并进行合理的比较和评估。
标准样品广泛应用于质量控制、食品安全和环境监测等领域,对于确保产品质量和测试可靠性至关重要。
五、标准电极(Standard electrode)标准电极是用于测量电位和电位差的参考物质。
基准物质与标准溶液PPT.

分析化学 基准物质与标准溶液
(3)用作准确配制一定物质的量浓度溶液的量 具。但固体或浓溶液不能在其中直接溶解 或稀释,不能将热的溶液倒入,不能作为 反应器,也不能长期存放溶液。移动容量 瓶,应手握刻度线以上部分。
= t ⋅ TT a
mA A × 1000 MA
a =
t TT
⋅ CT
=
A
⋅VT
mA VT
⋅M =a
t
A
⋅
/ 1000
CT M A 1000
注:t、a分别是滴定液和待测液前的系数
课堂练习
分析化学 基准物质与标准溶液
例1:THCl= 0.003001 g/ml是什么意思?
表示1 mL HCl标准溶液中含有0.003001 g HCl。
二、基准物质必须具备的条件
组成与化学式相同 H2C2O4.2H2O
基 准
纯度高(>99.9 %) Na2B4O7.10H2O
物 质
在空气中稳定
摩尔质量相对较大
反应定量进行,没有副反应
3
分析化学 基准物质与标准溶液
常 用
酸碱滴定
标定碱: KHC8H4O4,H2C2O4.2H2O 标定酸:Na2CO3,Na2B4O7.10H2O
基 准
配位滴定 标定EDTA:Zn,ZnO
物
质
氧化还原滴定 标定氧化剂:As2O3,Na 2C2O4
沉淀滴定
标定还原剂:K2Cr2O7, KIO3 标定AgNO3: NaCl
分析化学 基准物质与标准溶液
工业分析技术专业《基准物质和标准溶液》

标准溶液的配制在滴定分析中,不管采用哪种滴定方式,都离不开标准溶液,都是利用标准溶液的浓度和用量来计算待测组分的含量,因此,在滴定分析中,必须正确地配制标准溶液和确定标准溶液的准确浓度。
标准溶液的配制可分为直接配制法和间接配制法。
⑴直接配制法基准物质:能用于直接配制或标定标准溶液的物质称为基准物质standard substance。
作为基准物质必须具备以下条件:•物质的组成与化学式完全相符,假设含结晶水,其含量也应与化学式相符。
•物质的纯度足够高,一般要求其纯度在%以上。
•性质稳定,在保存或称量过程中其组成不变。
如在空气中不易吸水、不与空气中的CO2、O2等作用,加热枯燥时不分解等。
•试剂最好具有较大的摩尔质量。
这样称样质量相应较多,从而可减小称量误差。
例如Na2B4O7·10H2O和Na2CO3作为标定盐酸标准溶液浓度的基准物质,都根本符合上述前三条要求,各有优缺点。
前者摩尔质量大于后者,但前者含有结晶水,要做到所含结晶水与化学式完全相符相对不易,假设能做到Na2B4O7·10H2O所含结晶水与化学式完全相符,那么用它作为标定盐酸标准溶液浓度的基准物质更适合。
常用的基准物质及使用条件见表2-1直接配制方法:准确称取一定量的基准物质,溶于水后定量转入容量瓶中定容,然后根据所称物质的质量和“定容〞的体积即可计算出该标准溶液的准确浓度。
例如,准确称取4.903 g 基准K2Cr2O7,用水溶解后,定量转移至1000 mL的容量瓶中,加水稀释至刻度,即得mol⋅L-1的K2Cr2O7标准溶液。
⑵间接配制法当配制标准溶液所用的化学试剂不符合基准物条件时,要用间接法配制。
配制方法是:先配制成近似浓度的溶液,然后再用基准物质或准确浓度的标准溶液来标定该标准溶液的准确浓度,这种配制标准溶液的方法称为间接配制法,也称标定法。
如欲配制准确浓度的mol⋅L-1的HCl标准溶液,根据要配制溶液的体积,通过计算,取用一定体积的试剂浓盐酸,用水将其稀释,然后用基准物质如Na2B4O7·10H2O或Na2CO3对其进行标定。
标准滴定溶液和基准物质

1.标定: 1.标定: 标定
用配制溶液滴定基准物质计算其准 确浓度的方法称为标定。 确浓度的方法称为标定。
溶液; 如:0.1mol.L-1 NaOH溶液;先配成约为 溶液 的溶液, 0.1mol.L-1的溶液,再用邻苯二甲酸氢钾 标定,计算出 的准确浓度。 标定,计算出NaOH的准确浓度。 的准确浓度
(二) 间接配制法: 二 间接配制法:
许多物质纯度达不到基准试剂的纯度 许多物质纯度达不到基准试剂的纯度 要求,或它们在空气中不稳定,即粗 要求,或它们在空气中不稳定, 不稳定 略地称取一定量的物质或量取一定体 积的溶液, 积的溶液,配制成接近所需浓度的溶 液,然后用另一标准溶液来标定。 然后用另一标准溶液来标定。
级别 中文名称
一级 二级 三级 优级纯 分析纯 化学纯
英文名称
GR AR CP BR
标签颜色
绿 红 蓝 咖啡色
主要用途
精密分析实验 一般分析实验 一般化学实验 生物化学及 医用化学实验
生物化 生化试剂 学试剂 生物染色剂
(染色剂:玫红色) 染色剂:玫红色)
(二)基准物质(基准试剂) 基准物质(基准试剂)
干燥后组成
NaHCO3 Na2CO3 Na2CO3 KHCO3 Na2B4O7 .10H2O H2C2O4.2H2O KHC8H4O4 K2Cr2O7 KBrO3 KIO3 Cu As2O3 Na2C2O4 CaCO3 Zn ZnO NaCl KCl AgNO3
干燥条件/° 干燥条件 °C
270~300 270~300 270~300 270~300 放在装有NaCl和蔗糖 放在装有 和蔗糖 饱和溶液的干燥器中 室温空气干燥 105~110 120 180 180 室温干燥器中保存 硫酸干燥器中保存 105 110 室温干燥器中保存 800 500~550 500~550 硫酸干燥器中保存
标准溶液和基准物质

标准溶液和基准物质哎呀,一听到“标准溶液”和“基准物质”这两个词,是不是感觉脑袋都大啦?其实我一开始也是这样的,觉得这东西肯定超级难搞懂。
先来说说标准溶液吧。
这就好像是我们考试的标准答案一样,是有着非常准确、固定的浓度的溶液。
比如说,在化学实验里,我们要测一个东西的含量,就得靠标准溶液来帮忙。
那基准物质又是什么呢?它就像是一个超级厉害的“标杆”!基准物质得特别稳定,性质不能随便变化,而且纯度得特别高。
就像我们班的班长,成绩特别好,品德也特别棒,是大家学习的榜样。
有一次上化学课,老师拿着一瓶标准溶液走进教室,神秘兮兮地对我们说:“同学们,今天我们就来好好研究一下这个神奇的家伙!”大家都瞪大眼睛,好奇极了。
老师接着说:“这标准溶液啊,就像是一把精准的尺子,能帮我们量出其他物质的多少。
”我忍不住在心里想:“这尺子可真厉害,那它是怎么被制造出来的呢?”老师好像听到了我的心声,解释道:“要得到标准溶液,就得先有基准物质。
基准物质就是那个定海神针,决定了标准溶液的准确性。
”同桌凑过来悄悄跟我说:“这基准物质这么重要,那得有多难找啊?”可不是嘛,要找到合适的基准物质可不容易。
就像在大海里找一颗特别的珍珠,得费好大的劲儿呢!比如说,有些基准物质得从特别珍贵的矿石里提取,那过程可复杂啦,得经过好多道工序,就像我们做一道特别难的数学题,得一步一步仔细算。
再想想,如果没有标准溶液和基准物质,那化学实验不就乱套啦?就像没有指挥的乐队,演奏出来的肯定是乱七八糟的声音。
所以说啊,标准溶液和基准物质在化学世界里可太重要啦!它们就像是化学王国的基石,支撑着各种各样的实验和研究。
我以后一定要好好学习,把它们搞得明明白白的!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
标准溶液与基准物质到底啥关系
基准物质是分析化学中用于直接配制标准溶液或标定滴定分析中操作溶液浓度的物质。
基准物质应符合五项要求:一、纯度(质量分数)应≥%;二、组成与它的化学式完全相符,如,含有结晶水,其结晶水的含量均应符合化学式;
三、性质稳定,一般情况下不易失水、吸水或变质,不与空气中的氧气及二氧化碳反应;四、参加反应时,应按反应式定量地进行,没有副反应;五、要有较大的摩尔质量,以减小称量时的相对误差。
标准溶液与基准物质到底啥关系文章里有。
先来认识下标准溶液与基准物质
标准溶液:已知准确浓度的溶液,在各种滴定分析方法中都要用到标准溶液,可根据溶质的性质、特点,按不同方法配置,配制方法有直接配置法和间接配置法。
基准物质:能用来配制标准溶液或测定标准溶液浓度的物质。
应具备如下条件:
1、组成恒定并与化学式相符,若含结晶水,其结晶水的实际含量也应与化学式严格相符。
2、纯度足够高(达%以上),杂质含量应低于分析方法允许的误差限。
3、性质稳定,不易吸收空气中的水分和二氧化碳,不分解,不易被空气氧化。
4、有较大的摩尔质量,以减少称量时的相对误差。
5、试剂参加滴定反应时,应严格按反应式定量进行,没有副反应。
如何配制标准溶液
标准溶液是指已知准确浓度的溶液,它是滴定分析中进行定量计算的依据之一。
不论采用何种滴定方法,都离不开标准溶液。
因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。
配制标准溶液的方法一般有以下两种:
1、直接配制法
用分析天平准确地称取一定量的物质,溶于适量水后定量转入容量瓶中,稀释至标线,定容并摇匀。
根据溶质的质量和容量瓶的体积计算该溶液的准确浓度。
能用于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是用来确定某一溶液准确浓度的标准物质。
作为基准物质必须符合下列要求:
1)试剂必须具有足够高的纯度,一般要求其纯度在%以上,所含的杂质应不影响滴定反应的准确度。
2)物质的实际组成与执业医师网它的化学式完全相符,若含有结晶水(如,硼砂Na2B4O7·10H2O),其结晶水的数目也应与化学式完全相符。
3)试剂应该稳定。
例如,不易吸收空气中的水分和二氧化碳,不易被空气氧化,加热干燥时不易分解等。
4)试剂最好有较大的摩尔质量,这样可以减少称量误差。
常用的基准物质有纯金属和某些纯化合物,如,Cu, Zn, Al, Fe和K2Cr2O7,Na2CO3, MgO, KBrO3等,它们的含量一般在%以上,甚至可达%。
应注意,有些高纯试剂和光谱纯试剂虽然纯度很高,但只能说明其中杂质含量很低。
由于可能含有组成不定的水分和气体杂质,使其组成与化学式不一定准确相符,致使主要成分的含量可能达不到%,这时就不能用作基准物质。
一些常用的基准物质及其应用范围列于表中:
常用基准物质的干燥条件和应用
滴定分析中常用的一些基准物质的干燥条件及应用范围列于下表。
2、间接配制法(标定法)
需要用来配制标准溶液的许多试剂不能完全符合上述基准物质必备的条件,例如:NaOH极易吸收空气中的二氧化碳和水分,纯度不高;市售盐酸中HCl 的准确含量难以确定,且易挥发;KMnO4和Na2S2O3等均不易提纯,且见光分解,在空气中不稳定等。
因此这类试剂不能用直接法配制标准溶液,只能用间接法配制,即先配制成接近于所需浓度的溶液,然后用基准物质(或另一种物质的标准溶液)来测定其准确浓度。
这种确定其准确浓度的操作称为标定。
例如欲配制L HCl标准溶液,先用一定量的浓HCl加水稀释,配制成浓度约为L的稀溶液,然后用该溶液滴定经准确称量的无水Na2CO3基准物质,直至两者定量反应完全,再根据滴定中消耗HCl溶液的体积和无水Na2CO3的质量,计
算出HCl溶液的准确浓度。
大多数标准溶液的准确浓度是通过标定的方法确定的。
在常量组分的测定中,标准溶液的浓度大致范围为L至1mol/L,通常根据待测组分含量的高低来选择标准溶液浓度的大小。
为了提高标定的准确度,标定时应注意以下几点:
1)标定应平行测定3~4次,至少重复三次,并要求测定结果的相对偏差不大于% 。
2)为了减少测量误差,称取基准物质的量不应太少,最少应称取g以上;同样滴定到终点时消耗标准溶液的体积也不能太小,最好在于20mL以上。
3)配制和标定溶液时使用的量器,如滴定管,容量瓶和移液管等,在必要时应校正其体积,并考虑温度的影响。
4)标定好的标准溶液应该妥善保存,避免因水分蒸发而使溶液浓度发生变化;有些不够稳定,如,见光易分解的AgNO3和KMnO4等标准溶液应贮存于棕色瓶中,并置于暗处保存;能吸收空气中二氧化碳并对玻璃有腐蚀作用的强碱溶液,最好装在塑料瓶中,并在瓶口处装一碱石灰管,以吸收空气中的二氧化碳和水。
对不稳定的标准溶液,久置后,在使用前还需重新标定其浓度。
什么是“有证”标准物质
附有证书的标准物质,其一种或多种特性值用建立了溯源性的程序确定,使之可溯源到准确复现的用于表示该特性值的计量单位,而且每个标准值都附有给定置信水平的不确定度。
注:
1、有相应的标准物质证书。
2、有证标准物质一般成批制备,其特性值是通过对代表整批物质的样品进行测量而确定,并具有规定的不确定度。
3、当标准物质与特制器件相结合时,例如,已知三相点的物质装入三相点瓶,已知光密度的玻璃装入透射滤光片、均匀粒子尺寸板装在显微镜玻璃板上,有证标准物质的特性有时可方便地和可靠地确定,上述这些器件也可以认为是有证标准物质。
4、所有有证标准物质应符合<国际通用计量学基本术语>中给出的“计量基准标准”的定义。
5、有些标准物质和有证标准物质有这样的特性,它们与已确定的化学结构不相关,或由于其他原因不能用精确的物理和化学测量方法确定。
基准物质标定法与标准溶液标定法
1、基准物质标定法:
称取一定量的基准物质,溶解后用待标定的溶液滴定。
根据基准物质的质量和溶液的消耗体积,计算待标定溶液的准确浓度。
2、标准溶液标定法:
准确吸取一定量的待标定溶液,用另一种已知准确浓度的标准溶液滴定;或准确吸取一定量的已知准确浓度的标准溶液,用待标定的溶液滴定。
根据两种溶液的消耗体积及已知的标准溶液浓度,计算待标定溶液的准确浓度。
此法若标准溶液浓度不准确会直接影响待标定溶液浓度的准确性。
因此,标定时应尽量采用基准物质标定法。
无论用哪种方法标定,一般要求平行做3~4次实验,至少2~3次。
相对偏差小于%。
标定好的标准溶液应妥善保存。
放置一段时间后,标准溶液要先摇匀,再使用,若不稳定的溶液,还要定期标定。
标准物质的正确使用包括正确的选择、正确使用(防止误用)和使用的注意事项:
1)标准物质应根据不同的用途、目的,选择不同的标准来源,如,从相应的标准品供应处购买、购买相应的商品或从特殊途径获得。
2)目的不同,标准品级别要求则不同。
应选用标准物质特性量值与预期应用测试值水平相适应的标准物质。
使用者不应选用不确定度超过测量值与预期应用测量程序所容许水平的标准物质,一般工作场所可以选用满足要求的标准物质。
对实验室认证、方法验证、产品评价与仲裁等可以选用高水平的标准物质。
3)使用者在使用标准物质前应仔细、全面地阅读标准物质证书,只有认真的阅读证书中所给出的信息,才能保证正确使用标准物质。
4)选用的标准物质稳定性应满足整个实验计划的需要。
凡已超过稳定性的标准物质切不可随便使用。
5)使用者应特别注意证书中所给该标准物质的最小取样量。
最小取样量是标准物质均匀性的重要条件,不重视或者忽略了最小取样量,会影响测量结果的准确性和可信度。
6)所选用的标准物质数量应满足整个实验计划使用,必要时应保留一些储备,供实验计划后必要的使用。
7)选用标准物质除考虑其不确定度水平外还要考虑到标准物质的供应状况、价格以及化学的和物理的适用性。
有的使用者不顾花费昂贵的价格与手续非要从国外进口标准物质来使用,这也是标准物质的误用。
小结
总而言之,标准物质必须始终用于保证测量的可靠,正确使用标准物质可以保证量值准确、可靠。
